Абдоминальная боль что это такое при приеме одестона
Одестон Форте (Odeston Forte) инструкция по применению
Владелец регистрационного удостоверения:
Контакты для обращений:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Одестон Форте
Таблетки от белого до почти белого цвета, продолговатые, двояковыпуклые, без гравировки.
| 1 таб. | |
| гимекромон | 400 мг |
Фармакологическое действие
Гимекромон является производным кумарина. Желчегонный препарат. Увеличивает образование и выделение желчи. Оказывает селективное спазмолитическое действие в отношении желчных протоков и сфинктера Одди (не снижает перистальтику ЖКТ) и АД. Уменьшает застой желчи, предупреждает кристаллизацию холестерина и тем самым развитие желчных камней.
Фармакокинетика
При приеме внутрь легко всасывается из ЖКТ. C max в сыворотке крови достигается через 2-3 ч.
В плазме крови связывается с белками плазмы. V d составляет 20.8±114 л. Данные о выделении гимекромона с грудным молоком отсутствуют.
Гимекромон метаболизируется главным образом в печени на глюкуронид и сульфатные метаболиты.
Показания препарата Одестон Форте
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| K59.0 | Запор |
| K80 | Желчнокаменная болезнь [холелитиаз] (в т.ч. печеночная колика) |
| K81.1 | Хронический холецистит |
| K82.8 | Другие уточненные болезни желчного пузыря и пузырного протока (в т.ч. дискинезия) |
| K83.0 | Холангит |
| K83.4 | Спазм сфинктера Одди |
| K83.8 | Другие уточненные болезни желчевыводящих путей |
| K91.5 | Постхолецистэктомический синдром |
| R11 | Тошнота и рвота |
Режим дозирования
Внутрь, за 30 мин до еды.
Таблетку принимать целиком.
В случае пропуска приема дозы следует принять препарат как можно быстрее или, если приближается время следующего приема, пропущенную дозу не принимать. Не следует принимать двойную дозу сразу.
Побочное действие
Препарат Одестон Форте обычно хорошо переносится.
Противопоказания к применению
Следует прекратить прием препарата в случае появления симптомов почечной/печеночной недостаточности.
Применение при беременности и кормлении грудью
Применение при беременности
Данных о применении гимекромона у беременных женщин недостаточно. Данные о влиянии гимекромона на плод при применении препарата во время беременности отсутствуют. В качестве меры предосторожности рекомендуется избегать применение препарата Одестон Форте во время беременности.
Применение в период грудного вскармливания
Данные о выделении гимекромона с грудным молоком отсутствуют. Однако риск для новорожденных и младенцев не может быть исключен. В случае необходимости применения препарата следует решить вопрос о прекращении грудного вскармливания.
В доклинических исследованиях не наблюдалось влияния на фертильность.
Применение при нарушениях функции печени
Применение при нарушениях функции почек
Применение у детей
Особые указания
Препарат не следует применять, если развиваются симптомы почечной или печеночной недостаточности.
Специальные меры предосторожности при уничтожении неиспользованного лекарственного препарата
Лекарственные препараты нельзя выбрасывать в канализацию или в домашние контейнеры для отходов. О том, как утилизировать неиспользованный препарат, узнайте у фармацевта. Эти мероприятия помогут защитить окружающую среду.
Влияние на способность к управлению транспортными средствами и механизмами
Одестон Форте не оказывает влияния на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Лекарственное взаимодействие
Морфин ослабляет действие гимекромона.
При совместном приеме с метоклопрамидом происходит ослабление действия обоих препаратов.
Усиливает эффекты непрямых антикоагулянтов.
Условия хранения препарата Одестон Форте
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Абдоминальная боль что это такое при приеме одестона
Проблема современного лечения заболеваний поджелудочной железы (ПЖ), а также их многочисленных и опасных для жизни осложнений остается окончательно не решенной, продолжает привлекать внимание широкого круга практических врачей и научной общественности во всем мире. Вопросы лечения хронического панкреатита (ХП) достаточно хорошо изучены и изложены в соответствующей литературе, однако большая часть работ посвящена купированию симптомов основного заболевания без учета характерных особенностей и взаимоотягощающей патологии со стороны органов, входящих в единую зону функционирования данной системы [1].
Лечение ХП заключается в решенииследующих задач:
• исключение провоцирующих факторов (алкоголя и лекарственных препаратов, обструкции протоков);• облегчение боли;
• коррекция экзо- и эндокринной недостаточности;
• лечение сопутствующих расстройств (в т. ч. моторно-тонических нарушений гепатобилиарной системы, которые включают структурную или функциональную дисфункцию сфинктера Одди, гиперкинетическую дискинезию желчногопузыря);
• коррекция сопутствующей билиарной недостаточности (выявляющаяся, по данным наших исследований,у 67 % больных ХП) [1–3].
Основной целью лечения различных дисфункциональных расстройствжелудочно-кишечного и гепатобилиарного трактов является восстановление нормального тока желчи и секретаПЖ по билиарным и панкреатическимпротокам. Среди средств, влияющихна тонус гладкой мускулатуры, выделяют т. н. релаксанты гладкой мускулатуры – миотропные спазмолитики.
В настоящее время среди миотропных спазмолитиков, обладающихселективными свойствами, особоговнимания заслуживает препарат гимекромон (Одестон, Pabianickie Zaklady Farmaceutyczne Polfa S.A.) – фенольное производное кумарина, не имеющее свойств антикоагулянтов и оказывающее выраженное спазмолитическое и желчегонное действие. Гимекромон – синтетический аналог умбеллиферо-
на, обнаруженного в плодах аниса ифенхеля, которые применялись какспазмолитические средства. В результате проведенных клинических исследований выявлено, что препарат обеспечивает тот или иной эффект в зависимости от особенностей его действияна различных уровнях билиарноготракта. Одестон оказывает избирательное спазмолитическое действие насфинктер Одди и сфинктер желчногопузыря, снижает базальное давлениеи увеличивает длительность открытиясфинктера Одди, что приводит к увеличению пассажа желчи по желчнымпутям, вызывает дилатацию желчногопузыря, снижает внутрипротоковое давление, т. е. является антагонистом холецистокинина. Будучи высокоселективным спазмолитиком, Одестон не оказывает прямого желчегонного действия, но облегчает приток желчи в пищеварительный тракт, тем самым усиливая энтерогепатическую рециркуляцию желчных кислот, которые участвуют в первой фазе образования желчи. Холеретический его эффект обусловлен ускорением и увеличением поступления желчи и панкреатического сока в двенадцатиперстную кишку. Увеличение поступления желчи в просвет двенадцатиперстной кишки способствует улучшению процессов пищеварения, активизации кишеч-
ной перистальтики и нормализациистула [4–8].
Целью исследования явилось изучение влияния миотропного спазмолитика Одестона (гимекромона) на внешнесекреторную функцию ПЖ у больных ХП различного генеза.
Материал и методы
Были обследованы и пролечены 25 больных ХП в стадии нестойкой ремиссии после перенесенного обострения заболевания или в стадии ремиссии. По полу, возрасту и длительности заболевания больные распределились следующим образом (табл. 1). Контрольная группа состояла из практически здоровых лиц в возрасте от 19 лет до 21 года.
Таблица 1. Характеристика больных ХП по полу, возрасту и длительности заболевания.
Диагноз ХП был выставлен на основании жалоб больных, анамнеза заболевания, данных объективного, лабораторного, инструментального методов обследования. Инструментальное обследование включало ультразвуковое исследование ПЖ с помощью эхокамер SSD-650 фирмы “Aloka” и “Medisson” (Япония), работающих в режиме реального времени и серой шкалы с эхозондом 3,5 МГц.
Внешнесекреторная функция ПЖопределена с помощью интрадуоденального зондирования с последующим забором трех 20-минутных порций панкреатического сока. В качествераздражителя использован солянокислый метионин, т. к. соляная кислота,действующая как эндогенный секретин, стимулирует выделение жидкойчасти панкреатического сока и бикарбонатов и не стимулирует выделенияферментов. Зондирование проведенодважды – до и после курса приема препаратов. Амилаза в секрете определенапо Вольгемуту, бикарбонатная щелочность – методом обратного титрования по Шелагурову А.А.
Больные принимали гимекромон(7-гидрокси-4-метилкумарин) по 200 мг(1 капсула) 3 раза в сутки за 30 минут доприема пищи не разжевывая, запиваяобычной водой, согласно прилагаемойинструкции по медицинскому применению. Продолжительность лечениясоставила 30 дней. Каких-либо побочных эффектов и осложнений на фоне приема данного препарата не наблюдалось. Обработка и сопоставлениеполученных результатов, а также ихстатистический анализ проведены наПК с набором специально разработанных прикладных программ.
Результаты
В ходе исследования было выявлено, что в результате приема Одестона произошло снижение интенсивности болевого синдрома (с 64 до 32 % случаев), наблюдались некоторая нормализация частоты стула и его консистенции, уменьшение кратности актов дефекации с 3 до 1–2 раз в сутки (с 60 до 36 %); выраженность “вздутия живота” после курса приема Одестона уменьшилась с 72 до 36 % случаев.
В процессе исследования определены количество панкреатического сока, скорость секреции, часовое напряжение секреции после стимуляции соляно-кислым метионином, а также концентрация и дебит ферментов (амилазы) и бикарбонатная щелочность.
Таблица 2. Показатели панкреатической секреции и концентрации ингредиентов у больных ХП на фоне приема Одестона (M ± m).
До приема препарата Одестон у больных ХП наблюдалось исходное снижение количества панкреатического сокаи его качественного состава. Оценкарезультатов, полученных в ходе исследования панкреатической секреции, достоверно свидетельствовала о повышении секреции сока ПЖ на фонеприема данного препарата. Отмеченотакже увеличение исходно сниженногоуровня ферментов до уровня показателей контрольной группы и повышениеконцентрации бикарбонатов до субнормальных показателей (табл. 2).Определенный интерес представляет изучение скорости секреции ичасового напряжения панкреатического секрета, а также концентрациии дебита его основных компонентов,выделившихся в течение часа послевведения раздражителя (солянокислого метионина).
По данным исследования, на фонеприменения Одестона отмечено увеличение скорости и часового напряжения секреции, кроме того, наблюдалась положительная тенденция ростастимулированного дебита основных компонентов (табл. 3).
Таблица 3. Показатели внешнесекреторной функции ПЖ на фоне Одестона за час после проведенной стимуляции солянокислым метионином (M ± m).
Выводы
1. В ходе проведенного исследованияотмечена терапевтическая эффективность миотропного спазмолитика Одестона (гимекромона) в составекомплексного лечения больных ХП:
• число больных ХП с болевым синдромом после приема Одестонаснизилось с 64 до 32 %;
• количество случаев диареи уменьшилось с 60 до 36 %;
• явления метеоризма снизились с72 до 36 %.
2. Применение Одестона в составе комплексной терапии ХП оказывает положительное влияние на основные показатели внешнесекреторной функции ПЖ, при этом наблюдается достоверное повышение:
• часового напряжения сока ПЖ;
• средней концентрации бикарбонатов;
• дебита амилазы;
• дебита бикарбонатов за час послестимуляции.
3. Одестон является высокоэффективным средством купирования синдромов мальдигестии, оказывая избирательное спазмолитическое действие на сфинктеры Одди и Люткенса, усиливая энтерогепатическую рециркуляцию желчных кислот. Это способствует регрессу дискинезии двенадцатиперстной кишки и симптомов панкреатита.
4. Препарат хорошо переносится, каких-либо осложнений и отрицательных побочных эффектов при приеме Одестона в указанных дозировках выявлено не было.
Литература
1. Максимов В.А., Чернышев А.Л., Тарасов К.М. Дуоденальное исследование. М.,1998. С. 191.
2. Максимов В.А., Чернышев А.Л.,Тарасов К.М., Неронов В.А. Билиарнаянедостаточность. М., 2008. С. 232.
3. Губергриц Н.Б. Хроническая абдоминальная боль. Билиарная боль. Боль призаболеваниях печени. М., 2007. С. 419.
4. Максимов В.А., Бунтин С.Е., Бунтина В.Г. Эффективность одестона в лечениибольных хроническим панкреатитом// Фарматека 2009. № 13(187). С. 72–4.
5. Минушкин О.Н. Клиническое применение препарата Одестон (Hymecromone).Пособие для врачей. М., 2010. С. 79.
6. Максимов В.А., Бунтин С.Е., Бунтина В.Г., Мысенкова Е.Е., Самарцев К.Н. О влияниигимекромона на внешнесекреторную функцию поджелудочной железы у больных спостхолецистэктомическим синдромом //Лечащий врач 2009. № 7. С. 85–7.
7. Lancisch PG, Petersen M. Lipase/amylase ratio. Z Gastroent 1994;32:6–11.
8. Staritz M. Pharmacology of the sphincter ofOddi. Endoscopy 1998;20:171–74.
Абдоминальный болевой синдром: этиология, патогенез и вопросы терапии
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные Каковы причины абдоминального болевого синдрома? В чем заключается терапия абдоминального болевог
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные
Каковы причины абдоминального болевого синдрома?
В чем заключается терапия абдоминального болевого синдрома?
Абдоминальный болевой синдром является ведущим в клинике большинства заболеваний органов пищеварения. Боль — это спонтанное субъективное ощущение, возникающее вследствие поступления в центральную нервную систему патологических импульсов с периферии (в отличие от болезненности, которая определяется при обследовании, например, при пальпации). Тип боли, ее характер не всегда зависят от интенсивности инициальных стимулов. Органы брюшной полости обычно нечувствительны ко многим патологическим стимулам, которые при воздействии на кожу вызывают сильную боль. Разрыв, разрез или раздавливание внутренних органов не сопровождаются заметными ощущениями. В то же время растяжение и напряжение стенки полого органа раздражают болевые рецепторы. Так, натяжение брюшины (опухоли), растяжение полого органа (например, желчная колика) или чрезмерное сокращение мышц вызывают абдоминальные боли. Болевые рецепторы полых органов брюшной полости (пищевод, желудок, кишечник, желчный пузырь, желчные и панкреатические протоки) локализуются в мышечной оболочке их стенок. Аналогичные рецепторы имеются в капсуле паренхиматозных органов, таких как печень, почки, селезенка, и их растяжение также сопровождается болью. Брыжейка и париетальная брюшина чувствительны к болевым стимулам, в то время как висцеральная брюшина и большой сальник лишены болевой чувствительности.
Абдоминальные боли подразделяются на острые, которые развиваются, как правило, быстро или, реже, постепенно и имеют небольшую продолжительность (минуты, редко несколько часов), а также хронические, для которых характерно постепенное нарастание. Эти боли сохраняются или рецидивируют на протяжении недель и месяцев. Этиологическая классификация абдоминальных болей представлена в табл. 1.
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, париетальные (соматические), отраженные (иррадиирующие) и психогенные.
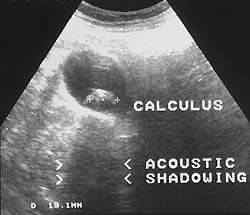 |
| Рисунок 1. Причиной абдоминальной боли может быть калькулезный холецистит (УЗИ) |
Висцеральная боль возникает при наличии патологических стимулов во внутренних органах и проводится симпатическими волокнами. Основными импульсами для ее возникновения являются внезапное повышение давления в полом органе и растяжение его стенки (наиболее частая причина), растяжение капсулы паренхиматозных органов, натяжение брыжейки, сосудистые нарушения.
Соматическая боль обусловлена наличием патологических процессов в париетальной брюшине и тканях, имеющих окончания чувствительных спинномозговых нервов.
Основными импульсами для ее возникновения являются повреждение брюшной стенки и брюшины.
Дифференциально-диагностические признаки висцеральной и соматической боли представлены в табл. 2.
Иррадиирующая боль локализуется в различных областях, удаленных от патологического очага. Она возникает в тех случаях, если импульс висцеральной боли чрезмерно интенсивен (например, прохождение камня) или при анатомическом повреждении органа (например, ущемление кишки). Иррадиирующая боль передается на участки поверхности тела, которые имеют общую корешковую иннервацию с пораженным органом брюшной области. Так, например, при повышении давления в кишечнике вначале возникает висцеральная боль, которая затем иррадиируют в спину, при билиарной колике — в спину, в правую лопатку или плечо.
Психогенная боль возникает при отсутствии периферического воздействия либо когда последнее играет роль пускового или предрасполагающего фактора. Особая роль в ее возникновении принадлежит депрессии. Последняя часто протекает скрыто и не осознается самими пациентами. Тесная связь депрессии с хронической абдоминальной болью объясняется общими биохимическими процессами и, в первую очередь, недостаточностью моноаминергических (серотонинергических) механизмов. Это подтверждается высокой эффективностью антидепрессантов, особенно ингибиторов обратного захвата серотонина, в лечении болевого синдрома. Характер психогенных болей определяется особенностями личности, влиянием эмоциональных, когнитивных, социальных факторов, психологической стабильностью больного и его прошлым «болевым опытом». Основными признаками данных болей являются их длительность, монотонность, диффузный характер и сочетание с другими локализациями (головная боль, боль в спине, во всем теле). Нередко психогенные боли могут сочетаться с другими, указанными выше типами болей и оставаться после их купирования, существенно трансформируя их характер, что необходимо учитывать при терапии.
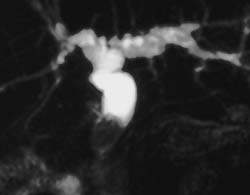 |
| Рисунок 2. Камень в общем желчном протоке у пациента после холецистэктомии (МРТ) |
Одной из разновидностей болей центрального генеза является абдоминальная мигрень. Последняя чаще встречается в молодом возрасте, носит интенсивный разлитой характер, но может быть локальной в параумбиликальной области. Характерны сопутствующие тошнота, рвота, понос и вегетативные расстройства (побледнение и похолодание конечностей, нарушения ритма сердца, артериального давления и др.), а также мигренозная цефалгия и характерные для нее провоцирующие и сопровождающие факторы. Во время пароксизма отмечается увеличение скорости линейного кровотока в брюшной аорте. Наиболее важными механизмами контроля болевого синдрома являются эндогенные опиатные системы. Опиатные рецепторы локализуются в окончаниях чувствительных нервов, в нейронах спинного мозга, в стволовых ядрах, в таламусе и лимбических структурах головного мозга. Связь данных рецепторов с рядом нейропептидов, таких как эндорфины и энкефалины, обусловливает морфиноподобный эффект. Опиатная система работает по следующей схеме: активация чувствительных окончаний приводит к выделению субстанции Р, что вызывает появление периферических восходящих и центральных нисходящих ноцицептивных (болевых) импульсов. Последние активизируют выработку эндорфинов и энкефалинов, которые блокируют выделение субстанции Р и снижают болевые ощущения.
Существенное значение в формировании болевого синдрома имеют серотонин и норадреналин. В структурах мозга находится большое количество серотонинергических и норадренергических рецепторов, а в состав нисходящих антиноцицептивных (противоболевых) структур входят серотонинергические и норадренергические волокна. Уменьшение уровня серотонина приводит к снижению болевого порога и усилению болей. Норадреналин опосредует увеличение активности антиноцицептивных систем.
Наличие болевого абдоминального синдрома требует углубленного обследования больного для уточнения механизмов его развития и выбора тактики лечения. Подавляющему большинству больных с наличием соматических болей, как правило, необходимо хирургическое лечение. Висцеральные боли, возникающие у больных как с наличием органических поражений органов пищеварения, так и без них, являются следствием нарушения, в первую очередь, моторной функции последних. В результате в полых органах повышается давление и/или наблюдается растяжение его стенки, и возникают условия для формирования восходящих ноцицептивных импульсов.
В регуляции транспорта ионов кальция участвуют ряд нейрогенных медиаторов: ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и приводит к открытию кальциевых каналов, через которые ионы кальция поступают в клетку, вызывая мышечное сокращение.
Серотонин оказывает существенное влияние на моторику желудочно-кишечного тракта, активируя ряд рецепторов, локализирующихся на эффекторных клетках. Выделяют несколько подтипов рецепторов (5-МТ1-4), однако наиболее изучены 5-МТ3 и 5-МТ4. Связывание серотонина с 5-МТ3 способствует расслаблению, а с 5-МТ4 — сокращению мышечного волокна. В то же время механизмы действия серотонина на мышечные волокна желудочно-кишечного тракта до конца не установлены. Имеются лишь предположения о вовлечении в эти процессы ацетилхолина.
Тахикинины, в состав которых входят три типа пептидов (субстанция Р, нейрокинин А и В), связываясь с соответствующими рецепторами миоцитов, повышают их моторную активность не только в результате прямой активации, но и вследствие выделения ацетилхолина. Определенную роль в регуляции моторной функции кишечника играют эндогенные опиаты. При связывании их с μ- и δ-опиоидными рецепторами миоцитов происходит стимуляция, а с κ-рецепторами — замедление моторики пищеварительного тракта.
Основные направления купирования болевого абдоминального синдрома включают: а) этиологическое и патогенетическое лечение основного заболевания; б) нормализацию моторных расстройств; в) снижение висцеральной чувствительности; г) коррекцию механизмов восприятия болей.
Нарушения двигательной функции органов желудочно-кишечного тракта играют значительную роль в формировании не только болевого синдрома, но и большинства диспепсических расстройств (чувство переполнения в желудке, отрыжка, изжога, тошнота, рвота, метеоризм, поносы, запоры). Большинство из указанных выше симптомов могут иметь место как при гипокинетическом, так и при гиперкинетическом типе дискинезии, и только углубленное исследование позволяет уточнить их характер и выбрать адекватную терапию.
Одним из наиболее частых функциональных нарушений, в том числе и с наличием органической патологии органов пищеварения, является спастическая (гиперкинетическая) дискинезия. Так, при спастической дискинезии любого отдела пищеварительного тракта наблюдается повышение внутрипросветного давления и нарушение продвижения содержимого по полому органу, что создает предпосылки для возникновения боли. При этом скорость нарастания давления в органе пропорциональна интенсивности боли.
Спастическая дискинезия мышечной оболочки стенки полого органа или сфинктеров представляет собой наиболее частый механизм развития болевого синдрома при эзофагоспазме, дисфункции сфинктера Одди и пузырного протока, синдроме раздраженного кишечника.
В настоящее время для купирования болевого синдрома в комплексном лечении вышеуказанных заболеваний используются релаксанты гладкой мускулатуры, которые включают несколько групп препаратов. Антихолинергические средства снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы. Последнее обстоятельство определяет существенные различия индивидуальной эффективности препаратов данной группы. В качестве спазмолитиков используют как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М1-холиноблокаторы (гастроцепин и др.). Однако довольно низкая эффективность и широкий спектр побочных эффектов ограничивают их применение для купирования болевого синдрома у значительной части больных.
Механизм действия миотропных спазмолитиков в конечном итоге сводится к накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Эти эффекты могут достигаться ингибированием фосфодиэстеразы, или активацией аденилатциклазы, или блокадой аденозиновых рецепторов, либо их комбинацией. Основными представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте, спазмол), бенциклан (галидор), отилония бромида (спазмомен), метеоспазмил и др. При использовании миогенных спазмолитиков, так же как и М-холиноблокаторов, необходимо учитывать существенные индивидуальные различия их эффективности, отсутствие селективности эффектов (действуют практически на всю гладкую мускулатуру, включая мочевыделительную систему, кровеносные сосуды и др.), развитие гипомоторной дискинезии и гипотонии сфинктерного аппарата пищеварительного тракта, особенно при длительном применении. Данные препараты используются кратковременно (от однократного приема до двух-трех недель) для купирования спазма, а следовательно, болевого синдрома.
В ряду миотропных спазмолитиков следует отметить препарат мебеверин (дюспатолин), механизм действия которого сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате прекращается фосфорилирование миозина и отсутствует сокращение мышечного волокна. Известно также, что выход ионов кальция из внутриклеточных депо в результате активации α1-адренорецепторов приводит к открытию калиевых каналов, выходу ионов калия из клетки, гиперполяризации и отсутствию мышечного сокращения, что может становиться в течение длительного времени причиной мышечной гипотонии. В отличие от других миотропных спазмолитиков мебеверин препятствует пополнению внутриклеточных кальциевых депо, что в конечном итоге приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации. Последняя предупреждает развитие постоянного расслабления или гипотонии мышечной клетки. Следовательно, назначение мебеверина (дюспатолина) приводит только к снятию спазма без развития гипотонии гладкой мускулатуры, т. е. не нарушает моторики желудочно-кишечного тракта. Препарат оказался эффективным для купирования абдоминальных болей и дискомфорта, нарушений стула, обусловленных синдромом раздраженного кишечника, а также возникающих на фоне органических заболеваний.
Среди миотропных спазмолитиков также обращает на себя внимание препарат гимекромон (одестон). Одестон (7-гидрокси-4-метилкумарин) оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, обеспечивает отток желчи в двенадцатиперстную кишку, снижает давление в билиарной системе и, как следствие, купирует билиарный болевой синдром. Одестон не обладает прямым желчегонным действием, но облегчает приток желчи в пищеварительный тракт, тем самым усиливая энтерогепатическую рециркуляцию желчных кислот, которые участвуют в первой фазе образования желчи. Преимущество одестона по сравнению с другими спазмолитиками заключается в том, что он практически не оказывает влияния на другие гладкие мышцы, в частности, кровеносной системы и кишечной мускулатуры.
Чрезвычайно перспективным направлением в лечении моторных расстройств является использование селективных блокаторов кальциевых каналов. В настоящее время из этой группы широкое распространение получил пинавериум бромид (дицетел). Дицетел блокирует потенциалзависимые кальциевые каналы миоцитов кишечника, резко снижает поступление в клетку экстрацеллюлярных ионов кальция и тем самым предотвращает мышечное сокращение. К числу достоинств дицетела относятся местное (внутрикишечное) действие препарата, тканевая селективность, отсутствие побочных, в т. ч. и кардиоваскулярных эффектов. Препарат можно применять в течение длительного времени, не опасаясь развития гипотонии кишечника. Клинические исследования показали высокую эффективность дицетела в лечении синдрома раздраженного кишечника и других заболеваний, при которых наблюдается спастическая дискинезия толстой кишки.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и механизмы восприятия болей. Это касается, в первую очередь, больных с функциональными заболеваниями желудочно-кишечного тракта (функциональная диспепсия, синдром раздраженного кишечника, функциональные абдоминальные боли и др.) и психогенными абдоминальными болями.
В настоящее время широко обсуждается возможность использования антидепрессантов, антагонистов 5-НТ3, агонистов κ-опиоидных рецепторов, аналогов соматостатина (октреотида). Из них лучше всего изучены антидепрессанты, реализующие противоболевой эффект двумя путями: 1) за счет уменьшения депрессивной симптоматики, учитывая тот факт, что хроническая боль может быть маской депрессии; 2) за счет активации антиноцицептивных серотонинергических и норадренергических систем. Антидепрессанты назначаются в терапевтических (но не в низких) дозах (амитриптилин 50-75 мг/сут., миансерин 30-60 мг/сут. и т. д.), продолжительность их приема должна составлять не менее 4-6 недель. Препараты эффективны в комплексной терапии.
Таким образом, генез абдоминальных болей является полиэтиологическим и полипатогенетическим. Лечение болевого синдрома должно быть направлено на нормализацию структурных и функциональных нарушений пораженного органа, а также на нормализацию функций нервной системы, отвечающих за восприятие болей.
Литература.
1. Вегетативные расстройства. Руководство для врачей. Под ред. проф. А.М. Вейна. М., 1998.
2. Вейн А. М., Данилова А. Б. Кардиалгии и абдоминалгии // РМЖ, 1999. 7, № 9. С. 428-32.
3. Григорьев П. Я., Яковенко А. В. Клиническая гастроэнтерология. М.: Медицинское информационное агентство, 2001. С. 704.
4. Ивашкин В. Т. Синдром раздраженной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. 1993, т. 2, № 3. С. 27-31.
5. Яковенко Э. П. Григорьев П. Я. Хронические заболевания внепеченочных желчевыводящих путей. Диагностика и лечение. Метод. пособие для врачей. М.: Медпрактика, 2000. С. 31.
Таблица 1. Этиология абдоминальных болей
Интраабдоминальные причины
Экстраабдоминальные причины
Примечание. Частота заболеваний в рубриках указана в убывающем порядке.
