Абдоминальный болевой синдром у детей что это
Острый живот у детей
Острый живот у детей — это клинический симптомокомплекс, который указывает на серьезные заболевания или травмы брюшной полости и забрюшинного пространства. Основное проявление — сильная абдоминальная боль постоянного или схваткообразного характера. Сопутствующие симптомы: тошнота, рвота, нарушения стула, повышение температуры тела. Диагностика острого живота включает физикальный осмотр, стандартный комплекс анализов крови, мочи, визуализационные методы — УЗИ и рентгенография брюшных органов, диагностическая лапароскопия. При симптомокомплексе ребенку нужна неотложная помощь детских хирургов, которая дополняется адекватной медикаментозной терапией.
МКБ-10
Общие сведения
Острый живот — одна из самых сложных проблем детской хирургии, что обусловлено многообразием причин его развития у детей, необходимостью экстренной постановки диагноза и высоким риском осложнений. Важная роль отводится педиатру или семейному врачу, который обычно первым сталкивается с жалобами на острую боль в животе и должен направить ребенка к хирургам или лечить самостоятельно. Абдоминальный болевой синдром составляет до 15% причин обращения родителей к педиатру, но не более четверти всех случаев относятся к хирургической патологии.
Причины
В педиатрической практике насчитывают несколько сотен причин острого живота. Установление этиологического фактора затрудняется еще и тем, что в младшем возрасте наблюдается функциональная незрелость пищеварительной системы, склонность к генерализации заболевания, неспособность ребенка четко обозначить свои жалобы. Основные причины абдоминальных болей у детей объединяют в следующие группы:
К редким причинам болевого синдрома относят объемные новообразования брюшной полости: лимфому Беркитта, эхинококковую кисту печени, лимфангиому брыжейки. Симптомы, характерные для острого живота, иногда встречаются при ущемлении врожденной паховой и пахово-мошоночной грыжи у мальчиков. Среди нехирургических причин стоит выделить кишечные инфекции (сальмонеллез, дизентерию, кампилобактериоз), менингококцемию, диабетический кетоацидоз.
Патогенез
Симптомы при остром животе вызваны двумя механизмами боли: висцеральной и соматической, что имеет решающее значение для дифференцировки хирургической и гастроэнтерологической патологии. Соматические ощущения появляются при раздражении нервных рецепторов брюшины, а соответствующие импульсы передаются в ЦНС через спиноталамические тракты. Такая боль имеет четкую локализацию, дополняется защитным напряжением передней стенки живота.
Висцеральный болевой синдром развивается при вовлечении в процесс рецепторов внутренних органов абдоминальной полости. Импульсы от них идут в составе чревного сплетения и вегетативного отдела спинномозговых нервов. Они вызваны растяжениями или сокращениями органа, его ишемией. При висцеральных болях невозможно четко указать локализацию. Подобные ощущения часто сопровождаются вегетативными расстройствами у детей.
Симптомы
Характер, локализация и периодичность боли — основные признаки, на которые необходимо обращать внимание. Дети старше 3-4 лет зачастую могут пожаловаться на дискомфорт в животе, но они не умеют определять источник боли и в лучшем случае способны показать рукой место наиболее болезненных ощущений. У малышей первых лет жизни симптомокомплекс проявляется беспокойством, криком и плачем, «сучением» и подтягиванием ножек к животу.
У старших детей, которые детально описывают симптомы, можно выяснить особенности болей. При постоянных нарастающих ощущениях в первую очередь думают об острых воспалительных процессах. Резкая и пронизывающая боль — признак перфорации стенки органа. Если болевые ощущения приходят волнообразно, предполагают кишечную непроходимость, инфаркт кишечника. Периодические схваткообразные боли беспокоят при желчной или почечной колике.
Тошнота и рвота — самые частые симптомы, которые сопровождают болевой синдром у детей. При воспалительных хирургических заболеваниях рвота носит рефлекторный характер, в желудочном содержимом нет патологических примесей. Срыгивание застойных масс с желчью или каловым запахом — симптомы кишечной непроходимости. Также у большинства пациентов возникают расстройств стула (диарея, запоры) и дизурические явления.
Острый живот характеризуется резким ухудшением общего состояния, лихорадкой. Ребенок становится вялым и апатичным, он лежит неподвижно либо, наоборот, беспокойно вертится в кровати из-за мучительных болей. Кожа бледная с сероватым оттенком, может выступать холодный пот. Черты лица приобретают страдальческое выражение, губы пересыхают и трескаются. Пульс учащенный и ослабленный, артериальное давление снижается.
Осложнения
Многие хирургические болезни при отсутствии своевременного лечения заканчиваются перитонитом. Чем младше ребенок, тем быстрее у него возникает генерализованное воспаление брюшины, обусловленное недостаточной активностью иммунитета. На фоне острого гнойного перитонита начинаются сепсис и септический шок, которые имеют крайне неблагоприятный прогноз для жизни.
При перфорации или травме органов может открыться массивное кровотечение, которое сопровождается снижением объема циркулирующей крови и гиповолемическим шоком. Такое острое состояние является наиболее частой причиной смерти, особенно у детей младше 5 лет. Из отдаленных последствий стоит отметить спайки в полости живота, которые формируются как исход воспаления или хирургического вмешательства. В будущем они могут вызывать кишечную непроходимость.
Диагностика
Детский хирург имеет ограниченное время для обследования больного с острым животом, поэтому основную ценность имеют данные физикального осмотра: выявление патогномоничных симптомов, «доскообразного живота», перкуссия и аускультация передней брюшной стенки. На основании этих сведений опытный врач ставит предварительный диагноз. В план дальнейшего обследования ребенка включаются:
Если врач исключает хирургическую патологию, дальнейшим обследованием пациента занимается гастроэнтеролог, детский инфекционист. Для уточнения причины болей в животе назначают инструментальные методы — ЭФГДС, колоноскопию, ирригоскопию, суточную рН-метрию. Объем диагностических методов определяется возрастом ребенка, сопутствующими симптомами.
Лечение острого живота у детей
Консервативная терапия
Медикаменты вводятся в пред- и послеоперационном периоде, а также как самостоятельный вариант лечения, когда отсутствуют показания к экстренному оперативному вмешательству. Терапию начинают со стабилизации состояния ребенка, для чего переливают инфузионные растворы, применяют анальгетики, спазмолитики. Обязательный компонент — антибиотики широкого спектра для предупреждения гнойных осложнений и ликвидации уже имеющихся процессов.
В случае исключения острого хирургического заболевания, детей переводят в профильный стационар (гастроэнтерологический, пульмонологический). Там назначается медикаментозная терапия противовоспалительными, обезболивающими, спазмолитическими средствами. При обнаружении мезаденита или аппендикулярного инфильтрата ребенок остается в хирургическом стационаре, но получает медикаментозное лечение.
Хирургическое лечение
Если по результатам обследования установлена острая хирургическая патология, после сокращенной премедикации ребенку проводят оперативное вмешательство. Тип операции выбирается соответственно выявленному заболеванию. В детской абдоминальной хирургии предпочитают использовать минимально травматичные лапароскопические методы, преимущества которых заключаются в коротком реабилитационном периоде, быстром восстановлении работы ЖКТ.
При обширных гнойных процессах показана классическая полостная операция, которая дает врачу возможность осмотреть все этажи брюшины, произвести санацию и дренирование. Оперативное лечение требуется и при некоторых поражениях органов дыхания, проявляющихся абдоминальным синдромом. При экссудативном плеврите выполняют плевральную пункцию и ставят дренаж, при деструктивной пневмонии делают торакоскопическую операцию.
Прогноз и профилактика
Вероятность полного выздоровления зависит от первопричины абдоминального синдрома и своевременности оказанной помощи. Если состояние диагностировано до развития перитонита, прогноз благоприятный. Оттягивание визита к врачу или затягивание сроков диагностики чревато жизнеугрожающими состояниями (перитонитом, сепсисом), и даже после успешного хирургического лечения больному потребуется длительный восстановительный период.
Первичная профилактика острого живота не разработана, что объясняется полиморфизмом этиологических факторов. Вторичные превентивные меры предполагают раннее обращение за врачебной помощью, даже если ребенок жалуется на абдоминальные боли невысокой интенсивности. Детские гастроэнтерологи должны проводить адекватное лечение и динамическое наблюдения детей с болезнями ЖКТ, чтобы не допустить обострений.
Абдоминальный болевой синдром у детей что это
Сотрудники Харьковской медицинской академии последипломного образования Украины опубликовали статью, посвященную одной из частых педиатрических проблем – функциональной абдоминальной боли.
В большинстве случаев причиной хронической боли в животе является неорганическая, функциональная абдоминальная боль (ФАБ) без объективных признаков основного органического расстройства. В настоящее время среди различных групп спазмолитиков при лечении функциональных расстройств пищеварительного тракта отдают предпочтение селективным миотропным спазмолитикам — блокаторам быстрых натриевых каналов клеточной мембраны миоцита.
Абдоминальная боль является одной из самых распространенных жалоб детей в практике педиатра и семейного врача. Рецидивирующие абдоминальные боли могут быть причиной дистресса и дискомфорта как у ребенка, так и у родителей. В большинстве случаев причиной хронической боли в животе является неорганическая, функциональная абдоминальная боль (ФАБ) без объективных признаков основного органического расстройства, характеризующаяся многообразием проявлений.
У детей с ФАБ, а также у их родителей снижается качество жизни, дети школьного возраста с болями в животе пропускают школу, а 10 % родителей пропускают работу. Распространенность функциональной абдоминальной боли, по данным литературы, составляет от 0,3 до 19 % (в среднем 8,4 %). По данным многочисленных эпидемиологических исследований, функциональными расстройствами пищеварительной системы страдает 50–60 % взрослого населения. Согласно данным ВОЗ, за последние 60 лет заболеваемость этими расстройствами возросла в 24 раза. В структуре абдоминальной боли у детей функциональная боль составляет 90–95 %; характеризуется многообразием проявлений и связана с различными функциональными расстройствами пищеварительной системы. При этом важно учитывать тот факт, что при уже имеющихся функциональных расстройствах всегда повышается риск органических изменений различных органов пищеварительной системы.
Согласно Римским критериям IV пересмотра функциональные гастроинтестинальные расстройства (ФГИР) определены как расстройства взаимодействия «кишка — головной мозг» («ЖКТ — ЦНС») (disorders of gut-brain).
В основе ФГИР лежат комбинированные морфологические и физиологические отклонения, связанные с висцеральной гиперчувствительностью, нарушениями моторики желудочно-кишечного тракта (ЖКТ), защитного слизистого барьера, иммунной функции и состава кишечной микробиоты, а также с расстройствами со стороны центральной нервной системы (ЦНС). Функциональные расстройства желудочно-кишечного тракта (ФРЖКТ) являются результатом взаимодействия психосоциальных факторов и измененной физиологии желудка, желчного пузыря, кишечника. В качестве базовой концепции развития ФРЖКТ рассматривается биопсихосоциальная модель, основанная на предположении о мультифакториальности генеза ФРЖКТ. Основные факторы в патофизиологии формирования функциональных гастроинтестинальных расстройств: нарушение желудочно-кишечной моторики, висцеральная гиперчувствительность и психосоциальные факторы. В детском возрасте генетические, социокультурные и средовые факторы могут оказывать большое влияние на психосоциальное развитие человека, его личностные качества, восприимчивость к стрессам и навыки преодоления трудностей. Эти факторы также во многом определяют предрасположенность к развитию ФРЖКТ. К критериям функциональных расстройств органов пищеварения относятся: отсутствие анатомических, метаболических и воспалительных изменений отделов ЖКТ; продолжительность персистирования или рецидивирования симптомов должна составлять не менее двух месяцев; симптомы функциональных расстройств могут сопровождаться и множественными жалобами в отношении других органов и систем (головные боли и боли другой локализации, головокружения, утомляемость и слабость, нарушения аппетита и сна, концентрации и памяти, раздражительность, потливость, похолодание конечностей, изменения артериального давления) при общем удовлетворительном соматическом состоянии; благоприятное течение заболевания без заметного прогрессирования, несмотря на обилие жалоб.
Наиболее часто встречается сочетание функциональной диспепсии, синдрома раздраженного кишечника, билиарной дисфункции. Диспепсия не является специфичным синдромом и может встречаться как при различной патологии ЖКТ (структурной и функциональной), так и при многих негастроэнтерологических заболеваниях.
В более чем 50 % случаев каких-либо органических изменений при диспепсии не выявляют, то есть она носит функциональный характер. Исходя из современных представлений, диспепсию следует трактовать двояко — и как синдром, и как самостоятельную нозологическую форму. Для обозначения диспепсии как предварительного диагноза, то есть для описания комплекса симптомов у первичного больного, рекомендуют использовать термин «неисследованная диспепсия». Этот первичный синдромный диагноз требует либо эмпирического симптоматического или антихеликобактерного лечения, либо дальнейшего обследования пациента. Синдром раздраженного кишечника в Римских критериях IV определяется как хроническое функциональное расстройство кишечника, при котором боль в животе связана с дефекацией или изменениями характера и консистенции стула, и это отличает его от функциональной диареи или запора, при которых боли отсутствуют, и от функционального вздутия, которое не сопровождается модификациями характеристик испражнений.
К основным критериям СРК относится рецидивирующая абдоминальная боль по крайней мере один день в неделю за последние три месяца, характеризующаяся двумя или более из нижеследующих признаков:
1) связанная с дефекацией;
2) связанная с изменением частоты стула;
3) связанная с изменением формы стула (Бристольская шкала).
Диагностика СРК базируется на трех ключевых пунктах:
1) клиническая картина и анализ истории заболевания;
2) физикальный осмотр с соблюдением методологии пропедевтики;
3) проведение минимального количества лабораторных тестов и инструментальных исследований, индивидуализированных в соответствии с клиническими особенностями каждого пациента, и только по показаниям — дополнительный набор необходимых исследований.
Функциональная патология билиарного тракта входит в группу функциональных заболеваний органов пищеварения, широко распространенных в развитых странах. В структуре билиарной патологии у детей функциональные расстройства желчного пузыря и сфинктера Одди составляют до 85 %. Функциональные расстройства обусловлены участием большого числа факторов в формировании моторно-тонических нарушений желчного пузыря и сфинктерного аппарата желчных путей. Проблемы, связанные с диагностикой и лечением функциональных билиарных расстройств, носят междисциплинарный характер и могут быть основой формирования органических и обменных заболеваний гепатобилиарной системы. Римскими критериями IV выделены принципы диагностики ФР желчного пузыря и сфинктера Одди.
При всех видах функциональной боли отмечают нарушение висцеральной моторики и развитие спазмов. Сочетанная патология создает новую клиническую ситуацию, которая требует подбора терапии с исключением полипрагмазии. Лечение рецидивирующих болей в животе направлено на устранение их причины: снятие спазма, нормализацию моторики желудочно-кишечного тракта.
Сложность патогенетических механизмов абдоминальной боли определяет и индивидуальный подход при выборе терапии. Несмотря на широкую встречаемость синдрома в педиатрии, в настоящее время отсутствуют эффективные стандарты его лечения. Общепризнана целесообразность системного подхода к терапии, который ориентирован на самые разные звенья патогенеза и включает мероприятия по нормализации режима, характера питания, назначения лекарственных средств с доказанным уровнем преимущества в безопасности и широким спектром терапевтических возможностей. Первой линией терапии при общих симптомах являются спазмолитики. Помимо спазмолитиков, при синдроме перекреста функциональных заболеваний пищеварительного тракта необходимы и психотерапевтические мероприятия, а в сочетании с синдромом функциональной диспепсии — назначение антисекреторных средств, прокинетиков, проведение эрадикационной терапии (при подтверждении инфицирования H.pylori). Для симптоматической терапии функциональной абдоминальной боли широко используют энтеросорбенты. Биологический смысл адсорбции заключается в том, что, согласно имеющимся данным, энтеросорбенты обладают адсорбционной способностью по отношению к веществам различной молекулярной массы, поэтому адсорбируют бактерии, вирусы и бактериальные токсины. Кроме того, повышают адсорбционную емкость и реализуют обволакивающее действие в отношении слизистой оболочки кишечника. Дополнением к лечению является назначение современных пробиотиков, которые обладают рациональным терапевтическим воздействием практически при всех заболеваниях ЖКТ, изменяющих функциональность микробиоты и кишечного барьера.
Своевременное купирование болевого синдрома в детской гастроэнтерологии — задача основная, трудная, и ее решение зависит от интенсивности и продолжительности боли, сопутствующих заболеваний и предшествующего опыта применения спазмолитических препаратов [9]. Учитывая, что основным патофизиологическим механизмом в развитии абдоминальной боли является спазм гладких мышц органов брюшной полости, для купирования абдоминального болевого синдрома в комплексном лечении заболеваний желудочно-кишечного тракта используют релаксанты гладкой мускулатуры, среди которых выделяют следующие группы препаратов:
Физиологические основы нарушения моторики, спастических сокращений связаны с транспортом Ca2+ в клетку посредством блокады натриевых каналов. В настоящее время среди различных групп спазмолитиков при лечении функциональных расстройств пищеварительного тракта отдают предпочтение селективным миотропным спазмолитикам — блокаторам быстрых натриевых каналов клеточной мембраны миоцита, которые блокирует быстрые натриевые каналы, расположенные на клеточной мембране миоцита, препятствуя поступлению ионов натрия в клетку. Этот механизм приводит к ослаблению сократительной функции гладкомышечного волокна и способствует устранению спазма, но не вызывает гипотонии. В отличие от антихолинергических препаратов, оказывает селективное действие в отношении гладких мышц пищеварительного тракта.
Таким образом, абдоминальная боль — одна из наиболее часто встречаемых и сложных проблем в практике врача. Наиболее часто она возникает при функциональных расстройствах желудочно-кишечного тракта. Применение селективных миотропных спазмолитиков для купирования абдоминальной боли патогенетически обосновано.
Шутова Е.В., Белоусова О.Ю., Павленко Н.В., Савицкая Е.В.
Журнал «Здоровье ребенка» том 14 №1 (2019г)
Абдоминальный болевой синдром: этиология, патогенез и вопросы терапии
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные Каковы причины абдоминального болевого синдрома? В чем заключается терапия абдоминального болевог
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные
Каковы причины абдоминального болевого синдрома?
В чем заключается терапия абдоминального болевого синдрома?
Абдоминальный болевой синдром является ведущим в клинике большинства заболеваний органов пищеварения. Боль — это спонтанное субъективное ощущение, возникающее вследствие поступления в центральную нервную систему патологических импульсов с периферии (в отличие от болезненности, которая определяется при обследовании, например, при пальпации). Тип боли, ее характер не всегда зависят от интенсивности инициальных стимулов. Органы брюшной полости обычно нечувствительны ко многим патологическим стимулам, которые при воздействии на кожу вызывают сильную боль. Разрыв, разрез или раздавливание внутренних органов не сопровождаются заметными ощущениями. В то же время растяжение и напряжение стенки полого органа раздражают болевые рецепторы. Так, натяжение брюшины (опухоли), растяжение полого органа (например, желчная колика) или чрезмерное сокращение мышц вызывают абдоминальные боли. Болевые рецепторы полых органов брюшной полости (пищевод, желудок, кишечник, желчный пузырь, желчные и панкреатические протоки) локализуются в мышечной оболочке их стенок. Аналогичные рецепторы имеются в капсуле паренхиматозных органов, таких как печень, почки, селезенка, и их растяжение также сопровождается болью. Брыжейка и париетальная брюшина чувствительны к болевым стимулам, в то время как висцеральная брюшина и большой сальник лишены болевой чувствительности.
Абдоминальные боли подразделяются на острые, которые развиваются, как правило, быстро или, реже, постепенно и имеют небольшую продолжительность (минуты, редко несколько часов), а также хронические, для которых характерно постепенное нарастание. Эти боли сохраняются или рецидивируют на протяжении недель и месяцев. Этиологическая классификация абдоминальных болей представлена в табл. 1.
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, париетальные (соматические), отраженные (иррадиирующие) и психогенные.
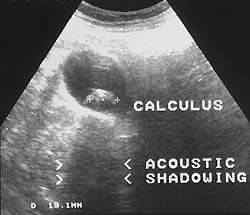 |
| Рисунок 1. Причиной абдоминальной боли может быть калькулезный холецистит (УЗИ) |
Висцеральная боль возникает при наличии патологических стимулов во внутренних органах и проводится симпатическими волокнами. Основными импульсами для ее возникновения являются внезапное повышение давления в полом органе и растяжение его стенки (наиболее частая причина), растяжение капсулы паренхиматозных органов, натяжение брыжейки, сосудистые нарушения.
Соматическая боль обусловлена наличием патологических процессов в париетальной брюшине и тканях, имеющих окончания чувствительных спинномозговых нервов.
Основными импульсами для ее возникновения являются повреждение брюшной стенки и брюшины.
Дифференциально-диагностические признаки висцеральной и соматической боли представлены в табл. 2.
Иррадиирующая боль локализуется в различных областях, удаленных от патологического очага. Она возникает в тех случаях, если импульс висцеральной боли чрезмерно интенсивен (например, прохождение камня) или при анатомическом повреждении органа (например, ущемление кишки). Иррадиирующая боль передается на участки поверхности тела, которые имеют общую корешковую иннервацию с пораженным органом брюшной области. Так, например, при повышении давления в кишечнике вначале возникает висцеральная боль, которая затем иррадиируют в спину, при билиарной колике — в спину, в правую лопатку или плечо.
Психогенная боль возникает при отсутствии периферического воздействия либо когда последнее играет роль пускового или предрасполагающего фактора. Особая роль в ее возникновении принадлежит депрессии. Последняя часто протекает скрыто и не осознается самими пациентами. Тесная связь депрессии с хронической абдоминальной болью объясняется общими биохимическими процессами и, в первую очередь, недостаточностью моноаминергических (серотонинергических) механизмов. Это подтверждается высокой эффективностью антидепрессантов, особенно ингибиторов обратного захвата серотонина, в лечении болевого синдрома. Характер психогенных болей определяется особенностями личности, влиянием эмоциональных, когнитивных, социальных факторов, психологической стабильностью больного и его прошлым «болевым опытом». Основными признаками данных болей являются их длительность, монотонность, диффузный характер и сочетание с другими локализациями (головная боль, боль в спине, во всем теле). Нередко психогенные боли могут сочетаться с другими, указанными выше типами болей и оставаться после их купирования, существенно трансформируя их характер, что необходимо учитывать при терапии.
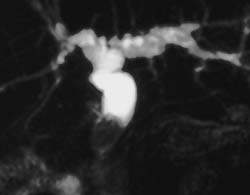 |
| Рисунок 2. Камень в общем желчном протоке у пациента после холецистэктомии (МРТ) |
Одной из разновидностей болей центрального генеза является абдоминальная мигрень. Последняя чаще встречается в молодом возрасте, носит интенсивный разлитой характер, но может быть локальной в параумбиликальной области. Характерны сопутствующие тошнота, рвота, понос и вегетативные расстройства (побледнение и похолодание конечностей, нарушения ритма сердца, артериального давления и др.), а также мигренозная цефалгия и характерные для нее провоцирующие и сопровождающие факторы. Во время пароксизма отмечается увеличение скорости линейного кровотока в брюшной аорте. Наиболее важными механизмами контроля болевого синдрома являются эндогенные опиатные системы. Опиатные рецепторы локализуются в окончаниях чувствительных нервов, в нейронах спинного мозга, в стволовых ядрах, в таламусе и лимбических структурах головного мозга. Связь данных рецепторов с рядом нейропептидов, таких как эндорфины и энкефалины, обусловливает морфиноподобный эффект. Опиатная система работает по следующей схеме: активация чувствительных окончаний приводит к выделению субстанции Р, что вызывает появление периферических восходящих и центральных нисходящих ноцицептивных (болевых) импульсов. Последние активизируют выработку эндорфинов и энкефалинов, которые блокируют выделение субстанции Р и снижают болевые ощущения.
Существенное значение в формировании болевого синдрома имеют серотонин и норадреналин. В структурах мозга находится большое количество серотонинергических и норадренергических рецепторов, а в состав нисходящих антиноцицептивных (противоболевых) структур входят серотонинергические и норадренергические волокна. Уменьшение уровня серотонина приводит к снижению болевого порога и усилению болей. Норадреналин опосредует увеличение активности антиноцицептивных систем.
Наличие болевого абдоминального синдрома требует углубленного обследования больного для уточнения механизмов его развития и выбора тактики лечения. Подавляющему большинству больных с наличием соматических болей, как правило, необходимо хирургическое лечение. Висцеральные боли, возникающие у больных как с наличием органических поражений органов пищеварения, так и без них, являются следствием нарушения, в первую очередь, моторной функции последних. В результате в полых органах повышается давление и/или наблюдается растяжение его стенки, и возникают условия для формирования восходящих ноцицептивных импульсов.
В регуляции транспорта ионов кальция участвуют ряд нейрогенных медиаторов: ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и приводит к открытию кальциевых каналов, через которые ионы кальция поступают в клетку, вызывая мышечное сокращение.
Серотонин оказывает существенное влияние на моторику желудочно-кишечного тракта, активируя ряд рецепторов, локализирующихся на эффекторных клетках. Выделяют несколько подтипов рецепторов (5-МТ1-4), однако наиболее изучены 5-МТ3 и 5-МТ4. Связывание серотонина с 5-МТ3 способствует расслаблению, а с 5-МТ4 — сокращению мышечного волокна. В то же время механизмы действия серотонина на мышечные волокна желудочно-кишечного тракта до конца не установлены. Имеются лишь предположения о вовлечении в эти процессы ацетилхолина.
Тахикинины, в состав которых входят три типа пептидов (субстанция Р, нейрокинин А и В), связываясь с соответствующими рецепторами миоцитов, повышают их моторную активность не только в результате прямой активации, но и вследствие выделения ацетилхолина. Определенную роль в регуляции моторной функции кишечника играют эндогенные опиаты. При связывании их с μ- и δ-опиоидными рецепторами миоцитов происходит стимуляция, а с κ-рецепторами — замедление моторики пищеварительного тракта.
Основные направления купирования болевого абдоминального синдрома включают: а) этиологическое и патогенетическое лечение основного заболевания; б) нормализацию моторных расстройств; в) снижение висцеральной чувствительности; г) коррекцию механизмов восприятия болей.
Нарушения двигательной функции органов желудочно-кишечного тракта играют значительную роль в формировании не только болевого синдрома, но и большинства диспепсических расстройств (чувство переполнения в желудке, отрыжка, изжога, тошнота, рвота, метеоризм, поносы, запоры). Большинство из указанных выше симптомов могут иметь место как при гипокинетическом, так и при гиперкинетическом типе дискинезии, и только углубленное исследование позволяет уточнить их характер и выбрать адекватную терапию.
Одним из наиболее частых функциональных нарушений, в том числе и с наличием органической патологии органов пищеварения, является спастическая (гиперкинетическая) дискинезия. Так, при спастической дискинезии любого отдела пищеварительного тракта наблюдается повышение внутрипросветного давления и нарушение продвижения содержимого по полому органу, что создает предпосылки для возникновения боли. При этом скорость нарастания давления в органе пропорциональна интенсивности боли.
Спастическая дискинезия мышечной оболочки стенки полого органа или сфинктеров представляет собой наиболее частый механизм развития болевого синдрома при эзофагоспазме, дисфункции сфинктера Одди и пузырного протока, синдроме раздраженного кишечника.
В настоящее время для купирования болевого синдрома в комплексном лечении вышеуказанных заболеваний используются релаксанты гладкой мускулатуры, которые включают несколько групп препаратов. Антихолинергические средства снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы. Последнее обстоятельство определяет существенные различия индивидуальной эффективности препаратов данной группы. В качестве спазмолитиков используют как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М1-холиноблокаторы (гастроцепин и др.). Однако довольно низкая эффективность и широкий спектр побочных эффектов ограничивают их применение для купирования болевого синдрома у значительной части больных.
Механизм действия миотропных спазмолитиков в конечном итоге сводится к накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Эти эффекты могут достигаться ингибированием фосфодиэстеразы, или активацией аденилатциклазы, или блокадой аденозиновых рецепторов, либо их комбинацией. Основными представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте, спазмол), бенциклан (галидор), отилония бромида (спазмомен), метеоспазмил и др. При использовании миогенных спазмолитиков, так же как и М-холиноблокаторов, необходимо учитывать существенные индивидуальные различия их эффективности, отсутствие селективности эффектов (действуют практически на всю гладкую мускулатуру, включая мочевыделительную систему, кровеносные сосуды и др.), развитие гипомоторной дискинезии и гипотонии сфинктерного аппарата пищеварительного тракта, особенно при длительном применении. Данные препараты используются кратковременно (от однократного приема до двух-трех недель) для купирования спазма, а следовательно, болевого синдрома.
В ряду миотропных спазмолитиков следует отметить препарат мебеверин (дюспатолин), механизм действия которого сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате прекращается фосфорилирование миозина и отсутствует сокращение мышечного волокна. Известно также, что выход ионов кальция из внутриклеточных депо в результате активации α1-адренорецепторов приводит к открытию калиевых каналов, выходу ионов калия из клетки, гиперполяризации и отсутствию мышечного сокращения, что может становиться в течение длительного времени причиной мышечной гипотонии. В отличие от других миотропных спазмолитиков мебеверин препятствует пополнению внутриклеточных кальциевых депо, что в конечном итоге приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации. Последняя предупреждает развитие постоянного расслабления или гипотонии мышечной клетки. Следовательно, назначение мебеверина (дюспатолина) приводит только к снятию спазма без развития гипотонии гладкой мускулатуры, т. е. не нарушает моторики желудочно-кишечного тракта. Препарат оказался эффективным для купирования абдоминальных болей и дискомфорта, нарушений стула, обусловленных синдромом раздраженного кишечника, а также возникающих на фоне органических заболеваний.
Среди миотропных спазмолитиков также обращает на себя внимание препарат гимекромон (одестон). Одестон (7-гидрокси-4-метилкумарин) оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, обеспечивает отток желчи в двенадцатиперстную кишку, снижает давление в билиарной системе и, как следствие, купирует билиарный болевой синдром. Одестон не обладает прямым желчегонным действием, но облегчает приток желчи в пищеварительный тракт, тем самым усиливая энтерогепатическую рециркуляцию желчных кислот, которые участвуют в первой фазе образования желчи. Преимущество одестона по сравнению с другими спазмолитиками заключается в том, что он практически не оказывает влияния на другие гладкие мышцы, в частности, кровеносной системы и кишечной мускулатуры.
Чрезвычайно перспективным направлением в лечении моторных расстройств является использование селективных блокаторов кальциевых каналов. В настоящее время из этой группы широкое распространение получил пинавериум бромид (дицетел). Дицетел блокирует потенциалзависимые кальциевые каналы миоцитов кишечника, резко снижает поступление в клетку экстрацеллюлярных ионов кальция и тем самым предотвращает мышечное сокращение. К числу достоинств дицетела относятся местное (внутрикишечное) действие препарата, тканевая селективность, отсутствие побочных, в т. ч. и кардиоваскулярных эффектов. Препарат можно применять в течение длительного времени, не опасаясь развития гипотонии кишечника. Клинические исследования показали высокую эффективность дицетела в лечении синдрома раздраженного кишечника и других заболеваний, при которых наблюдается спастическая дискинезия толстой кишки.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и механизмы восприятия болей. Это касается, в первую очередь, больных с функциональными заболеваниями желудочно-кишечного тракта (функциональная диспепсия, синдром раздраженного кишечника, функциональные абдоминальные боли и др.) и психогенными абдоминальными болями.
В настоящее время широко обсуждается возможность использования антидепрессантов, антагонистов 5-НТ3, агонистов κ-опиоидных рецепторов, аналогов соматостатина (октреотида). Из них лучше всего изучены антидепрессанты, реализующие противоболевой эффект двумя путями: 1) за счет уменьшения депрессивной симптоматики, учитывая тот факт, что хроническая боль может быть маской депрессии; 2) за счет активации антиноцицептивных серотонинергических и норадренергических систем. Антидепрессанты назначаются в терапевтических (но не в низких) дозах (амитриптилин 50-75 мг/сут., миансерин 30-60 мг/сут. и т. д.), продолжительность их приема должна составлять не менее 4-6 недель. Препараты эффективны в комплексной терапии.
Таким образом, генез абдоминальных болей является полиэтиологическим и полипатогенетическим. Лечение болевого синдрома должно быть направлено на нормализацию структурных и функциональных нарушений пораженного органа, а также на нормализацию функций нервной системы, отвечающих за восприятие болей.
Литература.
1. Вегетативные расстройства. Руководство для врачей. Под ред. проф. А.М. Вейна. М., 1998.
2. Вейн А. М., Данилова А. Б. Кардиалгии и абдоминалгии // РМЖ, 1999. 7, № 9. С. 428-32.
3. Григорьев П. Я., Яковенко А. В. Клиническая гастроэнтерология. М.: Медицинское информационное агентство, 2001. С. 704.
4. Ивашкин В. Т. Синдром раздраженной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. 1993, т. 2, № 3. С. 27-31.
5. Яковенко Э. П. Григорьев П. Я. Хронические заболевания внепеченочных желчевыводящих путей. Диагностика и лечение. Метод. пособие для врачей. М.: Медпрактика, 2000. С. 31.
Таблица 1. Этиология абдоминальных болей
Интраабдоминальные причины
Экстраабдоминальные причины
Примечание. Частота заболеваний в рубриках указана в убывающем порядке.