Абляция легочных вен что это
РЧА или криоаблация?
Донецкая О.П., Дзвониская В.Н.
Как известно, изоляция легочных вен, порождающих хаотические электрические сигналы, которые вызывают фибрилляцию предсердий, – стандартный метод лечения пациентов с фибрилляцией предсердий. При криобаллонной абляции с помощью охлаждающего вещества создаются круговые смежные зоны поражения и таким образом изолируются легочные вены, тогда как при радиочастотной абляции для этих целей используется тепло (радиочастотная энергия), но при этом дополнительно необходимы трехмерное картирование и пошаговое воздействие.
«Пламя и Лед» ( FIRE AND ICE) – самое широкомасштабное рандомизированное международное клиническое исследование, цель которого – сравнить два метода аблации, используемых для лечения фибрилляции предсердий, а именно криоаблации («Лед»), в которой применяются криобаллоны Arctic Front, и радиочастотной абляции («Пламя») с помощью радиочастотных аблационных катетеров ThermoCool
Результаты исследования, были представленные на шестьдесят пятой ежегодной научной сессии Американского колледжа кардиологии 2-4 апреля 2016 года и одновременно опубликованы в журнале The New England Journal of Medicine.
Руководителем исследования выступил известный профессор Карл-Хайнц Кук (Karl-Heinz Kuck), директор кардиологического отделения клиники Asklepios Klinik St. Georg в Гамбурге, Германия.
В ходе исследования было задействовано 769 пациентов из 16 медицинских центров по всей Европе. Все субъекты исследования имели диагноз «пароксизмальная фибрилляция предсердий», у них был неэффективен хотя бы один антиаритмический лекарственный препарат, и после первой аблационной процедуры они наблюдались у врача не дольше 33 месяцев (среднее значение = 1,54 года). Основная задача исследований такого типа – доказать, что новая технология сопоставима с общепринятой существующей технологией.
В ходе исследования была достигнута первичная конечная точка по критерию эффективности – доказано, что криобаллонные аблация не уступает радиочастотной аблации (p=0,0004) с точки зрения снижения частоты рецидивов аритмии или необходимости в антиаритмической медикаментозной терапии и/или повторной абляции. Также была достигнута первичная конечная точка по критерию безопасности, а именно по времени до первой смерти по любой причине, до инсульта или ТИА (транзиторная ишемическая атака) по любой причине либо до серьезных нежелательных явлений в связи с лечением (p = 0,24).
Обе технологии показали сравнимые низкие коэффициенты возникновения осложнений. Согласно результатам исследования, технология криобаллонной аблации обеспечивает более короткую продолжительность процедур (среднее значение = 124 минуты) в сравнении с группой радиочастотной абляции (среднее значение = 141 минута; p = 0,0001), однако при этом применение радиочастотного катетера позволяет использовать рентгеноскопию более короткое время (среднее значение = 17 минут) по сравнению с криобаллонным аблационным катетером (среднее значение = 22 минуты; p = 0,0001).
Авторы исследования заявили, что, по их мнению, полученные результаты будут способствовать тому, что интервенционные аритмологические вмешательства перестанут быть уделом узкоспециализированных клиник и станут доступны врачам с менее высоким уровнем подготовки. Если аблацию фибрилляции предсердий можно будет проводить легко и с достаточным уровнем безопасности, то, вероятно, лечение будет получать большее количество пациентов и, возможно, на более ранней стадии заболевания. Возможно, когда-то с фибрилляцией будут поступать так же, как сейчас рекомендуется делать при синдроме WPW — выполнять вмешательство после первого же пароксизма.
Несмотря на то, что обсуждаемое исследование было проведено на не очень большой выборке пациентов, ожидается, что полученные результаты могут изменить существующие клинические рекомендации. В частности, возможно, ее учтут эксперты, работающие в настоящее время над третьим обновлении консенсусного заявления Общества по изучению сердечного ритма (HRS).
В июне 2016 года на последнем европейском конгрессе CARDIOSTIM были представлены результаты, касающиеся вторичных конечных точек. Исследование продемонстрировало значительно меньшее количество потребности в повторных аблациях и более низкие показатели госпитализации больных с пароксизмальной формой фибрилляции предсердий в группе изоляции легочных вен с помощью криобаллона. Качество жизни оценивали исходно и через 6 месяцев после процедуры, данные были сопоставимы в исследуемых группах.
Таким образом, криобаллонная аблация – безопасный и эффективный метод, который позволяет сократить продолжительность процедуры, сделать график лечения более предсказуемым по времени, уменьшить потребность в повторных процедурах, снизить количество госпитализаций и улучшить качество жизни больных.
Статья добавлена 27 июня 2016 г.
Криобалонная или радиочастотная аблация: основные результаты исследования NO-PERSAF
Актуальность
Изоляция устьев легочных вен при помощи аблации – основной хирургический метод лечения фибрилляции предсердий. К сожалению, его эффективность далека от оптимальной.
В обсуждающемся исследовании сравнивались две техники аблации – с использованием радиочастотного катетера и криобаллона.
Методы
Рандомизированное исследование NO-PERSAF выполнялось в Норвегии. Его участниками были пациенты с симптомной персистирующей фибрилляцией предсердий. В соотношении 1:1 участники рандомизировались в группы радиочастотной и криобаллонной аблации.
Первичной конечной точкой в исследовании был рецидив предсердной тахиаритмии, длительностью более 30 с, спустя 3 месяца после вмешательства.
В исследование был включен 101 пациент. Наблюдение за каждым из них продолжалось в течение 12 месяцев с момента вмешательства.
Предсердные тахиаритмии не были зарегистрированы у 36 из 52 пациентов в группе криоаблации и у 30 из 49 пациентов в группе радиочастотной аблации (69.2 против 61.2%; p=0.393).
Частота рецидивов фибрилляции предсердий также была сопоставима между двумя группами (27.5% в группе криоаблации и 38% в группе радиочастотной аблации; p=0.258). Продолжительность процедуры криоаблации была меньше (160 против 197 мин; p
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Радиочастотная катетерная абляция (РЧА) сердца.
Радиочастотная катетерная абляция (РЧА) сердца.
РЧА сердца – хирургическое катетерное вмешательство, с использованием специальных катетеров, пункционно введенных в полость сердца через сосуды, и радиочастотной энергии, направленное на устранение нарушений сердечного ритма (аритмии).
Радиочастотная абляция — один из самых современных методов лечения некоторых видов нарушений ритма сердца. Этот вид лечения относится к малоинвазивным вмешательствам, так как для его проведения не требуется никаких разрезов и доступов к сердцу, но иногда РЧА выполняется при операциях на открытом сердце. Радиочастотная абляция проводится с помощью тонкого гибкого катетера-проводника, который вводится через кровеносный сосуд и подводится к источнику неправильного ритма в сердце, вызывающего аритмию. Далее по этому проводнику подается радиочастотный импульс, который разрушает участок ткани, отвечающий за неправильный ритм. Впервые высокочастотную энергию для устранения дополнительных АВ-путей проведения, применяемую и по сей день, произвели в 1986 году М.Borggrefe и соавт. С этого времени и началось бурное развитие интервенционной аритмологии в лечении аритмий сердца.
Подобная деструкция патологического очага может осуществляться также путем прочих физических воздействий, в соответствии с чем выделяют и другие виды абляции:
Показаниями к проведению РЧ-абляции являются нарушения сердечного ритма, которые уже невозможно скорректировать медикаментозно:
Наряду с показаниями к РЧА, абляция имеет и перечень противопоказаний:
Радиочастотная (РЧ) энергия имеет широкий диапазон и зависит от сопротивления и диэлектрических свойств тканей. Радиочастотный ток – это ток с меняющейся полярностью при частоте от 30 кГц до 300 МГц. Все генераторы РЧ тока, используемые для аблации, работают в диапазоне 300 кГц — 1 МГц. Для аблации структур сердца применяют немодулированный ток, поскольку именно он приводит к образованию коагуляционного некроза.
Существует два варианта подачи электрической энергии: монополярный и биполярный. При монополярной аблации переменный ток проходит между дистальным концом «активного» электрода через ткани к «пассивному» электроду на поверхности грудной стенки. Обычно «пассивным» или референтным электродом служит пластина. Эксперименты показали, что позиция пластины незначительно влияет на размер воздействия, в то время как увеличение ее площади ведет к отклонению импеданса и приводит к увеличению энергии и перегреву электрода. В случае биполярной коагуляции ток проходит между двумя активными электродами в полостях сердца.
Прогрессивное воздействие достигается благодаря созданным устройствам контроля температуры высокочастотной энергии (Haverkampf et al. 1991). Контроль температуры означает, что температура на конце катетера не только изменяется в течение процесса коагуляции, но и поддерживается на определенном уровне благодаря механизму обратной связи для подаваемой мощности. Такое устройство позволяет создавать ограниченное поражение с предсказуемой степенью in vitro и обеспечивает хороший контакт между электродом, вызывающим аблацию, и миокардом. Мониторинг температуры становится практически сложным при увеличении размера электрода или его геометрии. Так, например, для линейной аблации ФП и ТП используются удлиненные электроды, имеющие одну термопару, таким образом невозможно предсказать какой стороной происходит контакт поверхности электрода с эндокардом и температура краевой повехности может оказаться намного выше, чем тела электрода, где расположен термодатчик. Таким образом, температура в серединной точке остается недооцененной.
В некоторых экспериментальных исследованиях продемонстрирован трехмерный окончательный элементарный анализ влияния геометрии электрода, угла наклона контакта электрод-ткань и циркуляции окружающей крови на размер аблационного повреждения.
Длительность радиочастотной аблации так же является важным критерием, влияющим на трансмуральность воздействия. Наибольшее увеличение размера повреждения происходит в течение первых 30 секунд аблации, а затем наступает плато.
Некоторое усовершенствование аблации было достигнуто в результате использования электрода с охлаждением наконечника инфузией физиологического раствора. Такая конструкция позволяет использовать высокие цифры энергии воздействия, увеличивая размер повреждения, но избегая при этом высоких цифр импеданса. Эта концепция была подтверждена в экспериментах in vivo и in vitro. Охлаждение в течение аблации приводит к повышению температуры глубже поверхности эндокарда. Максимальная температура регистрируется на глубине 1 мм и более от поверхности эндокарда, таким образом даже выше, чем в области контакта электрода с поверхностью эндокарда. Катетеры для холодовой аблации могут быть закрытого типа, когда охлаждающий раствор циркулирует внутри системы и открытого типа, имеющие маленькие дырочки через которые происходит орошение электрода и жидкость вытекает наружу.
Таким образом, радиочастотная аблация является безопасной и эффективной методикой. В ходе проведения экспериментальных исследований не отмечено возникновения таких серьезных осложнений, как аритмии, расстройства гемодинамики, ишемия, тромбоз или эмболия. Наибольшую опасность представляет собой перегревание и последующее повреждение аблационного катетера и выпаривание ткани. С целью ограничения риска этих осложнений многие исследователи считают необходимым проводить измерение биофизических параметров (сила тока, напряжение, температура) на конце катетера.
Возможные осложнения РЧА сердца делятся на 4 группы:
4.Осложнения, обусловленные радиочастотным воздействием (АВ-блокада)
5. Случайное нарушение целостности тканей сердечной мышцы в момент абляции.
6. Сбои в работе электрической системы сердца, усугубляющие нарушение сердечного ритма и требующие трансплантации кардиостимулятора.
7. Стеноз легочных вен, т. е. сужение их просвета.
Осложнения после РЧА сердца крайне редки: вероятность негативных последствий абляции не превышает 1%. Потому РЧА причисляется к категории операций с малой степенью риска. Однако для профилактики осложнений существует ряд специальных мер, принимаемых на каждом из этапов обнаружения и лечения тахикардии.
Риск подобных осложнений повышается в тех случаях, когда пациент является диабетиком, если у него нарушена свертываемость крови, а также если он преодолел 75-летний возрастной порог.
Данная операция относится к классу малоинвазивных вмешательств. Преимущества же такого хирургического вмешательства очевидны: минимальная травматичность, как правило, отсутствие необходимости в назначении общей анестезии, небольшая продолжительность операции, короткий послеоперационной койко-день
Как подготовиться к РЧА.
Подготовка к данной операции заключается в проведении электрофизиологического исследования (ЭФИ) сердца. Необходимость РЧА у конкретного пациента констатируется его лечащим врачом на основании истории заболевания и данных таких диагностических методов, как:
После регистрации с помощью ЭКГ приступа тахикардии пациент госпитализируется в стационар для прохождения полного курса обследования и сдачи перечня необходимых анализов, на основе которых ему может быть назначена радиочастотная абляция сердца:
Общие принципы подготовки к операции включают в себя:
• Последний прием пищи вечером накануне операции (12 часов голода).
• В месте установки катетера (паховая и подключичная область) должны быть выбриты волосы
• В ночь перед исследование проводиться очищение кишечника.
• Спросите своего врача, следует ли вам принимать обычные лекарства утром.
• Все антиаритмические препараты отменяются за 2–3 дня до исследования (пять периодов полувыведения), для кордарона это 28 дней.
• Если у вас сахарный диабет, спросите своего врача, следует ли Вам принимать инсулин или другие сахароснижающие пероральные препараты перед исследованием.
Методика проведения РЧА сердца.
РЧА сердца проводится в плановом порядке в специально оборудованной операционной, оснащенной:
• рентгенотелевизионной системой для рентгеноскопии и/или рентгенографии;
• оборудованием для слежения за жизненно важными функциями организма и проведения реанимационных мероприятий (дефибриллятор, дыхательный аппарат, мониторы);
• специализированным ЭФИ-оборудованием для записи поверхностных электрокардиограмм и внутрисердечных электрограмм и снабженным
• специализированным электрокардиостимулятором и набором инструментов для проведения катетеризации сердца и электродов-катетеров для проведения ЭФИ и РЧА;
• защитным оборудованием для пациента и персонала (костюмы, фартуки, очки, передвижные стенки и т. д.).
Пациент для проведения операции РЧА поступает в операционную натощак, в слегка седатированном состоянии. Области предполагаемых пункций сосудов тщательно обрабатываются и накрываются стерильным бельем. Проведение катетеров всегда производится с использованием чрескожной техники. Для пункции используются обычно бедренные вены справа и/или слева, подключичная вена слева и/или справа и яремная вена справа, а также вены предплечья. Для артериального доступа обычно используется правая бедренная артерия, однако возможна пункция бедренной артерии слева и лучевых артерий.
Местная анестезия места пункции, после этого производится пункция вены с помощью иглы, которая вводится в сосуд, и проводится необходимой длины проводник, после чего игла вытаскивается. Далее по проводнику вводится интродьюсер, а затем электрод-катетер в соответствующую камеру сердца. Разместив катетеры в различных камерах сердца, их подключают к соединительной коробке, которая переносит электрические сигналы от электродов в сердце к записывающему оборудованию и позволяет стимулирующему импульсу от ЭКС достигать поверхности различных камер сердца. Выполняется ЭФИ сердца. Электрические сигналы, полученные от эндокардиальной поверхности сердца, фильтруются, усиливаются и выводятся на мониторе компьютера. Программируемый ЭКС должен обладать способностью для постоянной и программируемой стимуляции, подачи множества экстрастимулов (до 7), регулировки амплитуды и длительности импульса, а также возможностью воспринимать внешние и внутрисердечные сигналы.
При проведении ЭФИ пациент может ощущать дискомфорт в грудной клетке, сердцебиения, небольшую болезненность. Ощущения, возникающие при проведения ЭФИ, в виде перебоев сердца, секундных остановок, ускорения или замедления ритма являются результатом работы врача, т.е с помощью электрических импульсов, подаваемых непосредственно в сердце, врач полностью контролирует сердцебиение, провоцируя приступ сердцебиения или прекращая его во время поиска аритмогенных участков. При обнаружении аритмогенных зон (дополнительных предсердно-желудочковых соединений, эктопической активности и т. п.) на нее воздействуют радиочастотной энергией с помощью «лечебного» электрода. После чего в обязательном порядке (примерно через 20 минут) проводят еще раз ЭФИ для оценки эффективности воздействия. Если электрофизиологические показатели удовлетворяют врача, то операцию заканчивают. Удаляют катетеры. На места пункций накладывают гемостатические (давящие) повязки.
Вас переводят в отделение и назначают постельный режим в положении на спине на несколько часов (в некоторых случаях до суток) с целью предупреждение кровотечения из места пункции. Наблюдение в стационаре от одного до 3 дней.
Хирургическое лечение фибрилляции предсердий
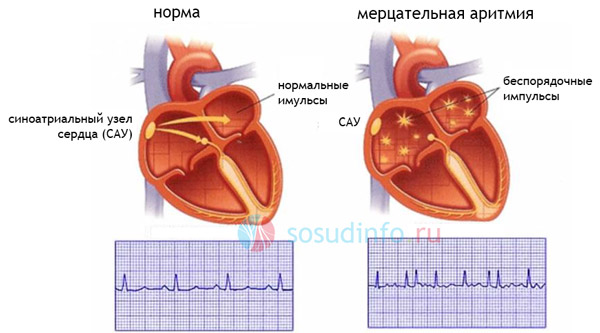
Фибрилляцией предсердий (ФП) в медицинской терминологии называется нарушение ритма сердца (мерцательная аритмия). Оно может быть спровоцировано повышенным количеством электрических контуров в предсердиях, которые приводят к беспорядочным сокращениям желудочков сердца и к недостаточности эффективного сокращения предсердий. Это, в свою очередь, становится причиной образования сгустков крови в предсердиях, что может в итоге привести к закупорке сосудов головного мозга и смерти пациента.
Среди основных методов лечения при мерцательной аритмии на сегодняшний день – медикаментозная терапия, катетеризация, а также хирургическая лабиринтная методика (Maze) – довольно сложная и потому не очень популярная среди кардиохирургов.
«Новым словом» в лечении мерцательной аритмии стала радиочастотная абляция сердца (РЧА) устьев легочных вен – малоинвазивная операция путем небольших проколов, осуществляемая с применением последних компьютерных технологий и в условиях постоянного рентгеновского контроля.
После абляции: хаотичные импульсы, провоцирующие аритмию, не могут попадать в полость предсердия
Реабилитация после РЧА
В целом реабилитация после РЧА длится несколько месяцев, в течение которых пациенту может быть назначен прием антиаритмических препаратов (к примеру, «Пропафенон», «Пропанорм» и др.), в том числе и тех, которые больной принимал до абляции. Постельный режим с контролем сердечного ритма и артериального давления показан больному лишь в самые первые сутки после операции, в течение которых происходит быстрое восстановление и стабилизация нормального общего самочувствия пациента. Необходимость же повторной РЧА, как показывает практика, у прооперированных пациентов возникает реже, если пациент пересмотрит свой привычный образ жизни:
Результаты абляции
Абляция сердца может быть успешной, но некоторым больным приходится повторять процедуру. Возможно, придется принимать лекарственные препараты, даже после проведения абляции.
Медицинские интернет-конференции
Языки
Случай успешного проведения поэтапных операций электрофизиологического исследования и радиочастотной аблации устьев легочных вен и правого перешейка
Резюме
Ключевые слова
Обзор
Введение.
Введение.
Фибрилляция предсердий (ФП) — одна из наиболее часто встречаемых в клинической практике тахиаритмий, ее распространенность в общей популяции колеблется от 0,3 до 0,4%. Выявляемость ФП увеличивается с возрастом. Так, среди людей до 60 лет она составляет приблизительно 1% случаев, а в возрастной группе старше 80 лет — более 6%. Около 50% пациентов с фибрилляцией предсердий в США — лица старше 70 лет, и более 30% госпитализированных в связи с нарушениями ритма сердца составляют больные с этой аритмией [1,2]. ФП также является наиболее частым нарушением ритма сердца, возникающее после кардиохирургических операций. Частота развития ФП в раннем послеоперационном периоде при трансплантации сердца составляет около 11%, при аортокоронарном шунтировании – 25–30%, при коррекции клапанной патологии – 33–49%, при сочетанных операциях – до 60%. Около 95% случаев развития ФП приходится на первые 6 сут после операции 3.
Трепетание предсердий (ТП) — существенно менее распространенная аритмия по сравнению с ФП. В большинстве стран ФП и ТП рассматриваются как разные нарушения ритма и не объединяются общим термином «мерцательная аритмия».
Клинический случай.
Пациентка И. 59 лет обратилась в отделение хирургического лечения интерактивной патологии ФГБНУ НЦ ССХ им.А.Н. Бакулева с жалобами на эпизоды учащенного сердцебиения возникающие без связи с чем либо, купирующиеся самостоятельно или введением кордарона. Впервые пароксизмы нарушения ритма появились у пациентки около 6 лет назад. Обратилась к врачу по месту жительства. Было проведено комплексное обследование и лечение по месту жительства.
На представленных ЭКГ – ритм фибрилляция предсердий (рисунок 1).
Назначенную медикаментозную терапию принимает регулярно – соталекс, аллапин, варфарин. Однако, в течение последующего года состояние больной ухудшалось – пароксизмы нарушения ритма стали беспокоить чаще. В связи с чем было предложено оперативное лечение – ЭФИ РЧА устьев легочных вен, что было успешно проведено.
В дальнейшем отмечает повторное появление пароксизмов, которые купировались внутривенным введение противоаритмических препаратов (кордарон, электролитные растворы).
По данным ЭхоКГ: левый желудочек: КСР = 3,6 см, КДР = 5,6 см, КДО = 154 мл, КСО = 54 мл, ФВ (Teicholtz) = 61 %. Недостаточность митрального клапана 1 степени. По данным ХМ-ЭКГ: Ритм синусовый с мин ЧСС 78 в мин. Максимальная ЧСС 122 в мин (пароксизм трепетания предсердии с проведением 2/1). Средняя ЧСС за сутки 62/65/54. Нарушение АВ-проводимости и данных за СССУ не получено.
Пациентка госпитализирована для проведения операции электрофизиологического исследования и радиочастотной аблации правого перешейка.
Выполнено ЭФИ: Антеградное проведение по ГПС. АТВ = 360 мс, АЭРП АВУ = 300 мс, Ретроградно VA diss. Максимальное КВВФСУ = 260 мс. Методами постоянной и программированной стимуляции трепетание предсердий индуцировать не удалось.
Пациентка выписана из стационара на 3 сутки после операции в удовлетворительном состоянии на синусовом ритме с ЧСС 78 в мин, без признаков нарушения проводимости сердца.
Рекомендовано выполнение Холтеровского мониторирования ЭКГ через 1 месяц – с целью коррекции медикаментозной терапии. Также рекомендовано выполнение ЭхоКГ каждые полгода для оценки функции митрального клапана (исходно регургитация 1 степени).
Заключение.
Л.А. Бокерия, А.Ш. Ревишвили с коллегами с 1991 г по 1995 г впервые в России выполнили 20 операций по изоляции левого или правого предсердия для лечения ФП и ТП и пришли к заключению, что различные операции изолирующего характера можно эффективно использовать для лечения сложных форм наджелудочковых аритмий, включая ФП и ТП [6].
Известно, что постоянная антиаритмическая терапия имеет много побочных эффектов и полностью не избавляет от данного заболевания, что снижает качество жизни и трудоспособность пациентов. Кроме того, высок риск развития таких осложнений, как тромбоэмболия и возникновение сердечной недостаточности, что усугубляет течение заболевания и нередко является причиной летальных исходов [7,8]. Проводимые во всем мире поиски альтернативных подходов лечения к лечению ФП в сочетании с типичной формой ТП позволили углубить понимание патофизиологических механизмов, приводящих к развитию и поддержанию данных видов аритмий.
Успешная радиочастотная абляция перешейка правого предсердия при типичном трепетании предсердий при сочетании с фибрилляцией предсердий может изменить клиническую манифестацию пароксизмальной формы ФП. Однако источник эктопических фокусов, запускающих ФП может быть локализован в легочных венах. Эффективность ограниченной блокады истмуса при сопутствующей ФП остается невыясненной. Типичное трепетание предсердий, поддерживаемое циркуляцией волны возбуждения в правом предсердии, может быть устранено при помощи абляции перешейка правого предсердия, а при сочетании ТП с переходом в ФП дополнительно использовать антиаритмическую терапию, которая в дальнейшем может уменьшить возникновение пароксизмов ФП.
В соответствии с теорией M.Haissaguerre, изучавшего механизм начала пароксизмальной ФП, следует, что ФП может быть инициирована ранними экстрасистолами в легочных венах и устранение этих запускающих фокусов может предотвратить или излечить ФП.
У данной пациентки первым этапом проведена успешная операция ЭФИ и РЧА легочных вен. В послеоперационном периоде у пациентке стали возникать пароксизмы типичного трепетания предсердий. И пациентке была успешно выполнена операция ЭФИ и РЧА правого перешейка.