Аденовирус ад5 что это
Ad5-nCoV (Convidicea)
Вакцина Ad5-nCoV
Векторные вакцины, такие как «Спутник V» и «Конвиденция», — из генома целевого вируса вычленяют необходимый ген (кусочек ДНК или РНК), который кодирует синтез белка, отвечающего за проникновение вируса в клетку человека. Если заблокировать этот белок, то при попадании в организм вирус не сможет пробраться внутрь клетки и будет инактивирован. Поэтому главная задача этой технологии — найти нужный ген.
К плюсам векторных вакцин можно отнести высокую иммуногенность — при их введении формируется достаточно высокий титр защитных антител. Это самые современные технологии создания вакцин — генная инженерия в чистом виде.
Вакцина
Разработчик
CanSino Biologics Inc., Китай.
Производитель
CanSino Biologics Inc., Китай.
Стадия
Компания CanSino получила разрешение Минздрава РФ на участие в масштабном международном исследовании III фазы по оценке эффективности и иммуногенности вакцины Ad5-nCoV. Международное исследование проводится в партнерстве с российской компанией «Петровакс». В клиническом исследовании принимают участие более 40 тыс. добровольцев, в том числе 8 тыс. граждан России. Первые группы добровольцев уже успешно вакцинированы. Они чувствуют себя хорошо, ни у кого из них не выявлено серьезных нежелательных явлений.
Основная информация
Из чего состоит вакцина?
Вакцина основана на нереплицирующемся вирусном векторе, используется рекомбинантный аденовирус человека 5 серотипа (Ad5)
Что такое аденовирус
Что если вам скажут, будто одна и та же группа вирусов может вызывать все на свете заболевания, – от банальной простуды до инфекций мочевого пузыря? Несколько странно, не так ли? И определенно это не та новость, которую хотелось бы услышать в преддверии гриппозно-простудного сезона (за что просим прощения).
Однако это соответствует действительности: представители группы патогенов, называемых аденовирусами, в некоторых случаях могут быть смертельно опасны. Корреспондент сайта « Health » обратился к эксперту в области инфекционных болезней за разъяснениями вопросов о том, что в сущности представляют собой аденовирусы, какие симптомы они могут вызывать и как можно вылечиться.
И вот что необходимо знать.
Согласно информационным материалам Центров по контролю и профилактике заболеваний (CDC), аденовирусами называют группу обычных вирусов, способных вызывать широкий спектр заболеваний, включая обычную простуду, желудочный грипп, ангину, бронхит, диарею, эпидемический конъюнктивит, лихорадку, – словом, все заболевания, протекающие с умеренно выраженной симптоматикой и, как правило, поддающиеся лечению в домашних условиях. Однако некоторые штаммы аденовирусов приводят к более серьезным проблемам, например, к инфекциям мочевых путей или воспалению легких.
Поскольку аденовирусы чрезвычайно разнообразны, вызываемая ими симптоматика также варьирует очень широко. В основном, развиваются респираторные заболевания и конъюнктивиты. Это означает, что именно аденовирусы «виновны» в большинстве регистрируемых случаев кашля, хрипов и зудящих красных глаз.
Отличие аденовирусов от прочих вирусов (например, от вируса гриппа) заключается в том, что первые не обязательно предпочитают холодное время года. «Аденовирусные инфекции наблюдаются круглогодично, – говорит Фрэнк Эспер, доктор медицины, педиатр, специализирующийся на инфекционных болезнях в Кливлендской клинике. – Лето нравится аденовирусу не меньше, чем зима».
Наиболее типичный путь распространения аденовирусной инфекции – через прямой контакт, например, прикосновение, кашель, чихание, рукопожатие, или же через прикосновение к зараженной поверхности с последующим касанием собственного рта, носа, глаз. Реже аденовирусы распространяются через инфицированный кал (при смене подгузника больному ребенку, например) или через воду (в общественных бассейнах и т.п.).
«Могут ли аденовирусы представлять опасность для жизни? – В некоторых случаях, да. Восемнадцатилетняя студентка колледжа при Университете Мэриленда умерла от аденовирусной инфекции во время эпидемической вспышки 2018 года, когда заболело 40 студентов и 15 из них пришлось госпитализировать».
«Как правило, – продолжает доктор Эспер, – под угрозой оказываются лица с ослабленной иммунной системой. Если у вас практически нет иммунитета, тогда аденовирус становится действительно серьезной проблемой».
Именно это случилось с погибшей девушкой, которая, как сообщает « Washington Post «, страдала и боролась с болезнью Крона, – разновидностью хронического кишечного воспаления, – постоянно принимая поддерживающие препараты в связи с данным заболеванием (определенные группы медикаментов, – используемые, в частности, для контроля болезни Крона и лечения рака, – в индивидуальных случаях могут стать причиной иммунодефицитного состояния).
Впрочем, аденовирусы могут становиться опасными даже для лиц с нормально функционирующей иммунной системой. Случится это или нет, зависит от конкретных осложнений аденовирусной инфекции. «Скажем, вирусный миокардит, т.е. воспаление сердечной мышцы, – объясняет доктор Эспер, – может развиться и у иммунокомпетентного человека, и это осложнение может стать фатальным».
«Существует ли лечение от аденовирусов? – Нет, специфическая терапия аденовирусных инфекций пока не разработана, и применяемые в этих случаях безрецептурные лекарства служат лишь для облегчения симптоматики (т.е. для устранения болей или лихорадки, снижения температуры и т.д.)».
В связи с этим приходится повторять, что лучшим средством против аденовирусных инфекций является их профилактика. Это означает частую и тщательную гигиену рук, исключение случаев употребления пищи или напитков из общей с контагиозным человеком посуды, и избегание любых людей, кто открыто кашляет или чихает (возможно, стоило бы им напомнить: хотя бы используйте локоть, пожалуйста).
В экстремальных случаях применяется препарат под названием цидофовир, но, опять же, его назначают крайне редко. По словам Ф.Эспера, «препарат очень токсичен, он сам по себе может стать причиной тяжелого состояния, например, почечной недостаточности. Обычно мы воздерживаемся от этиотропного лечения аденовирусов и прибегаем к выжидательной тактике. Больной должен быть в очень тяжелом состоянии, чтобы пришлось назначать эти медикаменты».
В общем и целом, для здорового человека аденовирусы не должны составлять особую проблему, – тем не менее, будет разумным соблюдать все меры предосторожности и, если вы все же заболели, защитить близких людей с помощью санитарно-гигиенического режима.
«Абсолютных ответов пока нет»: могут ли «Спутник V» и другие вакцины на основе аденовирусов увеличивать риск инфицироваться ВИЧ?
Петр Сапожников
В октябре прошлого года группа исследователей опубликовала в журнале The Lancet открытое письмо с тревожным предупреждением: по мнению ученых, вакцины от COVID-19 на основе аденовирусов могут увеличивать риск инфицироваться ВИЧ среди некоторых групп людей. Такой вывод авторы сделали, разрабатывая вакцину от ВИЧ под названием STEP — ее тоже планировали доставлять в организм с помощью аденовируса Ad5. Для России это тревожная новость, ведь в «Спутнике V» от Центра им. Гамалеи в качестве вектора (то есть носителя генетической информации коронавируса) используют именно аденовирусы, а в стране продолжается эпидемия ВИЧ.
«СПИД.ЦЕНТР» узнал у ведущих эпидемиологов, насколько серьезно они относятся к заявлению разработчиков STEP и стоит ли из-за этого переживать. А еще мы попытались выяснить, как принять решение о вакцинации от ковида людям, живущим с ВИЧ, и какую вакцину лучше выбрать, если у вас есть возможность выбирать.
Вакцина, с которой все началось
19 октября 2020 года журнал The Lancet опубликовал открытое письмо группы ученых, которые более 10 лет назад участвовали в исследовании вакцины против ВИЧ под названием STEP. Вакцина оказалась неэффективной, но по итогам исследования ученые сделали неожиданный вывод: необрезанные мужчины, получившие вакцину на основе аденовируса Ad5 и ранее встречавшиеся с этим вирусом в естественных условиях, в несколько раз сильнее рисковали инфицироваться ВИЧ по сравнению с группой плацебо. Среди мужчин, уже столкнувшихся с Ad5 и получивших настоящую вакцину, за год ВИЧ заболели 5,1 % (при этом в группе получивших плацебо заболели только 2,2 %). В группе необрезанных мужчин разница была еще более значимой — среди вакцинированных заболели ВИЧ 5,2 %, а получивших плацебо — всего 1,4 %. При этом как у женщин, так и мужчин, которые прошли обрезание, риск получения ВИЧ не увеличивался.
До сих пор неясно, как именно вакцина STEP могла увеличивать риск передачи ВИЧ. В статье The Lancet описано несколько вариантов, в том числе ослабление иммунитета к ВИЧ, усиление репликации вируса или увеличение числа «клеток-мишеней».
Авторы открытого письма задаются вопросом, могут ли вакцины против COVID-19 на основе аденовируса Ad5, который использовался в STEP, повысить риск получения ВИЧ, и «выражают свою озабоченность» по этому поводу. Сейчас вакцины на основе аденовирусов разрабатывают сразу несколько компаний — это российский Центр им. Гамалеи, китайская CanSino, Oxford совместно с AstraZeneca (Великобритания), Johnson & Johnson вместе с Janssen (США), ImmunityBio (США) и другие. При этом именно аденовирус Ad5 в качестве вектора используют Центр им. Гамалеи, CanSino и ImmunityBio.
Вакцинация «Спутником V» Центра им. Гамалеи проходит в два этапа: сначала в качестве вектора используется вирус Ad26, а через 21 день делается повторная вакцинация вторым компонентом на основе Ad5. Это связано с еще одним предполагаемым недостатком вакцин на основе аденовирусов — люди, уже столкнувшиеся с аденовирусом-вектором до прививки и получившие к нему иммунитет, могут иметь более слабый иммунный ответ. При этом Ad5 — один из самых распространенных аденовирусов в мире, а Ad26 встречается гораздо реже.
Что о ситуации думают исследователи из Центра Гамалеи?
«СПИД.ЦЕНТР» отправил в Центр им. Гамалеи официальный запрос с просьбой прокомментировать открытое письмо разработчиков STEP.
«Применение аденовируса в качестве вектора при создании вакцин началось довольно давно — с 50-х годов прошлого века. Поэтому к настоящему времени накопилось довольно много информации об этой векторной модели и успешных вакцинных проектов в отношении разных возбудителей, где не обнаружен эффект увеличения инфицированности ВИЧ при применении Ad5 вектора. Поэтому результаты проекта STEР трактуются специалистами различных исследовательских групп как “нечеткие”», — ответили нам в организации. Также пресс-служба Центра напомнила, что «заражение ВИЧ-инфицированных другими возбудителями инфекционных заболеваний: вирусом гепатита С, герпесвирусами, микобактериями туберкулеза — приводит к ухудшению течения болезни». Кроме того, в ответе Центр им. Гамалеи, помимо стандартных рекомендаций по защите, посоветовал после вакцинации обращать внимание на слизистую половых органов. «Возможно, что любое воспаление в области крайней плоти, связанное со временем введения вакцины и в процессе проведения испытаний, может увеличить риск заражения ВИЧ».
В октябре прошлого года открытое письмо разработчиков STEP прокомментировал главный научный сотрудник Института им. Гамалеи Анатолий Альтштейн. Тогда ответ был более четким: «Этот вектор не размножается в организме человека. Что касается антигенного воздействия, то на человека действует очень много антигенов, различные инфекции, из кишечника поступают антигены бактерий, и заявления, что именно аденовирус, не размножающийся аденовирусный вектор, что-то усиливает и изменяет, необоснованы». Также Альштейн раскритиковал разработчиков STEP: «Вакцинами против ВИЧ занимаются уже тридцать лет и еще лет пятьдесят будут заниматься, и все время будет вот так. Эти исследования сосут деньги, и серьезного результата там получить, скорее всего, невозможно», — заявил ученый.
Письмо китайским руководителям
Исследователи из китайской CanSino еще в июне 2020 года признали, что у них «существуют опасения» по поводу повышенного риска получения ВИЧ после вакцинации. В статье The Lancet, посвященной первой фазе исследований, китайские ученые пишут, что связь между повышенным риском инфицирования ВИЧ и вакцинами с вектором Ad5 является спорным вопросом, а ее механизм неясен. При этом в CanSino обещали учитывать потенциальные риски и наблюдать за участниками во 2 и 3 фазах, в том числе и в контексте ВИЧ.
Разработчики STEP, написавшие открытое письмо в The Lancet, особенно опасаются того, что вакцины на основе Ad5 могут появиться в регионах с высокой распространенностью ВИЧ, в том числе в африканских странах. Представители CanSino надеются, что риск повышенной восприимчивости к ВИЧ может быть ограничен только вакцинами на основе Ad5, которые производят белок вируса иммунодефицита человека (как в случае со STEP), но признают, что четкого ответа на вопрос пока нет. При этом власти Китая ранее уже одобрили использование вакцины на основе Ad5 против лихорадки Эбола, которую CanSino испытывала в Сьерра-Леоне. Из-за распространенности ВИЧ в этой стране шансы на выявление проблемы, по мнению разработчиков, были особенно высокими, но в итоге вакцина была признана безопасной.
В России испытаниями и локализацией производства вакцины CanSino занимается компания «Петровакс». «СПИД.ЦЕНТР» отправил в «Петровакс» официальный запрос с просьбой рассказать, брались ли во время испытаний вакцины во внимание риски, связанные с возможным повышенным риском получения ВИЧ, и как часто исследователи определяют ВИЧ-статус добровольцев. «Петровакс» не ответил на запрос, сославшись на болезнь руководителя пресс-службы.
При этом «СПИД.ЦЕНТРу» удалось получить текст информированного согласия одного из добровольцев, испытывающих китайскую вакцину в России.
Telegram-канал «Клинические исследования в СПб», который размещает объявления о поиске добровольцев для клинических испытаний, публиковал информацию о 3 этапе исследований CanSino в России. В посте было сказано, что повторный визит и сдача анализов запланирована только на 2022 год — ровно через год после вакцинации.
«Аргументы из письма меня не убедили»
«СПИД.ЦЕНТРу» удалось задать вопросы, связанные с вакцинами на основе аденовирусов, Михаилу Фаворову — доктору медицинских наук, эпидемиологу, эксперту в сфере контроля и профилактики распространения вирусных инфекций, ученому-исследователю Центра по контролю и профилактике заболеваний США.
— Хочется услышать ваше мнение — насколько высок риск того, что вакцины от коронавируса на основе аденовирусов могут увеличивать риск получить ВИЧ среди определенных групп людей?
— Абсолютных ответов сейчас нет. Никто не имеет никаких конкретных данных. У всех есть разные опасения и размышления, но на опасениях и размышлениях очень сложно делать какие-то твердые рекомендации.
Трудно ответить на вопрос, потому что приведенная в «Ланцете» информация лишена достаточного числа цифр, и самое главное — там грубейший кофактор. Они пишут, что испытывалась вакцина против ВИЧ, и дальше говорят, что добровольцы с вакциной против ВИЧ были необрезанными. А сколько у нас защиты дает обрезание? 60 % — то есть уже ясно, что это, наверное, не только с вакциной связано. Кроме того, наиболее уязвимой группой были те, кто занимался незащищенным инсертивным сексом, риски в этом случае тоже несопоставимо высоки. Таким образом, аргументы, которые напечатаны в журнале Lancet, меня совершенно не убедили. При этом однозначного ответа нет, но абсолютно отвергать возможность такого риска невозможно на сегодняшний день.
— Связан ли этот риск с конкретным аденовирусом, который использовался в качестве вектора (Ad5) в вакцине STEP, или подобные риски могут быть актуальны и для других аденовирусов (например, Ad26)?
— Нет, с конкретным аденовирусом это точно не связано, потому что вирус Ad5 наименее иммуногенен для человека и вызывает относительно небольшой иммунный ответ, незначительное количество антител. Именно поэтому он и используется как вектор для вакцины. В жизни человек десятки раз встречается с различными аденовирусами — вы знаете, что они вызывают конъюнктивит, насморк. С тем, что пятый тип какой-то особый в контексте ВИЧ-инфицированных, я не могу согласиться.
— В исследовании вакцины STEP неясно, как именно вакцина увеличила риск передачи ВИЧ. В статье The Lancet описано несколько вариантов, в том числе ослабление иммунитета к ВИЧ, усиление репликации вируса СПИДа или создание для него большего количества «клеток-мишеней». На ваш взгляд, какой из вариантов выглядит наиболее вероятным?
— Будьте осторожны с формулировками — никаких доказательств того, что риск увеличен, нет. Мое личное мнение: я считаю, что введение любого патогена, причем любым, не только вакцинным, способом будет вызывать появление иммунного ответа, будет вызывать увеличение количества Т-клеток и давать больше возможностей и мишеней для вируса. Но все это такие «турусы на колесах» — все очень теоретически, и реально говорить о том, что создается больше клеток-мишеней и именно поэтому это может быть риском, пока не приходится, данных, я подчеркиваю, нет.
— Как вы оцениваете риски, связанные с вакцинами на основе аденовирусов, для людей, живущих с ВИЧ?
— Конечно, введение любого инфекционного агента для людей со скомпрометированным иммунитетом повышает риск, но говорить о том, что мы рекомендуем или не рекомендуем людям, живущим с ВИЧ, прививаться, очень трудно, никаких данных пока не получено. Я считаю, что риск иметь тяжелую форму заболевания выше, чем риск побочных эффектов при вакцинации. Эпидемиология — это наука о соотношении рисков, однозначные ответы в ней бывают редко.
Если ВИЧ-инфицированный человек старше 50 лет — встает вопрос, вакцинироваться ему или нет. Вы прекрасно знаете, что частота тяжелых форм ковида растет с возрастом. Если бы была возможность выбирать — я бы выбрал вакцину без введения инфекционного агента. Такая вакцина в России скоро будет — Центр Чумакова уже подал документы в Минздрав. При ее использовании иммунный ответ все равно будет, но ведь и обычное заболевание, любой насморк, приведет к тому же. Я думаю, что для группы иммунокомпрометированных людей (опять же, подчеркну, что это только мое мнение и достаточных данных пока нет) вакцина Центра Чумакова представляется менее рисковой.
Виталий Васильевич Зверев, научный руководитель НИИ вакцин и сывороток им. И. И. Мечникова, тоже уверен в том, что однозначные выводы об открытом письме, опубликованном в The Lancet, делать рано.
«Определенный смысл в письме разработчиков STEP есть. Сказать, что все именно так, тоже нельзя. Это как раз потому, что никто эти вакцины до конца не исследовал. Сейчас можно спекулировать о чем угодно, в том числе и на тему ВИЧ-инфекции.
Вирусы разнообразны. Некоторые, например, обладают онкогенным свойством — то есть способностью вызывать опухоли. В случае с Ad5 и Ad26 я таких серьезных данных не встречал. Сложно сейчас говорить, нужно исследовать вакцины более подробно. Прямых данных нет, а предполагать можно все что угодно. Я пока прямой связи между аденовирусами и повышенным риском заражения ВИЧ не вижу», — рассказал ученый «СПИД.ЦЕНТРу».
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Крохотные курьеры: как аденоассоциированные вирусы спасают жизни
Авторы
Редакторы
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
Эта история началась в середине 1960-х, когда в препаратах аденовируса обезьян случайно было обнаружено загрязнение из маленьких неизвестных частиц [1]. Эти частицы были впоследствии названы аденоассоциированным вирусом (сокращенно ААВ, англ. adeno-associated virus, AAV). Тогда мало кто мог предположить, что именно эти крошечные вирусы дадут надежду многим неизлечимым больным. И лишь несколько исследовательских групп, движимых чисто научным любопытством, отправились изучать базовую биологию ААВ.
Прошло несколько десятков лет, и стало понятно, что ААВ обладает множеством уникальных свойств. Эти особенности позволяют использовать его в поистине революционном направлении — генной терапии. По разным оценкам, около 5% новорожденных детей страдает от различных генетических заболеваний [2]. Долгие годы такие болезни считались неизлечимыми, и для многих подобный диагноз приравнивался к приговору. К счастью, времена изменились. Мы находимся на пороге эры лекарств принципиально нового типа [3], и немаловажную роль в этом сыграл аденоассоциированный вирус [4].
Биология вируса
Какими же уникальными особенностями обладает ААВ? Чтобы ответить на этот вопрос, нужно подробнее поговорить про его жизненный цикл и строение.
Аденоассоциированный вирус принадлежит к роду Dependoparvovirus семейства Parvoviridae. Название рода отражает его необычный жизненный цикл, когда для размножения необходимо наличие вспомогательного вируса (от лат. Dependo — «зависеть»). В качестве такого вируса-помощника, как правило, выступает аденовирус (что явно следует из названия) или представители семейства герпесвирусов [5].
ААВ настолько безобиден, что помимо неспособности самостоятельно размножаться, он не вызывает никаких заболеваний человека и животных. Более того, согласно некоторым исследованиям, большинство людей (>70%) в течение жизни были заражены одним или несколькими серотипами ААВ [6]. (Серотип — вариант вируса, который отличается от других антигенами на своей белковой оболочке).
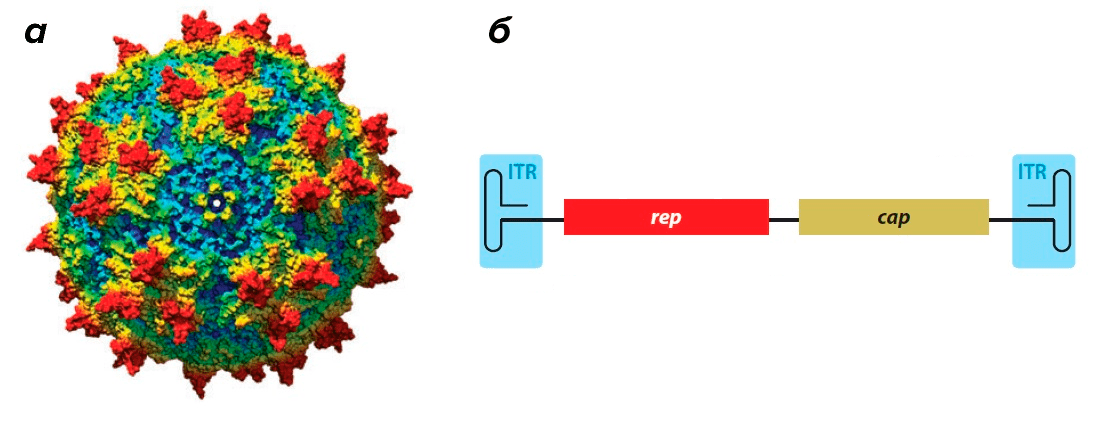
Вирус довольно мал — его икосаэдрическая белковая оболочка (капсид) в диаметре составляет всего около 25 нм (риc. 1а). Капсид необычайно стабилен: устойчив к кратковременному воздействию тепла, кислой среде и протеазам [7]. Геном, представленный одноцепочечной ДНК, по размерам также весьма скромен — всего 4,7 тысяч нуклеотидов [7].
Этот небольшой геном содержит минимальное количество генов. Ген rep (от слова replication) кодирует белки, необходимые для размножения вируса и его дальнейшей сборки внутри клетки (рис. 1б). Ген cap (от слова capsid) кодирует белки капсида (рис. 1б).
Геном ААВ обрамлен двумя Т-образными шпильками — инвертированными концевыми повторами (inverted terminal repeats, ITR) (рис. 1б).
Рисунок 1. Аденоассоциированный вирус. а — Модель капсида ААВ. б — Геном аденоассоциированного вируса. ITR (inverted terminal repeats) — инвертированные концевые повторы, образующие Т-образные шпильки; rep — ген, кодирующий белки, отвечающие за репликацию; cap — ген, кодирующий белки капсида.
Судьба вируса в клетке
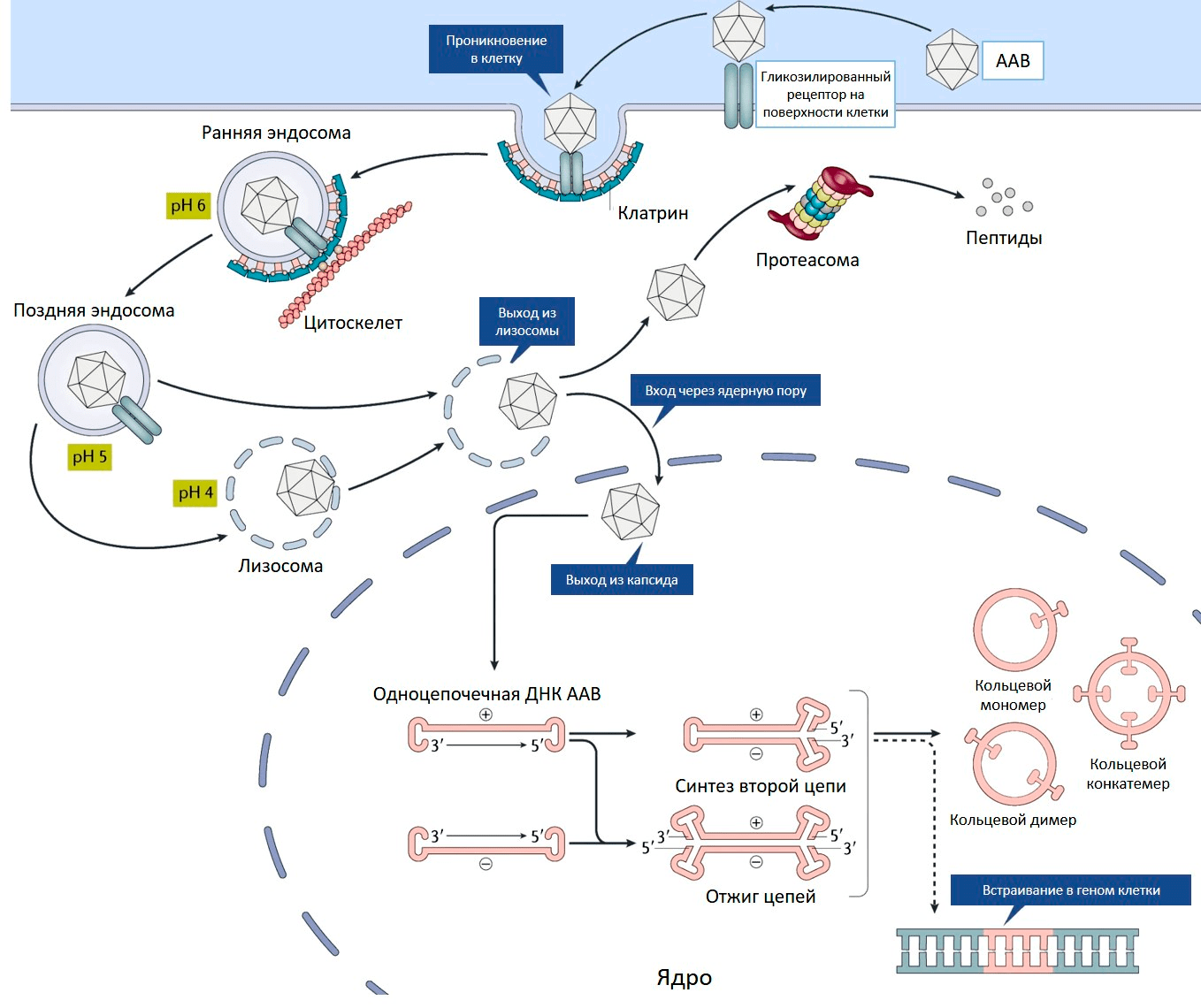
Ценное свойство ААВ — его способность проникать как в делящиеся, так и неделящиеся клетки [8]. На первом этапе аденоассоциированный вирус связывается с рецептором на поверхности клетки (рис. 2) [9]. Разные серотипы ААВ предпочтительно связываются со своими рецепторами, характерными для определенных типов клеток [10].
Рисунок 2. Проникновение ААВ внутрь клетки. Пояснения в тексте.
[9], рисунок с изменениями
И это важное свойство — определенный серотип преимущественно проникает лишь в конкретную ткань или орган, то есть обладает своим уникальным тропизмом.
Связывание вируса с рецептором запускает процесс проникновения внутрь клетки. Эндосома (мембранный пузырек, содержащий вирусную частицу) передвигается в цитоплазме по цитоскелету. Постепенно среда в эндосоме закисляется, что приводит к изменениям капсида, необходимым для дальнейшего успешного заражения клетки. После выхода из эндосомы у вируса два пути. Либо он попадает в клеточную машину по уничтожению белков (протеасому) и разрушается, либо переносится в ядро, где вирусный геном высвобождается из капсида (рис. 2) [10].
С одноцепочечного вирусного генома еще не могут нарабатываться белки, для этого необходимо достроить вторую цепь ДНК. Она синтезируется с помощью ДНК-полимеразы клетки-хозяина, используя шпильку ITR в качестве затравки для построения второй цепи.
Вирусные ITR помогают не только строить вторую цепь ДНК, но способствуют межмолекулярной и внутримолекулярной рекомбинации геномов вируса. В результате в ядре клетки образуются кольцевые молекулы ДНК — эписомы (рис. 2). В такой форме геномы ААВ могут в течение многих лет присутствовать в ядре [10].
Кроме того, геном ААВ может с низкой частотой встраиваться в определенный локус на 19 хромосоме человека [11]. Этот феномен обусловлен сходством последовательностей ДНК данного локуса и ITR вируса. У ААВ, лишенного гена rep, способность к встраиванию своего генома сильно снижена. Такие вирусные геномы присутствуют в клетках в виде эписом.
Модификация ААВ для применения в генной терапии
Если в гене человека произошла мутация, которая привела к развитию заболевания, то болезнь можно победить или облегчить, если доставить в клетки организма рабочую копию поломанного гена. Вот тут и выходит на сцену аденоассоциированный вирус.
Что же нужно было в нем изменить, чтобы он стал курьером для доставки таких терапевтических генов? Как это часто бывает в биологии, ученые просто воспользовались успешными решениями, уже созданными природой. Раз капсид ААВ сам по себе является ключом к входу в клетку и ядро, то можно смело этим воспользоваться. Остается только заменить гены самого вируса на гены, интересующие исследователя, и вирусный курьер готов!
Модификация генома ААВ
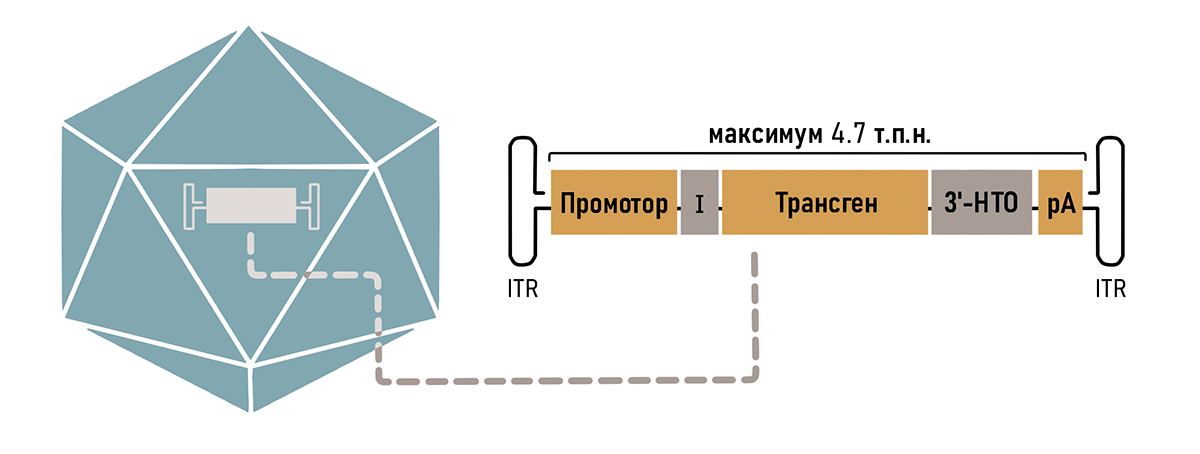
Оказалось, что от всего генома ААВ необходимо было оставить только концевые шпильки ITR, необходимые для сборки самого вируса и сохранения его генома в ядре (рис. 3) [12]. Таким образом, можно без последствий удалить до 96% генома ААВ, используя полученное пространство для кодирования нужных генов.
Так как ААВ вмещает в себя всего около 5000 пар нуклеотидов, то нужно очень тщательно продумать остальной состав кассеты. В первую очередь туда необходимо поместить рабочую копию гена (трансген), в зависимости от того генетического заболевания, на которое направлено лечение. Также обязательно наличие регуляторных последовательностей, таких как промотор и сигнал полиаденилирования (рис. 3). Разберем элементы кассеты подробнее.
Рисунок 3. Компоненты типичной кассеты ААВ вектора. Оранжевые блоки (промотор, трансген и сигнал полиаденилирования — рА) являются обязательными компонентами. Для повышения эффективности экспрессии могут быть включены необязательные регуляторные элементы, такие как интрон (I) и другие компоненты 3′-нетранслируемой области (НТО). Кассета обрамлена инвертированными терминальными повторами (ITR).
рисунок авторов статьи
Из-за ограниченной емкости вируса могут возникнуть трудности с доставкой больших терапевтических генов. Очевидное решение проблемы — разработка сокращенной версии гена, который кодирует усеченный, но функциональный белок. Создание таких укороченных генов требует глубокого понимания биологии терапевтического белка, взаимосвязи его структуры и функции. Такой подход уже успешно применяется в нескольких клинических испытаниях по лечению миодистрофии Дюшенна [13] (ссылки на клинические испытания: NCT03368742, NCT04281485, NCT03769116), в доклинических исследованиях по лечению дисферлинопатии, амавроза Лебера и многих других заболеваний.
Другим потенциально перспективным подходом для доставки слишком больших трансгенов может быть разделение гена между двумя ААВ-векторами [14]. Два этих векторных генома, попадая в одно и то же ядро клетки, могут подвергаться межмолекулярной рекомбинации с последующим восстановлением полноразмерного гена. Такой двухвекторный подход пока применяется лишь в редких клинических испытаниях (пример — NCT02710500). Низкая эффективность восстановления полноразмерного гена ограничивает более широкое применение этого приема.
Правильно выбранный промотор — во многом залог успешной генной терапии. Идеальный промотор должен запускать стабильную высокую экспрессию трансгена в пораженных органах в течение длительного периода, при этом быть неактивным в других тканях. Малая емкость ААВ также требует уменьшения размера промотора [15].
К кассету можно добавить необязательные элементы, способные улучшить экспрессию трансгена (рис. 3). Так, например, присутствие интрона повышает стабильность РНК в ядре [16], а также способствует эффективному транспорту мРНК из ядра в цитоплазму [17].
К обеспечению тканеспецифичности можно подойти с другой стороны — не только стимулируя экспрессию в целевых тканях, но и подавляя ее в нежелательных органах с помощью механизмов РНК-интерференции [18]. Для этого в 3′-НТО-кассеты добавляют сайты связывания микроРНК, присутствующих строго в нецелевых органах (рис. 3) [19]. Если трансген оказывается в нежелательном органе, то микроРНК связывается с комплементарными ей сайтами в транскрипте и запускает его деградацию.
Модификация капсида ААВ
Хотя капсид ААВ — сам по себе уже удачное изобретение природы, человечество не остановилось в своем научном поиске. Новые серотипы ААВ могут обладать рядом преимуществ:
Благодаря развитию новых методов анализа выделяют несколько основных направлений для создания или выявления новых серотипов.
К сожалению, всегда существует вероятность, что хорошо работающий in vitro модифицированный капсид в экспериментах на лабораторных животных продемонстрирует низкую эффективность или даже токсичность. Всестороннее изучение свойств разрабатываемых препаратов и строгий контроль качества призваны минимизировать риск неблагоприятного исхода исследований [23].
Применение ААВ в клинике
Целевые органы, на которые направлена терапия
К 14 декабря 2020 года 227 препаратов на основе ААВ проходят клинические испытания (по данным сайта ClinicalTrials.gov). Сегодня уже существует несколько препаратов на основе ААВ, которые получили одобрение от регулирующих органов для коммерческого использования у пациентов (подробнее про эти препараты можно почитать в [4]):
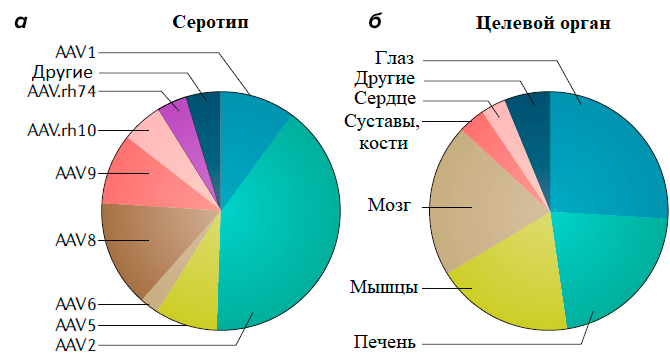
Большинство серотипов ААВ «предпочитают» проникать в такие органы, как печень, поперечно-полосатые мышцы и ЦНС, что и определило направление большинства программ генной терапии (рис. 4).
Рисунок 4. Данные с сайта ClinicalTrials.gov: на 13 ноября 2018 г. было зарегистрировано 145 клинических испытаний с использованием ААВ. а — Классифицикация клинических испытаний на основе примененного серотипа ААВ (AAV). б — Целевой орган, на который направлена терапия в указанных клинических испытаниях. Можно заметить, что спустя два года количество клинических испытаний с применением ААВ почти удвоилось (227 на сегодняшний день против 145 испытаний два года назад).
Почти все природные серотипы ААВ эффективно заражают печень после внутривенного введения. Благодаря данному свойству вируса в клинических испытаниях находятся препараты для лечения гемофилии A и B (NCT03392974, NCT03587116), семейной гиперхолестеринемии (NCT02651675), дефицита орнитинтранскарбамилазы (NCT02991144), мукополисахаридоза-IIIA (NCT03612869) и синдрома Криглера—Найяра (NCT03223194) [25].
Серотипы ААВ8 и ААВ9 могут эффективно заражать разные типы мышц по всему телу. Такое свойство делает их идеальными векторами для генной терапии множества мышечных заболеваний [26]. Так, активно исследуются в клинике препараты для лечения миодистрофии Дюшенна (NCT03375164), дисферлинопатии (NCT02710500), миотубулярной миопатии (NCT03199469), болезни Помпе (NCT03533673). Примечательно, что зараженная мышца может также служить биофабрикой для производства секретирующихся терапевтических белков для лечения немышечных заболеваний. Хотя большинство сердечных заболеваний полигенны и подвержены влиянию окружающей среды, ведется разработка препаратов генной терапии для лечения сердечной недостаточности [26].
Большой процент разрабатываемых препаратов на основе ААВ направлен на лечение неврологических и глазных болезней (рис. 4) [27], [28]. Глаз — весьма обособленный орган, обладающий уникальной иммунологической толерантностью, и легко доступный для прямого введения препарата. Нетрудно понять, почему один из первых одобренных препаратов, «Люкстурна», был направлен именно на лечение наследственной слепоты. Мозг, напротив, намного более крупный и сложно организованный орган. Прямая доставка препарата в мозг или спинномозговую жидкость позволяет локализовать вирус и снизить дозу препарата, но это инвазивная процедура, сопряженная со многими рисками. К счастью, такие серотипы, как ААВ9 или ААВrh.10, могут пересекать гематоэнцефалический барьер, что позволяет использовать рутинное внутривенное введение. В настоящий момент в клинических испытаниях уже находятся препараты для лечения болезни Паркинсона (NCT02418598), метахроматической лейкодистрофии (NCT01801709), болезни Баттена (NCT01414985), мукополисахаридоза 3 типа (NCT03300453).
Основные стратегии генной терапии на основе рААВ
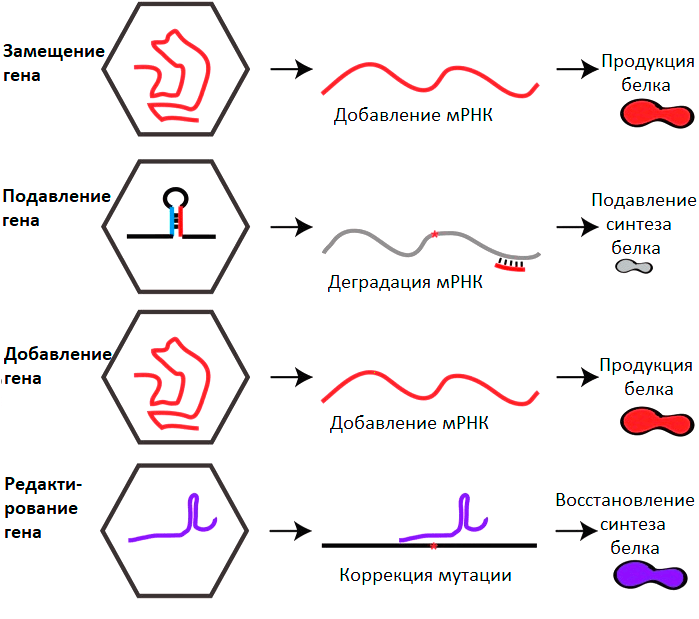
Можно выделить 4 глобальных направления генной терапии с применением ААВ (рис. 5).
Рисунок 5. Основные стратегии генной терапии на основе ААВ. Пояснения в тексте.
[29], рисунок с изменениями
Производство ААВ
Когда речь идет о клинических испытаниях, требуется очень большое количество вирусного препарата высокого качества. Его производство — весьма нетривиальная задача.
Вирусы не могут самостоятельно себя воспроизводить, им необходима помощь клеточной машинерии. Для наработки ААВ стали использовать культуры клеток. Вариантов может быть много: использование культуры дрожжей (Saccharomyces cerevisiae) [33], клеток насекомых (культура клеток Sf9 бабочки Spodoptera frugiperda) [34], человека — HEK293, HeLa. Некоторые из этих подходов, — скорее, экзотика, но использование культур клеток млекопитающих (HEK293) или насекомых (Sf9) уже прочно закрепилось на производстве.
Итак, для начала необходимо определиться с методикой производства, ведь от этого зависит, в чем будет расти сама культура. Вариантов масса: для клеток, растущих, прикрепившись к субстрату, это могут быть большие чашки Петри, специальные сосуды с множеством перегородок для увеличения площади поверхности (рис. 6а). Для культур, хорошо чувствующих себя в виде суспензии и при постоянном перемешивании, — колбы, герметичные пакеты и многое другое. При увеличении масштабов производства можно переходить на специальные биореакторы (рис. 6б). С их помощью можно следить за целой панелью важных для процесса параметров. Они делают производство более технологичным и позволяют увеличить объемы продукции до нескольких сотен литров вирус-содержащей суспензии за один цикл работы.
Рисунок 6. Производство ААВ: на культуральных чашках (а) и в биореакторе iCellis Nano (Pall corporation) (б)
фотографии авторов статьи
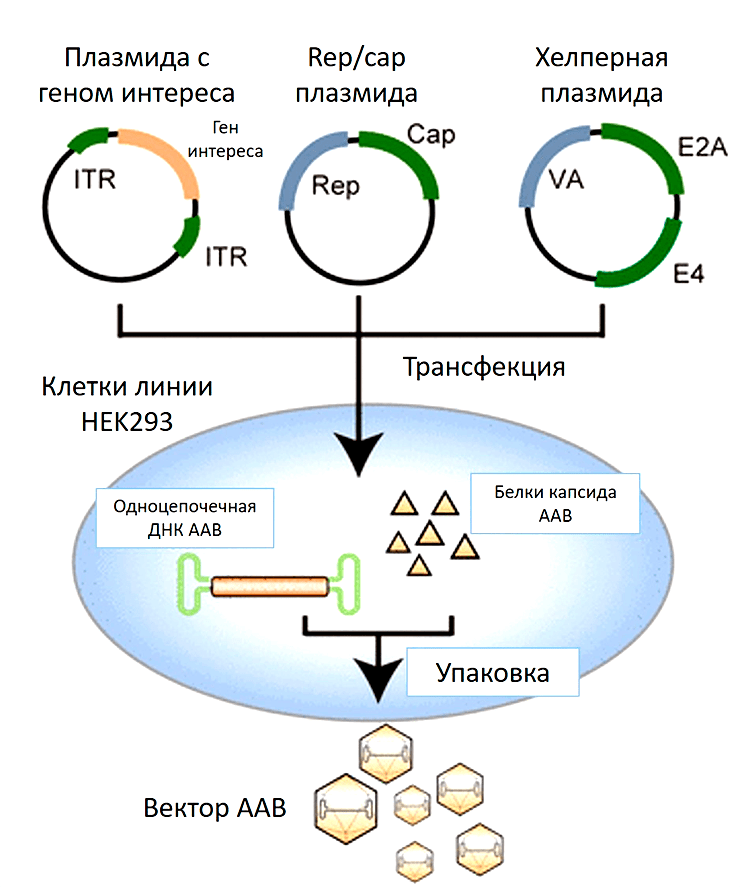
Что нужно сделать с культурой клеток, чтобы она стала биофабрикой по производству вирусных частиц? В такие клетки-производители вносят плазмидную ДНК, кодирующую необходимую для сборки вирусов информацию. Наиболее популярный протокол предполагает одновременное заражение клеток тремя плазмидами (рис. 7):
Кстати, вместо третьей плазмиды может быть добавлен сам вирус-помощник (аденовирус или герпесвирус), как это было в более ранних протоколах по производству частиц ААВ [35].
Рисунок 7. Производство ААВ, использующее в качестве клеток-производителей культуру клеток человека HEK293. Смесь трех плазмид доставляют внутрь клетки (плазмиду с терапевтическим геном, плазмиду, кодирующая гены rep/cap, и плазмиду с генами вируса помощника). Начинается наработка необходимых белков для сборки вирусных частиц. ДНК, содержащая терапевтический ген, упаковывается в готовый капсид ААВ.
Клетки начинают производить вирусные частицы, после чего их надо собрать и очистить.
Это критически важный этап, которому стоит уделить особое внимание [22], [23]. Любые примеси, которые будут содержаться в препарате, могут вызвать нежелательный иммунный ответ.
Вначале собирают сырой материал: это может быть клеточная среда, если вирусы выделяются клетками преимущественно в жидкость вокруг, а могут быть и сами клетки, если большинство вирусных частиц накапливается внутри. Как правило, это зависит от конкретного серотипа ААВ. Чтобы разрушить клеточные мембраны и высвободить вирус, клетки подвергают многочисленным циклам замораживания-оттаивания, ультразвуковой обработке или воздействию детергентов.
Теперь основная задача — очистить вирусные частицы от многочисленных примесей, находящихся в суспензии (рис. 8). В сыром материале находятся внутриклеточные свободные ДНК и РНК, белки и ферменты, крупные обломки клеточных мембран и многое другое. Способов очистки существует множество, и постоянно появляются как улучшенные версии уже применяемых методик, так и принципиально новые подходы. Все они различаются по уровням специфичности, эффективности и, разумеется, стоимости. Условно способы очистки можно разделить на серотип-специфичные и универсальные. К первой категории относится, например, аффинная хроматография [37], основанная на специфическом узнавании капсидов антителами. Ко второй — ультрацентрифугирование в градиентах плотности растворов йодиксанола или хлорида цезия, преципитация полиэтиленгликолем или сульфатом аммония, ионообменная хроматография и многие другие методы, основанные на общих физических свойствах вирусных частиц [38].
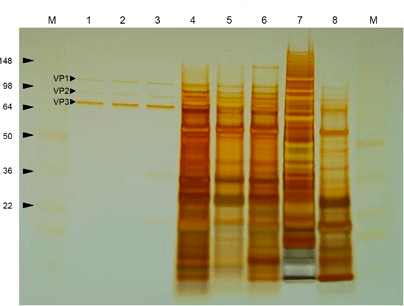
Рисунок 8. Окрашивание серебром очищенного (лунки 1–3) и загрязненного другими белками (лунки 4–8) препарата ААВ после гель-электрофореза [38].
Одна из неочевидных нежелательных примесей — так называемые пустые капсиды — вирусные частицы, не несущие в себе терапевтический ген, или содержащие внутри себя постороннюю ДНК. Дело в том, что изначально в клетке формируется пул пустых капсидов. Лишь потом ДНК связывается с пустым капсидом при помощи специальных сигналов на ITR и компактно упаковывается, формируя полноценную вирусную частицу. Но иногда пустой капсид может так и остаться пустым при нехватке вирусной ДНК или ее неэффективной упаковке. В пустой капсид может также упаковаться обрывок свободной ДНК, находящейся в клетке и содержащей последовательность, схожую с сигналом упаковки. Такие частицы (совсем пустые или несущие неправильную последовательность) не функциональны и подлежат удалению из очищаемого препарата. С определенной эффективностью их можно отделить от функциональных капсидов, используя градиенты плотности или методы хроматографии.
Основные проблемы
Наработка большого количества плазмид высокой степени очистки, поддержание культур клеток, дорогостоящие реактивы, сложный процесс очистки вирусных частиц и разработка аналитических методик для характеризации препаратов ведут к таким космическим ценам при масштабировании производства. На стоимость также влияет серьезный контроль качества вирусного препарата. Чтобы препарат вышел на рынок, проводятся исследования его токсичности, безопасности, биораспределения, эффективности. Оценивается содержание белковых примесей, бактериальных эндотоксинов, количество пустых капсидов, стерильность препарата, концентрация вирусных частиц в растворе и множество других характеристик [23]. В настоящий момент гиганты производств ААВ по всему миру работают над удешевлением препаратов, разрабатывая более эффективные протоколы сборки и очистки ААВ.
Иммунный ответ также представляет собой серьезную проблему. Потенциально иммунные реакции могут возникать на вирусный капсид, его геном, а также на белковый продукт трансгена. Препаратам на основе ААВ могут помешать нейтрализующие антитела к его капсиду [39]. Связываясь с вирусами в кровотоке, антитела препятствуют проникновению вирусных частиц в клетки, что ведет к низкой эффективности препарата. В настоящий момент обязательно проводится скрининг пациентов на наличие антител к применяемому серотипу ААВ [40]. В случае их обнаружения такой пациент исключается из клинических испытаний. Ведется разработка новых капсидов, которые не будут узнаваться нейтрализующими антителами [41]. После доставки терапевтических доз ААВ быстро развивается гуморальный иммунный ответ, который впоследствии помешает повторному введению препарата [42]. Именно поэтому большинство генотерапевтических препаратов на основе ААВ рассчитано на однократное введение. Для подавления Т-клеточного иммунного ответа у пациентов применяется фармакологическая супрессия стероидами [40].
Заключение
Генная терапия на основе ААВ — бурно развивающееся направление, и мы в данном обзоре затронули лишь небольшой кусочек этой удивительной области. Текущий экспоненциальный рост клинических испытаний с использованием ААВ предполагает, что мы находимся в самом начале эры новых генотерапевтических препаратов. Еще очень много задач предстоит решить, и для этого требуются мультидисциплинарные усилия. Дальнейшее развитие молекулярной биологии, биоинформатики, эпидемиологии, структурной биологии, иммунологии, геномики и других дисциплин, безусловно, будет способствовать совершенствованию технологии. Уже пройден длинный путь в попытке человечества победить генетические заболевания. Мы надеемся, что именно генная терапия приведет к окончательной победе!