Адъювант что это в медицине простыми словами
Адъювантная и неоадъювантная химиотерапия: что это?
Химиотерапевтическое лечение с применением противоопухолевых препаратов является достаточно эффективной и популярной процедурой для борьбы с онкологическими заболеваниями. Основная цель этой методики заключается в замедлении роста опухолевых клеток либо полном их уничтожении.
Для каждого пациента Юсуповской клиники в соответствии со стадией заболевания подбирается индивидуальная схема химиотерапии, благодаря чему достигается максимальный эффект и полное удаление опухоли из организма. Разработаны специальные терапевтические курсы, каждый из которых предполагает прием определенных противоопухолевых лекарственных средств либо их комбинации, что значительно повышает эффективность лечения. Процесс лечения разделен на несколько курсов, благодаря чему организм может быстрее восстанавливаться после воздействия сильных токсических препаратов.
Адъювантная и неоадъювантная химиотерапия: что это
Наряду с тем, что химиотерапия используется как самостоятельный метод лечения онкологических заболеваний (с радикальной или паллиативной целью), она также может применяться в качестве составной части комбинированного или комплексного лечения – неоадъювантная и адъювантная химиотерапия.
Неоадъювантная химиотерапия: что это такое?
Данный вид химиотерапевтического лечения является предоперационной процедурой, с помощью которой можно достичь значительного уменьшения размеров опухоли для последующего хирургического вмешательства. Например, пациентам с раком мочевого пузыря 1 стадии химиотерапию проводят для выявления чувствительности раковых клеток к тем или иным препаратам. Прием химиопрепаратов при раке поджелудочной железы назначается для определения эффективности химиопрепаратов после проведения хирургического вмешательства.
Адъювантная химиотерапия: что это?
Данная процедура назначается в целях профилактики: для того чтобы снизить вероятность рецидивов после радикальных операций. Основной целью адъювантной химиотерапии является минимизация риска развития метастазирования.
Теоретическое обоснование данной методики состоит в том, что опухоли небольших объемов (микроскопические резидуальные опухоли или микрометастазы) должны быть более чувствительны к химиотерапевтическому воздействию, т.к. в них меньше клеточных линий, благодаря чему снижена вероятность возникновения химиорезистентных клонов. Кроме того, в небольших опухолях большее количество активно делящихся клеток, которые наиболее чувствительны к препаратам цитостатического действия. Адъювантная химиотерапия особенно эффективна для таких клинических ситуаций, как: рак молочных желез, колоректальный рак, опухоли центральной нервной системы.
Для чего нужна химиотерапия
Как и любой другой вид лечения, адъювантная химиотерапия назначается при наличии определенных показаний. Перед началом лечения препаратами цитостатического действия проводится тщательное медицинское обследование пациента. После оценки всех рисков врач делает заключение о целесообразности проведения химиотерапевтического лечения.
Адъювантная химиотерапия назначается онкологами Юсуповской клиники для лечения онкопатологий пациентам со следующими проблемами:
Химиотерапия применяется также в качестве паллиативной помощи для больных с запущенными формами рака. Данная методика способствует облегчению состояния пациентов, наиболее часто её назначают детям.
Химиотерапия: порядок проведения
Больные переносят химиотерапию, как правило, достаточно тяжело. Чаще всего она сопровождается тяжелыми побочными реакциями, возникновение которых обусловлено введением цитостатиков. Нередко пациенты отказываются от химиотерапевтического лечения. Адъювантная химиотерапия предполагает курсовое введение препаратов. Лечение длится от трех месяцев до полугода и более. При выборе курса онколог учитывает состояние больного. В большинстве случаев за шесть месяцев проводят от шести до семи курсов химиотерапевтического лечения. Частота курсов химиотерапии влияет на эффективность результата. Например, курс продолжительностью три дня может повторяться через каждые две-четыре недели. В ходе терапии за состоянием больного тщательно следят. Кроме того, проверку показателей крови проводят и в перерывах между курсами.
Последствия химиотерапии
Химиотерапевтический метод лечения онкологических заболеваний сопровождается побочными эффектами, в чем и заключается его основная тяжесть. Кроме внешних проявлений неблагоприятное влияние препаратов сказывается на показателях крови. Основной побочный эффект заключается в угнетении системы кроветворения, что касается преимущественно лейкоцитарного ростка. Поражение белых кровяных телец приводит к угнетению иммунной системы организма, в результате чего у больных наблюдается общая слабость, присоединяются различные инфекции. В результате нейротоксического воздействия препаратов больные отмечают появление плаксивости, депрессивного состояния, у них нарушается сон, наблюдается тошнота, рвота, диарея. Применение цитостатических препаратов приводит и к изменению внешнего вида больных – у них выпадают волосы (возникает алопеция), бледнеют кожные покровы.
Адъювантная и неоадъювантная химиотерапия в Юсуповской больнице
Несмотря на то, что лечение цитостатиками обладает высокой эффективностью, оно назначается не во всех случаях. Не секрет, что адъювантная химиотерапия приводит к гибели не только раковых, но и здоровых клеток. Применение некоторых препаратов оказывают пагубное воздействие на дыхательную и сердечно-сосудистую системы. Данное лечение противопоказано пациентам, страдающим тяжелыми патологиями печени и почек, холециститом. Химиотерапия не проводится при наличии изменений в общем анализе крови. Кроме того, лечение цитостатическими препаратами недопустимо для больных, имеющих выраженный синдром астенизации (минимальная масса тела пациента должна составлять 40кг).
Данные статистики последних лет неумолимы: ежегодно число больных, страдающих раком, увеличивается. Однако одновременно с этим растет и количество пациентов, сумевших успешно вылечиться с помощью различных видов химиотерапии. Результаты исследований показали, что химиотерапевтическое лечение рака помогло более половине больных, которые, несмотря на побочные эффекты процедуры и плохую переносимость организмом, не побоялись использовать данный метод в борьбе с онкопатологиями. Химиотерапевты Юсуповской больницы успешно применяют адъювантную и неоадъювантную химиотерапию в лечении различных форм рака. Запись на консультацию проводится по телефону.
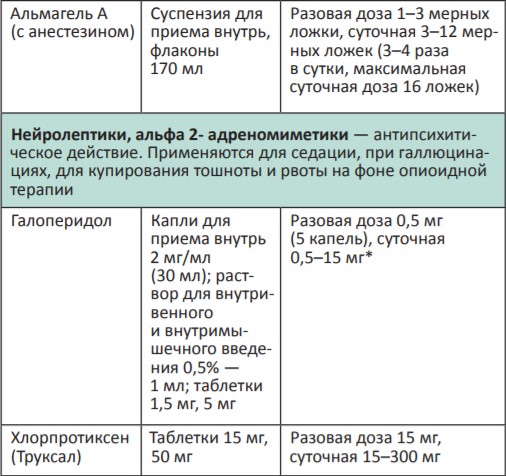
Адъювантная и симптоматическая терапия ХБС
Представляем фрагмент брошюры для врачей «Обезболивание в паллиативной помощи. Практическое руководство для врача», подготовленной благотворительным фондом «Вера».
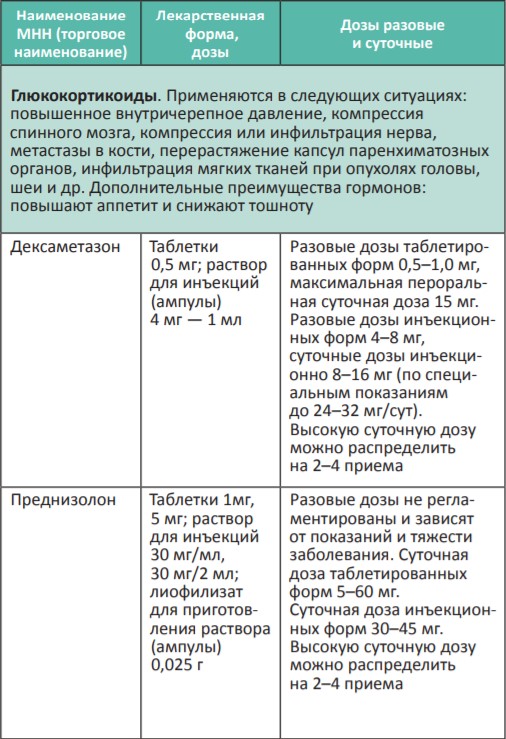
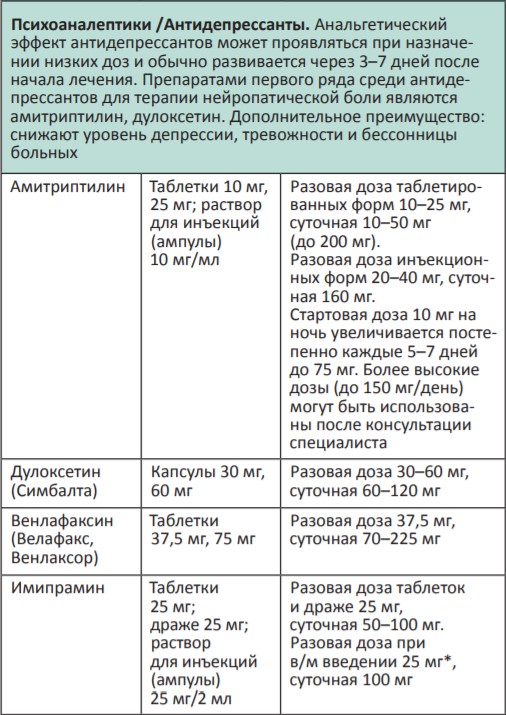
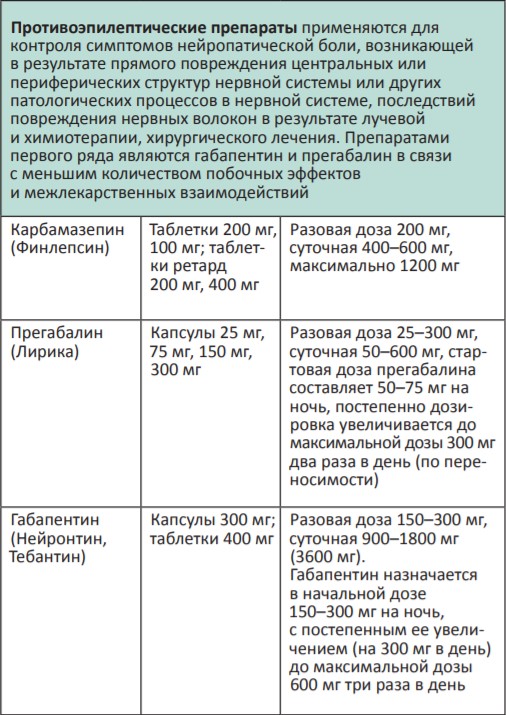
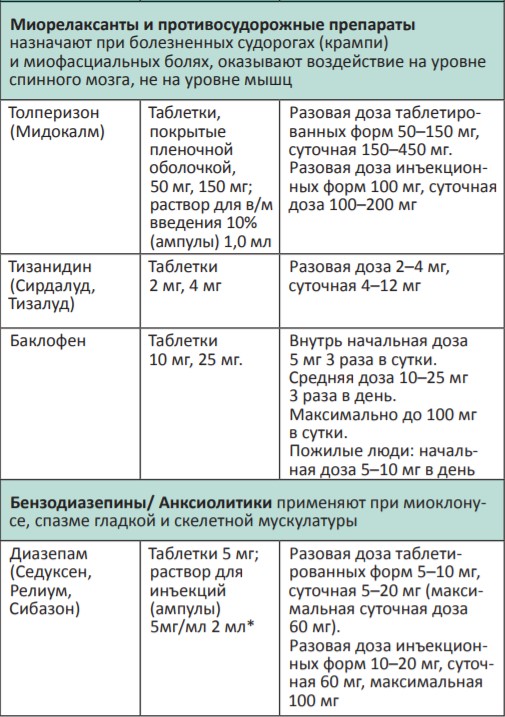
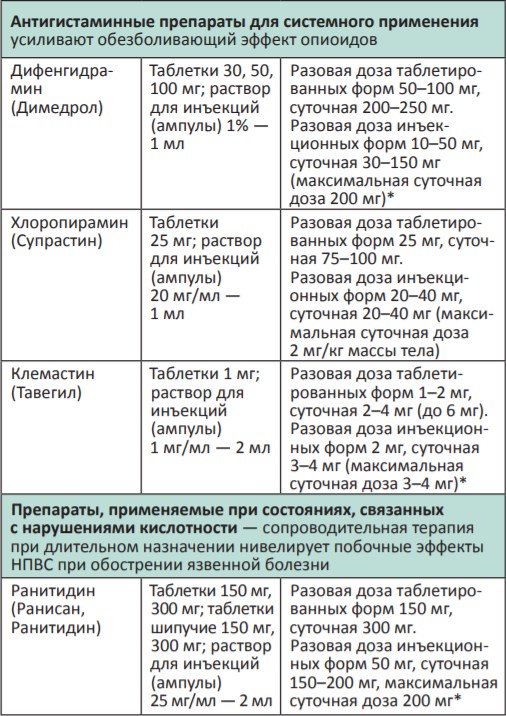
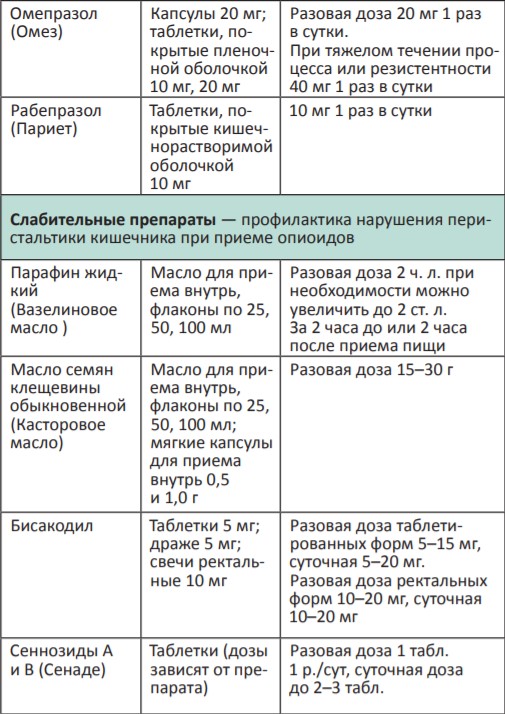
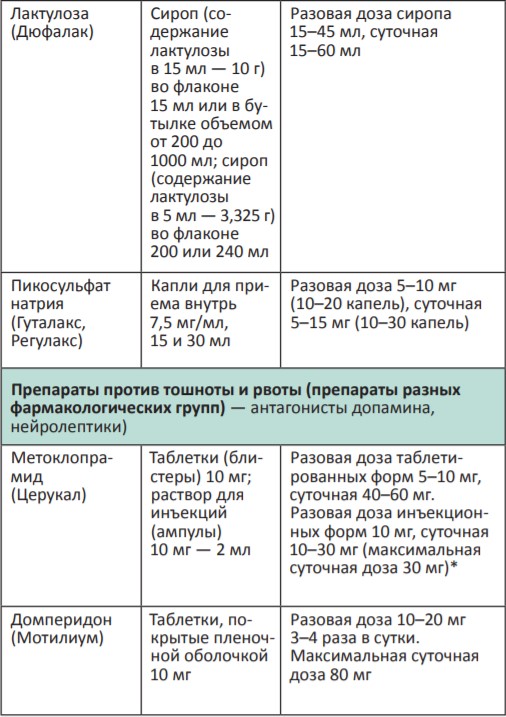
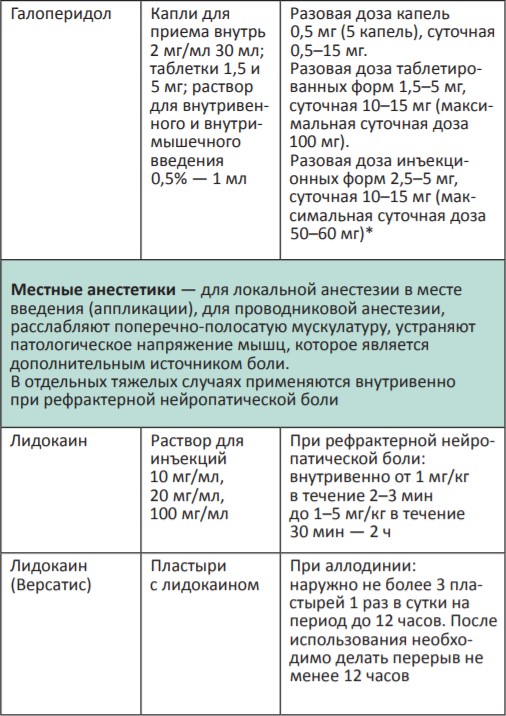
В процессе терапии болевого синдрома часто необходимо сочетать неопиоидные и опиоидные анальгетики с препаратами, позволяющими усилить их анальгетический эффект — адъювантными средствами. В различных клинических ситуациях одни и те же препараты могут использоваться как адъюванты или как симптоматические средства (например, глюкокортикоиды). Это позволяет не увеличивать дозы опиоидных анальгетиков, уменьшая тем самым их побочные эффекты, и повышать качество жизни больных. К адъювантам относятся глюкокортикоиды, антиконвульсанты, антидепрессанты, противосудорожные средства, спазмолитики, транквилизаторы, местные анестетики и др.
Адъювантные анальгетики и средства для симптоматической терапии:
* Для отдельных препаратов даны дозы для в/м введения, которое используется в паллиативной помощи крайне редко, например в ургентных ситуациях (когда нет возможности внутривенного доступа) или при подборе дозы препарата, с дальнейшим переводом пациента на пероральный прием.
АДЪЮВАНТЫ
Адъюванты (латинский adjuvans — помогающий, поддерживающий) — неспецифические стимуляторы иммуногенеза, вещества различного происхождения и состава.
Адъюванты могут обладать антигенными свойствами (убитые микроорганизмы или полисахариды бактериального происхождения) и не обладать ими (минеральные масла, квасцы и так далее). Действие адъювантных стимулирующих веществ отмечено в 1925 году Районом (G. Ramon), установившим активацию продукции антитоксинов (см.) у лошадей при совместном введении анатоксинов (см.) с квасцами, хлористым кальцием, тапиокой, лецитином, холестерином, ланолином, бензоином.
К адъвантам неорганической природы относят гидрат окиси алюминия, фосфат алюминия, фосфат кальция, хлористый кальций, алюминиево-калиевые квасцы, гидрат окиси железа, активированный уголь и другое. Среди органических веществ адъювантным действием обладают агар-агар, глицерин, желатина, крахмал, ланолин, лецитин, пектиновые вещества, протамины и другое. Более сложные адъюванты состоят из смесей масел или липополисахаридов с добавлением эмульгаторов, а также смесей липидов с минеральными сорбентами.
Наиболее тщательно изучено и широко применяется для усиления действия антигенов при изготовлении вакцинных препаратов (см. Вакцины) лишь небольшое количество адъювантных веществ. В качестве сорбентов при изготовлении вакцин чаще всего применяют гидрат окиси алюминия — Аl(ОН)3 и фосфат алюминия — АlPO4. Гидрат окиси алюминия представляет собой минеральный гель, содержащий 6—22 мг Аl(ОН)3 в 1 мл, с хорошими сорбционными свойствами; безвреден для организма. Фосфат алюминия также высокодисперсный препарат.
При изготовлении ассоциированных вакцин используют в качестве адъюванты убитые бактерии.
Разнообразные адъюванты находят применение в производстве лечебных сывороток (см.) и особенно в экспериментальных исследованиях по иммунологии. При этом нередко используют более реактогенные препараты (1% раствор алюминиево-калиевых квасцов, ланолин, холестерин, водно-масляные эмульсии, адъювант Фрейнда). Полный адъювант Фрейнда содержит BCG или липополисахариды, полученные из микобактерий туберкулеза, сложные жирные кислоты (дериваты ланолина), масла и эмульгаторы (Арлацел А или Твин-80). Адъювант Фрейнда, лишенный фракции микобактерий туберкулеза, называют неполным. Он является мощным стимулятором иммуногенеза, но не применяется в профилактической вакцинации в связи с его токсичностью и аллергизирующим действием. Использование адъюванта Фрейнда способствует индукции гиперчувствительности замедленного типа и развитию аутоиммунных процессов (см. Аутоантигены, Аутоантитела).
Выраженным адъювантным действием обладают бактериальные эндотоксины, нуклеиновые кислоты и продукты их распада, синтетические нуклеотиды и полианионы.
Механизм стимулирующего действия адъвантов на организм окончательно не выяснен. Усиление антигенного воздействия зависит прежде всего от развития в организме воспалительного процесса и стимуляции пролиферативной и фагоцитарной активности ретикулоэндотелиальной системы, усиления плазмоклеточной реакции и генерализации иммунологического процесса по лимфоидным органам и резкого увеличения общего синтеза белка. Вероятную роль играет также замедленная резорбция антигена из депо с замедлением разрушения антигена и дискретным действием его на лимфоидную ткань.
Адъюванты широко применяют как стимуляторы иммуногенеза при введении в организм человека и животных специфических антигенов. К последним относятся сорбированные на гидрате окиси алюминия анатоксины, полные антигены и противовирусные вакцины (против клещевого энцефалита, гриппа), а также ассоциированные препараты, напр, адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС). Обычно очищенные антигены сорбируют в определенном соотношении на стандартной суспензии гидрата окиси алюминия, проверяют на иммуногенность и реактогенность, а также учитывают ряд физико-химический констант: рН, содержание сорбента и так далее. (см. Вакцины, Иммунизация).
В 60-х годах пытались использовать в медицинской практике вакцины с адъювантами из минеральных масел. Испытания показали, что эти вакцины более иммуногенны, чем несорбированные, вызывают образование более широкого спектра антител. Однако при их использовании на месте введения иногда образовывались гранулемы, что послужило причиной прекращения их применения.
Для приготовления высокоактивных сывороток от животных, а также для получения гиперчувствительности замедленного типа, кроме полного и неполного адъюванта Фрейнда, успешно используют простые и двойные водно-масляные эмульсии, эмульгированные с раствором антигена до получения стойкой эмульсии. Двойные эмульсии получают при дальнейшем эмульгировании с равным объемом 2% раствора Твина-80 обычно на механическом эмульгаторе.
В фармакологии адъювантами называются вещества, усиливающие или пролонгирующие действие лекарственных средств.
Адъювантная болезнь
Адъювантная болезнь — заболевание у животных, вызываемое введением адъюванта Фрейнда и характеризующееся комплексом воспалительных изменений с преобладанием пролиферативного компонента, локализующихся главным образом в суставах и периартикулярной ткани. Это заболевание имеет сходство с такими заболеваниями человека, как ревматоидный артрит, узловатая эритема и используется как экспериментальная модель для их изучения.
Впервые «адъювантный артрит» был описан Пирсоном (C. M. Pearson, 1956) у крыс в виде острого воспаления в суставах хвоста, стопы и лодыжки с последующим развитием периоститов и экзостозов. Установлено, что воспалительные изменения развиваются не только в суставах, но и в коже, центральной нервной системы, легких, глазах, печени, почках, мочевыводящих путях и многих других органах. Поэтому в 1961 году был предложен термин «адъювантная болезнь», который более соответствует сущности изменений.
Адъювантная болезнь лучше всего воспроизводится у крыс различных линий обоего пола. Установлена зависимость между тяжестью болезни и линейной принадлежностью крыс.
Адъюванты готовят как по классической прописи (минеральное масло, ланолин, вода, в 1 мл которой содержится 3 мл микобактерий туберкулеза, убитых нагреванием), так и в различных вариациях. Вариации касаются состава эмульгатора, замены микобактерий туберкулеза отдельными фракциями из них или другими бактериями. Наиболее эффективный способ воспроизведения адъювантной болезни — однократная инъекция адъюванта в подушечки задних или всех четырех лап животного в дозе 0,05—0,1 мл.
Поражения суставов. Первые признаки воспаления суставов и окружающих тканей появляются через 10—16 дней после введения адъюванта. Суставы опухают, в полости суставов появляется экссудат, развивается периостит. Артриты носят мигрирующий характер и возникают у крыс в 70—100% случаев. Поражаются преимущественно запястно-пястные, межпястные, пястно-фаланговые и плечевые суставы на передних конечностях, а также предплюсне-плюсневые, межплюсневые, пястно-фаланговые и тазобедренные суставы па задних конечностях крыс.
Тяжелые формы артритов имеют тенденцию к затяжному течению, разрушению хрящевой поверхности суставов, развитию соединительной ткани, склероза и анкилоза суставов. В первые дни развития артритов гистологически определяется отечность периартпкулярной соединительной ткани и синовиальных оболочек, инфильтрация их мононуклеарами (моноциты, лимфоциты, гистиоциты), пролиферация фибробластов.
Через 3—4 недели среди клеток инфильтрата преобладают лимфоциты, усиливаются пролиферативные процессы, в костной ткани суставов — гиперплазия остеобластов. У большинства животных артриты заканчиваются выздоровлением с восстановлением подвижности в суставах.
Поражения кожи. Вслед за развитием артритов у крыс могут появляться участки облысения и сыпь в виде папул и бугорков. Гистологически в области небольших бугорков выявляются перивенозные мононуклеарные инфильтраты преимущественно из гистиоцитов и лимфоцитов и более диффузная гиперплазия гистиоцитов без выраженной перивенозной локализации. В больших узлах — массивная клеточная инфильтрация с изолированными фокусами некроза, содержащими материал, похожий на фибрин. Через 1—1,5 месяцев развиваются поздние кожные изменения в виде выпадения волос, шелушения, трещин, которые держатся до 3—4 мес.
Поражения селезенки и лимфатических узлов. В селезенке выявляется гиперплазия клеточных элементов, образование светлых центров в лимфатических фолликулах. Характерна гиперплазия лимфатических узлов, увеличение светлых центров реактивности (размножения) в фолликулах, пролиферация плазматических клеток в мякотных шнурах.
Поражения центральной нервной системы аналогичны тем, которые обнаруживаются при введении адъювантов с гомогенатом ткани спинного мозга и сопровождаются развитием экспериментального аллергического энцефаломиелита. Однако введение одного адъюванта не дает демиелинизацию.
Поражения глаз в виде конъюнктивита, эписклерита, увеита, иридоциклита возникают после развития артрита у небольшой части животных и держатся обычно от 2 до 14 дней. В легких случаях все явления проходят. В тяжелых случаях в передней камере глаза наблюдается скопление фибринозного экссудата, развитие задних синехий и атрофии радужки, образование преципитата на внутренней стороне роговицы и ее помутнение.
Поражения желудочно-кишечного тракта. Резко выраженная диарея отмечается примерно в 20% случаев. Она продолжается от нескольких дней до двух недель.
Поражения печени. Гистологически выявляется пролиферация клеток ретикулоэндотелиальной системы, образование клеточных инфильтратов.
Поражение почек и мочевыводящих путей. Развиваются различные виды нефрита.
Поражения органов и систем у разных видов животных, а также разных органов в пределах одного вида животных в общем однотипны, хотя имеются видовые и органные различия. Так, например, в печени, селезенке и легких мышей, морских свинок и хомяков хорошо выражена пролиферация элементов ретикулоэндотелиальной системы, но она отсутствует в сердце и почках этих животных. Амилоидоз печени, почек и селезенки наблюдается у мышей, но отсутствует у морских свинок и хомяков.
Патогенез
Существует две теории патогенеза адъювантной болезни.
1. Инфекционная теория предполагает активирование эндогенной инфекции (например, у крыс — активирование микробов семейства Mycoplasmataceae, часто обнаруживаемых у практически здоровых животных). Эта теория не получила подтверждения, так как посевы крови, ткани суставов и ткани с места инъекции адъюванта, жидкости из камер глаза оказывались стерильными, а введение больших доз различных антибиотиков не тормозило развития болезни.
2. Аутоаллергическая теория предполагает участие иммунологических механизмов. Эту теорию подтверждают следующие факты: а) латентный период при адъювантной болезни такой же, как при развитии других экспериментальных аутоаллергических процессов, при реинокуляции стимулятора он уменьшается; б) развитие заболевания тормозится воздействиями, угнетающими иммунологическую реактивность, — облучением рентгеновскими лучами в дозе 600 р, введением иммунодепрессантов, в частности 6-меркаптопурина и больших доз глюкокортикоидов, предварительной (за 4—12 нед.) тимэктомией, введением антилимфоцитарной сыворотки; в) воспроизведение адъювантной болезни невозможно у новорожденных и молодых крыс, так как механизмы иммунологической реактивности у них еще не развиты или только формируются; г) характер аутоаллергических механизмов развития болезни указывает на их отношение к реакциям замедленного типа, что подтверждается возможностью пассивного переноса адъювантной болезни взвесью клеток лимфоидного ряда и невозможностью переноса сывороткой крови, а также гистологической картиной тканевых изменений, характерной для реакций замедленного типа, торможением реакции миграции макрофагов, отсутствием снижения титра комплемента во время острого периода болезни; д) возможно воспроизведение феномена иммунологической толерантности (см. Толерантность иммунологическая), то есть подавление развития адъювантной болезни у животных, получивших при рождении микобактерий туберкулеза.
Библиография: Воробьев А. А. и Васильев Н. Н. Адъюванты, М., 1969, библиогр.; Гурвич Г. А. и др. Эндотоксины как неспецифические биостимуляторы антителообразования, Вести. АМН СССР, Л» 8, с. 50, 1964; Здродовский П. Ф. Проблемы инфекции, иммунитета и аллергии, с. 192, М., 1969; Кэбот Е. и Мейер М. Экспериментальная иммунохимия, пер. с англ., с. 316 и др., М., 1968; Рамон Г. Сорок лет исследовательской работы, пер. с франц., с. 235, М., 1962; Учитель И. Я. и Хасман Э. Л. О механизме адъювантного действия неспецифических стимуляторов антителообразования, Вестн. АМН СССР, № 3, с. 23, 1964, библиогр.; Chase М. W. Production of antiserum, в кн.: Methods in immunol. a. immunochem., ed. by C. A. Williams a. M. W. Chase, v. 1, p. 197, N. Y. — L., 1967; Freund J. The mode of action of immunologic adjuvants, Advanc. Tuberc. Res., v. 7, p. 130, 1956; Herbert W. J. Methods for the preparation of water-in-oil, and multiple, emulsions for use as antigen adjuvants, Handbook exp. immunol., ed. by D. M. Weir, p. 1207, Oxford — Edinburgh, 1967, bibliogr.; International symposium on adjuvants of immunity, ed. by R. H. Regamey a. o., Basel — N. Y., 1967; Merritt K. a. Johnson A. G. Studies on the adjuvant action of bacterial endotoxins of antibody formation, J. Immunol., v. 94, p. 416, 1965, bibliogr.; Schmidtke J. R. a. Jоhnsоn A. G. Regulation of the immune system by synthetic polynucleoti-des, ibid., v. 106, p. 1191, 1971, bibliogr.
Адъювантная болезнь — Канчурин А. X., Аскеров М. А. и Лазько И. Е. Адъювантная болезнь, Пат. физиол. и эксперим. тер., т. 13, №2, с. 78, 1969, библиогр.; Amkraut A. A., Sоlоmon G. F. a. Kraemer H. C. Stress, early experience and adjuvant-induced arthrits in the rat, Psychosom. Med., v. 33, p. 203, 1971; Bonhomme F. a. o. Arthritogenicity of unaltered and acetylated cell walls of mycobacteria, Int. Arch. Allergy, v. 36, p. 317, 1969; Carter R. L., Jamison D. G. a. Vоllum R. L. Histological changes evoked in mice by Freund’s complete adjuvant, J. Path. Bact., v. 97, p. 503, 1969; Laufer A., Tal C. a. Behar A. J. Effect of adjuvant (Freund’s type) and its components on the organs of various animal species, Brit. J. exp. Path., v. 40, p. 1, 1959; Pearson С. M. Development of arthritis, periarthritis and periostitis in rats given adjuvants, Proc. Soc. exp. Biol. (N. Y.), v. 91, p. 95, 1956; Pearson C. M. a. Wood F. D. Studies of arthritis and other lesions induced in rats by the injection of mycobacterial adjuvant, Amer. J. Path., v. 42, p. 73, 1963; Pearson C. M., Waksman В. H. a. Sharp J. T. Studies of arthritis and other lesions induced in rats by injection of mycobacterial adjuvant, J. exp. Med., v. 113, p. 485, 1961, bibliogr.; Rosenthale M. E. A comparative study of the Lewis and Sprague Dawley rat in adjuvant arthritis. Arch. int. Pharmacodyn., v. 188, p. 14, 1970, bibliogr.; Steiner J. W., Langer B. a. Sсhatz D. L. The local and systemic effects of Freund’s adjuvant and its fractions. Arch. Path., v. 70, p. 424, 1960, bibliogr.; Waksman B. H. a. Bullington S. J. Studies of arthritis and other lesions induced in rats by injection of mycobacterial adjuvant, Arch. Ophthal., v. 64, p. 751, 1960, bibliogr.; Waksman B. H. a. Wennersten C. Passive transfer of adjuvant arthritis in rats with living lymphoid cells of sensitized donors, Int. Arch. Allergy, v. 23, p. 129, 1963.
И. Н. Кокорин; В. И. Пыцкий (Адъювантная болезнь).
Национальный Фармацевтический журнал
Войти на сайт
ВАКЦИНЫ ПРОТИВ COVID-19 И АДЪЮВАНТЫ, УЛУЧШАЮЩИЕ ИХ СВОЙСТВА.

Новый адъювант для профилактических вакцин компании SEPPIC

• вакцины на основе цельного (полногеномного) ослабленного вируса;
• инактивированные вакцины на основе полностью нежизнеспособного вируса;
• векторные вакцины;
• генетические вакцины (ДНК и РНК вакцины);
• субъединичные вакцины на основе отдельных компонентов патогена, таких как белки, пептиды или генетический материал (например, белковые или рекомбинантные вакцины). Разработчики из различных стран на основании накопленных знаний и имеющихся у них результатов и методов исследований выбирают для разработки тот тип вакцины, который считают наиболее действенным для обеспечения эффективной защиты людей от вируса SARS-CoV-2 (Рис.1).
На настоящий момент среди вакцин-кандидатов против COVID-19, зарегистрированных в списке ВОЗ, можно найти практически все из вышеназванных типов вакцин. Коротко напомним, что представляет собой каждый из них и чем они отличаются друг от друга.

Векторные вакцины – это также вакцины на основе живых вирусов, однако здесь есть небольшой, но очень важный нюанс: это вакцины на основе хорошо изученных и достаточно безобидных для человека вирусов («векторов» или вспомогательных транспортных вирусов) с встроенными в них фрагментами генома «злого вируса» (Рис. 3). В случае векторных вакцин в геном хорошо изученного и, в целом, безобидного вируса, например, аденовируса («вектора»), путём генетических модификаций встраивается небольшой ген – участок генома SARS-CoV-2. При вводе в организм такой векторной вакцины генетически модифицированные вспомогательные вирусы провоцируют такой же сильный иммунный ответ на белки-антигены SARS-CoV-2, как в случае «живой» полногеномной вирусной вакцины.
Преимущество указанных вакцин, по замыслу разработчиков, в той же высокой эффективности, что и у вакцин на основе живых ослабленных вирусов, но в большей управляемости в связи с достаточной изученностью и предсказуемостью «вектора»-носителя. Векторные вакцины начали разрабатываться и изучаться относительно недавно, поэтому к массовому применению вакцин этого типа ученые также подходят с должной и необходимой осторожностью.

Еще два перспективных типа вакцин против COVID-19, разрабатываемые мировым сообществом, – вакцины на основе нуклеиновых кислот, а именно, ДНК- и РНК-вакцины. В случае ДНК-вакцины нуклеотидная последовательность, кодирующая антиген SARS-CoV-2, встраивается в вектор – бактериальную плазмиду – небольшую стабильную кольцевую молекулу ДНК, способную к автономной репликации. Сама по себе плазмида не вызывает нужного специфического иммунного ответа, для этого, собственно, в неё и вшивают гены иммуногенных белков. Указанный модифицированный геном направляется в клетку, встраивается в ее ядро и образует вирусный белок (антиген), индуцирующий иммунный ответ.
Согласно замыслу разработчиков, ДНК-вакцины не могут вызвать заражение SARS-Cov-2, однако иммунитет, который они обусловливают, должен оказаться таким же сильным, как в случае «живых» вакцин. Тем не менее, влияние ДНК-вакцин на живые организмы изучено еще в меньшей степени, чем влияние векторных вакцин, поэтому вряд ли в ближайшее время ДНК-вакцины будут допущены к массовому применению на людях. 
В случае применения РНК-вакцины получается двойной иммунный ответ: с одной стороны, выработку антител вызывают вирусные белки, с другой стороны, сами липидные частицы с мРНК могут стимулировать иммунный ответ, так как «похожи на вирус» и воспринимаются организмом соответственно. Разработчики предполагают, что при вакцинации РНК-вакцинами из-за их «двойного действия» в организме быстро возникнет сильный и стойкий иммунитет.
В случае генетических вакцин преимуществом является их относительно быстрое и экономически выгодное производство: небольшую молекулу мРНК можно довольно быстро воссоздать, наработка нужного антигена обойдется недорого. Это делает вакцину доступной широким массам. Тем не менее иммунологи очень осторожно относятся к РНК-вакцинам, так как из-за малого периода их изучения никто не знает наверняка, как именно мРНК будет вести себя в живом, особенно в репродуктивном, организме.

Одним из самых безопасных типов вакцин в настоящее время считаются субъединичные вакцины, то есть вакцины на основе белков или фрагментов вируса (Рис. 6), не имеющих в своем составе ни ДНК, ни РНК как, например, белковые вакцины.
Попадая в организм при вакцинации, смесь фрагментов вирусных белков-антигенов также способна вызывать иммунный ответ. При этом такая вакцина абсолютно безопасна, здесь невозможны мутации вируса, поэтому вызвать у человека заболевание COVID-19 такая вакцина не может. Недостатком субъединичных вакцин является довольно длительный и сложный процесс наработки и очистки – получить достаточное для вакцинации очищенное количество вирусного белка не так легко. Кроме того, в чистом виде белковые вакцины не вызывают сильный иммунный ответ, поэтому недостаточно эффективны. В связи с этим при разработке белковых вакцин очень важно:
а) усилить иммунный ответ, вводя в состав белковых вакцин соединения, усиливающие их эффективность (эти вещества называют адъюванты),
б) увеличить количество нарабатываемой вакцины также за счет добавления к наработанному вирусному белку существенного количества того же адъюванта.

Наконец, мы подошли к еще одному безопасному и перспективному типу вакцин – инактивированным вакцинам. Здесь так же, как и в случае «живых» вакцин на основе ослабленного вируса используется цельный геном SARS-Cov-2, но в случае инактивированных вакцин вирус полностью деактивирован либо высокой температурой, либо дезинфицирующими составами, либо определенным видом излучения, что делает его совершенно нежизнеспособным. Этот инактивированный вирус никогда не сможет инфицировать клетку. Тем не менее по структуре «неживой» инактивированный вирус остается полным аналогом «живого» вируса и поэтому вызывает в организме иммунный ответ. Проблема в том, что в чистом виде инактивированные вирусы индуцируют существенно более низкий иммунный ответ, нежели живые, пусть даже и ослабленные вирусы. В связи с этим в составах инактивированных вакцин так же, как и в случае субъединичных вакцин используют адъюванты – вещества, которые значительно усиливают иммунный ответ, делая эти вакцины схожими по эффективности с живыми.
Основываясь на вышесказанном, мы склоняемся к выводу, что наиболее безопасными для человека являются субъединичные и инактивированные вакцины. Для повышения эффективности указанных безопасных вакцин до уровня более иммуногенных «живых», векторных или генетических вакцин необходимо применение в их составах современных адъювантов. Что же такое адъюванты и какова их роль в вакцинах?

Адъювант (от лат. adjuvans – «помогающий, поддерживающий») – соединение или комплекс веществ, используемых для усиления иммунного ответа при введении одновременно с антигеном.
Адъюванты на протяжении десятилетий применяются для улучшения иммунного ответа на вакцинные антигены. Включение адъювантов в состав вакцин направлено на усиление, ускорение и продление специфического иммунного ответа до желаемого уровня. Таким образом, адъюванты играют ключевую роль в получении эффективного и длительного иммунитета.
Использование адъювантов в вакцинах позволяет:
• Усилить краткосрочный иммунный ответ;
• Увеличить продолжительность иммунитета, то есть сократить частоту требуемых бустерных иммунизаций;
• Направить иммунный ответ (гуморальный или клеточный иммунитет);
• Уменьшить антигенную нагрузку при сохранении эффективности вакцины;
• Улучшить иммунный ответ у ослабленных или иммунокомпроментированных вакцинируемых лиц;
• Снизить себестоимость вакцины;
• Повысить стабильность вакцины.
Интерес к адъювантам для вакцин резко возрос в 2000-е годы. Ведущие фармацевтические компании-производители путем применения адъювантов разработали более эффективные и безопасные вакцины против гриппа.
В последние годы появляется все больше и больше новых вакцин-кандидатов как для профилактики инфекционных заболеваний, так и для терапии самых тяжелых заболеваний человечества. В связи с низкой иммуногенностью таких вакцин во многих случаях требуется введение в их состав адъювантов. Новые достижения в области аналитической биохимии, очистке макромолекул, технологии рекомбинантной ДНК, улучшенное понимание иммунологических механизмов и патогенеза заболевания позволили улучшить техническую основу разработки и применения адъювантов.
В настоящее время известно довольно много эффективных адъювантов, которые классифицируются по природе происхождения, механизму действия и физическим или химическим свойствам.
Так, в современных вакцинах широко применяются гели гидроксида алюминия, фосфаты алюминия или кальция, препараты на основе масляных эмульсий и ПАВ, дисперсные адъюванты, например, виросомы, структурные комплексы сапонинов и липидов и многие другие типы адъювантов.
Как уже упоминалось выше, наиболее эффективно и поэтому чаще всего адъюванты используются в следующих категориях вакцин:
• вакцины на основе белков (рекомбинантные субъединичные);
• инактивированные;
• векторные вакцины (для уменьшения дозы).
Для каждой вакцины адъювант подбирается таким образом, чтобы получить оптимальное соотношение эффективности указанной вакцины (получение сильного и продолжительного иммунного ответа) и ее безопасности для человека (минимальная реактогенность и отсутствие побочных эффектов).
К сожалению, немаловажным аспектом уже зарегистрированных в настоящее время адъювантов является их недоступность широкому кругу разработчиков. Практически все имеющиеся на настоящий момент современные адъюванты, применяемые в профилактических вакцинах, за исключением соединений алюминия, являются собственностью крупнейших фармацевтических компаний (см. табл. 2). В первую очередь, к ним относятся адъюванты для приготовления эмульсионных вакцин. Эти адъюванты на настоящий момент считаются наиболее перспективными в профилактических вакцинах, но остаются при этом и наименее доступными, так как были специально разработаны крупными биофармацевтическими компаниями исключительно для вакцин собственного производства.
Эти недоступные широкому кругу разработчиков адъюванты ведущих фармацевтических компаний отлично зарекомендовали себя в составах готовых вакцин указанных производителей. К примеру, эмульсионные адъюванты масло-в-воде MF59, AS03 и AF03 продемонстрировали высокую эффективность в вакцинах против гриппа. Сегодня вакцинами на их основе провакцинировано >120 миллионов человек, их профиль безопасности и иммуногенности тщательно и глубоко изучен и подтвержден на значительном количестве клинических испытаний (см. табл. 3).

Франсуа Бертран, руководитель направления разработки и производства адъювантов компании Seppic, в своем выступлении по поводу выпуска адъюванта SEPIVAC TM SWE на мировой рынок сказал: «Указанная разработка иллюстрирует наше общее стремление привнести готовый эффективный и общедоступный адъювант в мировое сообщество разработчиков вакцин. Мы твердо верим, что SEPIVAC TM SWE ускорит разработку новых профилактических вакцин для людей и будет способствовать более здоровому будущему человечества во всем мире».