Агенезия и аплазия матки что это значит
Агенезия и аплазия матки что это значит
Термин «аплазия матки и влагалища» (т.е. синдром Майера-Рокитанского-Кюстера-Хаузера) был впервые использован в 1829 г. Известно, что заболеваемость составляет 1 на 5000 новорожденных девочек. Поскольку данное нарушение препятствует нормальному развитию влагалища и соответствующих структур матки, ASRM относит его к классу аномалий IA. В подростковом возрасте у пациенток возникают жалобы на первичную аменорею. Являясь причиной первичной аменореи, мюл-лерова агенезия по распространенности занимает второе место, уступая только дисгенезии гонад.
У пациенток с аплазией матки и влагалища отмечают нормальное начало полового созревания и своевременное появление вторичных половых признаков. Они не испытывают циклической боли в малом тазу, что характерно для пациенток с обструктивными мюл-леровыми аномалиями. Внешние гениталии полностью соответствуют норме, отмечают нормальный рост волос на лобке и нормальное развитие малых половых губ, в отличие от пациенток с синдромом полного отсутствия чувствительности к андрогенам. Края девственной плевы могут быть различимы, но вход во влагалище отсутствует. Уплотнений в области малого таза, позволяющих заподозрить гематокольпос, нет, что служит отличием от полной поперечной перегородки.
Поскольку у пациенток имеется кариотип 46,XX, в малом тазу у них присутствуют нормальные яичники, а также происходит овуляция (определяют при измерении БТТ). Гормональный уровень у таких пациенток находится в пределах нормы, длина цикла варьирует от 30 до 34 дней. Кроме того, пациентки могут испытывать ежемесячную боль (боли в середине цикла), указывающую на овуляцию.
Сопутствующие аномалии аплазии матки и влагалища
Некоторые, но не все описанные аномалии могут закладываться еще в процессе эмбрионального развития. У пациенток с мюллеровой агенезией обнаруживают проблемы со слухом. У больных с мюллеровыми аномалиями чаще отмечают нарушения слуха по сравнению с теми, у кого мюллеровы структуры развиваются нормально.
Пороки развития половых органов могут сочетаться с аномалиями почек и опорно-двигательного аппарата. Отклонения в формировании и развитии почек отмечают у 40% таких пациенток. Возможны полная агенезия почки, неправильное расположение и изменения ее структуры. Отклонения в развитии костного скелета отмечают в 12% случаев. Это, прежде всего, дефекты позвоночного столба, конечностей и ребер. Пациенток с аномалиями гениталий необходимо обследовать на наличие сопутствующих аномалий.
Все врожденные пороки развития формируются в эмбриональном периоде. Ни по данным литературы, ни по нашим наблюдениям не отмечено частых нарушений слуха. Встречаются единичные сообщения о таком сочетании, связанном со многими пороками развития.
Этиология аномалий гениталий (аплазия матки и влагалища) остается неизвестной. Возможно, на ее развитие влияет ряд наследственных факторов, однако сообщений об аналогичных случаях в семьях пациенток немного. По всей вероятности, аномалии гениталий не наследуются по аутосомно-доминантному типу, поскольку ни у одной девочки из потомства женщин с мюллеровой агенезией (рожденной в результате ЭКО суррогатной матерью) не была выявлена агенезия влагалища.
Диагностика аплазии матки и влагалища
Диагноз «пороки развития матки и влагалища» устанавливают с помощью различных визуализирующих методов. УЗИ брюшной полости в этом случае указывает на отсутствие матки при наличии яичников. Уплотнение по средней линии живота, в котором обнаруживают скопление крови, как правило, позволяет выявить обструктивную мюллерову аномалию. Дифференциальная диагностика мюллеровой агенезии и обструкции представляется чрезвычайно важной, потому что ошибочная диагностика может привести к выбору того или иного метода лечения, опасного для пациентки.
МРТ позволяет проводить предоперационную диагностику аномалий матки и влагалища. К типичным находкам в области малого таза относится обнаружение нормальных яичников и фаллопиевых труб, а также (обычно) незначительных по размеру мюллеровых рудиментов, непосредственно присоединенных к проксимальной части фаллопиевых труб, которые могут быть солидными или содержать функционирующий эндометрий.
Очень важно перед началом исследования предупредить радиолога о необходимости дифференциальной диагностики. Возможно, что радиолог, не имеющий достаточной квалификации, может принять рудиментарные структуры за нормальную матку. Радиологу необходимо обращать внимание на малые размеры этих структур — это позволит поставить диагноз пороков развития матки.
К счастью, с помощью современных репродуктивных технологий (рождения детей суррогатной матерью после искусственного оплодотворения) молодые женщины получают возможность иметь собственных генетических детей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Рокитанского-Кюстнера
Общие сведения
Частота встречаемости синдрома Рокитанского-Кюстнера составляет 1 на 4500-5000 случаев новорожденных девочек. Регистрируются как спорадические, так и семейные формы аномалии. Современная гинекология выделяет изолированный синдром Рокитанского-Кюстнера, характеризующийся только аплазией матки и влагалища, а также тип порока, сочетающийся с врожденными аномалиями развития позвоночника, почек, сердца и др. органов.
Первое упоминание порока развития матки и влагалища относится к началу XIX в., когда немецкий ученый Майер описал аплазию влагалища, сочетающуюся с множественными аномалиями развития. Позднее Рокитанским и Кюстером было замечено, что при данном синдроме также отсутствует матка, но сохранены и нормально функционируют яичники. В дальнейшем Хаузер обнаружил частое сочетание аплазии матки и влагалища с пороками развития почек и скелета.
Этиология
Эпизоды семейного синдрома Рокитанского-Кюстнера наследуются по аутосомно-доминантному типу передачи с неполной пенетрантностью и экспрессивностью гена. Синдрома Рокитанского-Кюстнера в гинекологии диагностируется у женщин с первичной аменореей в 20% случаев.
Клинические проявления
Основной жалобой, с которой девочки 15-16 лет приходят на консультацию гинеколога, служит отсутствие менструаций. Пациенток более старшего возраста обычно беспокоит невозможность ведения половой жизни. В отдельных случаях синдром Рокитанского-Кюстнера выявляется в результате экстренного обращения женщины в связи с тяжелыми разрывами промежности при попытке полового сношения.
Лица с синдромом Рокитанского-Кюстнера сложены по женскому типу, имеют нормально развитые наружные гениталии и вторичные половые признаки. При синдроме Рокитанского-Кюстнера влагалище либо полностью отсутствует, либо определяется в виде укороченного слепого мешка. Недоразвитие внутренних половых органов может проявляться наличием рудиментной матки в виде небольшого тяжа или двух рогов с тонкими неполноценными фаллопиевыми трубами или полным их отсутствием. При этом яичники имеют нормальную архитектонику и полноценно функционируют.
У 40% женщин синдром Рокитанского-Кюстнера сочетается со скелетными аномалиями и пороками мочевой системы – подковообразной почкой, дистопией почки, аплазией почки, удвоением мочеточников. Больные с синдромом Рокитанского-Кюстнера бесплодны.
Диагностика
Общий осмотр выявляет правильное телосложение, соответствие физического и полового развития возрастным нормам. При гинекологическом осмотре на кресле пациенток с синдромом Рокитанского-Кюстнера определяется нормальное развитие наружных гениталий, оволосение по женскому типу. Исследование влагалища с помощью зонда выявляет за девственной плевой укороченное и слепо заканчивающееся влагалище длиной 1-1,5 см. Ректально-абдоминальное исследование позволяет пальпировать тяж в месте типичного расположения матки и отсутствие придатков.
График измерения БТ в прямой кишке соответствует смене фаз менструального цикла и подтверждает нормальное функционирование яичников. Показатели уровня гонадотропинов и стероидов в плазме соответствуют норме. Проведение трансабдоминального УЗИ или МРТ органов малого таза удостоверяет наличие синдрома Рокитанского-Кюстнера. На УЗИ почек нередко выявляются аномалии мочевыводящих путей. Иногда для уточнения степени аплазии перед проведением кольпопоэза прибегают к диагностической лапароскопии. Синдром Рокитанского-Кюстнера дифференцируют с атрезией влагалища и матки при синдроме тестикулярной феминизации (мужской кариотип 46-XY).
Лечение
Единственным способом лечения синдрома Рокитанского-Кюстнера является пластическое формирование неовлагалища – кольпопоэз из тазовой брюшины или сигмовидной кишки. Бужирование и дилятация рудиментного влагалища (кольпоэлонгация) возможна только при его достаточной длине – 2-4 см. Целью вмешательств служит устранение препятствия для нормальной половой жизни.
В большинстве случаев в реконструктивно-восстановительной интимной пластике проводится лапароскопический кольпопоэз с ротацией фрагмента сигмовидной кишки на собственной брыжейке. Искусственное влагалище, сформированное из тканей кишки, не требует дополнительного увлажнения, что положительно сказывается на качестве сексуальной жизни женщин с синдромом Рокитанского-Кюстнера.
Ткани неовагины после операции подвергаются некоторым морфофункциональным изменениям, выражающимся в склерозе, атрофии и дисплазии слизистой кишки. Чтобы не допустить склерозирования и стеноза просвета искусственного влагалища необходимо ведение регулярной половой жизни или периодическое проведение бужирования.
Лапароскопический кольпопоэз при синдроме Рокитанского-Кюстнера имеет преимущества перед открытым вмешательством, позволяя достичь лучших эстетических результатов. При невозможности выполнения кольпопоэза из сигмовидной кишки (недостаточной длине брыжейки) для пластики неовлагалища используются тазовая брюшина, поперечно-ободочная или тонкая кишка.
Прогноз
При синдроме Рокитанского-Кюстнера возможен только паллиативный вариант лечения, которое направлено на адаптацию пациентки к нормальной сексуальной жизни при сохранении аменореи. После пластики влагалища у пациенток с синдромом Рокитанского-Кюстнера нормализуется половая функция. Рождение генетических детей от женщин с синдромом Рокитанского-Кюстнера может быть достигнуто только с использованием экстракорпорального оплодотворения и суррогатного материнства.
Агенезия и аплазия матки что это значит
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Генетические факторы развития синдрома Майера—Рокитанского—Кюстера—Хаузера (аплазии матки и влагалища)
Журнал: Проблемы репродукции. 2020;26(5): 43-50
Аракелян А.С., Попрядухин А.Ю., Карапетян Э.А. Генетические факторы развития синдрома Майера—Рокитанского—Кюстера—Хаузера (аплазии матки и влагалища). Проблемы репродукции. 2020;26(5):43-50.
Arakelyan AS, Popryadukhin AYu, Karapetyan EA. Genetic factors in the development of the Mayer-Rokitansky-Küster-Hauser syndrome (aplasia of the uterus and vagina). Russian Journal of Human Reproduction. 2020;26(5):43-50.
https://doi.org/10.17116/repro20202605143
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
Под врожденными пороками развития понимают стойкие отклонения от нормы, морфологические и функциональные изменения органов и тканей, возникающие внутриутробно или после рождения. Пороки развития женских половых органов составляют 4% от всех аномалий развития. Зачастую диагностика отклонений развития гениталий сопровождается диагностическими ошибками в связи с большим разнообразием пороков и отсутствием единой классификации. В данном обзоре обобщены и представлены для обсуждения сведения о генетической предрасположенности к формированию одного из пороков развития — аплазии матки и влагалища.
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Даты принятия в печать:
История и эмбриогенез
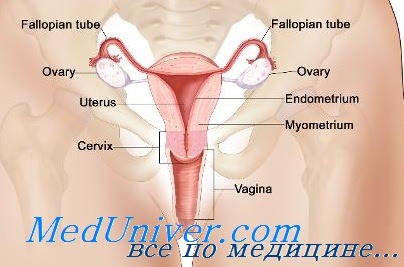
Женская репродуктивная система человека включает в себя матку, шейку матки, фаллопиевы трубы, яичники и влагалище. Принято считать, что фаллопиевы трубы, матка, шейка матки и верхние две трети влагалища берут свое начало из парамезонефрических (мюллеровых) протоков, тогда как нижняя часть влагалища образуется из урогенитального синуса [1, 2]. Формирование мюллеровых протоков начинается примерно на 5—6-й неделе гестации в виде билатеральных краниокаудальных инвагинаций целомического эпителия мочеполовых гребней (промежуточная мезодерма), растущих каудально по мезонефрическим (вольфовым) протокам и достигающих урогенитального синуса. Каудальная часть двух мюллеровых протоков сливается, образуя матку, шейку матки и верхнюю часть влагалища, тогда как верхние части образуют два яйцевода (маточные трубы). Синдром Майера—Рокитанского—Кюстера—Хаузера (МРКХ) вызывается либо полным агенезом, либо аплазией парамезонефрических протоков с образованием матки и верхней части влагалища [3].
Синдром Майера—Рокитанского—Кюстера—Хаузера (СМРКХ) имеет давнюю историю и тем самым оправдывает свое длинное название. Впервые немецкий анатом C. Mayer в 1829 г. описал врожденное отсутствие влагалища как одну из особенностей мертворожденных плодов с множественными врожденными аномалиями [4]. Немного позднее, в 1838 г., австрийский врач и патологоанатом K. Rokitansky определил, что аплазия влагалища часто сочетается с отсутствием матки, однако при этом анатомия и функция яичников не нарушены. H. Küster в 1910 г. описал несколько случаев, отметив типичное сочетание этого порока с аномалиями скелета и почек [5, 6]. И только швейцарский гинеколог G. Hauser в 1961 г. подтвердил связь между аплазией матки и влагалища и аномалиями развития скелета и почек, и синдром получил свое полное название [7].
В зарубежной литературе представлены и другие названия данного синдрома, такие как CAUV-синдром (Congenital Absence of the Uterus and Vagina), MA-синдром (Mullerian Aplasia), GRES-синдром (Genital Renal Ear Syndrome) [8].
Классификация и фенотипические проявления
СМРКХ, который также именуется как аплазия матки и влагалища, является второй по частоте причиной первичной аменореи и вдобавок приводит к проблемам, связанным с половой жизнью. Для него характерно врожденное отсутствие матки, шейки матки и влагалища у фенотипически нормальных девочек с кариотипом 46, XX. Частота встречаемости данного синдрома наблюдается примерно в соотношении 1/4000—5000 новорожденных девочек. В литературе описано два типа СМРКХ: тип I включает только аплазию матки и влагалища с нормальным развитием яичников и других систем, а тип II, или MURCS-ассоциация (Mullerian duct aplasia, Renal dysplasia and Cervical Somite anomalies), включает аплазию матки и влагалища и сопутствующие дефекты, такие как пороки развития почек, скелета (чаще в шейно-грудном отделе), дефекты слуха и редкие сердечные аномалии [9].
Число женщин с I типом составляет примерно 44% случаев СМРКХ, он характеризуется полной аплазией матки при наличии двух симметричных рудиментарных рогов, соединенных перитонеальной складкой. В свою очередь, рудиментарные рога могут быть как функционирующими с эндометриальной тканью, так и нефункционирующими. У таких пациенток поражается только каудальная часть мюллерова протока (верхняя часть влагалища, шейка матки и матка) и нет сопутствующих пороков развития. Зачастую данный порок развития диагностируется в подростковом возрасте из-за первичной аменореи [10].
СМРКХ II типа наблюдается сравнительно чаще — на данную форму приходится примерно 56% случаев [11].
Для этой формы характерна дополнительная асимметричная гипоплазия одной или двух почек с дисплазией или без дисплазии одной или обеих маточных труб. Часто наблюдаются другие сочетанные аномалии, в частности почечные дефекты (у 40—60% пациентов), включая одностороннюю агенезию (23—28%), или эктопию одной или обеих почек (17%), или подковообразную почку [12, 13].
Нередко встречаются различные пороки развития скелета, в то время как пороки развития сердца и нарушения слуха встречаются гораздо реже [8].
Скелетные аномалии обычно затрагивают позвоночник (30—40%) и реже лицо и конечности. Сколиоз встречается в 20% случаев. Аномалия Клиппеля—Фейля представляет собой слияние минимум двух шейных сегментов, короткую шею, низкую линию роста волос и ограничение движений шеи [14]. Деформация Шпренгеля — это врожденное одно- или двусторонее высокое стояние лопаток [15].
В литературе агенезия женских половых органов может встречаться в сочетании с другими редкими синдромами, такими как синдром McKusick—Kaufman (ген MKKS, локус 20p12), для которого характерно сочетание трех признаков: дополнительные пальцы рук и/или ног (полидактилия), пороки сердца и аномалии половых органов; синдром Bardet—Biedl (ген MKKS, локус 20p12 и ряд других генов в разных хромосомах) — потеря зрения, аносмия, ожирение, полидактилия, короткие или сросшиеся пальцы рук или ног, гипогонадизм, бесплодие; синдром Wolf—Hirschhom (делеции хромосомы 4р16.3), основные признаки которого включают характерный внешний вид лица, задержку роста и развития, умственную отсталость, низкий мышечный тонус (гипотонию) и судороги; синдром Goldenhar — редкий врожденный дефект, характеризующийся неполным развитием уха, носа, мягкого нёба, губ и нижней челюсти, как правило, на одной стороне тела [16].
Слуховые дефекты или глухота возникают из-за пороков развития среднего уха или в результате нейросенсорных дефектов различной степени тяжести [17].
Гены и хромосомные аномалии
В настоящее время генетика СМРКХ остается недостаточно изученной, трудности заключаются в выявлении единственной генетической причины данного заболевания. Поиск молекулярной основы СМРКХ продолжается, но в настоящее время лечение включает в себя только метод создания неовлагалища. Такой способ лечения должен быть предложен пациенткам лишь тогда, когда они эмоционально зрелы и готовы начать половую жизнь. На сегодняшний день применяется нехирургический метод кольпоэлонгации и хирургический кольпопоэз из тазовой брюшины / сигмовидной кишки для улучшения качества жизни и удовлетворения сексуальной функции [18].
Клиническое применение трансплантации матки для деторождения пациенток с СМРКХ находится в стадии изучения и клинических испытаний по всему миру. Впервые M. Brännström успешно провел трансплантацию матки человеку в 2013 г. в Швеции. Матка пожертвована живой 61-летней женщиной (донор), родившей двоих детей, 35-летней женщине (реципиент) с аплазией матки и влагалища. Спустя год после трансплантации с помощью процедуры экстракорпорального оплодотворения наступила беременность. В результате пациентка госпитализирована на 31-й неделе беременности с преэклампсией, выполнены оперативные роды с помощью кесарева сечения. Родился здоровый мальчик: 9—10 баллов по шкале APGAR. Следует отметить, что данный метод является перспективным и многообещающим, однако пока широко не применяется. Дороговизна и ряд ограничений, таких как отторжение органа, поиск донора, осложнения во время беременности, обусловливают необходимость дальнейшего изучения этого способа лечения при аплазии матки и влагалища [19].
Гетерогенность СМРКХ предполагает наличие молекулярных дефектов на пути развития внутренних органов, тесно связанных в процессе эмбриогенеза. Действительно, СМРКХ проявляется в результате возникновения повреждений на сроке 5—6 нед беременности, поражая промежуточную мезодерму и приводя к слиянию мюллеровых протоков. Почечная система также развивается из мезодермы, что и объясняет агенезию почек или эктопию, часто ассоциированную с СМРКХ [20].
Долгое время синдром считался спорадической аномалией, но увеличивающееся число семейных случаев подтверждает гипотезу генетической причины. В семейных случаях синдром передается как аутосомно-доминантный признак с неполной пенетрантностью и переменной выразительностью. Это предполагает вовлечение либо мутаций в основном гене развития, либо более ограниченного хромосомного дисбаланса.
Семейство WNT включает группу генов, участвующих в эмбриональном развитии. Более того, гены WNT играют хорошо известную роль в развитии мочеполовой системы млекопитающих [21, 22]. Среди ряда генов данной группы наиболее известный — WNT4 является основным геном, определяющим пол, и необходим для инвагинации целомических эпителиоцитов [23], в то время как WNT9b экспрессируется эпителием вольфовых протоков и способствует удлинению мюллеровых протоков [21]. Нокаутные мыши WNT9b демонстрируют МРКХ-подобный фенотип с отсутствием матки и верхней части влагалища и нормальными яичниками [21]. У человека WNT4 — первый ген, ассоциированный с дефектами развития матки и сопутствующим гиперандрогенизмом. Мутация WNT4 ингибирует репрессию стероидных ферментов яичников и вызывает аномальную экспрессию 17α-гидроксилазы, вызывая у этих пациентов гиперандрогению. В своих исследованиях A. Biason-Lauber и соавт. выявили мутации в гене WNT4 только у 4 пациентов с СМРКХ и гиперандрогенией [23—25].
Известно, что белок Wnt4 подавляет гены, кодирующие стероидогенные ферменты CYP17A1 и HSB3B2, которые необходимы для синтеза тестостерона [23]. Мутировавший WNT4 не может подавлять экспрессию андроген-синтезирующих ферментов в клетках яичников, что приводит к проявлению гиперандрогенного фенотипа [24, 25].
Синонимичные изменения также наблюдались и в исследованиях P. Philibert и соавт., которые провели функциональный анализ ДНК у 28 девочек-подростков с первичной аменореей и аплазией матки и влагалища. Путем прямого секвенирования идентифицирована новая мутация L12P в экзоне 1 гена WNT4. Функциональный анализ показал, что мутация индуцирует значительно повышенную экспрессию ферментов, участвующих в биосинтезе андрогенов (3β-гидроксистероиддегидрогеназы и 17α-гидроксилазы) [26]. Поэтому сделано предположение, что СМРКХ с признаками андрогенизации за счет гетерозиготных мутаций WNT4 — это отдельная клиническая ситуация, которую можно отличить от классического СМРКХ.
Мутации в гене WNT7 вызывают различные пороки развития конечностей с дополнительными пороками развития мочеполовой системы. C. Ravel и соавт. не наблюдали в своей когорте из 11 пациентов с СМРКХ мутации в гене WNT7A [27]. Исследователи утверждают, что мутации WNT7A у человека больше связаны с рядом гиподисплазий конечностей, включая синдром Fuhrmann (нелетальный порок развития конечностей с различной степенью аплазии/гипоплазии конечностей и дисплазии суставов. Основные проявления включают гипоплазию таза, аплазию или гипоплазию малоберцовых костей, сильное искривление бедер, отсутствие ногтей и полидактилию) и Al-Awadi/Raas-Rothschild/Schinzel phocomelia syndrome — AARRS (редкое аутосомно-рецессивное заболевание, характеризующееся тяжелыми пороками развития верхних и нижних конечностей с выраженной гипоплазией таза и аномальными гениталиями) [28].
В 2014 г. M. Wang и соавт. сообщили о первой мутации WNT9B, связанной с СМРКХ в китайской популяции; однако другое исследование не подтвердило эту ассоциацию [29, 30]. Возможная роль мутаций WNT9B в СМРКХ выявлена в недавнем исследовании, в котором авторы обнаружили 5 гетерозиготных миссенс-мутаций и гетерозиготную нонсенс-мутацию у пациентов с СМРКХ I типа [31].
Интересно, что A. Pedersen и соавт. обнаружили дополнительные изменения, возможно, связанные с мутациями WNT9B и фенотипом СМРКХ: делецию в хромосомной области 17q12, включающую ген LHX1, подтвержденную связью этого гена с экспрессией WNT9b в мышиной модели, и мутацию в TBX6. Таким образом, у этих пациентов специфический фенотип может быть результатом совместного возникновения мутаций WNT9B и делеции LHX1 или мутации TBX6 [32].
Гены, содержащие гомеобокс, принадлежат к большому семейству, включающему кластеры HOX. Некоторые из Hox-генов (Hoxa9—13 и Hoxb9—13) играют решающую роль в развитии женских репродуктивных путей и поэтому считаются предполагаемой причиной СМРКХ [33].
HOXA9 экспрессируется в фаллопиевых трубах, HOXA10 — в матке, HOXA11 — в матке и шейке матки, а HOXA13 — в верхней части влагалища [38].
Самки мышей с нокаутом по HOXA9—13 обнаруживают аномалии развития мочеполового аппарата [39]. Более того, также сообщалось о роли HOXA9—11 в развитии почек [40]. Несмотря на их центральную роль, никаких патогенных мутаций в этих генах у пациентов с СМРКХ не выявлено [41].
Ассоциация SHOX, еще одного члена семейства гомеобокс-содержащих генов, с СМРКХ идентифицирована у пациентов с дупликациями гена SHOX [42]. Мутации SHOX связаны с дефектами развития и аномалиями скелета [43]. У пациентов с СМРКХ гетерозиготная дупликация гена SHOX, включающая экзоны 4 и 5 и часть экзона 6, первоначально обнаружена у двух пораженных сестер и их здорового отца. Включение в анализ еще 28 женщин с СМРКХ привело к выявлению дупликаций HOXA у трех неродственных пациенток [42].
Гены с широким спектром активности в раннем развитии (например, WT1 [44], PAX2 [45], HOXA7, HOXA13 [41] и PBX1 [42]) также предложены в качестве кандидатов на основе наблюдаемых фенотипов у мутантных мышей. Однако их роль в развитии СМРКХ впоследствии не подтверждена.
Научный интерес вызывают данные о том, что у одного из монозиготных близнецов развивается СМРКХ, а у другого нет, это означает, что заболевание обусловлено различиями в фенотипе. Таким образом, патогенетический механизм СМРКХ может включать эпигенетические изменения, обусловленные экологическими факторами [42]. K. Rall и соавт. [46] исследовали различия в продуктах транскрипции и уровнях метилирования у пациентов с СМРКХ и у здоровых добровольцев с помощью общегеномного анализа. Анализ микрочипов выявил 293 продукта транскрипции с различными уровнями экспрессии и 194 CpG-островка с различными паттернами метилирования по сравнению с таковыми у здоровых добровольцев. Оценивали два кластера генов, 9 потенциально причинных генов (HOXA5, HOXA9, WISP2, CDH5, PEG10, MFAP5, LRRC32, RALGPS2 и ralgps2) идентифицированы, 6 из этих генов (CDH5, MFAP5, WISP2, HOXA5, PEG10 и HOXA9) участвуют в развитии женских половых органов. Последующие сетевые анализы выявили WISP2, HOXA5, HOXA9, GATA4 и WT1 в качестве причины развития СМРКХ.
WT1 и GATA4 регулируют определение и дифференцировку пола с помощью антимюллерова гормона (АМГ) [47]. WT1 и GATA4 деметилируются у пациентов с СМРКХ по сравнению со здоровыми добровольцами. WT1 и GATA4 способствуют экспрессии АМГ, что приводит к дегенерации мюллерова протока. Активирующая мутация гена рецептора АМГ, приводящая к неадекватной избыточной продукции АМГ либо самого рецептора, является основной причиной развития СМРКХ [46]. Эктопическая экспрессия HOXA9 приводит к аномалии развития верхнего мюллерова протока [48, 49]. Кроме того, HOXA5 является фактором транскрипции р53 и рецептора прогестерона [50]. Эктопическая экспрессия HOXA5, как и HOXA9, ингибирует дифференцировку мюллеровых протоков [51].
WISP2 играет важную роль в пролиферации и миграции гладкомышечных клеток и индуцируется эстрогеном в матке [52]. Эстроген регулирует уровень экспрессии АМГ [52], а чрезмерное воздействие эстрогена во время развития активирует промоторы АМГ [46]. Воздействие на плод эндокринно-разрушающих химических веществ способствует внематочной экспрессии генов HOXA. K. Rall и соавт. [46] предположили, что чрезмерное воздействие эстрогена и эктопическая экспрессия HOXA могут привести к гипоплазии женских половых органов и вызвать СМРКХ.
Альтернативный подход, основанный либо на очевидной ассоциации с другими генетическими заболеваниями, либо на плейотропном действии во время эмбриогенеза и последующих проявлениях в виде дефектов развития, привел к исследованию нескольких генов [53].
Проанализирована генетическая ассоциация СМРКХ с галактоземией [54] или с муковисцидозом [55], но ни ген галактозо-1-фосфатуридилтрансферазы (GALT) [56], ни ген, кодирующий трансмембранный регулятор муковисцидоза (CFTR) [55], не имели каких-либо мутаций или полиморфизма, связанных с этим заболеванием.
СМРКХ в основном носит спорадический характер, однако описаны семейные случаи, указывающие на то, что по крайней мере у некоторых пациентов СМРКХ может быть наследственным заболеванием [57, 58].
На сегодняшний день зарегистрировано только 68 случаев семейного СМРКХ [58].
Синдром демонстрирует аутосомно-доминантный тип наследования с неполной пенетрантностью и переменной экспрессивностью. Недавно M. Herlin и соавт. (2019) сообщили об уникальной семье из трех поколений, состоящей из двух двоюродных сестер с СМРКХ и односторонней аплазией почки и двух умерших мужчин-родственников, также имевших аплазию почки [58]. Выполнено полное экзомное секвенирование у восьми членов семьи, что привело к идентификации нового патогенного миссенс-варианта в GREB1L, гене, недавно идентифицированном как новая причина аплазии почки. L. De Tomasi и соавт. в своем исследовании описали случаи лиц женского пола с аплазией матки и аплазией почки, подтверждающие, что ген GREB1L играет важную роль в развитии почек и женских половых путей [59]. M. Herlin и соавт. утверждают, что GREB1L — новый и перспективный ген-кандидат в этиологические факторы развития этиологии СМРКХ [58, 60].
Связь гена TCF2 (ранее v-HNF1 или HNF-1β) первоначально обнаружена с сахарным диабетом, почечными кистами и другими нарушениями развития почек [61, 62]. Следует отметить, что генитальные пороки развития, такие как двурогая матка [63], аплазия мюллеровых протоков [64], иногда обнаруживались в сочетании с аномалиями почек в некоторых семейных случаях, демонстрирующих мутации в гене TCF2. Дефектами этого гена можно объяснить некоторые редкие случаи генитальных пороков развития, включая аплазию, что позволяет предположительно подтвердить генетическую связь с СМРКХ, но наблюдения ограничиваются семейными случаями с почечным и/или диабетическим анамнезом.
Сообщалось также о случаях носительства хромосомных аномалий при СМРКХ, затрагивающих хромосомы 1—7, 10—18, 22 и X, но сравнение результатов различных исследований выявило только 5 повторяющихся делеций/дупликаций в хромосомных областях 1q21.1, 16p11.2, 17q12, 22q11.21 и Xp22 [65—71]. В целом эти изменения выявлены у 28 пациентов с СМРКХ и составляют примерно 10% случаев СМРКХ. Подробно описаны 2 делеции 0,4—4,6 Mb [68, 72] и 2 унаследованные дупликации 0,26—2,7 Mb [66, 72], вовлекающие область 1q21. Что касается 16p11.2, такая же делеция 0,6 Mb зарегистрирована у 4 неродственных пациентов с СМРКХ [70]. Делеция 1,2—1,8 Mb в 17q12 является наиболее частой перестройкой, описанной у 11 пациентов и ассоциированной с вариабельным фенотипом СМРКХ [66—68, 70—72]. Область 22q11 участвует в 5 делециях [65, 66, 68, 70] размером от 390 kb до 2,6 Mb и в 2 дупликациях размером 0,6—3,5 Mb [66, 68]. Эти две дупликации составляют часть сложного кариотипа, включающего дополнительные хромосомные аномалии, и у одного из двух пациентов [66] они унаследованы от здоровой матери. Наконец, дупликации Xp22 зарегистрированы в 7 случаях СМРКХ, включая двух сестер [42, 68, 71]. Интересно, что ген SHOX картируется в этой хромосомной области и, по-видимому, дублируется у подгруппы пациентов с СМРКХ [42]. Восемь перестроек считались de novo: 4 делеции 17q12 [66, 67, 71], 1 случай с делецией 22q11 [66], делеции 1q21 и 1q44 [72] и 1 дупликация Xp22 [42]. Напротив, 2 дупликации в 22q11 и 1q21, выявленные у одной и той же пациентки, унаследованы от здоровой матери [66], что ставит под сомнение их роль в патогенезе. Унаследованные от отца хромосомные изменения, о которых сообщалось в 5 случаях (дупликация 1q21, делеции 13q21 и 15q26 и дупликация Xp22 у двух сестер), по-видимому, не были патогенными для здорового отца, но стали причиной развития заболевания у дочери. Несмотря на эти данные, отсутствие информации о наследовании для всех других случаев СМРКХ затрудняет определение четкого патогенетического вклада в эти перестройки. Дополнительная сложность в выявлении патогенных эффектов перестроек возникает из-за фенотипической изменчивости пациентов. Фенотипы пациентов с СМРКХ с хромосомным дисбалансом варьируют от изолированной мюллеровой аномалии до сложных синдромных признаков, включая тип 2/MURCS, и различные клинические проявления также могут быть связаны с одной и той же хромосомной перестройкой.
Заключение
Генетическая гетерогенность, вероятно, недооценена, потому что большинство исследований на сегодняшний день основано на «гене-кандидате», в то время как следует применять более широкие методы, такие как полное секвенирование экзома, особенно в семейных случаях, чтобы идентифицировать новые причинные гены и уточнить характер наследования и пенетрантности. Кроме того, открытие новых генов, вызывающих синдром Майера—Рокитанского—Кюстера—Хаузера, также расширит знания о молекулярных путях, играющих роль в развитии женского репродуктивного тракта. Только анализ больших когорт пациентов с синдромом Майера—Рокитанского—Кюстера—Хаузера, безусловно, поможет определить новые гены-кандидаты в этиологические факторы развития данного заболевания и установить фенотип / генотипические корреляции, необходимые для генетического анализа и диагностики синдрома.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.