Агенезия щитовидной железы что это такое
ВРОЖДЕННЫЙ ГИПОТИРЕОЗ
Врожденный гипотиреоз (ВГ) — заболевание щитовидной железы, встречающееся с частотой 1 случай на 4000–5000 новорожденных. У девочек заболевание выявляется в 2–2,5 раза чаще, чем у мальчиков. В основе
Врожденный гипотиреоз (ВГ) — заболевание щитовидной железы, встречающееся с частотой 1 случай на 4000–5000 новорожденных. У девочек заболевание выявляется в 2–2,5 раза чаще, чем у мальчиков.
В основе заболевания лежит полная или частичная недостаточность тиреоидных гормонов, вырабатываемых щитовидной железой, которая приводит к задержке развития всех органов и систем. В первую очередь страдает от недостатка тиреоидных гормонов центральная нервная система. Установлена прямая связь между возрастом, в котором начато лечение, и индексом интеллектуального развития ребенка в дальнейшем. Благоприятного (адекватного) умственного развития можно ожидать, только если заместительная терапия была начата в первый месяц жизни ребенка.
Своевременно поставить диагноз и, следовательно, вовремя начать лечение можно только при проведении раннего (в первые дни жизни) обследования всех новорожденных.
Массовое обследование (скрининг) по поводу врожденного гипотиреоза впервые было осуществлено в Канаде в 1971 г. На сегодняшний день это обычный метод обследования в большинстве развитых стран. В России аналогичный скрининг проводится в течение последних 12 лет.
Основные принципы проведения неонатального скрининга ВГ заключаются в следующем. Все варианты врожденного гипотиреоза сопровождаются низкими уровнями тиреоидных гормонов (Т4, Т3), повышение уровней тиреотропного гормона (ТТГ) характерно для первичного гипотиреоза. Но поскольку он представляет собой наиболее распространенный вариант заболевания (до 90% всех случаев), в большинстве стран в основе скрининга лежит определение ТТГ. В США и Канаде скрининг базируется на определении Т4. Оптимальным было бы определение обоих параметров, однако это значительно увеличивает стоимость обследования.
Основная цель скрининга по врожденному гипотиреозу — раннее выявление всех новорожденных детей с повышенным уровнем ТТГ в крови. Все новорожденные с аномально высоким ТТГ требуют срочного углубленного обследования для окончательной диагностики заболевания и немедленного начала заместительной терапии (оптимально — в первые 3 нед жизни).
У всех новорожденных на 4–5-й день жизни (у недоношенных детей на 7–14-й день жизни) берется кровь (чаще из пятки) и 6–8 капель наносится на специальную пористую, фильтровальную бумагу. Полученные и высушенные образцы крови отсылаются в специализированную лабораторию, где проводится определение ТТГ.
Концентрация ТТГ зависит от метода определения. Пороговый уровень ТТГ подвержен колебаниям и устанавливается отдельно для каждой лаборатории в зависимости от выбранного метода определения. Большинство лабораторий работают с диагностическими наборами «Дельфия», для которых пороговым является уровень ТТГ — 20 мЕд/л. Таким образом, все образцы ТТГ до 20 мЕд/л — это вариант нормы. Все образцы с концентрацией ТТГ выше 20 мЕд/л должны быть проверены повторно, концентрация ТТГ выше 50 мЕд/л позволяет заподозрить гипотиреоз, а уровни ТТГ выше 100 мЕд/л с высокой степенью вероятности указывают на наличие заболевания. Поэтому необходимо срочное уточнение диагноза у всех новорожденных с уровнем ТТГ выше 20 мЕд/л, это возможно при повторном взятии крови и определении уровней ТТГ и св. Т4 в сыворотке крови.
После взятия крови детям с уровнем ТТГ выше 50 мЕд/л сразу же (не дожидаясь результатов) назначается заместительная терапия левотироксином (эутирокс, L-тироксин, тиро-4, Л-тирок, L-тироксин-Акри, L-тироксин-Фармак). Лечение может быть отменено после получения нормальных результатов св. Т4 и ТТГ.
Вопрос о назначении лечения детям, имеющим уровни ТТГ 20–50 мЕд/л, решается после повторно сданной крови и получения показателей уровней ТТГ и св. Т4.
Детям, которым лечение сразу же не было назначено, необходимы повторные осмотры с определением уровней ТТГ, Т4 (через неделю, затем через месяц), и если уровень ТТГ увеличивается, следует назначить заместительную терапию тиреоидными препаратами с дальнейшим тщательным наблюдением за ребенком.
Этиология врожденного гипотиреоза
Врожденный гипотиреоз — достаточно гетерогенная по этиологии группа заболеваний, обусловленных морфофункциональной незрелостью гипоталамо-гипофизарной системы, щитовидной железы или их анатомическим повреждением во внутриутробном периоде.
В последние годы в связи с развитием методов молекулярно-генетического анализа во многом изменились взгляды на этиологию врожденного гипотиреоза. В подавляющем большинстве случаев (85–90%) имеет место первичный врожденный гипотиреоз. Примерно 85% случаев первичного гипотиреоза являются спорадическими, 15% — наследственными. Большинство спорадических случаев обусловлено дисгенезией щитовидной железы, причем случаи эктопии щитовидной железы встречаются чаще, чем полное ее отсутствие (агенезия) или гипоплазия щитовидной железы. По данным различных авторов, в 22–42% случаев встречается агенезия щитовидной железы, в 35–42% — ткань щитовидной железы эктопирована, в 24–36% — имеет место гипоплазия щитовидной железы.
Вероятно, причиной дисгенезии щитовидной железы могут быть как генетические факторы, так и факторы внешней среды, однако ее молекулярная основа пока мало изучена. На сегодняшний день идентифицированы 3 транскрипционных фактора, участвующих в закладке и дифференцировке щитовидной железы — PAX-8 (paired domain homeobox), TTF-1 и TTF-2 (thyroid transcription factors 1 и 2). В эксперименте на мышах показана роль TTF-1 в наличии агенезии щитовидной железы, тяжелых пороков легких и передних отделов мозга. Ген TTF-1 локализован в регионе 14q13.
TTF-2 необходим для нормального морфогенеза щитовидной железы. Экспериментально доказано участие TTF-2 в миграции щитовидной железы и зарастании твердого неба. Кроме того, TTF-2 регулирует экспрессию тиреоглобулина и тиреоидной пероксидазы в щитовидной железе, как и PAX-8.
Большинство семейных случаев ВГ — это врожденные «ошибки», нарушающие синтез Т4 или его связывание с органами-мишенями, этот вариант заболевания чаще всего проявляется врожденным зобом. На сегодняшний день известны следующие врожденные нарушения гормоногенеза в щитовидной железе: снижение чувствительности к тиреотропному гормону; отсутствие способности концентрировать йодид; нарушение органификации йода (вследствие дефектов пероксидазы или системы, генерирующей Н2О2); нарушение дейодиназы йодтирозинов; нарушение синтеза или транспорта тиреоглобулина.
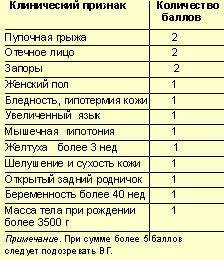 |
| Шкала Апгар для диагностики врожденного гипотиреоза у новорожденных |
Описаны мутации в генах тиреоидной пероксидазы и тиреоглобулина. Отсутствие активности тиреоидной пероксидазы ведет к снижению захвата йодида тиреоцитами, нарушению процессов органификации йодидов, что, в свою очередь, приводит к снижению синтеза тиреоидных гормонов. Новорожденные с ферментативными дефектами ТПО имеют при рождении очень высокий уровень ТТГ и очень низкий уровень Т4, в дальнейшем у них формируется зоб.
Гораздо реже (5–10% случаев) встречается вторичный врожденный гипотиреоз, проявляющийся изолированным дефицитом синтеза ТТГ или гипопитуитаризмом. В ряде случаев причиной вторичного гипотиреоза становится дефект Pit-1 гена — гипофизарного специфического транскрипционного фактора-1, мутации в котором вызывают комбинированный дефицит гормона роста, пролактина и тиреотропного гормона. Изучается роль дефекта Prop-1 гена — транскрипционного фактора, вызывающего дефицит не только ТТГ, СТГ и пролактина, но и гонадотропинов.
Врожденный изолированный дефицит ТТГ — это очень редкое аутосомно-рецессивное заболевание, причиной которого являются мутации гена ТТГ. Приводим наиболее распространенную на сегодняшний день классификацию причин врожденного гипотиреоза.
Резистентность к тиреоидным гормонам. Транзиторный гипотиреоз
Диагностика врожденного гипотиреоза
До начала эры скрининга по врожденному гипотиреозу, широкого внедрения в клиническую практику радиоиммунологических методов определения гормонов в сыворотке крови диагноз ВГ ставился на основании клинико-анамнестических данных, чем и объяснялось достаточно позднее начало заместительной терапии.
Типичная клиническая картина врожденного гипотиреоза у новорожденных, детей первого месяца жизни, когда крайне важно поставить диагноз, наблюдается всего в 10–15% случаев. Наиболее типичными признаками заболевания в ранний постнатальный период являются: переношенная беременность (более 40 нед); большая масса тела при рождении (более 3500 г); отечное лицо, губы, веки, полуоткрытый рот с широким, «распластанным» языком; локализованные отеки в виде плотных «подушечек» в надключичных ямках, тыльных поверхностях кистей, стоп; признаки незрелости при доношенной по сроку беременности; низкий, грубый голос при плаче, крике; позднее отхождение мекония; позднее отхождение пупочного канатика, плохая эпителизация пупочной ранки; затянувшаяся желтуха.
В дальнейшем, на 3–4-м месяце жизни, если не начато лечение, появляются другие клинические симптомы заболевания: сниженный аппетит, затруднения при глотании, плохая прибавка в массе тела; метеоризм, запоры; cухость, бледность, шелушение кожных покровов; гипотермия (холодные кисти, стопы); ломкие, сухие, тусклые волосы; мышечная гипотония.
В более поздние сроки, после 5–6-го месяца жизни, на первый план выступает нарастающая задержка психомоторного, физического развития ребенка, позднее прорезывание зубов.
Пропорции тела у детей с гипотиреозом приближаются к хондродистрофическим, отстает развитие лицевого скелета (широкая запавшая переносица, гипертелоризм, позднее закрытие родничков). Запаздывают прорезывание, а позднее и смена зубов. Обращают на себя внимание кардиомегалия, глухость сердечных тонов, снижение АД, уменьшение пульсового давления, брадикардия (у детей первых месяцев частота пульса может быть нормальной). Для детей с врожденным гипотиреозом характерен низкий, грубый голос, у них часто встречаются цианоз носогубного треугольника, стридорозное дыхание.
Суммируя вышеперечисленные клинические признаки врожденного гипотиреоза, приводим шкалу Апгар, помогающую в раннем клиническом скрининге ВГ (табл.). Однако только скрининг по врожденному гипотиреозу позволяет поставить диагноз в первые дни жизни ребенка, до появления развернутой клинической картины заболевания и избежать, таким образом, тяжелых последствий болезни, основными из которых являются задержка умственного и физического развития ребенка. Экономически стоимость скрининга и стоимость лечения ребенка-инвалида в поздно диагностируемых случаях соотносятся как 1:4.
Заместительная терапия левотироксином натрия
Наблюдение за детьми с ВГ на первом году жизни следует осуществлять эндокринологу, педиатру, невропатологу.
Контрольные заборы крови проводятся через 2 нед и 1,5 мес после начала заместительной терапии. Необходимо постоянно иметь в виду возможность передозировки левотироксина натрия. Дозировка левотироксина натрия подбирается индивидуально, с учетом клинических и лабораторных данных.
У детей первого года жизни необходимо преимущественно ориентироваться на уровень Т4, так как в первые месяцы жизни возможно нарушение регуляции секреции ТТГ по принципу обратной связи. Оценка только уровня ТТГ может привести к назначению излишне больших доз левотироксина натрия. В случаях относительно высоких уровней ТТГ и нормальных уровней общего Т4 или св. Т4 доза левотироксина натрия может считаться адекватной. Дальнейшие контрольные определения концентрации уровней ТТГ, Т4 следует проводить на первом году жизни каждые 2–3 мес жизни, после года — каждые 3–4 мес.
Таким образом, сразу же после установления диагноза, а также в сомнительных случаях должна быть начата заместительная терапия препаратами левотироксина натрия (эутирокс, L-тироксин, тиро-4, Л-тирок, L-тироксин-Акри, L-тироксин-Фармак). Лечение в большинстве стран начинают не позднее первого месяца жизни, в среднем на 2-й нед, например в Германии лечение начинают на 8–9-й день жизни, в Великобритании — на 11–15-й день.
Препаратом первого ряда при лечении врожденного гипотиреоза является левотироксин натрия. Препарат может выпускаться в различных дозировках — 25, 50 и 100 мкг в одной таблетке. На наличие различных дозировок препаратов обязательно следует обращать внимание родителей и указывать назначенную дозу левотироксина в мкг, а не только в частях таблетки.
Левотироксин совершенно идентичен естественному гормону человека тироксину, что является главным его преимуществом перед другими синтетическими препаратами. Кроме того, после приема левотироксина (эутирокса, L-тироксина, тиро-4, Л-тирока, L-тироксина-Акри, L-тироксина-Фармак) в крови создается «депо» этого препарата, которое расходуется по мере необходимости путем дейодирования тироксина и превращения его в Т3. Таким образом, удается избежать высоких, пиковых уровней трийодтиронина в крови.
Всю суточную дозу необходимо давать утром за 30 мин до завтрака, с небольшим количеством жидкости. Маленьким детям препарат следует назначать во время утреннего кормления, в растолченном виде.
Принимая во внимание клинические симптомы, тем не менее следует помнить, что самым надежным показателем адекватности получаемого ребенком лечения при гипотиреозе служит нормальный уровень ТТГ в сыворотке крови, у детей первого года жизни — уровни тироксина. Нужно учитывать, что уровень Т4 обычно нормализуется через 1–2 нед после начала лечения, уровень ТТГ — через 3–4 нед после начала заместительной терапии. При длительном лечении показателями адекватности применяемой дозы левотироксина натрия служат данные динамики роста, общего развития ребенка, показатели дифференцировки скелета.
В. А. Петеркова, профессор, доктор медицинских наук
О. Б. Безлепкина, кандидат медицинских наук
ГУ ЭНЦ РАМН, Москва
Агенезия щитовидной железы что это такое
Различными заболеваниями щитовидной железы страдает множество людей. Чаще всего они обнаруживаются у лиц молодого и среднего возраста. В этой статье мы расскажем, как определить, есть ли у Вас проблемы с щитовидной железой, чем опасна её патология и самое главное – что делать, если Вы обнаружили у себя симптомы.
О щитовидной железе
Щитовидная железа – один из важнейших органов человека. Щитовидная железа продуцирует гормоны. Она располагается спереди на шее, чуть ниже щитовидного хряща гортани (его выступающая часть у мужчин называется «кадык» или «адамово яблоко»), но возможные и другие – атипичные – варианты расположения щитовидной железы. Щитовидная железа состоит из двух (иногда трех) долей и перешейка между ними.
Зачем нужна щитовидная железа?
Вас должно насторожить!
Почти не оставляет сомнений наличие припухлости или даже опухолевидного образования на передней поверхности шеи. Иногда может появляться осиплость голоса, затруднение глотания и дыхания.
Если Вы обнаружили хотя бы некоторые из перечисленных симптомов, Вам следует обратиться к врачу.
Какие существуют заболевания щитовидной железы?
Почему заболевания щитовидной железы необходимо обязательно лечить?
Не всегда заболевания щитовидной железы имеют выраженные симптомы и причиняют неудобства пациентам. Однако лечить их необходимо, поскольку в дальнейшем заболевание обязательно будет прогрессировать. Гормоны щитовидной железы в избыточном количестве токсичны – тиреотоксикоз может приводить к нарушениям работы сердечнососудистой, нервной систем, желудочно-кишечного тракта, других желез (в том числе и половых), изменениям психики. Однако и недостаток гормонов щитовидной железы лишает человека нормальной и здоровой жизни. При сильном увеличении щитовидной железы может происходить сдавливание и смещение органов шеи (гортань, трахея, пищевод), а также повреждение нервов, иннервирующих гортань, в результате чего возникают различные нарушения голоса, вплоть до его потери.
Диагностика заболеваний щитовидной железы
Судя по вышеизложенному, заболеваний щитовидной железы довольно много. Только лишь пройдя осмотр у врача, можно узнать точный диагноз и получить необходимое лечение.
Необходимыми анализами крови являются:
Необходимыми исследованиями являются:
Также врач может назначить:
Узловой зоб. Диагностика. Основные принципы лечения
Узловой эутиреоидный зоб
Зобом называют любое увеличение щитовидной железы. Существуют клиническое и морфологическое определения понятия «зоб». С позиции морфолога зоб это любое диффузное или узловое увеличение щитовидной железы, обусловленное избыточным накоплением коллоида в фолликулах (коллоидный зоб), или гиперплазией (увеличением количества клеток) фолликулярного эпителия. С точки зрения клинициста зоб это собирательное понятие, так как этим термином называют различные по происхождению заболевания щитовидной железы гиперпластического, неопластического и воспалительного характера, сопровождающиеся увеличением этого органа. Одной из основных причин увеличения щитовидной железы является дефицит йода в воде и продуктах питания. Клиническое и социальное значений йододефицитных состояний заключается не только в увеличении щитовидной железы и формировании зоба, но и нарушением ее функциональной активности, оказывающем негативное влияние на физическое и умственное развитие людей.
Узловой эутиреоидный зоб – клиническое понятие, объединяющее все очаговые образования в щитовидной железе, имеющие различную морфологическую картину. Узлом щитовидной железы обычно называют образование, выявленное в ней при осмотре и/или пальпации. Подавляющее большинство узловых образований щитовидной железы доброкачественные. Злокачественные образования щитовидной железы составляют 5-8%.
Этиология и патогенез
Общепринята теория, согласно которой дефицит йода или изменения его метаболизма (нарушение всасывания в ЖКТ, либо окисления при генетических дефектах в энзимной системе и др. ) приводят к снижению концентрации тиреоидных гормонов в крови, что по механизму обратной связи приводит к увеличению образования тиреотропного гормона гипофиза, и щитовидная железа подвергается мощной стимуляции. В результате развивается компенсаторная гипертрофия щитовидной железы, способствующая восполнению недостатка тиреоидных гормонов, и в гипоталамо-гипофизарно-тиреоидной системе наступает временное равновесие. При продолжающем воздействии первичных этиологических факторов такое равновесие быстро нарушается, наступает новая волна тиреотропной стимуляции. В итоге компенсаторный процесс переходит в патологический, и образуется зоб.
Большую роль в патологии щитовидной железы играют и аутоиммунные процессы. Развитие зоба связывают с влиянием ТТГ-подобных факторов, иммуноглобулинов, стимулирующих рост железы, но не влияющих на ее функциональное состояние, а также с образованием тиреоидстимулирующих и тиреоидингибирующих антител.
Узловой эутиреоидный зоб включает в себя следующие морфологические формы:
Узловой коллоидный зоб.
Наиболее частый вариант узлового зоба патогенетически обусловлен дефицитом йода в организме. Коллоидный зоб формируется за счет избыточного накопления коллоида в полости фолликулов и бывает диффузным, а чаще узловым.
Фолликулярная аденома.
В отличие от коллоидного зоба фолликулярная аденома (до 25% случаев узлового зоба) является доброкачественной опухолью из фолликулярного эпителия (А-клеток). Среди фолликулярных аденом выделяют несколько мофологических вариантов: трабекулярная, микрофолликулярная и макрофолликулярная. Аденома развивающаяся приемущественно из В-клеток щитовидной железы, называется В-клеточной аденомой или опухоль из клеток Гюртле-Ашкенази.
Киста щитовидной железы.
Киста представляет собой полостное, заполненное жидкостью образование в ткани щитовидной железы. На долю кист приходится около 5% всех узловых образований щитовидной железы. Истинную кисту от ложной отличает наличие клеток фолликулярного эпителия, выстилающих полость кисты. Выявление кисты при УЗИ не представляет трудностей, тем не менее не позволяет дифференцировать от цистаденомы или цистаденокардиномы.
Гипертрофическая форма аутоиммунного тиреоидита (АИТ).
Аутоиммунный тиреоидит с узлообразованием может протекать как самостоятельно, так и сочетаться с фолликулярной аденомой или раком.
Рак щитовидной железы.
Раки щитовидной железы по морфологическим признакам принято делить на две группы. Это дифференцированный и недифференцированный рак. Они резко отличаются как по своей структуре, так и по клиническому течению. Дифференцированный рак (фолликулярный и папиллярный) встречаются значительно чаще, характеризуются сохранением гистотипических свойств тиреоидной ткани и отличается сравнительно длительным развитием и относительно благоприятным течением. Недифференцированный рак (анапластический) характеризуется выраженными морфологическими признаками тиреоидной атипии и быстропрогрессирующим течением. Промежуточное положение между дифференцированными и недифференцированными раками щитовидной железы по клиническому течению занимает медуллярный рак, происходящий из С-клеток. Все карциномы щитовидной железы идентифицируют согласно классификации TNM Международного противоракового союза (UICC). Т1- размер опухоли не более 1 см; Т2- размер карциномы 1-4 см; Т3- опухоль более 4 см; Т4- каринома с инвазией капсулы железы независимо от размеров. Для дифференцированных форм рака щитовидной железы введен возрастной критерий. При этом, у больных моложе 45 лет независимо от размера опухоли и поражения регионарных лимфоузлов, при отсутствии отдаленных метастазов устанавливают I стадию. При наличии у данной категории больных отдаленных метастазов – относят ко II стадии.
Диагностика узлового зоба
Разделение узловых образований на доброкачественные и злокачественные является кардинальным вопросом диагностики. При сборе анамнеза и осмотре необходимо выявить факторы высокого онкологического риска. К числу неблагоприятных факторов, увеличивающих вероятность наличия карциномы, относятся:
При наличии двух или более факторов риска показано оперативное лечение независимо от результатов дополнительных лабораторных и инструментальных обследований.
УЗИ щитовидной железы
Коллоидные узлы в большинстве случаев определяются как изо- или гипоэхогенные образования обычно овальной формы или реже округлой формы, имеющие четкие, ровные контуры и окруженные гипоэхогенным ободком. При этом в них часто определяются дегенеративные изменения в виде участков сниженной, повышенной эхогенности и кист. В режиме цветного допплеровского картирования (ЦДК) коллоидные узлы, как правило, аваскулярны. На основании нескольких ультразвуковых признаков можно сделать лишь предположение о характере узлового образования.
Аденома в большинстве случаев имеет вид четко очерченного гиперэхогенного образования с гомогенной структурой, окруженной ободком с резко повышенной интенсивностью отраженных эхосигналов. Возможно наличие микрокальцинатов по периферии узла. При ЦДК определяется периферический, перинодулярный кровоток.
Рак щитовидной железы выявляется в виде гипоэхогенного образования, с нечеткими и неровными контурами, с наличием гиперэхогенных включений и микрокальцинатов внутри узла. В ЦДК режиме картируется интранодулярный кровоток.
Радиоизотопное сканирование
Возможности сцинтиграфии в плане дифференциальной диагностики узлового зоба ограничены. Тем не менее, следует отметить, что: до 10% автономно функционирующих («горячих») узлов являются злокачественными. Для «холодных» узлов этот показатель гораздо выше. Поэтому выявление «холодных узлов» при сцинтиграфии определяет лишь «мишень» для последующего ТАБ под контролем УЗИ.
ТАБ под контролем УЗИ
На сегодняшний день имеет решающее значение в плане морфологической верификации любых узловых тиреоидных образований и является обязательным компонентом в протоколе обследования больных с узловым зобом. ТАБ определяет дальнейшую программу ведения пациента и показания для оперативного лечения. Основные ограничения метода связаны с тем, что с его помощью идентифицируются морфологические изменения, происходящие только на уровне клетки. В связи с этим нет возможности оценить наличие инвазии опухолевых клеток в капсулу узла или в сосуды. В таком случае больные направляются на оперативное лечение. Тактика ведения больных с узловыми образованиями щитовидной железы представлена на рис. 18. 1.
Функциональная автономия щитовидной железы (ФА)
Автономия определяется как функционирование фолликулярных клеток щитовидной железы независимое от влияния ТТГ гипофиза. Самым частым клиническим вариантом функциональной автономии щитовидной железы является многоузловой токсический зоб. Для функциональной автономии щитовидной железы характерны два основных критерия:
Патогенез функциональной автономии щитовидной железы
В условиях йодного дефицита щитовидная железа подвержена воздействию комплекса стимулирующих факторов. В результате, у наиболее предрасположенных лиц происходит увеличение щитовидной железы, формируется диффузный эутиреоидный зоб. Отдельные клетки щитовидной железы оказываются более чувствительными к указанным стимулирующим влияниям, благодаря чему получают преимущественный рост. Так формируется узловой и многоузловой эутиреоидный зоб. Отдельные активно делящиеся тиреоциты приобретают способность автономно, то есть вне регулирующих эффектов тиреотропного гормона (ТТГ), продуцировать тиреоидные гормоны. Конечным этапом является развитие узлового и/или многоузлового токсического зоба.
Основным следствием автономии является неконтролируемая секреция тиреоидных гормонов. Уровень этой секреции определяется количеством автономных тиреоидных клеток, их активностью и обеспеченностью йодидом. При достаточно крупных узлах повышенное поступление йодида приводит к увеличению секреции и в конце концов к тиреотоксикозу. Это свидетельствует об отсутствии эффективного ауторегуляторного механизма в таких клетках и объясняет возникновение случаев тиреотоксикоза после увеличения содержания йода в диете.
Узловой токсический зоб является йододефицитным заболеванием, при котором стойкая патологическая гиперпродукция тиреоидных гормонов обусловлена формированием в щитовидной железе автономно функционирующих тиреоцитов. Клиническая картина такого зоба в первую очередь определяется проявлениями тиреотоксикоза со стороны отдельных органов и систем.
Клинические проявления
Синдром поражения сердечно-сосудистой системы
Тахикардия, мерцательная аритмия, развитие дисгормональной миокардиодистрофии («тиреотоксическое сердце»), высокое пульсовое давление. Кардиальные нарушения связаны как с токсическим действием переизбытка гормонов на миокард, так и усиленной работой сердца в связи с возросшими потребностями периферических тканей в кислороде в условиях интенсивного обмена. В результате увеличения УО, МОС и ускорения кровотока повышается систолическое АД, на верхушке сердца и над сонными артериями выслушивается систолический шум. Механизм снижения диастолического АД связан с развитием недостаточности коры надпочечников и недостаточного синтеза глюкокортикоидов – основных регуляторов тонуса сосудистой стенки.
Синдром поражения желез внутренней секреции
Кроме надпочечников часто поражается поджелудочная железа с развитием тиреогенного сахарного диабета. Усиленный распад гликогена с поступлением большого количества глюкозы в кровь заставляет работать железу в напряжении, что в итоге приводит к истощению компенсаторных механизмов и развитию инсулиновой недостаточности. У женщин отмечается дисфункция яичников с нарушением менструального цикла, фиброзно-кистозная мастопатия (тиреотоксическая мастопатия, болезнь Вельяминова). У мужчин может развиться гинекомастия.
Синдром поражения центральной и
периферической нервной системы
Синдром метаболических нарушений
Повышение основного обмена приводит к похуданию при повышенном аппетите, сопровождается субфебрильной температурой тела и мышечной слабостью.
Синдром поражения органов пищеварительной системы
Проявляется неустойчивым стулом со склонностью к диарее, приступами болей в животе, иногда желтухой, связанной с дисфункцией печени.
Глазные симптомы
Симптом Дальримпля – расширение глазной щели с появлением белой полоски склеры между радужкой и верхним веком.
Симптом Греффе – отставние верхнего века от радужки при фиксации взгляда на медленно перемещающемся вниз предмете, при этом между верхним веком и радужкой остается белая полоска склеры. Симптом Кохера – при фиксации взгляда на медленно перемещающемся вверх предмете, между нижним веком и радужкой остается белая полоска склеры. Симптом Штельвага – редкое мигание век. Симптом Мебиуса – потеря способности фиксировать взгляд на близком расстоянии, вследствие слабости приводящих мышц. Фиксированные на предмете глазные яблоки расходятся и занимают исходное положение. Симптом Репнева-Мелехова – «гневный взгляд».
В основе их развития лежит гипертонус мышц глазного яблока и верхнего века вследствие нарушения вегетативной иннервации под влиянием избытка тиреоидных гормонов в крови.
Тиреогенный экзофтальм следует отличать от эндокринной офтальмопатии – аутоиммунного заболевания. При этом поражаются периорбитальные ткани: инфильтрация лимфоцитами, отложение кислых гликозаминов, выделяемых фибробластами, развивается отек и увеличение ретробульбарной клетчатки, миозит и разрастание соединительной ткани в периокулярных мышцах. При этом больные жалуются на боли, двоение, ощущение «песка» в глазах, слезотечение. Различают три стадии эндокринной офтальмопатии:
При тиреотоксикозе также развивается и претибиальная микседема, которая проявляется поражением кожи передней поверхности голени, ее отеком и утолщением, что сопровождается зудом и эритемой.
Отметим, что клиническая картина тиреотоксикоза имеет закономерную возрастную особенность: у молодых людей, у которых, как правило, речь идет о болезни Грейвса, в большинстве случаев имеет место развернутая классическая клиническая картина тиреотоксикоза, тогда как у пожилых пациентов, единственным его проявлением может служить необъяснимый субфебрилитет или суправентрикулярная аритмия, которую обычно связывают с ИБС.
На следующем этапе диагностического поиска у пациентов с клиническими симптомами тиреотоксикоза должен быть подтвержден или отвергнут при гормональном исследовании. Функциональная автономия примерно в 20% случаев развивается при отсутствии отчетливых узловых образований в щитовидной железе (диссеминированная автономия). В то же время болезнь Грейвса может развиваться на фоне предшествующего ей банального эутиреоидного коллоидного зоба. Более специфичным диагностическим методом является сцинтиграфия щитовидной железы: для болезни Грейвса характерно диффузное повышение захвата радиофармпрепарата, при функциональной автономии выявляются «горячие» узлы, либо чередование зон повышенного и пониженного накопления. Нередко оказывается, что в многоузловом зобе наиболее крупные узлы, выявленные при УЗИ, по данным сцинтиграфии оказываются «холодными» или «теплыми», а тиреотоксикоз развивается в результате гиперфункционирования ткани, окружающей узлы.
Ценным исследованием, которое позволяет дифференцировать болезнь Грейвса и функциональную автономию, является определение уровня антител к щитовидной железе. Высокие титры антител к тиреоидной пероксидазе (ТПО) и тиреоглобулину (ТГ) встречаются примерно в 80% случаев болезни Грейвса. При функциональной автономии щитовидной железы они в большинстве случаев отсутствуют.
Консервативное лечение
Лечение токсического зоба является весьма трудоемкой и кропотливой задачей для врача. Как уже указывалось, методы лечения болезни Грейвса и различных клинических вариантов функциональной автономии щитовидной железы отличаются. Главное отличие заключается в том, что в случае функциональной автономии щитовидной железы на фоне тиреостатической терапии невозможно достижение стойкой ремиссии тиреотоксикоза; после отмены тиреостатиков он закономерно развивается вновь. Таким образом, лечение функциональной автономии подразумевает хирургическое удаление щитовидной железы или ее деструкцию при помощи радиоактивного йода131. В случае болезни Грейвса у отдельных групп пациентов возможно проведение длительной консервативной терапии, которая при правильном отборе больных в 30-40% случаев приведет к стойкой ремиссии заболевания. Для тиреостатической терапии могут использоваться различные препараты. В нашей стране и в странах Европы наиболее популярны препараты тиамазола (Метизол). Кроме того, могут использоваться препараты пропилтиоурацила, которые наиболее популярны в США. Пропилтиоурацил назначают внутрь по 100-150 мг каждые 6 часов, или тиамазол, по 10-30 мг каждые 8 часов. Через 12 месяцев примерно у 30% больных функция щитовидной железы нормализуется и после отмены препарата сохраняется эутиреоз. По мере восстановления функции щитовидной железы, дозы антитиреоидных средств постепенно уменьшают. Антитиреоидные препараты могут вызывать агранулоцитоз. При уменьшении числа лейкоцитов ниже 4500, а гранулоцитов ниже 45%, следует отменить данные препараты.
При неэффективности тиреостатической терапии в течение года, а так же в случае декомпенсации тиреотоксикоза показано оперативное лечение, после предоперационной подготовки в условиях стационара. Субтотальная резекция щитовидной железы считается операцией выбора более 50 лет и является эффективным способом лечения тиреотоксикоза. Операцию проводят только на фоне удовлетворительного самочувствия пациента. Поэтому в предоперационном периоде необходимо нормализовать уровень тиреоидных гормонов с помощью антитиреоидных препаратов. За 7-10 дней до операции назначают йодиды, чтобы уменьшить кровоснабжение щитовидной железы и увеличить ее плотность. При подготовке больных с тяжелым тиреотоксикозом применяют Бета-адреноблокаторы, механизм действия которых связан не только с уменьшением потребностей миокарда в кислороде, но и с замедлением периферической конверсии Т4 в активный Т3. Назначают пропранолол по 5-40 мг в сутки. Прием препарата продолжают и в течение нескольких суток после операции, так как время полужизни Т4 составляет 7 дней. Применение Бета-адреноблокаторов особенно оправдано в тех случаях, когда больные не переносят антитиреоидные средства.
Источник: Основы клинической хирурги. Практическое руководство, Издание 2-е, переработанное и дополненное Под редакцией профессора Н.А.Кузнецова, Москва, Издательская группа «ГЭОТАР-Медиа»,2009