Агрегатное состояние что это
Основные агрегатные состояния вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.
Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
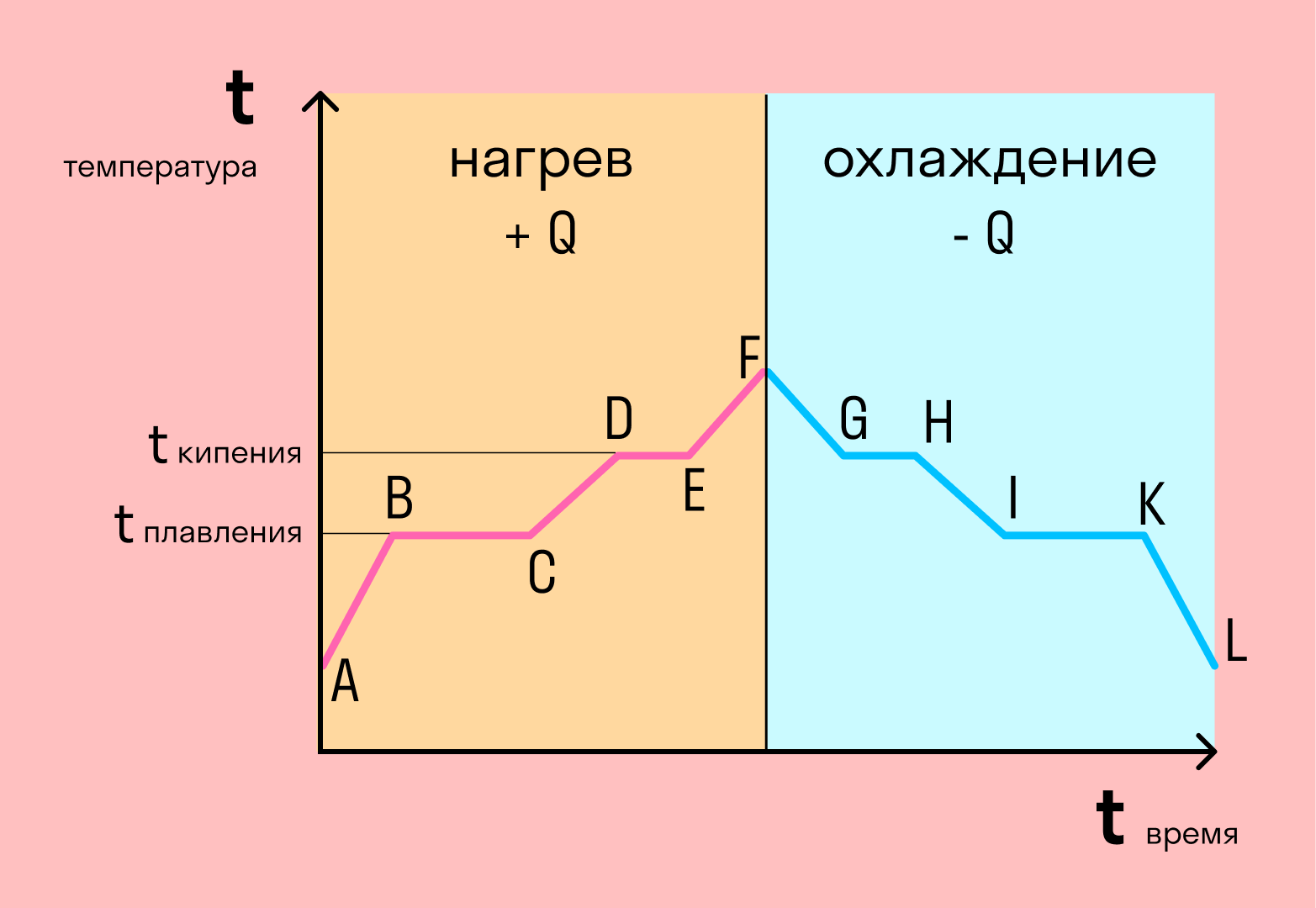
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
Первый шаг в обратную сторону — охлаждение до температуры кипения.
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
80 кДж/кг = 80000 Дж/кг
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
Примерчики из жизни🤓
Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка.
Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха.
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.
Агрегатное состояние
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе — Эйнштейна.
Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Содержание
Твёрдое тело
Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Жидкость
Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако не способно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Плазма
Часто причисляемая к агрегатным состояниям вещества плазма отличается от газа большой степенью ионизации атомов. Большая часть барионного вещества (по массе ок. 99,9 %) во Вселенной находится в состоянии плазмы. [2]
Сверхкритический флюид
Возникает при одновременном повышении температуры и давления до критической точки, в которой плотность газа сравнивается с плотностью жидкости; при этом исчезает граница между жидкой и газообразной фазами. Сверхкритический флюид отличается исключительно высокой растворяющей способностью.
Конденсат Бозе — Эйнштейна
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В результате этого часть атомов оказывается в состоянии со строго нулевой энергией (то есть в низшем из возможных квантовом состоянии). Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фишбаха.
Фермионный конденсат
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов. (В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше. [3]
Вырожденная материя
Другие состояния
При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния, безусловно, являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности.
Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.
Примечания
См. также
Полезное
Смотреть что такое «Агрегатное состояние» в других словарях:
агрегатное состояние — — [Л.Г.Суменко. Англо русский словарь по информационным технологиям. М.: ГП ЦНИИС, 2003.] Тематики информационные технологии в целом EN state of aggregation … Справочник технического переводчика
агрегатное состояние — agregatinė būsena statusas T sritis Standartizacija ir metrologija apibrėžtis Kietoji, skystoji, dujinė ar plazminė medžiagos būsena. atitikmenys: angl. aggregation state vok. Aggregatzustand, m rus. агрегатное состояние, n pranc. état… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
агрегатное состояние — agregatinė būsena statusas T sritis chemija apibrėžtis Medžiagos kietoji, skystoji, dujinė ar plazminė būsena. atitikmenys: angl. aggregative state; state of aggregation rus. агрегатное состояние … Chemijos terminų aiškinamasis žodynas
агрегатное состояние — agregatinė būsena statusas T sritis fizika atitikmenys: angl. aggregation state vok. Aggregatzustand, m rus. агрегатное состояние, n pranc. état d’agrégation, m … Fizikos terminų žodynas
агрегатное состояние — agregatinė būsena statusas T sritis Energetika apibrėžtis Tos pačios medžiagos kietoji, skystoji, dujinė ar plazminė būsena, kurią lemia atomų (molekulių) išsidėstymas, sąveika ir šiluminis judėjimas. atitikmenys: angl. aggregation state vok.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Агрегатное состояние вещества — ► aggregative state Физическое состояние вещества: твердое (кристаллическое), жидкое или газообразное, в котором может находиться всякое вещество в зависимости от температуры и давления, которые определяют в данном веществе расстояние между… … Нефтегазовая микроэнциклопедия
Газы (агрегатное состояние вещества) — Газы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им… … Большая советская энциклопедия
Плазма (агрегатное состояние) — Плазменная лампа, иллюстрирующая некоторые из наиболее сложных плазменных явлений, включая филаментацию. Свечение плазмы обусловлено переходом электронов из высокоэнергетического состояния в состояние с низкой энергией после рекомбинации с ионами … Википедия
Агрегатные состояния вещества
Агрегатные состояния вещества (от лат. “aggrego” означает “присоединяю”, “связываю”) – это состояния одного и того же вещества в твердом, жидком и газообразном виде.
При переходе из одного состояния в другое наблюдается скачкообразное изменение энергии, энтропии, плотности и прочих свойств вещества.
Твердые и жидкие тела
Твердые тела – это тела, которые отличаются постоянством своей формы и объема.
В твердых телах межмолекулярные расстояния маленькие, а потенциальную энергию молекул можно сравнить с кинетической.
Твёрдые тела подразделяются на 2 вида:
В состоянии термодинамического равновесия находятся только лишь кристаллические тела. Аморфные же тела по факту представляют собой метастабильные состояния, которые по строению схожи с неравновесными, медленно кристаллизующимися жидкостями. В аморфном теле происходит чересчур медленный процесс кристаллизации, процесс постепенного преобразования вещества в кристаллическую фазу. Разница кристалла от аморфного твердого тела состоит, в первую очередь, в анизотропии его свойств. Свойства кристаллического тела определяются в зависимости от направления в пространстве. Разнообразные процессы (например, теплопроводность, электропроводность, свет, звук) распространяются в разных направлениях твердого тела по-разному. А вот аморфные тела (например, стекло, смолы, пластмассы) изотропные, как и жидкости. Разница аморфных тел от жидкостей заключается лишь только в том, что последние текучие, в них не происходят статические деформации сдвига.
У кристаллических тел правильное молекулярное строение. Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Жидкие тела – это тела, имеющие определенный объем, но не имеющие упругой формы.
Для вещества в жидком состоянии характерно сильное межмолекулярное взаимодействие и малая сжимаемость. Жидкость занимает промежуточное положение между твердым телом и газом. Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Газ – это такое состояние вещества, при котором расстояния между молекулами огромны.
Силами взаимодействия между молекулами при небольших давлениях можно пренебречь. Частицы газа заполоняют весь объем, который предоставлен для газа. Газы рассматривают как сильно перегретые либо ненасыщенные пары. Особый вид газа – плазма (частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов почти одинаковые). То есть плазма – это газ из заряженных частиц, взаимодействующих между собой при помощи электрических сил на большом расстоянии, но не имеющих ближнего и дальнего расположения частиц.
Как известно, вещества способны переходить из одного агрегатного состояния в другое.
Испарение – это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости либо твердого тела вылетают молекулы, кинетическая энергия которых преобразовывает потенциальную энергию взаимодействия молекул.
Испарение является фазовым переходом. При испарении часть жидкости или твердого тела преобразуется в пар.
Вещество в газообразном состоянии, которое находится в динамическом равновесии с жидкостью, называется насыщенным паром. При этом изменение внутренней энергии тела равняется:
Конденсация представляет собой процесс, обратный парообразованию.
Плавление – это процесс преобразования вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
При нагревании вещества растет его внутренняя энергия, поэтому увеличивается скорость теплового движения молекул. При достижении веществом своей температуры плавления кристаллическая решетка твердого тела разрушается. Связи между частицами также разрушаются, растет энергия взаимодействия между частицами. Теплота, которая передается телу, идет на увеличение внутренней энергии данного тела, и часть энергии расходуется на совершение работы по изменению объема тела при его плавлении. У многих кристаллических тел объем увеличивается при плавлении, однако есть исключения (к примеру, лед, чугун). Аморфные тела не обладают определенной температурой плавления. Плавление представляет собой фазовый переход, который характеризуется скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она остается неизменной в ходе процесса. Тогда изменение внутренней энергии тела равняется:
Кристаллизация представляет собой процесс, обратный плавлению.
Изменение внутренней энергии каждого тела системы при нагревании или охлаждении вычисляется по формуле:
При рассматривании преобразований веществ из одних агрегатных состояний в другие нельзя обойтись без так называемого уравнения теплового баланса: суммарное количество теплоты, выделяемое в теплоизолированной системе, равняется количеству теплоты (суммарному), которое в данной системе поглощается.
По сути, уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
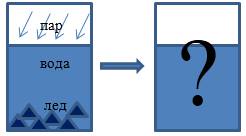
Определим, какие процессы осуществляются в системе, какие агрегатные состояния вещества мы наблюдали и какие получили.
Водяной пар конденсируется, отдавая при этом тепло.
Тепловая энергия идет на плавление льда и, может быть, нагревание имеющейся и полученной изо льда воды.
Прежде всего, проверим, сколько теплоты выделяется при конденсации имеющейся массы пара:
Для плавления льда понадобится следующее количество тепла:
Выходит, что пар отдает тепла больше, чем необходимо, только для расплавления имеющегося льда, значит, уравнение теплового баланса запишем следующим образом:
Уравнение теплового баланса будет иметь вид:
Сделаем вычисления с учетом того, что теплоемкость воды табличная
тогда T = 273 + 3 = 276 К