Актиферрин или мальтофер что лучше
Коррекция дефицита железа у детей
Целью терапии железодефицитной анемии (ЖДА) является устранение дефицита железа и восстановление его запасов в организме. Добиться этого можно только при ликвидации причины, лежащей в основе ЖДА в организме.

Основные принципы лечения ЖДА сформулированы Л. И. Идельсоном в 1981 г.:
Ранее существовало мнение, что дефицит железа можно устранить назначением диеты, содержащей яблоки, гречневую крупу, гранаты и другие продукты растительного происхождения, содержащие железо. Однако в 60-е гг. ХХ века исследователями было доказано, что железо, содержащееся в продуктах в виде гема (мясо, печень, рыба), лучше усваивается в организме, чем из других соединений. Около 90% железа всасывается в 12-перстной кишке, остальное – в верхнем отделе тощей кишки. При железодефицитных состояниях абсорбционная поверхность тонкого кишечника увеличивается. Железо всасывается в 2-х формах:
Количество железа, поступающее в течение суток с пищей, содержит около 10–12 мг железа (гемовое + негемовое), но только 1–1,2 мг микроэлемента из этого количества абсорбируется. Установлено, что биодоступность гемового железа в пищевых продуктах более высокая, чем из негемовых соединений, и составляет 25–30%.
Большая часть поступающего с пищей железа представлена негемовой формой. Биодоступность железа из злаковых, бобовых, клубневых, овощей и фруктов значительно ниже, чем из гемовых соединений, и во многом зависит от преобладания в рационе факторов, ингибирующих либо потенцирующих кишечную ферроабсорбцию (табл. 3).
Несмотря на высокое содержание железа в части продуктов растительного происхождения, они не в состоянии обеспечить им организм ребенка. Присутствующие в продуктах питания растительного происхождения вещества (танины, фитины, фосфаты) образуют с Fe (III) нерастворимые соединения и выводятся с калом. Имеются также сведения о неблагоприятном влиянии на абсорбцию железа пищевых волокон, которыми богаты крупы, свежие овощи, фрукты. В кишечнике пищевые волокна практически не перевариваются, железо фиксируется на их поверхности и выводится с калом. Напротив, повышают биодоступность железа аскорбиновая кислота, животный белок (мясо, рыба), которые увеличивают абсорбцию микроэлемента. Необходимо отметить также, что продукты из мяса, печени, рыбы, в свою очередь, увеличивают всасывание железа из овощей и фруктов при одновременном их применении.
Полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит.
Естественной профилактикой ЖДА у детей первых месяцев жизни является исключительно грудное вскармливание до 4–6 мес. Известно, что концентрация железа в женском молоке составляет всего 0,2–0,4 мг/л, однако абсорбция железа из него достигает 50%, что обеспечивает потребность ребенка первых 4–6 мес. К моменту удвоения массы тела ребенка (5–6 мес) антенатальные запасы железа в его организме истощаются.
С целью профилактики ЖДА при искусственном вскармливании целесообразно у детей, относящихся к группе риска по развитию ЖДА, использовать смеси, обогащенные железом. Они назначаются доношенным детям, относящимся к группе риска (из двойни, тройни, имеющих большую прибавку в массе), начиная с 3–5 мес жизни, а недоношенным – с 1,5–2 мес. Содержание железа в смесях для искусственного вскармливания детей первого полугодия жизни составляет 3–5–8 мг/л смеси, а для детей второго полугодия – 10–14 мг/л.
Включение в питание детей продуктов прикорма, обогащенных железом (фруктовые соки, фруктовые и овощные пюре, инстантные каши), заметно повышает количество железа, поступающего с пищей в организм ребенка.
Детям в возрасте 4–6 мес, находящимся на грудном вскармливании, и младенцам после 6 мес жизни, не получающим обогащенное железом питание, целесообразно назначать препараты железа в профилактической дозе 1–2 мг/кг/день до 12–18 мес жизни.
ЖДА у детей раннего возраста связывают с ранним использованием в пищу коровьего или козьего молока, содержащего высокий уровень белка. Следует отметить, что развитие ЖДА у этих детей связано не только с низким уровнем железа в коровьем молоке, плохим его усвоением, но и потерей железа за счет микродиапедезных кишечных кровотечений. Многочисленными исследованиями отмечена взаимосвязь между количеством употребляемого неадаптированного продукта (молока, кефира) и степенью выраженности микродиапедезных кишечных кровопотерь у младенцев. Отмечено, что чувствительность к неадаптированным продуктам уменьшается с возрастом и после 2-х лет жизни микродиапедезных кишечных кровотечений на фоне приема коровьего молока не отмечается. Механизм, лежащий в основе повышенной экскреции гемоглобина с калом на фоне приема неадаптированных молочных продуктов, у детей раннего возраста точно не известен. Часть авторов связывают микродиапедезные кишечные кровотечения с непереносимостью белков коровьего молока.
Выбору препарата для коррекции ЖДА придается особое значение, поскольку длительность лечения может составлять от нескольких недель до нескольких месяцев. При этом важны не только эффективность, но и отсутствие побочных эффектов и осложнений, приверженность к проводимой терапии, особенно в педиатрической практике.
В настоящее время все препараты железа разделяют на две группы (табл. 4):
Терапия железодефицитных состояний должна быть направлена на устранение причины и одновременное восполнение дефицита железа лекарственными Fe-содержащими препаратами.
Терапия железодефицитных состояний должна проводиться преимущественно препаратами железа для приема внутрь.
Пероральный прием препаратов Fe:
Парентеральное введение препаратов железа показано лишь по специальным показаниям (синдром нарушенного кишечного всасывания, состояние после обширной резекции тонкого кишечника).
Требования к препаратам железа для приема внутрь, применяемым в детской практике:
Детям раннего возраста предпочтительно назначение железосодержащих препаратов, выпускаемых в форме капель, сиропа. Хороши для детей этой возрастной группы Актиферрин (капли, сироп), Мальтофер (капли, сироп), Феррум Лек (сироп), Гемофер (капли) (табл. 5).
Для детей подросткового возраста лучше всего назначать препараты железа типа Феррум Лека (жевательные таблетки) или Тардиферона и Ферроградумента, которые медленно всасываются, обеспечивая пролонгированную и равномерную абсорбцию медикаментозного железа в кишечнике. Как правило, эти препараты хорошо переносятся больными.
После выбора железосодержащего препарата и способа его применения необходимо определить ежедневную суточную дозу лекарственного средства и кратность приема (табл. 6).
Рекомендуемые дозы двухвалентного железа рассчитаны на основе данных, свидетельствующих, что лишь 10–15% поступающего в организм железа всасывается.
Препараты железа (III) – ГПК используются у детей с ЖДА разного возраста в терапевтической дозе 5 мг/кг/сут.
При латентном дефиците железа все препараты железа используются в половинной терапевтической дозе.
Профилактические дозы препаратов железа:
Известно, что лечение солевыми препаратами может сопровождаться расстройствами стула, в связи с чем терапию препаратами двухвалентного железа необходимо начинать с дозы, равной 1/4–1/2 от расчетной терапевтической, с последующим постепенным достижением полной дозы в течение 7–14 дней. Темп «постепенного наращивания» дозы до терапевтической зависит как от выраженности дефицита железа, так и от состояния желудочно-кишечного тракта и индивидуальной переносимости препарата. Данная методика позволяет подобрать индивидуальную дозу в зависимости от переносимости и снизить риск побочных эффектов терапии солевыми препаратами железа.
Хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию железа. В связи с этим солевые препараты железа рекомендуют назначать за 1 ч до приема пищи. Назначение препаратов Fe (III) – ГПК не требует применения методики постепенного наращивания дозы. Препараты этой группы назначаются сразу в полной дозе вне зависимости от еды, поскольку пища не влияет на их абсорбцию.
Терапевтический эффект при пероральном приеме железа появляется постепенно. Вначале отмечается клиническое улучшение и лишь спустя некоторое время происходит нормализация гемоглобина. Первым положительным клиническим признаком, появляющимся при лечении препаратами железа, является исчезновение или уменьшение мышечной слабости. Последнее обусловлено тем, что железо входит в состав ферментов, участвующих в сокращении миофибрилл. На 10–12 день от начала лечения повышается содержание ретикулоцитов в периферической крови. Повышение гемоглобина может быть постепенным либо скачкообразным. Чаще всего начало подъема уровня гемоглобина происходит на 3–4 нед от начала терапии. Как показали многочисленные исследования, исчезновение клинических проявлений заболевания отмечается к 1–2 мес терапии, а исчезновение тканевой сидеропении наступает на 3–6 мес лечения. Суточная доза элементарного железа после нормализации уровня гемоглобина должна соответствовать 1/2 терапевтической дозы (табл. 7). Раннее прекращение лечения препаратами железа, как правило, приводит к рецидивам ЖДА. Длительность основного курса лечения препаратами железа составляет 6–10 нед в зависимости от степени тяжести выявленной железодефицитной анемии. Продолжительность профилактического курса препаратами железа с целью создания депо железа в организме составляет:
Критерии эффективности лечения препаратами железа:
Рефрактерность железодефицитной анемии обусловлена неадекватностью назначаемой терапии или анемией, не связанной с дефицитом железа!
Парентеральные препараты при лечении железодефицитной анемии должны использоваться только по строгим показаниям!
Показания к парентеральному введению препаратов железа:
Парентеральные препараты лучше использовать не ежедневно, а с интервалом в 1–2 дня. При этом в первые 1–3 введения можно использовать половинную дозу.
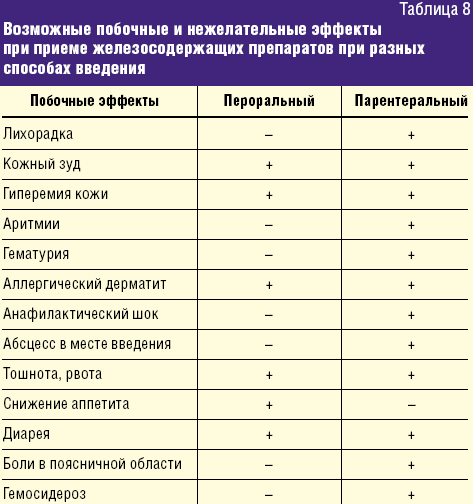
Учитывая длительность проведения ферротерапии, выбор препаратов для коррекции ЖДА у детей раннего возраста требует особого внимания. Как солевые препараты железа, так и препараты Fe(III) — ГПК полимальтозного комплекса являются эффективными при терапии ЖДС. Побочные и нежелательные явления при пероральной ферротерапии ЖДА в основном связаны с превышением рекомендуемых доз и чаще проявляются диспепсией. Побочные реакции и нежелательные эффекты, которые могут развиться при ферротерапии у детей, суммированы в таблице 8.
Парентеральные препараты железа должны применяться только строго по специальным показаниям.
Переливания крови или эритроцитарной массы при ЖДА проводятся крайне редко и строго по жизненным показаниям. Критериями для гемотрансфузии является снижение гемоглобина ниже критического уровня в сочетании с признаками нарушения центральной гемодинамики, геморрагического шока, анемической прекомы, гипоксического синдрома (табл. 9). Гемотрансфузия может проводиться и при значениях гемоглобина и гематокрита выше критических, если имеет место массивная острая кровопотеря.
Эффект от гемотрансфузий при ЖДА кратковременный. Отмечено отрицательное влияние гемотрансфузий на эритропоэз. К тому же сохраняется высокий риск трансфузионного инфицирования реципиента. При наличии витальных показаний для заместительной гемотрансфузии предпочтение отдается эритроцитарной массе или отмытым эритроцитам из расчета 10–15 мл/кг массы. Детям старшего возраста обычно переливают от 150 до 250 мл. Цельную кровь в последние годы в педиатрической практике не используют.
Профилактика ЖДА у детей включает:
1. Антенатальную профилактику:
2. Постнатальную профилактику:
Вакцинация детей с ЖДА проводится после нормализации уровня гемоглобина.
Снятие с диспансерного учета осуществляется через год.
И. Н. Захарова, доктор медицинских наук, профессор
Н. А. Коровина, доктор медицинских наук, профессор
А. Л. Заплатников, доктор медицинских наук, профессор
Н. Е. Малова, кандидат медицинских наук
РМАПО, Москва
Эффективность и безопасность препаратов трехвалентного железа в лечении железодефицитной анемии
Рассмотрено применение препаратов железа на основе гидроксид-полимальтозного комплекса в лечении железодефицитной анемии. Показано, то они сопоставимы по эффективности с солевыми препаратами железа, но при их использовании значительно реже возникают нежел
Application of iron preparations based on hydroxide-polimaltosis for complex treatment of iron-deficiency anemia is examined. It is stated that in terms of efficiency they can be compared with the salt preparations of iron, but with their use undesirable phenomena appears considerably more rarely.
В настоящее время фармацевтическая промышленность выпускает довольно большое количество препаратов железа для лечения железодефицитной анемии (ЖДА) и продолжается разработка новых препаратов. Возникла необходимость классифицировать препараты железа (рис. 1) и описать их свойства для того, чтобы облегчить выбор. В зависимости от способа введения в организм препараты железа делятся на пероральные и парентеральные (внутривенные, внутримышечные). Пероральные препараты могут содержать различные соли железа (молекулы небольшого размера) или гидроокись железа с полимальтозным комплексом (молекулы большого размера, более 50 кД). Пероральные препараты железа могут быть простыми, т. е. содержащими только соединение железа, или комбинированными с добавлением других веществ (аскорбиновой кислоты, фолиевой кислоты, витамина В12, микроэлементов и других веществ). Комплексы железа для внутривенного введения могут содержать декстран (высокомолекулярный или низкомолекулярный), сахарозу или карбоксимальтозу.
Многие годы «золотым стандартом» среди пероральных препаратов железа являлся сульфат железа. Последний представляет собой солевой препарат железа, который недорог в производстве и, соответственно, имеет невысокую стоимость. Кроме того, оказалось, что сульфат железа обладает высокой всасываемостью в организме, которая выше, чем у глюконата, хлорида или фумарата железа. По этой причине в настоящее время выпускается большое количество препаратов железа, содержащих сульфат железа (Актиферрин, Гемофер пролонгатум, Сорбифер Дурулес, Тардиферон, Ферроплекс, Ферроградумет, Ферро-Фольгамма и др.) [1].
При использовании солевых препаратов железа возможно локальное раздражение слизистой оболочки желудка в месте растворения препарата и слизистой оболочки двенадцатиперстной кишки, где преимущественно происходит всасывание препарата. Процесс всасывания является пассивным, быстрым и дозозависимым. В связи с низкой молекулярной массой солевые препараты железа могут всасываться в большом количестве, приводя к опасным для организма концентрациям, что может вызвать интоксикацию и отравление. Диссоциация солей двухвалентного железа происходит в желудочно-кишечном тракте и сопровождается выделением свободных ионов железа. Следующим процессом метаболизма солевых препаратов железа является окисление, которое осуществляется также в желудочно-кишечном тракте и заключается в переходе двухвалентного железа в трехвалентное. Последнее поступает в кровь и в плазме связывается с транспортным белком — трансферрином и в виде этого комплекса (металлопротеина) направляется в костный мозг и органы депо железа (печень, селезенка). Возврат железа из этих органов осуществляется через лимфатическую систему. Нарушение процесса окисления приводит к высвобождению электронов, образованию свободных радикалов, активации перекисного окисления липидов, повреждению клеток паренхиматозных органов.
В процессе лечения ЖДА солевыми препаратами железа могут возникнуть следующие проблемы:
.jpg)
Препараты железа на основе ГПК обладают следующими свойствами и преимуществами перед солевыми препаратами железа [5]:
На сегодняшний день в арсенале врача имеются современные препараты трехвалентного железа на основе различных полисахаридных комплексов [1]: пероральные препараты железа на основе ГПК (Мальтофер, Мальтофер Фол, Феррум Лек); препараты железа на основе ГПК (Феррум Лек — раствор для внутримышечного введения); препараты железа на основе гидроксид сахарозного комплекса (Венофер — раствор для внутривенного введения); препараты железа на основе карбоксимальтозата (Феринжект) и другие.
Международной тенденцией является смена солевых препаратов железа на препараты железа на основе ГПК [6].
ЖДА — самое «благодарное» гематологическое заболевание и должна вылечиваться сразу и навсегда, что и наблюдается в большинстве случаев. Причинами неуспешного лечения ЖДА препаратами железа являются:
Лечение латентного дефицита железа (ЛДЖ), который рассматривается как предстадия ЖДА и характеризуется снижением запасов железа в депо при нормальной концентрация гемоглобина, проводится пероральными препаратами железа в 50-процентной дозировке в течение 2 мес [9]. Основная задача лечения ЛДЖ — пополнить запасы железа в депо и не дать этому состоянию перейти в ЖДА.
.gif)
Особенностью лечения указанных двух форм дефицита железа (ЛДЖ и ЖДА) является длительное применение пероральных препаратов железа, при котором часто возникают указанные выше нежелательные явления [11].
Показано, что препараты железа на основе ГПК обладают сходной с сульфатом железа биодоступностью [12], обладают стабильной структурой молекулы, имеют контролируемую абсорбцию железа из комплекса [13]. Метаанализ сравнительных исследований [14] подтвердил одинаковую эффективность препаратов железа на основе ГПК и сульфата железа в лечении ЖДА.
В литературе имеется большое количество работ, в которых сравнивается эффективность и переносимость различных солевых препаратов железа и препаратов железа на основе ГПК. Однако лишь недавно были опубликованы результаты рандомизированных исследований, которые являются наиболее доказательными в медицине. Например, в работе B. Yasa и соавт. [15] проведено сравнение эффективности лечения ЖДА и переносимости препаратов железа. Больные были рандомизированы на 2 группы: 1-я группа (52 пациента) получала лечение препаратом железа на основе ГПК в дозе 5 мг/кг в сутки в 1 прием, 2-я группа (51 больной) — сульфат железа в дозе 5 мг/кг в сутки в 2 приема. Эффективность лечения оценивали по приросту концентрации гемоглобина в двух точках — к концу 1-го и к концу 4-го месяцев лечения. Прирост концентрации гемоглобина у пациентов, которые получали препарат железа на основе ГПК, к концу 1-го и 4-го месяца в среднем составил 12 ± 9 и 23 ± 13 г/л соответственно (в обоих случаях р = 0,001 по сравнению с исходной концентрацией гемоглобина), а у пациентов, которые получали сульфат железа, — 18 ± 17 и 30 ± 23 г/л соответственно (в обоих случаях р = 0,001 по сравнению с исходной концентрацией гемоглобина). Статистически значимых различий между группами не получено. Переносимость препаратов оценивали с помощью регистрации нежелательных явлений (боли в животе, тошнота, запоры или сочетание этих симптомов). Нежелательные явления были зарегистрированы у 26,8% пациентов, которые получали препарат железа на основе ГПК, и у 50,8% пациентов, которые получали сульфат железа (р = 0,012).
Таким образом, препараты железа на основе ГПК сопоставимы по эффективности с солевыми препаратами железа, но при их использовании значительно реже возникают нежелательные явления, что обосновывает все возрастающий интерес врачей к препаратам этой группы.
Литература
* ФНКЦ ДГОИ им. Дмитрия Рогачева МЗ РФ,
** ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Сравнительная эффективность и переносимость различных железосодержащих препаратов у больных железодефицитной анемией
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
МГМСУ им. Н.А. Семашко
50 ГКБ Департамента здравоохранения Правительства Москвы
Ж елезодефицитная анемия является самым распространенным анемическим синдромом и составляет приблизительно 80% всех анемий (ВОЗ, 1970). Дефицит железа той или иной степени имеется почти у 30% населения планеты (ВОЗ, 1998), причем скрытый его дефицит встречается в два раза чаще, чем железодефицитная анемия.
В 1998 г. в России насчитывалось около 480 тыс. больных анемией взрослых и подростков; из них примерно 432 тыс. – с железодефицитной анемией (Отдел медицинской статистики и информатики Информационно–аналитического центра МЗ РФ, 2001).
В настоящее время имеется большой выбор ферросодержащих препаратов. Для повышения биодоступности и улучшения переносимости железа фармакологическими фирмами используются различные методические подходы. Среди них – поддержание железа в двухвалентном состоянии, использование «носителей», усиление гемопоэза, утилизации и абсорбции железа, замедление всасывания и обеспечение независимости от pH среды и активности ферментов, задействование специальных рецепторов для абсорбции Fe 3+ в виде комплексов. Однако до настоящего времени отсутствуют сравнительные исследования по эффективности и переносимости этих препаратов.
Целью настоящего исследования явилась объективизация выбора ферросодержащих препаратов на основе сравнительного изучения их эффективности и переносимости у больных железодефицитной анемией.
Под наблюдением находилось 83 человека (22 мужчины и 61 женщина) в возрасте от 17 до 92 лет (средний возраст – 57,7±1,4 года) с анемией различной степени тяжести.
В среднем по группе уровень гемоглобина был снижен до 87,8±0,4 г/л, средняя длительность анемии составила 1,5±0,1 года. Причины анемии: острая или хроническая кровопотеря в 54,3% случаев, нарушение всасывания в 28,3 %, другие или комбинированные причины в 17,3 % случаев.
Анемия послужила причиной госпитализации у 10 больных, явилась осложнением основного заболевания у 28 и у 45 была обнаружена в процессе обследования по поводу другого заболевания, послужившего причиной госпитализации.
Причинами острой или хронической кровопотери были: в 22 (26,5%) случаях мено– и метроррагии, у 12 (14,5%) хронический кровоточащий геморрой, у 7 (8,4%) кровотечение из язвы 12–ти перстной кишки, у 2 (2,4%) грыжа пищеводного отверстия диафрагмы и по 1 (1,2%) случаю кровотечение из варикозно расширенных вен пищевода, неспецифический язвенный колит, болезнь Крона, длительно существующая цистостома по поводу доброкачественной гиперплазии предстательной железы с макрогематурией.
Нарушение всасывания железа было результатом синдрома раздраженной толстой кишки у 17 (20,5%) больных, резецированного желудка по поводу язвенной болезни у 4 (4,8%) пациентов, атрофического гастрита в 1 (1,2%) случае.
Анемия отмечалась на фоне вегетарианства (1 случай, 1,2%), в разные сроки после родов (2 случая, 2,4%) и при комбинации различных причин (у 10 пациентов, 12,1%).
Сопутствующей патологией в большинстве случаев (62 пациента, 75%) были заболевания сердечно–сосудистой системы (ИБС, АГ, ревматический митральный порок сердца) с признаками недостаточности кровообращения (не выше I стадии по классификации Стражеско–Василенко).
Все пациенты случайным методом были разделены на 5 групп, которым назначались разные антианемические препараты (табл. 1).
Пациенты I группы получали Ферроплекс (ФП), выпускающийся в драже, содержащих железа сульфат (50 мг или 10 мг элементарного железа) и кислоту аскорбиновую (30 мг). Суточная доза составляла 8 драже, которые назначали за 30–40 минут до еды.
Пациентам II группы назначали Актиферрин (А). Препарат выпускается в капсулах, содержащих железа сульфат (113,85 мг или 34,5 мг элементарного железа) и D,L–серин (129 мг). Доза актиферрина составляла 3 капсулы в сутки за 30–40 минут до еды.
В III группе использовался Актиферрин композитум (АК), выпускающийся в капсулах и содержащий, кроме железа сульфата (113,85 мг или 34,5 мг элементарного железа) и D,L–серина (129 мг), кислоту фолиевую (0,5 мг) и цианокобаламин (0,3 мг). Препарат назначали в дозе 2 капсулы в сутки за 30–40 минут до еды.
Пациенты IV группы получали Ферро–Фольгамму (ФФ) фармацевтической компании Woerwag Pharma (Германия). Препарат выпускается в капсулах, содержащих железа сульфат (100 мг или 37 мг элементарного железа), кислоту фолиевую (5 мг), цианокобаламин (10 мкг), кислоту аскорбиновую (100 мг). Препарат назначали в дозе 3 капсулы в день за 30–40 минут до еды.
Больные V группы получали Сорбифер дурулес (С). Препарат выпускается в таблетках, покрытых оболочкой, которые содержат железа сульфат (320 мг или 100 мг элементарного железа) и кислоту аскорбиновую (60 мг). Сорбифер дурулес назначали в дозе 2 таблетки в день за 30–40 минут до еды.
Клинический анализ крови с измерением уровня гемоглобина, подсчетом количества эритроцитов, ретикулоцитов, тромбоцитов и лейкоцитов, определением цветового показателя и СОЭ, а также морфологическим исследованием эритроцитов выполнялся в клинической лаборатории ГКБ № 50 (совместно с к.б.н. Барской Н.В.).
Уровень гемоглобина (Hb) капиллярной крови определяли унифицированным гемиглобинцианидным методом, а подсчет количества эритроцитов проводили в счетной камере Горяева под микроскопом.
Все показатели обмена железа определялись в ГНЦ РАМН (совместно с к.м.н. Левиной А.А.).
Уровень сывороточного железа (СЖ) и общей железосвязывающей способности сыворотки крови (ОЖСС) определяли колориметрическим методом с бетафенантролином с использованием реактивов фирмы «La Chema».
Ферритин сыворотки (ФС) и ферритин гемолизата (ФГ) определяли радиометрическим методом наборами ИРМА–ферритин, производства ИОХ, Минск. ФГ был использован, как показатель ферритина эритроцитов.
Насыщение трансферрина железом (НТЖ) является произвольной величиной и рассчитывается по формуле: НТЖ=100% (СЖ/ОЖСС).
Трансферрин определяли иммунодиффузным методом с моноспецифичной антисывороткой против трансферрина, полученной в лаборатории отделения химиотерапии лейкозов ГНЦ РАМН.
Из данных, приведенных в таблице 2, видно, что сформированные группы были однородными по тяжести анемии и выраженности нарушений обмена железа.
Дизайн исследования (рис. 1). Каждое обследование включало: анализ жалоб пациента, оценку объективных клинических признаков анемии, определение уровня гемоглобина, эритроцитов, цветового показателя, определение показателей обмена железа – сывороточного железа, ферритина сыворотки, ферритина эритроцитов, трансферрина, насыщения трансферрина железом, общей железосвязывающей способности сыворотки крови.
Рис. 1. Схема дизайна исследования
После исходного обследования пациенты получали соответствующий препарат до достижения уровня гемоглобина, превышающего 115 г/л (целевого уровня). Через месяц после окончания лечения оценивали стабильность полученного результата. В течение месяца контролировался уровень гемоглобина для исключения его снижения менее 100 г/л (чего в обследованной группе не было отмечено ни в одном случае). После третьего обследования больным назначалось продолжение терапии ферропрепаратами для создания адекватных депо железа.
Статистическая обработка полученного материала проводилась на ЭВМ IBM типа PC в программе Microsoft Excel (версия для Microsoft Windows–98). Достоверность различий определялась с помощью t–критерия Стъюдента для независимых и попарно связанных величин. Различия или динамика считались достоверными при р Полученные результаты и их обсуждение
У всех 83 наблюдавшихся пациентов на фоне терапии были получены благоприятный клинический эффект (табл. 3) и положительные сдвиги лабораторных показателей. При этом, поскольку клинические проявления сидеропенического синдрома отмечались лишь в отдельных случаях и чаще всего имелись признаки анемического синдрома, в данной части работы анализировались последние.
В целом субъективные симптомы анемии купировались несколько быстрее, чем объективные. Из субъективных признаков в каждой из групп быстрее всего регрессировала одышка при физической нагрузке. На фоне приема современных комбинированных препаратов железа она наблюдалась до 4–5 суток лечения; к 8–10 суткам исчезли головокружение и общая слабость.
В группе больных, получавших Актиферрин, Актиферрин композитум, Ферро–Фольгамма, Сорбифер дурулес, среди объективных признаков быстрее всего регрессировала бледность слизистых оболочек, а дольше всего сохранялась бледность кожи. В целом у них имелась следующая последовательность регресса субъективных и объективных признаков анемии: одышка при физической нагрузке, бледность слизистых оболочек, тахикардия, головокружение, общая слабость и бледность кожи.
На фоне приема Ферроплекса эта последовательность нарушалась: хотя быстрее всего регрессировала одышка при физической нагрузке, однако на втором месте по длительности сохранения оказалась тахикардия, затем исчезли головокружение, бледность слизистых оболочек, общая слабость и, наконец – бледность кожи. Длительность сохранения каждого симптома на фоне лечения Ферроплексом превышала таковую в группах больных, получавших другие комбинированные препараты, в 1,7–3,4 раза.
Ни жалобы пациентов, ни объективные клинические признаки анемии не появлялись вновь после прекращения приема препаратов и не были отмечены при обследовании через месяц после окончания лечения.
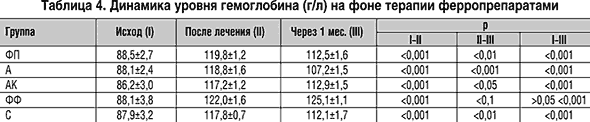
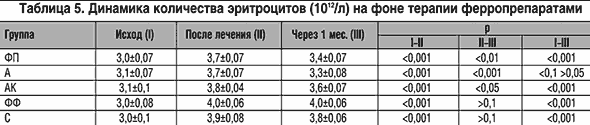
На фоне лечения все препараты обеспечивали достоверное (р (табл. 4 и 5). Однако через месяц после прекращения лечения в большинстве групп наблюдалось снижение уровня гемоглобина и только после приема Ферро–Фольгаммы отмечалась тенденция к нарастанию уровня Hb (0,1>р>0,05).
Количество эритроцитов, достигнутое во время лечения, удерживалось на полученном уровне в течение месяца после отмены лечения у пациентов, получавших Ферро–Фольгамму и Сорбифер дурулес, а в других группах оно достоверно снизилось.
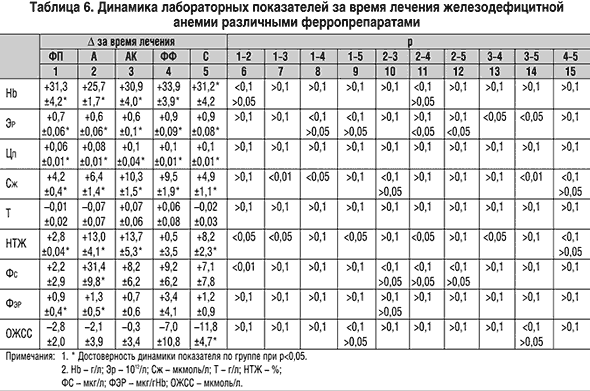
При использовании современных комбинированных препаратов время достижения целевого уровня гемоглобина было одинаковым (от 14,4±1,3 суток для Сорбифера дурулес до 16,4±1,3 суток для Актиферрина композитум; p>0,1). Прием же Ферроплекса потребовал наибольшего времени – 21,8±0,9 суток. Он же обеспечивал наименьшую скорость прироста гемоглобина (1,3±0,1 г/л/сутки). Более быстрый прирост наблюдался на фоне Актиферрина (1,7±0,1 г/л/сутки), а наибольшая скорость – при использовании Ферро–Фольгаммы (2,5±0,4 г/л/сутки). Скорости прироста гемоглобина на фоне приема Актиферрина композитум и Сорбифера дурулес были практически одинаковыми (2,1±0,4 и 2,2±0,2 г/л/сутки, соответственно).
Более существенные различия выявлены по приросту количества эритроцитов, который был наибольшим на фоне Ферро–Фольгаммы и Сорбифера дурулес, где он превышал динамику в других группах. Динамика цветового показателя была значимой во всех группах и заключалась в возрастании этого показателя на 0,06–0,1. Однако несмотря на некоторые различия между группами по динамике уровня гемоглобина и количества эритроцитов этот прирост во всех группах был близким и не различался достоверно на фоне приема всех применявшихся ферропрепаратов (р>0,1 для всех пар).
В то же время прием всех препаратов, за исключением Ферро–Фольгаммы, сопровождался достоверным увеличением насыщения трансферрина железом. Наибольший прирост НТЖ наблюдался на фоне приема Актиферрина композитум и Актиферрина, наименьший – при применении Ферроплекса, что не отличалось от недостоверной динамики, наблюдавшейся в группе Ферро–Фольгаммы. Можно высказать предположение, что малая динамика НТЖ в группе Ферроплекса, где была наименьшей скорость прироста гемоглобина, отражает низкую эффективность данного препарата. В то же время отсутствие нарастания НТЖ в группе Ферро–Фольгаммы, где достигнута наибольшая скорость прироста гемоглобина, связано с быстрой утилизацией железа в результате активного синтеза гемоглобина и быстрым освобождением трансферрина (апотрансферрина), несмотря на высокую скорость абсорбции железа в кишечнике.
1. Комбинированные препараты Ферро–Фольгамма и Актиферрин композитум, а также медленно абсорбирующийся Сорбифер дурулес в короткий срок обеспечивают регресс клинических симптомов железодефицитной анемии и быстрое нарастание уровня гемоглобина даже при относительно непродолжительном лечении.
2. Несмотря на то, что в большинстве случаев достигнутый уровень гемоглобина не удерживается в течение месяца после отмены лечения, показатели ферростатуса в этот период либо не менялись, либо сдвигались в положительную сторону (исключение – Ферроплекс).
3. Среди больных, принимавших Актиферрин, Актиферрин композитум и Ферро–Фольгамму, не было отмечено побочных эффектов, что позволяет говорить об их хорошей переносимости; Сорбифер дурулес переносится хуже, что, однако, при использованной схеме терапии не потребовало отмены препарата или коррекции дозы.
4. Самая низкая скорость прироста гемоглобина, наибольшая длительность терапии до достижения целевого уровня гемоглобина и худшая переносимость лечения отмечены при применении Ферроплекса.
5. При интегральной оценке эффективности в процессе лечения, стойкости достигнутого эффекта и переносимости безусловными преимуществами обладает комбинированный препарат Ферро-Фольгамма.







_500.gif)