Активная реакция среды чем определяется
АКТИВНАЯ РЕАКЦИЯ СРЕДЫ
Расстановка ударений: АКТИ`ВНАЯ РЕА`КЦИЯ СРЕДЫ`
А. р. с. принято характеризовать отрицательным десятичным логарифмом концентрации водородных ионов рН (см. Водородный показатель). Для количественной характеристики А. р. с. пользуются эмпирической шкалой рН. Для построения этой шкалы и для калибровки электродов, служащих для измерения рН, предложен ряд растворов с точно установленными значениями рН. Особенно пригодными для этой цели оказались пять стандартных растворов, предложенных Национальным бюро стандартов США. Выше приведена таблица значений рН этих растворов при различных температурах. В растворе кислого виннокислого калия легко образуется плесень, поэтому его рекомендуется применять свежеприготовленным. Остальные растворы не изменяются в течение приблизительно двух месяцев.
| Температура | 0,05 М раствор КН3  (С2О4)2 (С2О4)2  2Н2О (тетраоксалат калия) 2Н2О (тетраоксалат калия) | Раствор кислого виннокислого калия, насыщенного при t° 25° | 0,05 М раствора кислого фталевокислого калия | 0,025 М КН2РО4 + Na2HPO4 | 0,01 М раствора буры |
|---|---|---|---|---|---|
| 0 | 1,67 | — | 4,01 | 6,98 | 9,46 |
| 5 | 1,67 | — | 4,01 | 6,95 | 9,39 |
| 10 | 1,67 | — | 4,00 | 6,92 | 9,33 |
| 15 | 1,67 | — | 4,00 | 6,90 | 9,27 |
| 20 | 1,68 | — | 4,00 | 6,88 | 9,22 |
| 25 | 1,68 | 3,56 | 4,01 | 6,86 | 9,18 |
| 30 | 1,69 | 3,55 | 4,01 | 6,85 | 9,14 |
| 35 | 1,69 | 3,55 | 4,02 | 6,84 | 9,10 |
| 40 | 1,70 | 3,54 | 4,03 | 6,84 | 9,07 |
| 45 | 1,70 | 3,55 | 4,04 | 6,83 | 9,04 |
| 50 | 1,71 | 3,55 | 4,06 | 6,83 | 9,01 |
| 55 | 1,72 | 3,56 | 4,08 | 6,84 | 8,99 |
| 60 | 1,73 | 3,57 | 4,10 | 6,84 | 8,96 |
| 70 | — | 3,59 | 4,12 | 6,85 | 8,92 |
| 80 | — | 3,61 | 4,16 | 6,86 | 8,88 |
| 90 | — | 3,64 | 4,20 | 6,86 | 8,85 |
| 95 | — | 3,65 | 4,22 | 6,87 | 8,83 |
См. также Алкалоз. Ацидоз, Буферные растворы, Растворы, Электролиты, Электроды.
Библиогр.: Бейтс Р. Г. Определение рН, теория и практика, пер. с англ., Л., 1968; Швабе К. Основы техники измерения рН, пер. с нем., М., 1962.
АКТИВНАЯ РЕАКЦИЯ
Полезное
Смотреть что такое «АКТИВНАЯ РЕАКЦИЯ» в других словарях:
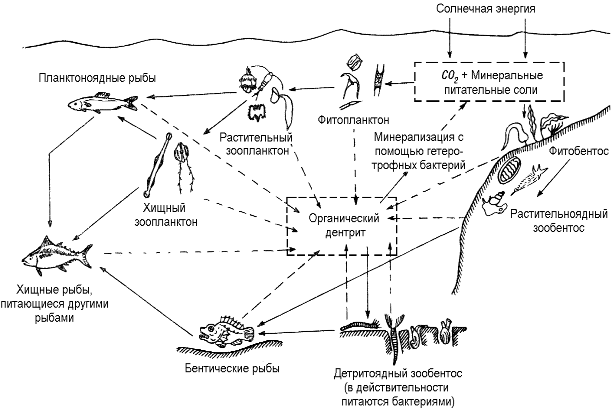
АКТИВНАЯ РЕАКЦИЯ СРЕДЫ — водородный показатель, концентрация водородных ионов в среде (почве, воде); рН. При рН 7 среда нейтральная, ниже 7 кислая, выше 7 щелочная. Активная реакция среды один из основных абиотических факторов. Изменяя проницаемость наружных мембран… … Экологический словарь
АКТИВНАЯ РЕАКЦИЯ ВОДЫ — концентрация в воде свободных водородных ионов (Н*); обозначается латинскими буквами рН. А. р. в. может быть кислой (рН меньше 6), слабокислой (рН от 6 до 7), нейтральной (рН 7), слабощелочной (рН от 7 до 8) и щелочной (рН больше 8). Для… … Прудовое рыбоводство
РЕАКЦИЯ СРЕДЫ — РЕАКЦИЯ СРЕДЫ, термин, употребляемый в химии и характеризующийся соотношением водородных и гидроксильных ионов. Р. с. является кислой, если в растворе преобладают водородные ионы; раствор обнаруживает в атом случае свойства к^гы. В случае… … Большая медицинская энциклопедия
РЕАКЦИЯ ВОДЫ — см. в ст. Активная реакция среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
Активная зона — Core центральная часть реактора, в которой протекает самоподдерживающаяся цепная реакция деления и выделяется энергия. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
Активная зона реактора — центральная область ядерного реактора (содержащая тепловыделяющие элементы), в котором происходит цепная реакция деления … Российская энциклопедия по охране труда
Активная зона — ядерного реактора, пространство, в котором осуществляется контролируемая цепная реакция деления ядер тяжёлых элементов (урана, плутония). Цепная реакция сопровождается выделением кинетической энергии осколков деления, а также энергии… … Большая советская энциклопедия
ОПРЕДЕЛЕНИЕ АКТИВНОЙ РЕАКЦИИ СРЕДЫ
1.Цель работы: ознакомление с методами определения активной реакции среды, определение рН электрометрическим методом.
Активная реакция среды (рН), характеризующая степень ее кислотности или щелочности, определяется соотношением концентраций водородных и гидроксильных ионов.
Согласно классической теории электролитической диссоциации, произведение концентрации водородных и гидроксильных ионов представляет при определенной температуре постоянную величину – константу диссоциации:
Согласно предложению Серенсена, активную реакцию среды выражают водородным показателем рН, представляющим собой отрицательный десятичный логарифм концентрации водородных ионов:

В соответствии с этим в кислых растворах 

Постоянство рН, от которого зависит протекание в воде различных биологических и физико-химических процессов, поддерживается в природных водах гидрокарбонатной буферной системой, состоящей из растворенной в воде угольной кислоты, 

Активную реакцию воды чаще всего определяют колориметрическим или электрометрическим методом.
Колориметрический метод основан на изменении окраски индикатора в зависимости от концентрации ионов водорода.
Электрометрический метод определения рН основан на измерении разности потенциалов, возникающей на поверхности раздела между стеклянным электродом и раствором. Пределы линейной подчиненности потенциала электрода зависят от состава стекла электрода.
Стеклянный электрод применяют для измерения рН от 1 до 12,7. Он представляет собой трубку с напаянным на конце полым шариком из литиевого электродного стекла. При погружении электрода в раствор между поверхностью шарика и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла замещаются ионами водорода, и стеклянный электрод приобретает свойства водородного.
В качестве вспомогательного электрода сравнения рН используют проточный каломельный или хлорсеребряный электрод, корпус которого заполняется насыщенным раствором хлорида калия. Верхняя часть корпуса с отверстием для заливки хлорида калия закрывается резиновой пробкой, которая при измерениях вынимается.
Соединения железа, сероводорода, мышьяка, свободный хлор, взвешенные вещества и коллоиды на измерение концентрации ионов водорода в природных водах не влияют. Результат определения рН зависит от температуры воды.
3. Описание установки.
Для проведения лабораторной работы используются: лабораторный рН-метр (типа рН-150 или рН-340) со стеклянным электродом измерения и каломельным или хлорсеребряным электродом сравнения (рис. ); реактивы: 1) буферный раствор с рН 1,68 при 20 °С: 12,710 г диоксалата калия 



4. Порядок проведения работы.
4.1. Перед измерением рН проверяют прибор по стандартным буферным растворам.
4.2. Электроды промывают дистиллированной, затем исследуемой водой, после чего погружают в тщательно перемешанную исследуемую воду. Исследуют две пробы воды. Проба № 1 – водопроводная вода; проба №2 – вода после очистки ваграночных газов в мокром пылеуловителе.
4.3. С изменением температуры контролируемого раствора изменяются и характеристики электродной системы. В связи с этим применяют специальный автоматический термокомпенсатор или термометр, входящий в комплект лабораторного датчика ДЛ-02.
4.4. Величину потенциала стеклянного электрода отсчитывают в единицах рН, округляя результаты до 0,05-0,1. Результаты записывают в отчет.
5. Требования к отчету. Отчет должен содержать:
5.1. Цель работы и краткое изложение теории.
5.2. Порядок проведения работы и результаты опытов.
5.3. Анализ полученных результатов и вывод.
6. Контрольные вопросы.
6.1. Что такое «активная реакция среды»?
6.2. Что такое водородный показатель pH? Каковы его значения для кислых, нейтральных и щелочных растворов?
6.3. Какие методы применяются для определения активной реакции среды?
6.4. Какой метод использовался в работе, в чем его суть?
6.7. Какие приборы и материалы используются для определения pH?
6.8. Принцип работы прибора?
1. Андоньев М.С., Филипьев О.В. Пылегазовые выбросы предприятий черной металлургии. – М.: Металлургия, 1979, 192 с.
2. Глуховский В.И. Разработка системы очистки от высокодисперсных частиц пылегазовых выбросов плавильных агрегатов чугунолитейных цехов. – Автореф. Канд.дис. – Минск: БПИ, 1990, 17 с.
3. Гордон Г.М., Пейсахов И.Л. Контроль пылеулавливающих установок. – М.: Металлургия, 1973, 384 с.
4. Дубинская, Ф.Е., Белый О.А., Глуховский В.И. Газоочистное оборудование к чугунолитейным вагранкам. – Обзорн. информ. – М.:ЦИНТИХИМНЕФТЕМАШ, 1991, 40 с.
5. Перечень методик выполнения измерений, допущенных к применению в деятельности лабораторий экологического контроля предприятий и организаций Республики Беларусь. Т.1. – Минск.: НТЦ «АПИ», 1996, 208 с.
6. Расчет выбросов загрязняющих веществ в атмосферный воздух при горячей обработке металлов. Руководящий документ Республики Беларусь (РД 0212.3-2002), Минск, 2002, 156 с.
7. Ровин Л.Е. Защита воздушного бассейна от выбросов промышленных предприятий. – Обзорн. информ. – Минск: БелНИИНТИ, 1984, 55 с.
8. Сборник методик по расчету выбросов в атмосферу загрязняющих веществ различными производствами. – Ленинград: Гидрометиоиздат, 1986, 184 с.
9. Худокормов Д.Н., Белый О.А., Глуховский В.И., Дедовец В.А. Прогрессивные технологии очистки пылегазовых выбросов. – Обзорн. информ. – Минск: БелНИИНТИ, 1990, 43 с.
1. Основные правила техники безопасности 3
2. Лабораторная работа № 1
Определение дисперсности пыли 4
3. Лабораторная работа № 2
Определенте скорости осаждения частиц 13
4. Лабораторная работа № 3
Исследование выделений оксида углерода при
термодеструкции связующих разных классов,
применяемых для изготовления форм и стержней 19
5. Лабораторная работа № ;
Определение активной реакции среды 27
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Потенциал



Активная реакция и окислительно-восстановительный
Рисунок 4.6 – Схема круговорота вещества в океане (по [9])
Активная реакция природных вод довольно устойчива, т.к. они благодаря присутствию карбонатов представляют собой сильно забуфференную систему. В случае отсутствия карбонатов рН воды может снижаться. Во время интенсивного фотосинтеза рН может подниматься до 10 и более вследствие почти полного исчезновения из воды углекислоты.
В морских водах рН обычно равен 8,1-8,4. Природные воды с рН от 3,4 до 6,5 называются кислыми,с рН от 6,5 до 7,5 – нейтральными, с рН от 7,5 до 10 и выше – щелочными.
В одном и том же водоеме рН в течение суток может колебаться на 2 единицы и более: ночью рН понижается в результате подкисления воды выделяющимся в процессе дыхания углекислым газом, днем повышается за счет потребления углекислого газа фотосинтезирующими растениями. В грунтах озер и болот рН обычно несколько ниже 7, в океанических осадках он часто бывает несколько сдвинут в щелочную сторону.
По отношению к различным концентрациям водородных и гидроксильных ионов гидробионты подразделяются на:
– эвриионных, выдерживающих большие изменения рН;
– стеноионных, обитающих в водах с колебанием рН в незначительных пределах. Среди стеноионных выделяются ацидофильные (предпочитают кислые воды), алкалифильные (обитают в щелочных водах).
Экологическое действие рН связано с изменением проницаемости наружных мембран клеток, влиянием на водно-солевой обмен, границы распространения и характер жизнедеятельности гидробионтов.
Окислительно-восстановительный потенциал. Характеризует условия протекания в среде окислительных и восстановительных процессов.
В результате взаимодействия двух веществ может происходить окислительно-восстановительная реакция, приводящая к возникновению между ними разности электрических потенциалов – Еh, или редоксипотенциала. Величина Еh измеряется обычно милливольтами (мВ). Он тем выше, чем больше отношение концентрации компонентов, способных к окислению, к концентрации компонентов, могущих восстанавливаться.
Концентрация окисленной формы водорода (Н + ) характеризуется величиной рН, концентрация восстановленной формы водорода выражается показателем rH (или rH2), представляющим собой логарифм величины давления молекулярного водорода, взятый с обратным знаком. Чем меньше величина rH, тем выше восстановительная способность среды. Таким образом, окислительно-восстановительные свойства среды могут характеризоваться как величиной редоксипотенциала Eh, так и условными единицами rH, указывающими концентрацию молекулярного водорода, способную создать данные окислительно-восстановительные условия. Чем выше редоксипотенциал, тем выше окислительная способность среды и тем выше величина r, т.е. ниже концентрация молекулярного водорода, необходимая для создания окислительно-восстановительных условий.
Связь между Eh, rH и рН выражается зависимостью:
Вода морских и пресных водоемов, содержащая значительное количество кислорода, имеет положительный Eh=300-350 мВ, т.е. является средой окисленной, и в ней величина rH=35-40. В придонных слоях воды содержание кислорода снижается, Eh становится отрицательным, rH падает до 15-12.
Величина редоксипотенциала влияет на скорость окисления сероводорода серными бактериями, на поведение гидробионтов.
Те или иные свойства воды в разных участках водоемов, водотоков проявляются в неодинаковой степени. Проникновение света, движение воды, температурный режим, кислородный баланс и др. показывают, что в различных участках водоемов свойства воды проявляются не в равной мере.
АКТИВНАЯ РЕАКЦИЯ СРЕДЫ
Смотреть что такое «АКТИВНАЯ РЕАКЦИЯ СРЕДЫ» в других словарях:
РЕАКЦИЯ СРЕДЫ — РЕАКЦИЯ СРЕДЫ, термин, употребляемый в химии и характеризующийся соотношением водородных и гидроксильных ионов. Р. с. является кислой, если в растворе преобладают водородные ионы; раствор обнаруживает в атом случае свойства к^гы. В случае… … Большая медицинская энциклопедия
РЕАКЦИЯ ВОДЫ — см. в ст. Активная реакция среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
ФЕРМЕНТЫ — (син. энзимы; франц. диастазы), биол. агенты, катализирующие большинство хим. реакций, лежащих в основе жизнедеятельности клетки и организма. Ряд характерных свойств термолябильность, специфичность действия, высокая каталитическая эффективность,… … Большая медицинская энциклопедия
Ферменты — (от лат. fermentum – закваска) энзимы, специфические белковые катализаторы, присутствующие во всех живых клетках. Почти все биохимические реакции, протекающие в любом организме и в своём закономерном сочетании составляющие его Обмен… … Большая советская энциклопедия
ОБЛИТЕРАЦИЯ — (лат. obliteratio уничтожение), термин, употребляемый для обозначений закрытия, уничтожения той или иной полости или просвета посредством разрастания^ ткани, идущего со стороны стенок данного полостного образования. Указанное разрастание чаще… … Большая медицинская энциклопедия
ЛЮМИНИСЦЕНЦИЯ — (от лат. lumen свет), «холодное свечение», обусловленное не повышением t° (тепловое или температурное излучение), но различными иными причинами. В зависимости от способа возбуждения свечения различают несколько видов Л. Таковы: 1) … Большая медицинская энциклопедия
УГЛЕКИСЛОТА — встречается в воде водоема в нескольких видах: свободная, бикарбонатная и монокарбонатная. Количество свободной У. является показателем загрязнения воды органическими веществами; увеличение ее до 30 мл/л вредно для рыб (вызывает у них учащенное… … Прудовое рыбоводство
Кровь — жидкая ткань, циркулирующая в кровеносной системе человека и животных; обеспечивает жизнедеятельность клеток и тканей и выполнение ими различных физиологических функций. Одна из основных функций К. транспорт газов (O2 от органов… … Большая советская энциклопедия
ПУЩА — густой, труднопроходимый широколиственно темнохвойный многоярусный заболоченный или переувлажненный лес. Термин обычно применяется к европейским лесам (например, Беловежская пуща, Налибокская пуща). рН СРЕДЫ, см. Активная реакция среды.… … Экологический словарь
ЭВРИИОННЫЕ ВИДЫ — виды, выдерживающие большие изменения рН среды (например, личинки комара Chironomus, способные выдерживать колебания рН от 2 до 10, рачки Cyclops languidus и Chydorus ovalis, коловратки Anuraea cochlearis и др.). Ср. Стеноионные виды. См. также… … Экологический словарь