Актовегин что дает организму
Как принимать Актовегин?
Врачи для активизации обмена веществ, улучшения питания и стимуляции процесса восстановления тканей назначают пациентам актовегин. Препарат выпускается в форме таблеток и раствора для инъекций. Основное действующее вещество – депротеинизированный гемодериват. Его получают из крови телят.
При применении препарата повышается поглощение и усвоение кислорода тканями, улучшается транспорт и утилизация глюкозы, ускоряются энергетические процессы, снижается количество лактата, образующегося в условиях кислородного голодания.
Указана минимально возможная цена на товар в городе.
Цены на товар в разных аптеках отличаются.
Для чего назначают уколы взрослым
Почему актовегин запрещён во многих странах
Что лучше взрослому – актовегин или церебролизин
Что лучше взрослым – актовегин или кортексин
Оба препарата выпускаются из природного сырья. Они улучшают обменные процессы в клетках организма и снабжение тканей кислородом, стабилизируют клеточные мембраны. Актовегин – препарат, который относится к метаболическим средствам.
Выпускается в виде раствора для инъекций, который вводят как внутривенно, так и внутримышечно, и в форме таблеток, мази. Препарат назначают не только взрослым, но и новорожденным, детям грудного возраста для лечения заболеваний центральной и периферической нервной системы, нарушений периферического кровообращения.
Побочные действия актовегина
Противопоказания
Актовегин не назначают пациентам, у которых ранее была зарегистрирована повышенная чувствительность к ингредиентам препарата или аналогичных лекарственных средств. Препарат противопоказан при непереносимости глюкозы, недостаточности сахарозы-изомальтозы и глюкозо-галактозной мальабсорбции.
Лекарственное средство беременным назначают в том случае, если польза от его применения превышает риск развития осложнений со стороны матери и плода.
Актовегин что дает организму
Buchmayer F., Pleiner J., Elmlinger M.W., Lauer G., Nell G., Sitte H.H.
Введение
На протяжении последних десятилетий на молекулярном уровне получен колоссальный обьем новой информации о структурных и физиологических механизмах клеточной пролиферации, дифференциации, созревания и дегенерации. Было создано множество экспериментальных моделей различных неврологических заболеваний на животных для изучения механизмов гибели клеток и выявления потенциальных мишеней для проведения нейропротективной и нейрорепаративной терапии. На основании нового представления о генетических и молекулярных механизмах церебрального поражения современные способы нейропротекции были успешно воспроизведены на животных и быстро внедрялись в клиническую практику. В то же время многие рандомизированные плацебо-контролируемые исследования по нейропротекции у человека не дали положительных результатов при остром инсульте и хронических формах цереброваскулярных заболеваний. Более того, некоторые исследования были досрочно прекращены вследствие увеличения риска негативных эффектов и отсутствия терапевтической пользы.
Из многочисленных лекарственных субстанций, протестированных в экспериментальных моделях, лишь немногие исследованы в клинических условиях и доказали свою безопасность. Среди них – нейротрофические и мембраностабилизирующие средства, антиоксиданты, блокаторы калиевых и кальциевых каналов, глутаматных рецепторов, ингибиторы каспаз и препараты биологического происхождения с полимодальным эффектом.
Биологические препараты сегодня находятся в центре внимания фармацевтических компаний. Однако не меньшего внимания заслуживают представления и препараты, давно существующие на рынке. Так, вакцинация, появившаяся в европейской медицине около 200 лет назад, снискала беспримерный успех. Несмотря на существующие недостатки и побочные эффекты, ее достижения огромны, например искоренение оспы в результате начатой Всемирной организацией здравоохранения в конце 1950-х гг. всемирной программы вакцинации. Создание новых представлений позволяет начать использование вакцинации в борьбе с рядом опухолей, хотя этой терапии еще предстоит пройти путь от научных разработок до клинических испытаний. Примерами других “старых” биологических препаратов могут служить моноклональные антитела (за создание которых в 1984 г. K. Niels Jerne, J.F. Kohler и Cesar Milstein были удостоены Нобелевской премии) и ряд препаратов крови, таких как концентраты фактора VIII и гемодиализат телячьей крови, названный Актовегином.
Актовегин представляет собой прозрачный водный раствор желтовато-коричневатого цвета. Он лишен белка, но содержит вещества, дающие положительную реакцию с нингидрином. Будучи диализатом крови, Актовегин содержит характерные для нее соли и микроэлементы. Сложный состав этой смеси затрудняет выделение единственного действующего начала. Первоначально им считались низкомолекулярные пептиды (2 % сухого вещества) и производные нуклеиновых кислот; тем не менее на эту роль претендует и ряд других низкомолекулярных веществ (см. ниже).
Показаниями к применению гемодиализата телячьей крови являются нарушения кровообращения и трофики головного мозга (ишемические инсульты, черепно-мозговые травмы), нарушения периферического кровотока и связанные с этим болезни (ангиопатии и трофические язвы голеней), трансплантация кожи, ожоги (в т. ч. химические), нарушения заживления ран (вялотекущие раны, пролежни), профилактика и лечение лучевых поражений кожи и слизистых оболочек. Несмотря на разнообразие показаний, активность препарата легко связать с трофическим действием на ткани.
В данном обзоре мы сосредоточимся на фармакодинамике Актовегина — препарата, который ранее применялся при многих заболеваниях и сегодня возвращается в широкую практику, становясь объектом фундаментальных и клинических исследований. После короткого вступительного обзора, посвященного процессу приготовления препарата, мы рассмотрим современные представления о механизме его действия. После этого мы остановимся на применении гемодиализата телячьей крови на практике в виде резюме некоторых клинических испытаний.
Производство
Актовегин представляет собой депротеинизированный апирогенный и неиммуногенный гемодиализат телячьей крови. При изготовлении он проходит несколько ступеней ультрафильтрации. На первом этапе используется порог в 6 кД, после чего проводятся вакуумная дистилляция, удаление преципитата путем фильтрации через поры диаметром 0,45 мкм и доведение pH до 6,8. После этого полученный продукт фильтруется в стерильных условиях через фильтры с порами 0,2 и 0,45 мкм и выдерживается при 2–6 oС не менее 14 суток, после чего снова подвергается фильтрации (0,45 мкм) и доведению pH до 6,8. После последующих коррекций pH продукт снова фильтруется (7 мкм и 0,2 мкм) и подвергается еще одной ультрафильтрации с порогом 10 кД и фильтрации в стерильных условиях через фильтры с порами 0,2 и 0,45 мкм. После еще одной выдержки (не менее 56 суток при 2–6 oС) готовый продукт отделяют с помощью фильтрации (0,45 мкм) и разводят до номинальной концентрации 200 мг/мл сухого веса. Депротеинизация завершается фильтрацией через фильтры с порами 0,2 и 0,45 мкм в стерильных условиях.
Анализ готового препарата показывает, что он представляет собой смесь природных веществ, как неорганических – электролитов (хлоридов, натрия, калия, кальция, магния, соединений азота), так и органических (глюкозы, ацетата, лактата, аминокислот, пептидов, нуклеозидов, гликосфинголипидов, других продуктов метаболизма). Поскольку белки удаляются из дефибринированной крови при ультрафильтрации (порог – 5 кД), при электрофорезе в полиакриламидном геле следов белка не обнаруживается. Об отсутствии белков и других загрязняющих веществ говорит и безопасность Актовегина; если не брать в расчет отдельные наблюдения, за полвека применения препарата иммунных реакций на него не наблюдали. Токсикологические исследования на мышах и других лабораторных животных показали, что при внутривенном введении гемодиализат телячьей крови токсичен в дозах, превышающих максимальную терапевтическую более чем в 50 раз. Исследования хронической токсичности показали, что при применении в течение 3 месяцев Актовегин не токсичен и не приводит к макро- и микроскопическим патологоанатомическим изменениям.
Поскольку Актовегин имеет биологическое происхождение, он проходит два теста, подтверждающих его однородность. Первый – потребление кислорода (в мкл/мг ткани/ч) гомогенатами печени морских свинок (по Warburg, с помощью микроспирометра). Целевое значение QO2 для Актовегина составляет 4,0/8 мг вещества. Вторым методом стандартизации служит определение захвата меченой тритием глюкозы липидной фракцией жировых клеток придатка яичек крыс. Гемодиализат телячьей крови усиливает ее захват, подобно инсулину; инсулиноподобная активность его в инкубационной среде с концентрацией 1 мг/мл должна составлять не менее 20 мкЕД.
Доклинические исследования
Актовегин оказывает на организм многообразное действие, связанное преимущественно с органонезависимым влиянием на метаболизм клеток, что приводит к повышению потребления и использования кислорода, а также усилению поступления в клетки глюкозы. Благодаря этому Актовегин активирует энергетический метаболизм, оказывая благотворное действие в различных ситуациях. Кроме того, он усиливает окислительные процессы, сдвигая баланс окислительно-восстановительных процессов в сторону окисления. При этом также возрастает содержание высокоэнергетичных фосфатов (например, АТФ и креатинфосфата).
Данная гипотеза появилась в результате ряда исследований, проводившихся как in vitro (например, в культурах клеток), так и in vivo (в опытах на животных). Более того, было показано, что применение Актовегина бывает эффективным при нарушениях кровообращения. Препарат улучшает поступление энергии в ткани, включая головной мозг. Далее мы подведем итоги доклинических испытаний фармакодинамики Актовегина, разделив их по основному оказываемому действию. Разнообразие эффектов Актовегина можно связать с природой препарата, представляющего собой смесь веществ, аналогичную растительным экстрактам, где это считается преимуществом.
Инсулиноподобное действие и метаболизм глюкозы
По характеру действия Актовегин сходен с инсулином [1]. Это наблюдение было дополнительно подтверждено D. Parade [2], описавшим у крыс его инсулиноподобное действие в отношении захвата глюкозы жировыми клетками. Авторы пришли к выводу, что Актовегин содержит вещества, обладающие подобным действием; вопрос о природе этих активных веществ побудил к проведению ряда исследований. Сегодня инсулиноподобное действие Актовегина и стимуляцию метаболизма глюкозы связывают с инозитолфосфоолигосахаридами (IPO).
IPO высвобождаются из мембран гепатоцитов под действием инсулина [3, 4] и благодаря хорошей растворимости, большому объему распределения могут воспроизводить разнообразные инсулиноподобные эффекты во многих клетках [5]. Это наблюдение позднее подтвердили J.M. Mato и соавт. [6] и M. Kellerer и соавт. [7] в опытах на фибробластах крыс с гиперэкспрессией изоферментов человеческого рецептора инсулина, которые инкубировали с инсулином. При этом наблюдалось высвобождение IPO, которые, как показали эти исследования, напрямую стимулировали захват глюкозы ее переносчиками. Так как в этих опытах использовались клетки с резко выраженной гиперэкспрессией инсулиновых рецепторов, в последующем были проведены аналогичные исследования на жировых клетках крыс с физиологическим уровнем экспрессии инсулинового рецептора.
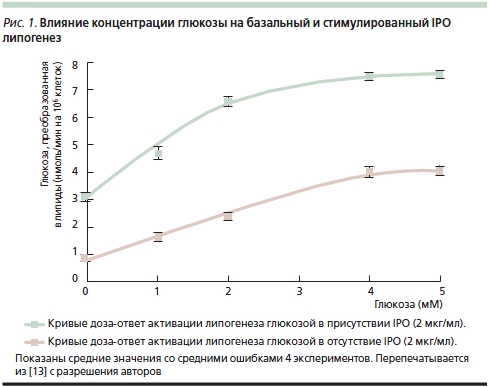
Первые исследования уровня глюкозы проводились на гомогенатах печени морских свинок [8]. Актовегин достоверно изменял уровень глюкозы после 60, 90 и 120 минут инкубации. Более того, инсулиноподобное действие (ИПД), описанное W. Bachmann и соавт. [1], не требовало присутствия инсулина, т. к. проявлялось даже в присутствии антител к инсулину: уровень глюкозы у животных, получавших Актовегин, был отчетливо ниже, чем в контрольной группе. G. Mohnike и соавт. [10] описали опыты по оценке стимуляции захвата и утилизации глюкозы Актовегином в клетках диафрагмы крыс. В последующем исследовании, проведенном в той же лаборатории, F. Machicao и соавт. [11] изучали, обладают ли выделенные из гемодиализата IPO инсулиноподобным действием на жировые клетки крыс. Авторы показали, что ключевые эффекты IPO напоминают действие инсулина на жировые клетки [12]. Любопытно, что действие IPO полностью подавлялось инозитолмонофосфатом, глюкозамином и маннозой, что свидетельствовало о фармакологической специфичности этих активных компонентов Актовегина [13]. В опытах in vitro на миоцитах (линии BC3H-1) инсулин вызывал гидролиз фосфатидилинозитолгликана и повышал образование инозитолгликана и диацилглицерола [14]. Тем не менее эти авторы не получили данных относительно усиления захвата глюкозы инозитолгликаном в этих клетках; отчетливо усиливались только окисление глюкозы и липогенез (рис. 1).
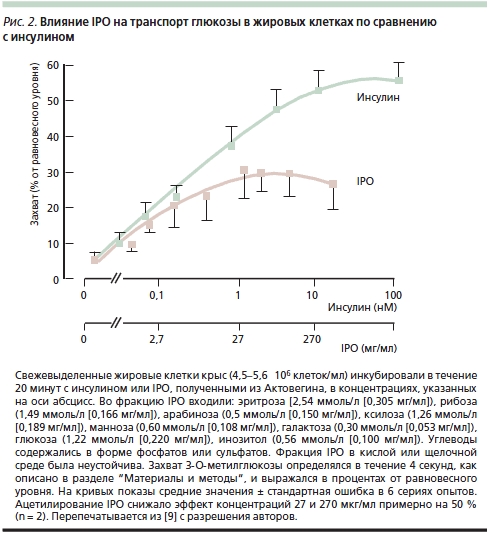
B. Obermier-Kusser и соавт. [9] с целью дальнейшего подтверждения предположения об ИПД содержащихся в Актовегине IPO изучали их влияние на транспорт глюкозы в жировых клетках крыс по сравнению с инсулином: добавление IPO оказывало достоверное дозозависимое действие на транспорт 3-O-метилглюкозы, повышая его в 5 раз (инсулин – в 10) (рис. 2). В той же работе B. Obermier-Kusser и соавт. также изучали связывание цитохалазина B с мембранными переносчиками глюкозы. К удивлению исследователей, число последних в присутствии IPO не возрастало в отличие от действия инсулина, который повышал их содержание в 3–5 раз [9]. Авторы исключили также возможность стимуляции IPO тирозинкиназной активности инсулинового рецептора и предположили, что они не взаимодействуют с нижележащими внутриклеточными сигнальными путями. В итоге была предложена двухступенчатая модель, предполагающая как повышение активности переносчиков глюкозы в цитоплазматической мембране, так и прямое увеличение ее транспорта. Для окончательного выяснения активного вещества требуется изучение свойств отдельных фракций IPO.
Таким образом, существуют как прямые, так и косвенные данные в пользу существования у Актовегина ИПД, которое отличается от действия самого инсулина преимущественным влиянием на переносчики глюкозы, а не на увеличение ее потока. Тем не менее конечным итогом действия как самого инсулина, так и IPO с инсулиноподобным действием служит повышение утилизации глюкозы, напрямую влияющее на метаболизм клеток и баланс энергии в тканях.
Потребление кислорода, обмен веществ и гипоксия
Исследования потребления кислорода, обмена веществ и гипоксии проводились на таких лабораторных животных, как крысы, морские свинки и собаки. Исследование K.H. Jager и соавт. [15] дало первые доказательства влияния Актовегина на клеточное дыхание: он усиливал потребление кислорода очищенными митохондриями печени крыс. H. De Groot и соавт. [16] изучали влияние гипоксии на гепатоциты крыс, окрашивая их трипановым синим. Добавление Актовегина достоверно повышало их выживаемость в условиях гипоксии. Авторы пришли к выводу, что Актовегин обладает выраженными антигипоксическими свойствами. M. Brecht и H. de Groot [17] изучали влияние свободных аминокислот на гипоксическое повреждение гепатоцитов крыс. Эксперименты проводились аналогично вышеописанному исследованию H.de Groot и соавт. [16]. Это сообщение подтвердило представление о том, что защита от гипоксического повреждения может быть связанной с содержащимися в Актовегине аминокислотами. В соответствии с этими наблюдениями G. Schafer [18] сравнил потребление кислорода гепатоцитами крыс под действием Актовегина и плацебо и описал усиление клеточного дыхания Актовегином (неопубликованные данные). H. Reichel и соавт. [19] показали, что усиление захвата глюкозы и потребления кислорода клетками под действие Актовегина зависит от их фосфорилирующей активности; в присутствии препарата повышение потребления кислорода доходило до 40 %. Это также говорит в пользу представления об усилении Актовегином активности клеток. В подтверждение T. Kuninaka и соавт. [20] исследовали митохондриальное дыхание в митохондриях печени крыс с помощью полярографии и пришли к выводу, подтверждающему данные H. Reichel и соавт. [19]: добавление Актовегина достоверно усиливает окислительное фосфорилирование.
Еще одним интригующим вопросом была скорость воздействия Актовегина на поступление энергии в клетку: К. Schwabe [21] показал, что Актовегин значительно активирует внутриклеточные окислительные процессы и ускоряет не только энергетический, но и резервный метаболизм (например, в сердце и печени сопровождается усиленным накоплением гликогена и калия).
J. Pichotka и соавт. изучали влияние препарата на потребление кислорода. Актовегин вызывал высокодостоверное дозозависимое повышение потребления кислорода по сравнению с контролем. L. Rammler [23] с помощью фотометрии изучал влияние Актовегина на концентрацию АТФ в головном мозге в течение 4 часов. Ему удалось показать, что Актовегин обладает способностью повышать содержание АТФ в тканях (неопубликованные данные). Эти данные стали одним из первых наблюдений, показавших прямое влияние Актовегина на метаболизм головного мозга. Однако от повышения потребления кислорода и метаболизма выигрывает не только головной мозг, но и миокард. P.H. Chanh и соавт. [24, 25] изучали влияние Актовегина на дыхание, обмен веществ и системную гемодинамику при экспериментальной гипоксии, описали существенное повышение потребления кислорода и стимуляцию работы сердца.
Таким образом, Актовегин обладает ИПД и стимулирует клеточный метаболизм, а также повышает потребление кислорода и выработку энергии. Эти эффекты были описаны в различных органах и тканях, что подтверждает представление об Актовегине как о стимуляторе, поддерживающем работу тканей, нуждающихся в поступлении энергии. Поэтому представляется интересным выяснить, может ли восполнение запасов энергии и кислорода в тканях усилить также рост и репликацию клеток. Эта гипотеза изучалась в исследованиях влияния Актовегина на заживление ран.
Влияние препарата на заживление ран и радиационные повреждения
Влияние Актовегина на заживление ран наблюдалось уже на ранних этапах изучения гемодиализата. J. Neinhardt [26] при экспериментальном изучении заживления ран обнаружил, что при лечении Актовегином оно наступало примерно на 2 дня раньше по сравнению с контролем. В другой серии экспериментов H. Mochida и соавт. [27] исследовали влияние Актовегина на силу натяжения надрезанных мышц брюшной стенки животных и пришли к выводу, что Актовегин достоверно ускоряет заживление ран. Это предположение получило подтверждение в опытах D. Schonwald и соавт. in vitro на эндотелиальных клетках сердца морских свинок [28], обнаруживших синергизм между репаративным действием Актовегина и различных ростовых факторов.
Заживление ран существенно зависит от способности отдельных клеток к миграции в зоны повреждения и репликации в этих местах. В связи с этим было предпринято несколько исследований, изучавших способность Актовегина стимулировать миграцию культивируемых клеток. H.G. Miltenburger и соавт. [29] изучали воздействие Актовегина на функцию фибробластов и кератиноцитов и выяснили, что Актовегин высокодостоверно влияет на миграцию клеток, причем его действие усиливается при добавлении трансформирующего фактора роста β. Более того, присутствие Актовегина отчетливо усиливает рост кератиноцитов, а стало быть, и способность тканей восстанавливать нарушенную целостность.
В опытах in vitro подверглись изучению не только трофические свойства препарата и его способность усиливать миграцию клеток, но и функциональная целостность и активность иммунных клеток, усиливающих перестройку тканей, а в результате – заживление ран. Таким образом, Актовегин должен обладать способностью стимулировать иммунокомпетентные клетки. В нескольких исследованиях эти свойства Актовегина изучались в опытах in vitro. Большую роль в воспалительных процессах играют макрофаги; Актовегин оказывает существенное влияние на моноциты, культивируемые in vitro в присутствии сыворотки человека. P. Spessotto и соавт. [30] выделяли моноциты из лейкоконцентрата и исследовали с помощью светового микроскопа плотность и морфологию клеток в монослойных культурах, а также оценивали содержание белка. Плотность клеток и содержание белка повышались при всех изучавшихся концентрациях Актовегина, который мог частично заменить человеческую сыворотку в отношении выживания и дифференцировки моноцитов в культуре.
Радиационные повреждения клеток и тканей считаются важнейшим тестом, в котором проверяются заживляющие и поддерживающие свойства различных фармакологически активных веществ. Действие Актовегина изучалось при тотальном облучении экспериментальных животных, причем некоторые исследования доказали его эффективность. В то же время протоколы этих исследований не всегда совпадали. Тем не менее положительное влияние Актовегина прослеживается в большинстве исследований. Многие наблюдения указывают на возможное радиозащитное действие Актовегина. D. Bauer и A. Locker [31] изучали влияние Актовегина на выживаемость мышей после облучения в летальных дозах. Применение Актовегина вызывало дозозависимое повышение их выживаемости через 30 дней после облучения. В контрольной группе к этому сроку живых животных практически не осталось. G. Barth и соавт. [32] изучали выраженность лучевых повреждений в зависимости от времени инъекции Актовегина. Оптимальным сроком оказались 3 часа после облучения. Профилактическое применение Актовегина в течение 6 суток перед облучением профилактическим действием не обладало. В аналогичном исследовании S.K. Basu и соавт. [33] изучали радиозащитные свойства Актовегина у взрослых крыс, в то время как контрольные животные погибали в первые 30 суток. Среди крыс, получивших Актовегин за час до облучения, выживаемость была, как и в вышеописанном исследовании D. Bauer и A. Locker [31], достоверно выше, что подтверждало их результаты. Напротив, S. Tamou и K.R. Trott [34] при изучении лучевых язв в прямой кишке крыс не нашли различий у животных, получавших Актовегин, и контрольной группой.
Таким образом, представлялось заманчивым исследовать влияние Актовегина на лучевые повреждения in vitro. C.P. Sigdestad и соавт. [35] попытались понять, какие внутриклеточные события происходят при добавлении Актовегина к облученным клеткам в культуре. Авторы не обнаружили никакого его влияния на выживаемость облученных клеток in vitro; тем не менее они выяснили, что после обработки Актовегином в клетках наблюдалось гораздо меньше одноцепочечных разрывов ДНК по сравнению с контролем. Этот факт также подтверждает ранее наблюдавшиеся эффекты, указывающие на положительное влияние Актовегина на выживаемость клеток уже на уровне ядра.
В согласии с описанными выше результатами находится недавно проведенное двойное слепое многоцентровое рандомизированное контролируемое клиническое исследование по изучению эффективности и безопасности Актовегина для больных сахарным диабетом 2 типа с клинически значимой диабетической полиневропатией [36]. Лечение привело к значительному ослаблению нарушений чувствительности и снижению порога вибрационной чувствительности с отчетливой тенденцией к достоверности различий по сравнению с группой плацебо.
Расстройства кровообращения
V.R. Wolff [37] провел биохимический анализ печени крыс через 60 минут после развития экспериментального геморрагического шока. Вызываемые Актовегином изменения в метаболитном составе печеночной ткани сравнивались с таковым после введения плацебо. После анализа полученных данных автор выдвинул предположение об активации Актовегином оксилительных процессов в клетках в соответствии с вышеперечисленными данными. Поскольку гиперхолестеринемия играет важную роль в патогенезе тромбозов и эмболий, P. Giarola [38] задался вопросом: способен ли Актовегин влиять на уровень липидов плазмы кроликов с экспериментальной гиперхолестеринемией? Авторы сообщили о положительном влиянии Актовегина на риск тромбозов и эмболий. В согласии с этими опытами P.H. Chahn и соавт. [24] сравнивали у находившихся под наркозом собак дыхание, обмен веществ и системную гемодинамику в присутствии Актовегина и без него. Был сделан вывод, что Актовегин способен напрямую повышать сердечный выброс и улучшать работоспособность при разных патофизиологических состояниях. Аналогичным образом E. Somogyi [39] попытался изучить эффекты Актовегина на уровне кардиомиоцитов в условиях периодической экспериментальной гипоксии, достигаемой при перекрытии аортокоронарного шунта. Актовегин позволял успешно предотвращать появление морфологических и биохимических нарушений. Авторы сделали вывод, что Актовегин защищает миокард от тяжелых гипоксических повреждений. Эти данные были полностью подтверждены K. Eichler и R. Volker [40], которые оценивали in vitro (в культурах сердечной мышцы куриного эмбриона) при экспериментальной сердечной недостаточности: способно ли добавление Актовегина ее компенсировать или поспособствовать активации и регенерации миокарда? Более того, добавление Актовегина к этим культурам увеличивало промежуток времени до появления первых признаков сердечной недостаточности. Авторы сочли этот эффект следствием прямой стимуляции Актовегином метаболизма клеток.
Действие на центральную нервную систему
Помня о вышеописанных разнообразных эффектах, оказываемых Актовегином на различные органы и системы, можно ожидать и его быстрого благоприятного воздействия на центральную нервную систему (ЦНС). Действительно, некоторые наблюдения, сделанные в опытах на животных и нервной ткани, позволяют экстраполировать достигнутые на соматических клетках эффекты и на них.
Что касается метаболизма клеток ЦНС, G. Lanner и G. Argyropoulos [41] провели серию электроэнцефалографических экспериментов на кроликах с искусственной ишемией головного мозга. Они пришли к выводу, что средства, способные, подобно Актовегину, повышать поступление и утилизацию глюкозы клетками, должны стимулировать поврежденную мозговую ткань. Авторы вводили Актовегин внутримышечно в течение 3 дней, анестезировали кроликов и начинали эксперимент с перевязывания кровоснабжающих мозг артерий, что вызывало острую ишемию. Опытной группе в отличие от контрольной в сонную артерию вводили Актовегин. Результаты экспериментов отчетливо показали, что Актовегин по сравнению с контрольной группой достоверно удлиняет промежуток времени, в течение которого возможно восстановление головного мозга. Это наблюдение согласуется с данными сообщения G. Kruger и G. Quadbeck [42], которые вводили препарат крысам в условиях гипоксии и обнаружили, что наибольший эффект достигается при его сочетании с глюкозой. По мнению авторов, этот результат связан со способностью Актовегина усиливать поступление глюкозы в головной мозг.
С учетом мощной системы саморегуляции сосудистого русла в ЦНС этот эффект Актовегина тем более примечателен, что он подводит к мысли о прямом стимулирующем действии на клеточный метаболизм поврежденной нервной ткани, хотя прямого влияния на мозговой кровоток не наблюдается. Это также вытекает из ранних экспериментов G. Quadbeck и соавт. [43], которые показали повышенный захват ЦНС меченой по 14C глюкозы под действием Актовегина. Повышенное содержание глюкозы в ткани мозга не было при этом результатом ее недостаточной утилизации, т. к. при этом возрастала продукция [14C]CO2. Исследование S. Hoyer и K. Betz [44], в котором изучалась ишемия головного мозга в целом, подтвердило описанные явления. Авторы изучали развившуюся с течением времени нормализацию метаболических нарушений (уровней глюкозы, лактата, креатинфосфата и АТФ) у 2-летних крыс. После перенесенной тотальной ишемии головного мозга эти показатели сравнительно быстро возвращались к исходным цифрам. Однако через 48 и 72 часа после начала реперфузии авторы отметили продолжительное нарушение энергетического баланса в коре головного мозга и гиппокампе. Применение Актовегина успешно препятствовало этому повреждению мозга. Эти результаты были также подтверждены наблюдениями над крысами с вызванным каиновой кислотой повреждением мозга: применение Актовегина снижало летальность крыс от эпилептического статуса [45].
Все эти результаты подчеркивают эффективность Актовегина при повреждениях мозга, например при ишемии, когда абсолютно необходима поддержка клеточного метаболизма. Таким образом, Актовегин помогает при постишемических расстройствах и обеспечивает выживание нейронов в критических ситуациях.
Эффекты, наблюдавшиеся в опытах на различных животных, были показаны также и в ряде клинических испытаний: Актовегин изучался при гипоксии в рамках двойного слепого перекрестного клинического испытания [46]. Авторы записывали потенциалы действия, вызванные зрительными стимулами, а также электроретинограммы у пробандов, получавших Актовегин или плацебо в условиях гипоксии (концентрация кислорода во вдыхаемом воздухе 10,5 %), соответствующей пребыванию на высоте 5500 м над уровнем моря. Дозозависимые изменения обоих оцениваемых показателей наблюдались только после введений Актовегина. В двойном слепом перекрестном контролируемом клиническом испытании эти сообщения получили дополнительное подтверждение [47, 48], позволяющее использовать Актовегин пожилыми больными.
В недавно закончившемся исследовании in vitro эти клинические данные были подтверждены следующими результатами: Актовегин оказывал дозозависимое защитное действие в отношении первичных нейронов крыс; результаты позволили предположить возможную роль Актовегина в защите нейронов от апоптоза и снижении оксидативного стресса (Elmlinger, Bobrova, Kriebel, Movsesyan, Husun, McCracken; данные приняты к публикации).
Заключение
Актовегин доказал свою клиническую эффективность в ряде лабораторных работ, включая как опыты на лабораторных животных, так и in vitro. Его прямое влияние на клеточный метаболизм связывают с ИПД на транспорт глюкозы в клетки. В основе действия Актовегина скорее всего лежат IPO, которые делают гемодиализат телячьей крови препаратом выбора, особенно в эру биологической терапии. С патофизиологической точки зрения не вызывает сомнений, что обладающий антигипоксантным и антиоксидантным действиями Актовегин может широко применяться при неврологических заболеваниях центральной и периферической нервной системы, в патогенезе которых играют роль гипоксия, ишемия и оксидативный стресс. Препарат может использоваться при сосудистых заболеваниях головного мозга, при когнитивных нарушениях, обусловленных сосудистыми или сосудисто-дегенеративными факторами. Заболевания периферической нервной системы, например ишемические невропатии, тоннельные и радикулярные синдромы, в генезе которых сосудистый фактор играет важную роль, также являются возможной целью для применения Актовегина.
Литература
1. Bachmann W, Forster H, Mehnert H. Experimental studies in animals on the effect of a proteinfree blood extract on the metabolism of glucose. Arzneimittel-Forschung/Drug Research 1968;18:1023–27.
2. Parade D, Biro G, Ketti H, et al. Studies on the insulinlike action of a lowmolecular-weight blood extract on the glucose metabolism of isolated adipose tissue of the rat in vitro. Arzneimittel-Forschung/Drug Research 1968;18:1019–21.
3. Saltiel AR, Cuatrecasas P. Insulin stimulates the generation from hepatic plasma membranes of modulators derived from an inositol glycolipid. Proc NatlAcad Sci USA 1986;83:5793–97.
4. Fox JA, Soliz NM, Saltiel AR. Purification of a phosphatidylinositolglycan-specific phospholipase C from liver plasma membranes: a possible target of insulin action. Proc Natl Acad Sci USA1987;84:2663–67.
5. Saltiel AR, Sorbara-Cazan LR. Inositol glycan mimics the action of insulin on glucose utilization in rat adipocytes. Biochem Biophys Res Commun1987;149:1084–92.
6. Mato JM, Kelly KL, Abler A, et al. Identification of a novel insulinsensitive glycophospholipid from H35 hepatoma cells. J Biol Chem 1987;262:2131–37.
7. Kellerer M, Machicao F, Berti L, et al. Inositol phospho-oligosaccharides from rat fibroblasts and adipocytes stimulate 3-O-methylglucose transport. Biochem J 1993;295:699–704.
8. Bachmann H. Wirkung von Actihaemyl auf den Kohlenhydratstoffwechsel–Untersuchungen in vivo; Dissertation, Medizinische Poliklinik der Universitat Munchen, 1968.
9. Obermaier-Kusser B, Muhlbacher C, Mushack J, et al. Further evidence for a two-step model of glucose-transport regulation. Inositol phosphateoligosaccharides regulate glucose-carrier activity. Biochem J, 1989;261:699–705.
10. Mohnike G, Lippmann HG, Dieckmann I, et al. Zur Wirkung eines Extraktes aus Kalberblut im Stoffwechsel der Glucose. Arzneimittel-Forschung/Drug Research 1968;18:1021.
11. Machicao F, Muhlbacher Ch, Haring HU. Inositol phospho-ooligosaccharides from a dialysate (Actovegin) obtained from blood mimic the effect on lipogenesis glucose transport and lipolysis in rat adipocytes. Aktuelle Endokrinologie undStoffwechsel, 1989;10:111.
12. Machicao F, Sixt B, Seffer E, et al. Adipocytes release inositol phosphate oligosaccharides with insulin like activity similarly as found in hemodialysate. IV International Symposium on Insulin Receptor and Insulin Action, Verona, Italy 1990:124.
13. Machicao F, Mushack J, Seffer E, et al. Mannose, glucosamine and inositol monophosphate inhibit the effects of insulin on lipogenesis. Further evidence for a role for inositol phosphate-oligosaccharides in insulin action. Biochem J1990;266:909–16.
14. Suzuki S, Sugawara K, Satoh Y, et al. Insulin stimulates the generation of two putative insulin mediators, inositol-glycan and diacylglycerol in BC3H-1 myocytes. J Biol Chem 1991;266:8115–21.
15. Jager KH, Leybold K, Mittenzwei H, et al. The promotional of cell respiration by a blood extract. Arzneimittel-Forschung/Drug Research, 1965;15:750–54.
16. de Groot H, Brecht M, Machicao F. Evidence for a factor protective against hypoxic liver parenchymal cell injury in a protein-free blood extract. Res Commun Chem Pathol Pharmacol 1990; 68:125–28.
17. Brecht M, de Groot H. Protection from hypoxic injury in cultured hepatocytes by glycine, alanine and serine. Amino Acids 1994;6:25–35.
18. Schafer G. Untersuchungsbefund (Report) Wirkung von Actovegin bzw Placebo auf die Sauerstoffaufnahme isolierter Leberparenchym Zellen. Internal Company Report, Institut fur Klinische Biochemie, Medizinische Hochschule Hannover, 1977.
19. Reichel H, Weiss C, Leichtweiss HP. The effects of a blood extract on the oxygen uptake of isolated artificially perfused kidneys and skeletal muscles in rats. Arzneimittel-Forschung/Drug Research1965;15:756–57.
20. Kuninaka T, Senga Y, Senga H, et al. Nature of enhanced mitochondrial oxidative metabolism by a calf blood extract. J Cell Physiol 1991; 146:148–55.
21. Schwabe K. Experimentelle Untersuchungen mit einem eiweiβfreien Extrakt aus Vollblut von Kalbern mit hoher RES-Aktivitat. Arzneimittel-Forschung/Drug Research 1966;16:364–70.
22. Pichotka J, Jager KH, Pape J, et al. Wirkung eines Blutextraktes auf den Stoffwechsel einfacher Systeme. Arzneimittel-Forschung/Drug Research 1965;15:754.
23. Rammler L. Actihaemyl/ATP-Konzentrationen in Meerschweinchen-Gerhirnhomogenaten. Internal Company Report, Pharmakologische Abteilung Hormon-Chemie Munchen, 1974.
24. Chanh PH, Chanh AP, Basile JP, et al. Cardiovascular activity of a deproteinized blood extract. Arzneimittel-Forschung/Drug Research1980;30:1874–77.
25. Chanh PH, Chanh AP, van Thoai MN, et al. Effects of deproteinized blood extract on respiratory and hemodynamic modifications induced by hypoxia in the anaesthetized animal. Arzneimittel-Forschung/Drug Research 1980;30:1508–10.
26. Neinhardt J. Extra- und intraorale Wundheilung. Dissertation/PhD Thesis, Universitats- und Poliklinik fur Zahn-, Mund-, und Kieferkrankheiten Wurzburg, 1967.
27. Mochida H, Kikuchi T, Tanaka H, et al. Influence of Actovegin containing infusion solutions on wound healing and function of the intestinal tract in rats. Pharmacology and Therapeutics 1989;17:789–97.
28. Schonwald D, Sixt B, Machicao F, et al. Enhanced proliferation of coronary endothelial cells in response to growth factors is synergized by hemodialysate compounds in vitro. Res Exp Med (Berl) 1991;191:259–72.
29. Miltenburger HG, BaschongW, Horner V, et al. Cooperative effects in vitro on fibroblast and keratinocyte functions related to wound healing by transforming growth factor-beta and a low molecular weight fraction from hemolyzed blood. Arzneimittel-Forschung/Drug Research1994;44:872–76.
30. Spessotto P, Dri P, BaschongW, et al. Effect of a protein-free dialysate from calf blood on human monocyte differentiation in vitro. Arzneimittel-Forschung/Drug Research 1993;43:747–51.
31. Bauer D, Locker A. The radioprotective effect of solcoseryl. Experientia 1974;30:643.
32. Barth G, Graebner HF, Lotz H. Therapy of lethal radiation injury with Actihaemyin an animal experiment. Strahlentherapie 1969;138:714–23.
33. Basu SK, Srinivasan MN, Chuttani K, et al. Evaluation of some radioprotectors by the survival study of rats exposed to lethal dose of whole body gamma radiation. J Radiat Res (Tokio),1985;26:395–403.
34. Tamou S, Trott KR. Modification of late radiation damage in the rectum of rats by deproteinized calf blood serum (ActoHorm) and pentoxifylline (PTX). Strahlenther Onkologie 1994;170:415–20.
35. Sigdestad CP, Doak KW, Grdina DJ. Differential protection of radiation-induced DNA single-strand breaks and cell survival by solcoseryl. Experientia 1988;44:707–8.
36. Ziegler D, Movsesyan L, Mankovsky B, et al. Treatment of symptomatic polyneuropathy with actovegin in type 2 diabetic patients. Diabetes Care2009;32:1479–84.
37. Wolff VR. Effect of a protein-free hemoderivative on recovering capability of rat liver following 60 minutes of hemorrhagic shock. Arzneimittel-Forschung/Drug Research 1975;25:388–92.
38. Giarola P. Effects of blood extract on plasma lipids, blood coagulation, fibrinolysis and platelet aggregation in experimental hypercholesterolemia of rabbits. Arzneimittel-Forschung/Drug Research 1974;24:925–28.
39. Somogyi E, Sotonyi P, Nemes A. The effects of a deproteinized blood extract on the myocardial changes developing during experimentally induced intermittent hypoxia. Arzneimittel-Forschung/Drug Research 1979;29:1376–81.
40. Eichler K, Volker R. Cardiotonic effect of blood extracts on myocardial tissue; in Cardiotonische Wirkung von Blutextrakten auf das Herzmuskelgewebe. Arzneimittel-Forschung/Drug Research 1971;21:1750–52.
41. Lanner G, Argyropoulos G. Pharmacological effect of Solcoseryl on the metabolism of the brain. Animal experiments and clinical research. Wien Med Wochenschrift 1975;125:681–85.
42. Kruger G, Quadbeck G. The electroencephalogram of the rat in oxygen deficiency as an indicator of drug effects on cerebral metabolism. Arzneimittel-Forschung/Drug Research 1972;22:451–56.
43. Quadbeck G, Claver B, Minet G. The influence of stimulants and antidepressants on the EEG amplitude in the rat. Arzneimittelforschung 1964;14(5).
44. Hoyer S, Betz K. Elimination of the delayed postischemic energy deficit in cerebral cortex and hippocampus of aged rats with a dried, deproteinized blood extract (Actovegin). Arch Gerontol Geriatr,1989;9:181–92.
45. Mintz M, Knowlton B, Myslobodsky MS. Effect of nootropic Solcoseryl on kainic acid-induced excitotoxic brain injury. Pharmacol Biochem Behav 1993;45:55–8.
46. Schaffler K, Wauschkuhn CH, Hauser B. Study to evaluate the encephalotropic potency of a hemodialysate. Controlled study using electroretinography and visual evoked potentials under hypoxic conditions in human volunteers (preliminary communication). Arzneimittelforschung1991;41:699–704.
47. Saletu B, Grunberger J, Linzmayer L, et al. EEG brain mapping and psychometry in age-associated memory impairment after acute and 2-week infusions with the hemoderivative Actovegin: doubleblind, placebo-controlled trials. Neuropsychobiology1990;24:135–48.
48. Semlitsch HV, Anderer P, Saletu B, et al. Topographic mapping of cognitive event-related potentials in a double-blind, placebo-controlled study with the hemoderivative Actovegin in age-associated memory impairment. Neuropsychobiology1990;24:49–56.
Об авторах / Для корреспонденции
1 Center for Physiology and Pharmacology, Institute of pharmacology, Medical University of Vienna, Vienna, Austria
2 Department of Clinical Pharmacology, Medical University of Vienna, Vienna, Austria
3 Nycomed GmbH, Biomarker Development, Konstanz, Germany