Алд диагноз у беременных что это
Алд диагноз у беременных что это
Адренолейкодистрофия (АЛД) представляет собой группу дегенеративных заболеваний ЦНС, которые часто ассоциируются с надпочечниковой недостаточностью и передаются по Х-сцепленному рецессивному типу. Классическая адренолейкодистрофия (АЛД) дебютирует в возрасте 5-15 лет в виде снижения школьной успеваемости, поведенческих изменений и расстройства походки.
Адренолейкодистрофия (АЛД) вызвана мутацией в гене ABCD 1 на хромосоме Xq28, кодирующем синтез пероксисомного переносчика, который участвует в транспорте жирных кислот с очень длинной цепью внутрь пероксисомы. Заболеваемость адренолейкодистрофией (АЛД) составляет примерно 1:20 000 мальчиков. На ранних стадиях характерны генерализованные судороги.
Признаки поражения пирамидных путей включают спастический тетрапарез и контрактуры, появляется атаксия, выражены нарушения глотания вследствие псевдобульбарного паралича — эти симптомы преобладают в конечных стадиях заболевания.
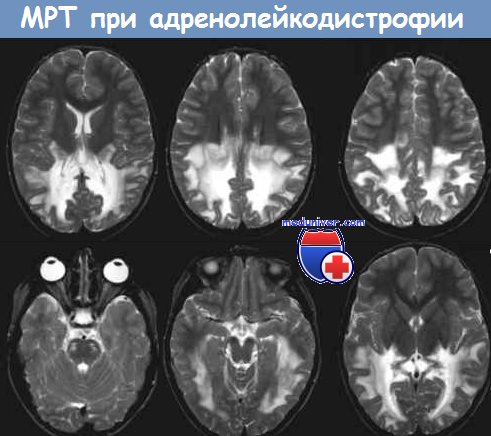
Снижение функции надпочечников наблюдается примерно в 50 % случаях; надпочечниковая недостаточность с патологической пигментацией кожи (смуглый, коричневатый оттенок кожи без воздействия солнца) может предшествовать дебюту неврологической симптоматики. На КТ и МРТ перивентрикулярная демиелинизация, начинаясь с задних отделов, постепенно распространяется в белом веществе в передние отделы больших полушарий.
Адреномиелоневропатия начинается с медленно прогрессирующего спастического парапареза, недержания мочи и импотенции на 3-4-м десятилетии жизни, хотя признаки надпочечниковой недостаточности возможны с детского возраста. Описаны случаи типичной адренолейкодистрофии (АЛД) в семьях, в которых у пробанда была диагностирована адреномиелоневропатия.
Одна из сложностей диагностики Х-адренолейкодистрофии (АЛД) состоит в том, что у пациентов из одной семьи нередко наблюдается различное клиническое течение заболевания. Например, у мальчика диагностирована адренолейкодистрофия (АЛД) с тяжелым течением и летальным исходом в возрасте 10 лет, у брата этого пациента отмечалась адреномиелоневропатия с поздним дебютом, у третьего брата симптомы болезни отсутствовали. Генетическое консультирование в семьях, в которых выявлены мальчики на пресимптомной стадии заболевания, затруднено, так как отсутствуют надежные методы прогнозирования клинического течения заболевания.
Неонатальная адренолейкодистрофия (АЛД) характеризуется выраженной гипотонией, тяжелой задержкой психомоторного развития и ранним дебютом судорог. Тип наследования — аутосомно-рецессивный. Отсутствие зрительной фиксации обусловлено атрофией зрительных нервов. Тесты, определяющие функцию надпочечников, без нарушений, однако при посмертном патоморфологическом исследовании находят атрофию надпочечников. Коррекция надпочечниковой недостаточности для предотвращения прогрессирования неврологических нарушений неэффективна.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «неврология»
Пероксисомные болезни: трудности диагностики у ребенка в раннем периоде заболевания
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Ключевые слова: пероксисомные болезни, Х-сцепленная адренолейкодистрофия, ген ABCD1, очень длинноцепочечные жирные кислоты.
Для цитирования: Шишкина Е.В., Бархатов М.В., Денисова Г.В. и др. Пероксисомные болезни: трудности диагностики у ребенка в раннем периоде заболевания. РМЖ. Медицинское обозрение. 2019;3(8):48-51.
1 V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
2 Krasnoyarsk Territorial Clinical Center of Protection for Motherhood and Childhood
3 Krasnoyarsk Regional Children Clinical Hospital No. 1
Peroxisomal disorders belonging to a group of hereditary metabolic disorders vary in their clinical course and manifestations and are often fatal. These disorders manifest at the age of 2 to 10 years and can lead to death within the first two years. If treatment (i.e., bone marrow transplantation) is successful, life can be prolonged to several decades. Currently, there are three classes of peroxisomal disorders. Among them, X-linked adrenoleukodystrophy is characterized by the dramatic course. This rare X-linked recessive hereditary disorder is characterized by the progressive course and affects both central and peripheral nervous system and adrenal glands. X-linked disorders are observed primarily in male patients (since they have only one X-chromosome). Typically, a healthy man and a woman who is a carrier have a son with X-linked adrenoleukodystrophy. A c hance of having X-linked adrenoleukodystrophy in sons as well as a chance of being a carrier in daughters is 50%. This paper describes in detail the development of a 3-year old boy with X-linked adrenoleukodystrophy. Non-typical disease manifestation has made the diagnosis challenging. The diagnosis was verified by characteristic markers only, i.e., elevated concentrations of very long-chain fatty acids and mutations in the АBCD1 gene.
Keywords: peroxisomal disorders, X-linked adrenoleukodystrophy, АBCD1 gene, very long-chain fatty acids.
For citation: Shishkina E.V., Barkhatov M.V., Denisova G.V. et al. Peroxisomal disorders: challenging diagnosis in a child with early disease. RMJ. Medical Review. 2019;8:48–51.
В статье описывается клиническое наблюдение за развитием и течением Х-сцепленной адренолейкодистрофии у трехлетнего мальчика.
Актуальность
Наследственные метаболические заболевания (НМЗ) в педиатрической практике — это огромный класс моногенных наследственных заболеваний, обусловленных мутациями генов, кодирующих ферменты, транспортные или сигнальные белки. НМЗ на сегодняшний день являются одной из ведущих проблем в клинике, они насчитывают более 500 нозологических форм, и это число постоянно увеличивается. Ранняя диагностика НМЗ дает врачу возможность применять эффективные методы лечения, которые малорезультативны или безуспешны на более поздних стадиях патологического процесса. Кроме того, правильный окончательный диагноз необходим для проведения грамотного медико-генетического консультирования семьи. Одну из групп НМЗ составляют пероксисомные заболевания.
Цель настоящей работы — осветить проблемы, с которыми сталкивается практический врач при ранней диагностике пероксисомных заболеваний.
Пероксисомные болезни возникают в результате нарушения функции пероксисом. Согласно современной классификации их подразделяют на 3 большие группы [1]:
С нарушением биогенеза пероксисом (их полное отсутствие или нарушение их функциональной активности): синдром Цельвегера, неонатальная адренолейкодистрофия, инфантильная болезнь Рефсума, точечная хондродисплазия тазобедренного сустава; синдром, подобный синдрому Цельвегера).
С дефицитом одного пероксисомного фермента, включающим дефекты бета-окисления (псевдоадренолейкодистрофия новорожденных, X-сцепленная адренолейкодистрофия, псевдосиндром Цельвегера, дефицит бифункционального фермента).
С дефицитом одного пероксисомного фермента без дефекта бета-окисления (болезнь Рефсума, псевдохондродисплазия тазобедренного сустава, ди-(три-)гидрохолестановая ацидемия; мевалоновая ацидурия).
Х-сцепленная адренолейкодистрофия
Х-сцепленная адренолейкодистрофия (Х-АЛД) является одной из пероксисомных болезней. По данным различных источников, заболеваемость лиц мужского пола составляет 1:21 000, а в целом заболеваемость мужчин и женщин оценивается как 1:16 800 (США) и 1:22 000 (Франция) [2]. В среднем у новорожденных Х-АЛД встречается с частотой 1 на 17 000 случаев [3–5]. Согласно Международной классификации болезней 10-го пересмотра это заболевание имеет шифр «Е71.33» и характеризуется разрушением жирового покрытия (миелина) нервов в головном и спинном мозге и повреждением наружного слоя надпочечников (коры надпочечников), что приводит к дефициту некоторых гормонов (надпочечниковая недостаточность). Надпочечниковая недостаточность может вызвать слабость, потерю веса, изменения кожи, рвоту и кому. На основании клинических проявлений, возраста дебюта, скорости нарастания неврологических симптомов заболевание подразделяется на 7 фенотипов у мужчин (детская, юношеская и взрослая церебральные, адреномиелоневропатия, оливопонтомозжечковая, изолированная надпочечниковая недостаточность, асимптомная) и 5 фенотипов у женщин (бессимптомная, легкая миелопатия, от умеренной до тяжелой миелонейропатия с вовлечением надпочечников или с церебральным участием) [2]. Церебральная форма является наиболее тяжелой и частой (встречается у 35–40% лиц мужского пола в возрасте до 20 лет), с манифестацией чаще после 4-летнего возраста жизни (в среднем в 7 лет) и приводит к летальному исходу в 95% случаев в течение нескольких лет от начала клинических проявлений [6].
Причинами данного заболевания являются мутации в гене ABCD1, локализованном на 28 локусе Х-хромосомы. Ген ABCD1 кодирует белок — мембранный переносчик, который участвует в транспортировке некоторых жиров в пероксисомы [7]. Мутации в гене ABCD1 соответственно вызывают дефицит транспортера, что приводит к аномальному повышению уровней некоторых жиров очень длинноцепочечных жирных кислот (ОДЦЖК) в организме. Накопление этих жиров и ОДЦЖК может быть токсичным для коры надпочечников и миелина. Исследования показывают, что накопление жиров вызывает воспалительную реакцию в мозге и, соответственно, разрушение миелина.
Поскольку мужчины имеют только одну Х-хромосому, мутация в гене ABCD1 проявляется у них выраженной клинической картиной. У женщин-носителей, как правило, не наблюдаются наиболее тяжелые проявления заболевания и манифестировать болезнь у них может в более позднем возрасте [2].
Особенности течения и диагностики Х-АЛД
Современные знания о патогенезе болезни пока не могут объяснить различия в возникновении фенотипических проявлений Х-АЛД. Несмотря на то, что при этом заболевании избыток ОДЦЖК обнаруживается практически во всех тканях организма, симптоматика проявляется в основном со стороны нервной системы и надпочечников [2]. Вместе с тем нормализация концентрации ОДЦЖК при лечении заболевания не влияет на прогрессирование болезни и фатальный исход [8].
Трудности диагностики заболевания связаны с многообразием клинических проявлений. Так, детская церебральная форма длительное время может проявляться лишь эмоциональной лабильностью, синдромом гиперактивности и дефицитом внимания у мальчиков [8]. По истечении короткого времени болезнь прогрессирует, нарастает церебральная демиелинизация с выраженной картиной воспаления в белом веществе мозга, что заканчивается каскадной нейродегенерацией и летальным исходом до пубертатного периода [2, 9]. При подозрении на Х-АЛД у мальчиков и мужчин инициальная диагностика начинается с тандемной масс-спектрометрии на плазменную концентрацию ОДЦЖК. Эта методика подтверждает заболевание на 100% у лиц мужского пола, но у женщин в 15–20% случаев результаты могут быть ложноотрицательными [10]. Следующий этап диагностики — секвенирование экзома на наличие мутации гена ABCD1. На начало 2017 г. известно более 750 мутаций в этом гене. В обязательный алгоритм диагностики пероксисомных болезней входит проведение магнитно-резонансной томографии (МРТ) головного мозга. В 1994 г. нейрорадиолог Daniel J. Loes предложил шкалу оценки степени тяжести Х-АЛД с диапазоном значений от 0 до 34, основанную на местоположении и выраженности визуализируемых атрофических изменений в головном мозге, позволяющую оценить степень прогрессирования заболевания и эффективность терапии [11].
Вопросы терапии Х-АЛД
Вопрос о превентивной терапии Х-АЛД стоит особенно остро, т. к. диагноз можно поставить за многие годы до появления клинических симптомов заболевания. Поиски эффективного лечения продолжаются. В настоящее время в экспериментах на культуре кожных фибробластов удалось получить снижение синтеза дексадеканоевой кислоты при добавлении олеиновой кислоты. На этом основании прежде для лечения больных с Х-АЛД использовали глицеротриолеатное масло, при применении которого отмечалось снижение уровня ОДЦЖК на 30–40%. Следующим этапом стало открытие масла Лоренцо, которое синтезировали родители мальчика Lorenzo Odone, больного Х-АЛД. Использование масла Лоренцо, содержащего смесь ненасыщенных жирных кислот (глицерин, триолеат и глицерил трирукат в соотношении 4:1) позволяет нормализовать концентрацию ОДЦЖК, что, однако, не влияет на прогноз заболевания и не улучшает функцию надпочечников и нервной системы [8, 12–14]. В настоящее время основным методом лечения Х-АЛД и стандартом терапии является трансплантация костного мозга [15, 16]. Однако для эффективности этой методики процедура должна быть проведена на ранней стадии заболевания, т. е. практически сразу после рождения [17]. В противном случае трансплантация может ускорить прогрессирование болезни и увеличить степень риска тяжелых инфекционных осложнений в раннем посттрансплантационном периоде [12]. Генная терапия с экспрессией генов ABCD1 и АВСD2 (ближайшего гомолога ABCD1) при помощи векторов лентивирусов является, по всей видимости, терапией будущего, и в нескольких наблюдениях применение генной терапии было успешным и предотвратило процесс демиелинизации на 2 года [18]. Также терапией будущего может стать использование антиоксидантов, нейропротективная терапия с использованием таких препаратов, как бутираты и вальпроаты [12, 14, 18–24]. Пренатальная диагностика Х-АЛД проводится с использованием как биохимических (определение уровня ОДЦЖК), так и молекулярно-генетических методов.
Мы приводим собственный клинический опыт постановки у ребенка раннего возраста диагноза X-АЛД, т. к. уверены, что описание клинического случая пероксисомного заболевания у ребенка представляет несомненный интерес для практических врачей — неврологов и педиатров.
Клиническое наблюдение
Больной О.К., мальчик, 3 года 2 мес. Из анамнеза жизни известно, что ребенок родился от второй доношенной беременности, протекающей на фоне цитомегаловирусной инфекции (ЦМВ). При рождении был выставлен диагноз: внутриутробная ЦМВ-инфекция, генерализованная форма, с преимущественным поражением печени. Холестатический гепатит. Гипоксически-геморрагическое поражение головного мозга.
В острый период получил лечение ЦМВ-инфекции: цитотек № 5. В возрасте 2 нед. выявлена атрезия желчевыводящих путей, по поводу чего был прооперирован. Послеоперационный период протекал без осложнений.
Ребенок наблюдался в кабинете катамнеза, где отмечались нарушения в неврологическом статусе, в возрасте одного года была оформлена инвалидность с диагнозом: детский церебральный паралич, атактическая форма, сенсомоторная тугоухость.
В возрасте 2 лет и 5 мес. проведена плановая МРТ, в результате которой визуализированы: выраженная внутренняя неокклюзионная гидроцефалия; множественные, диффузно расположенные очаги и сливные зоны глиоза в белом веществе полушарий головного мозга лобных, теменных, затылочных, височных долей, а также в области колена мозолистого тела, перивентрикулярные зоны глиоза; мелкая гетеротопия серого вещества.
В 2 года 10 мес. ребенок был госпитализирован в инфекционное отделение с жалобами на повышение температуры тела до 39,5 °C, однократную рвоту и развившийся однократный тонико-клонический приступ, продолжавшийся в течение 10–15 мин. Развился правосторонний гемипарез. Клинический диагноз при выписке из стационара: шигеллез, гастроэнтероколитная тяжелая форма. Токсико-метаболическая энцефалопатия. Судорожный синдром.
Повторная госпитализация — через 1,5 мес. (3 года жизни) с жалобами на нарастающий гемипарез справа. Заключение по результатам МРТ головного мозга при госпитализации: картина структурных изменений тканей головного мозга, более вероятно дистрофического, глиального и воспалительного характера, в левой лобной области с распространением на мозолистое тело, базальные ядра слева, левую ножку мозга, левые отделы ствола головного мозга. Изменения в правой лобной области и правой гемисфере мозжечка.
Клинический и биохимический анализы крови в пределах нормы. По результатам тандемной масс-спектрометрии исключены: болезнь Нимана — Пика, болезнь Помпе, митохондриальные энцефалопатии. Выставлен клинический диагноз при выписке: подострый лейкоэнцефалит.
В 3 года 1 мес. — госпитализация в связи с повторными тонико-клоническими приступами. С учетом данных анамнеза заподозрено обострение ЦМВ-инфекции: тяжелая генерализованная форма с поражением центральной нервной системы (ЦНС) (склерозирующий панэнцефалит, внутренняя гидроцефалия) и печени (гепатит с переходом в фиброз), хроническое прогредиентное течение, фаза реактивации.
В стационаре проведены исследования: полимеразная цепная реакция ликвора, мочи, крови, слюны: ЦМВ не обнаружена; воспалительных изменений в ликворе нет, общий белок 627 мг/л.
Последняя госпитализация в КГБУЗ «Красноярский краевой клинический центр охраны материнства и детства» через 1 мес. после предыдущей выписки (3 года 2 мес. жизни ребенка) с приступом двукратной рвоты, нарушением сознания и дыхания (искусственная вентиляция легких в течение 2 сут). В клиническом анализе ликвора при поступлении: цитоз 4, белок 1416 мг/л, глюкоза 3,5 ммоль/л. В динамике через 10 дней: цитоз 3, белок 325 мг/л, лактат 1,4.
При переводе ребенка из реанимационного отделения состояние тяжелое. Реакция на осмотр резко негативная, задержка формирования высших корковых функций, речи нет, произносит отдельные звуки. Глоточный рефлекс снижен, гиперсаливация. Гипертонус по гемитипу справа, гиперрефлексия с клонусом, патологические кистевые и стопные знаки, походка гемипаретичная. Судорог не отмечалось.
Проведена МРТ головного мозга с контрастом: отмечается отрицательная динамика в сравнении с предыдущей МРТ в виде увеличения зоны дистрофических и глиальных изменений в головном мозге: в левой лобной доле с распространением на прилежащие отделы левой теменной доли, базальные структуры слева, левую ножку мозга и передние отделы моста мозга, а также через передние отделы мозолистого тела на перивентрикулярные отделы правой лобной доли, в левой гемисфере мозжечка определяются зоны неоднородно гиперинтенсивного сигнала в Т2 режиме, без четких контуров масс-эффекта на прилежащие структуры, с умеренно выраженным перифокальным отеком. Киста прозрачной перегородки. После введения контраста определяются участки повышения сигнала в области лобной доли, передних отделах мозолистого тела и в базальных структурах слева.
Проведена МРТ спинного мозга: в спинном мозге шейного и грудного отделов позвоночника, в боковых отделах определяются симметричные участки повышенного сигнала в режиме Т2 и изогипоинтенсивного сигнала в режиме Т1 с явлениями умеренного перифокального отека. Не исключается миелит или глиоматоз.
При проведении позитронно-эмиссионной томографии (ПЭТ) картина не укладывается в представление об опухолевой природе поражения суб- и супратенториальных структур головного мозга. Более вероятным является воспалительный процесс с возможным аутоиммунным компонентом и активной метаболической реакцией. На основании заключения ПЭТ диагноз «глиоматоз» снят.
Исходя из гендерной принадлежности ребенка, клинических и анамнестических особенностей, быстрого прогрессирования симптоматики, данных нейровизуализации заподозрено наличие пероксисомного заболевания. Исследование на ОДЦЖК показало повышение их концентрации, что свидетельствовало о наличии пероксисомного заболевания.
По результатам проведенного молекулярно-генетического тестирования выявлена мутация в гене ABCD1, что подтвердило диагноз Х-АЛД.
Таким образом, постановка диагноза через 8 мес. от начала проявлений первых симптомов говорит о сложности диагностики и неспецифичности клинических проявлений пероксисомных заболеваний в детской практике. Ранний дебют на фоне уже имеющихся органических нарушений со стороны ЦНС, полиморфизм клинических проявлений: обязательное поражение ЦНС (бульбарные нарушения, поражение пирамидного пути), деменция, судороги — могут клинически затруднить дифференциальную диагностику, и окончательный диагноз возможно выставить только при помощи современных методов: тандемной масс-спектрометрии, молекулярно-генетического тестирования, МРТ.
Заключение
К сожалению, в российской практической медицине пренатальная и ранняя натальная диагностика пероксисомных заболеваний на сегодня затруднительна. В нашем случае поздняя постановка диагноза не позволяет провести ребенку трансплантацию костного мозга, что утяжеляет прогноз заболевания. Эффективная терапия Х-АЛД в будущем возможна с использованием генной инженерии и новых эффективных лекарственных средств.
Только для зарегистрированных пользователей
Адренолейкодистрофия – это наследственная патология из группы пероксисомных болезней, связанная с накоплением в организме жирных кислот с очень длинной углеродной цепью. Заболеванию свойственен клинический полиморфизм – различные формы характеризуются поражением мозговой ткани и надпочечников, проявляясь сочетанием неврологических расстройств (сенсомоторных, эмоционально-когнитивных, поведенческих) и гипокортицизма. Диагностируют патологию по клиническим данным, подтверждая биохимическими, молекулярно-генетическими тестами, МРТ и КТ мозга. Комплексное лечение предполагает диету, фармакотерапию, трансплантацию гемопоэтических клеток.
МКБ-10
Общие сведения
Адренолейкодистофия (болезнь Зиммерлинга-Крейтцфельдта, Аддисона-Шильдера) была впервые описана немецкими невропатологами Эрнстом Зиммерлингом и Гансом-Герхардом Крейтцфельдтом в 1923 году. Является не настолько редким заболеванием, как считалось ранее – встречается повсеместно, превосходя по распространенности другие пероксисомные болезни. По данным различных исследований, частота данного варианта лейкодистрофии варьируется от 1:100000 до 1:15000, патология затрагивает представителей всех возрастных групп (детей, подростков, взрослых). Обычно болеют лица мужского пола, женщины являются носителями мутантного гена, но при гетерозиготном генотипе в 20% случаев симптомы обнаруживаются и у них.
Причины адренолейкодистофии
Возникновение патологии связано с мутациями гена ABCD1, занимающего терминальный участок длинного плеча X-хромосомы (локус Xq28). Он кодирует синтез трансмембранного белка-переносчика, называемого адренолейкодистофическим протеином (ALDP). Последний находится на специфических клеточных органеллах, участвующих в реакциях окисления – пероксисомах, отвечая за транспортировку и дальнейшее расщепление очень длинноцепочечных жирных кислот (ОДЦЖК).
Структурный дефект пероксисомного транспортного белка делает его функционально неспособным, что ведет к накоплению в тканях токсических соединений. Уже идентифицировано более 2600 мутаций ABCD1, связанных с заменой нуклеотидов ДНК, потерей локусов, и многие из них вызывают структурные изменения ALDP. Адренолейкодистофии развиваются при наличии в генотипе лишь одного рецессивного гена (у мужчин-гемизигот) или двух его разновидностей (у женщин-гетерозигот).
Патогенез
Из-за структурной аномалии белка-переносчика страдает транспорт ОДЦЖК внутрь пероксисом, где они должны подвергаться β-окислению. В норме насыщенные жирные кислоты с длинной цепью присутствуют в липидах нервной ткани (цереброзидах, сульфатидах), эритроцитах, но при адренолейкодистрофии их содержание может возрастать в тысячу раз. Обычные эфиры холестерина заменяются аномальными с длиной цепи в 24–30 и более атомов углерода. Когда их концентрация в оболочке нервных волокон достигает 10%, миелин дестабилизируется и разрушается.
Накопление ацил-КоА-производных жирных кислот нарушает физико-химические свойства клеточных мембран: повышается проницаемость митохондрий, возрастает концентрация цитозольного кальция. В свою очередь, это приводит к атрофии нейроэндокринной ткани надпочечников. Важным механизмом демиелинизации считают активацию нейроглиальных структур, стимуляцию воспалительных процессов с участием цитокинов (фактора некроза опухолей).
Гистологические изменения при церебральных вариантах адренолейкодистофии характеризуются резким снижением содержания миелина, периваскулярной лимфоцитарно-макрофагальной инфильтрацией. В основном демиелинизирующий процесс начинается с мозолистого тела, постепенно переходя на белое вещество затылочно-теменных областей. Реже наблюдается вовлечение лобных долей, пирамидного тракта.
Классификация
Адренолейкодистофия характеризуется выраженным фенотипическим полиморфизмом, обусловленным различиями пенетрантности и экспрессивности аномального гена. Учитывая время дебюта, основные проявления, скорость нарастания симптоматики, в современной неврологии различают несколько форм заболевания:
Симптомы адренолейкодистрофии
Клиническая картина патологии очень вариабельна, что определяется конкретным фенотипическим вариантом. Клиницистам чаще всего приходится сталкиваться с признаками церебральной формы, адреномиелонейропатией, изолированной надпочечниковой недостаточностью.
Церебральная форма
Для всех разновидностей церебральной адренолейкодистрофии характерно быстрое прогрессирование. Пик манифестации детской формы приходится на период между 5 и 10 годами жизни. У большинства пациентов нервно-психические расстройства предшествуют признакам надпочечниковой недостаточности. Характерны расстройства поведения, мышления, двигательной сферы. Дети становятся гиперактивными или аутистичными, эпизодически проявляют агрессию. Возникает дефицит внимания, прогрессирующая деменция, нарушается походка.
Ювенильная адренолейкодистрофия манифестирует в возрасте 10–21 года. По симптоматике она напоминает детскую форму. У взрослых 30–50 лет патология начинается шизофреноподобным синдромом, нарастающей деменцией. Среди церебральных симптомов присутствуют дисфагия, зрительные нарушения (скотомы). Патология может быстро прогрессировать, но описывают и так называемые хронические варианты, когда процесс на многие годы приостанавливается, а после ремиссии наблюдается внезапное ухудшение с нарастанием неврологического дефицита.
Адреномиелонейропатия
Начинается заболевание в широком возрастном диапазоне – от 12 до 50 лет (чаще между вторым и четвертым десятилетиями жизни). Во многих случаях симптомы хронического гипокортицизма предшествуют или сопутствуют неврологическим расстройствам. Иногда самым первым признаком, возникающим задолго до развертывания всей клинической картины (еще в раннем детстве), становится изолированная гиперпигментация кожи.
Начальные неврологические признаки представлены миелопатией со снижением глубокой чувствительности, нижним парапарезом. Дальнейшее развитие такой адренолейкодистрофии проявляется тетрапарезом с нарушением функции тазовых органов (мочеиспускания, дефекации, эрекции). Со временем присоединяются психические расстройства (депрессия), гипогонадизм, алопеция. Патологическое состояние характеризуется медленным течением, но неуклонно прогрессирует.
Изолированная недостаточность надпочечников
Поражение коры надпочечных желез проявляется сначала глюкокортикоидной, а затем и минералокортикоидной недостаточностью, дебютирует в различные сроки, начиная с двухлетнего возраста. Наиболее частые симптомы представлены потерей аппетита, мышечной слабостью, рвотой. Пациенты теряют в весе, страдают от абдоминальных болей, гипотонии. Кожная гиперпигментация возникает не всегда. Неврологическое исследование указывает на снижение вибрационной чувствительности, гиперрефлексию, интеллектуальные расстройства, возникающие спустя несколько лет.
Симптоматическая адренолейкодистрофия
У некоторых женщин-носителей отмечается возникновение неврологических симптомов без сопутствующих эндокринных сдвигов. Заболевание дебютирует позже, чем у мужчин со спинальным поражением – к 50–60 годам. В тяжелых случаях симптоматика схожа с церебральной формой, умеренные нарушения напоминают адреномиелонейропатию. Наиболее часто выявляют сенсорную атаксию, умеренный спастический парапарез и боли в нижних конечностях, дисфункцию органов малого таза. Недостаточность коры надпочечников возникает редко.
Осложнения
Прогрессирование церебральных форм и адреномиелонейропатии сопровождается выраженным неврологическим дефицитом с инвалидностью. Опасным осложнением гипокортицизма является острая декомпенсация с развитием аддисонического криза, проявляющегося дегидратацией, сердечно-сосудистой, почечной недостаточностью. Быстропрогрессирующие варианты без активной коррекции заканчиваются коматозным состоянием и смертью.
Диагностика
Предположить заболевание удается при внимательной оценке анамнестической информации (наличия семейных случаев, времени манифестации, характера течения), клинических данных. Но этиопатогенетические особенности адренолейкодистрофии устанавливаются при комплексном лабораторно-инструментальном исследовании. Диагностическая программа включает следующие методы:
Дифференцировать заболевание врачу-неврологу приходится со многими состояниями. Церебральные нарушения требуют исключения других лейкодистрофий, рассеянного склероза, подострого склерозирующего энцефалита. Адреномиелонейропатию следует отличать от бокового амиотрофического склероза, фуникулярного миелоза, спинальных опухолей. Дифференцировать изолированный гипокортицизм необходимо с болезнью Аддисона, синдромом Оллгрова.
Лечение адренолейкодистрофии
Консервативная терапия
Выбор обоснованной патогенетической терапии – наиболее острая проблема, стоящая перед клиницистом при лечении конкретного пациента. Поскольку диагностировать заболевание можно еще до развития клинических признаков, особое значение приобретает пресимптоматическая коррекция. При проведении терапии адренолейкодистрофии задействуют консервативные методы:
Экспериментальное лечение
Несмотря на некоторые успехи, заболевание плохо поддается лечению. Но возрастающая активность исследователей в сфере молекулярной генетики и лучшее понимание патогенеза адренолейкодистрофии поддерживают попытки разработать новые эффективные методы коррекции. Среди них особого внимания заслуживают следующие:
Прогноз и профилактика
Долгосрочный прогноз при Х-сцепленной адренолейкодистрофии зависит от конкретного фенотипа. У детей церебральная форма принимает особо тяжелое, быстропрогрессирующее течение с пятилетней выживаемостью на уровне 59%, многие умирают в течение нескольких лет после дебюта болезни. Другие формы могут не влиять на продолжительность жизни, но снижать ее качество за счет потери трудоспособности. Учитывая высокую степень полиморфизма, даже у членов одной семьи прогноз может существенно варьироваться.
Мероприятия первичной профилактики при адренолейкодистрофии предполагают медико-генетическое консультирование вероятных носителей, пренатальную диагностику (биопсию ворсин хориона, анализ амниотической жидкости). Раннее выявление биохимических изменений в крови важно для подтверждения диагноза на доклинических стадиях. В сочетании с активной патогенетической терапией, это поможет избежать прогрессирования, снижая риск дальнейшей инвалидизации.