Альдостерон что это такое у женщин если повышен
Синдром первичного идиопатического гиперальдостеронизма: клиника, диагностика, лечение на примере клинических случаев
Гиперальдостеронизм — это синдром, обусловленный гиперсекрецией альдостерона надпочечниками. Здесь речь пойдет о первичном идиопатическом гиперальдостеронизме (ПИГА), который не зависит от регуляции со стороны ренин-ангиотензиновой системы, не связан с г
Гиперальдостеронизм — это синдром, обусловленный гиперсекрецией альдостерона надпочечниками. Здесь речь пойдет о первичном идиопатическом гиперальдостеронизме (ПИГА), который не зависит от регуляции со стороны ренин-ангиотензиновой системы, не связан с гормонально-активной опухолью альдостеромой. ПИГА обусловлен различными патогенетическими механизмами и морфологическими изменениями в обоих надпочечниках.
Впервые Foley в 1955 г. предположил, что нарушение водно-электролитного баланса может быть обусловлено гормональными изменениями на фоне внутричерепной гипертензии. Это мнение было подтверждено другими авторами (M. B. A. Oldstone, 1966; M. Greer, 1964; R. D. Gordone, 1995). Однако выявить причинно-следственную связь этих нарушений не удалось.
В дальнейшем, в ходе изучения патогенеза так называемой эссенциальной гипертонии, у ряда больных был диагностирован гипоренинемический гиперальдостеронизм, а у части этих пациентов наблюдалась гипокалиемия. Процент данного типа гипертонии к настоящему времени, согласно результатам ряда исследований, достигает 20–30% (R. D. Gordone, M. Stowasser, T. Tunny et al., 1994; G. P. Ross, E. Ross, E. Pavan et al., 1998). При этом, как правило, при обследовании надпочечников выявляется двусторонняя диффузная или мелкоузелковая гиперплазия.
Однако механизм регуляции секреции альдостерона надпочечниками в подобных случаях и причины их гиперплазии оставались неясными. В то же время в литературе имеются указания на участие в синтезе и секреции альдостерона адренокортикотропного гормона (АКТГ), предсердного натрийуретического пептида, дофамина, серотонина.
Эти предположения не лишены основания, так как проопиомеланокортин (ПОМК), который предположительно синтезируется в промежуточной доле гипофиза, является предшественником АКТГ и находится под влиянием таких нейромедиаторов гипоталамуса, как дофамин и серотонин (В. М. Кеттайл, Р. А. Арки, 2001). Поэтому можно предположить, что нарушения в гипоталамо-гипофизарной системе любого генеза (инфекции, травмы и др. причины) могут изменить нормальную гормональную регуляцию различных органов и тканей-мишеней. В результате развивается соответствующая клиническая картина, которая чаще всего трактуется как гипоталамический синдром с различными метаболическими и соматическими нарушениями.
Развитие гипоталамического синдрома исследователи связывали с выявленной внутричерепной гипертензией. Однако нарушение функции клубочковой зоны коры надпочечников с патологией гипоталамических структур не рассматривалось. Патогенез развития ПИГА оставался неясным.
Впервые нами в 2002 г. была опубликована работа (З. И. Левитская, М. И. Балаболкин, 2002) с описанием истории болезни пациентки 50 лет, у которой наблюдалось развитие дексаметазонзависимого ПИГА на фоне внутричерепной гипертензии после двух перенесенных операций в детском возрасте по поводу гнойного некротического мастоидита. Диагноз был поставлен через 40 лет от начала заболевания.
В 2003 г. Weber и соавторы сообщили о двух женщинах 55 и 57 лет с длительным анамнезом заболевания, у которых ПИГА развился на фоне внутричерепной гипертензии. В обоих случаях имела место гиперплазия надпочечников. Weber и соавторы связывают патофизиологию данного заболевания с увеличением объема цереброспинальной жидкости, церебральным внутриклеточным отеком и/или увеличением внутримозгового объема крови. При этом патогенез заболевания остается под вопросом.
В 2002 г. у одной из пациенток мы, наряду с выявленными нарушениями водно-солевого обмена, обнаружили повышение в суточной моче содержания серотонина, 5-оксииндолуксусной кислоты (5-ОИУК), гистамина. Этот факт навел нас на мысль о причастности гипоталамо-гипофизарных структур к гиперплазии и гиперфункции клубочковой зоны коры надпочечников.
Синдром ПИГА диагностируется поздно, так как заболевание длительное время протекает с нерезко выраженными клиническими симптомами, такими, как «мягкая» артериальная гипертония, увеличение массы тела, задержка жидкости. Поскольку у больных имеется артериальная гипертония, то назначение мочегонных препаратов препятствует своевременной диагностике нарушения водно-солевого обмена.
Основными жалобами у этих больных являются головная боль, иногда довольно сильная, с тошнотой и рвотой, головокружение, периодически наблюдаются нарушения зрения, редко судороги с потерей сознания, иногда нарушение сердечного ритма, могут иметь место изменение поведенческих реакций и транзиторная гипергликемия.
В связи с гетерогенностью жалоб больные часто обращаются к врачам различных специальностей, не получая должной оценки клинического состояния. В лучшем случае диагностируется гипоталамический синдром с нарушением жирового обмена и проводится симптоматическая терапия, в том числе и гипотензивная. Клинический эффект, как правило, оказывается неубедительным.
В связи с вышесказанным мы приводим анализ анамнестических, клинических, лабораторных данных 11 больных (1 мужчина и 10 женщин), которые находились под нашим наблюдением. Возраст больных колебался от 21 до 65 лет. У всех больных характерными симптомами явились жалобы на головную боль различной интенсивности и продолжительности, задержку жидкости при отсутствии отеков, увеличение массы тела — от 28 до 80 кг сверх нормы в течение нескольких лет, артериальную гипертонию с повышением артериального давления — у различных пациентов от 160/90 до 300/170 мм рт. ст. У 4 больных периодически возникал судорожный синдром с кратковременной потерей сознания. Иногда судороги сопровождались рвотой. У 2 больных наблюдалась полидипсия до 5–6 л/сут при суточном диурезе 1,0–1,5 л.
Все больные задолго до развития клинической картины описываемого заболевания болели ангиной, гайморитом, отитом с развитием гнойного мастоидита либо имели черепно-мозговую травму (как правило, во время родов).
В связи с этим представляют интерес диагнозы, с которыми пациенты обратились к нам.
Анализируя анамнез заболевания, жалобы и клиническую картину, мы пришли выводу, что у обследуемых больных имеется гипоталамический синдром с нарушением жирового и водно-солевого обмена. Причем нарушение водно-солевого обмена связано с вторичной гиперплазией коры надпочечников и гиперсекрецией альдостерона. Кроме того, у всех пациентов были выявлены признаки внутричерепной гипертензии — по данным рентгенологического исследования. Причинами изменений на краниограммах, скорее всего, являлись перенесенные в детстве нейроинфекции, которые осложняют течение хронических воспалительных заболеваний носоглотки, а также черепно-мозговые травмы.
С целью выявления нарушения водно-электролитного баланса были рекомендованы измерение массы тела утром и вечером, контроль суточного диуреза и артериального давления в различное время суток.
Результат измерения массы тела показал, что разница между утренними и вечерними показателями составляла от 1,5 до 2,5 кг в сутки (при норме до 1,0 кг). Разница в количестве потребляемой и выделяемой жидкости колебалась от 0,5 до 2,5 л в сутки. Подъем артериального давления находился в прямой зависимости от задержки жидкости.
Мы исследовали электролиты в суточной моче и крови (натрий, калий, кальций), ренин и альдостерон крови, серотонин, 5-ОИУК и суточную экскрецию гистамина в моче.
Полученные результаты исследования показали, что у 10 больных концентрация в крови калия и натрия оставалась в пределах нормы. И только у одной больной отмечалась незначительная гипокалиемия. В суточной моче результаты были более информативны: у 2 больных экскреция натрия с мочой оказалась в норме. У 9 пациентов отмечалось снижение суточной экскреции натрия, что свидетельствовало о задержке выделения натрия из организма. В анализах 3 больных, у которых исследовалась экскреция кальция с мочой, также отмечалась его задержка.
Исследования ренина крови показало нижнюю границу нормы у 3 больных, у остальных отмечалась гипоренинемия. Концентрация альдостерона в крови у 10 из 11 была умеренно повышена. В отношении суточной экскреции альдостерона с мочой были получены следующие результаты: в 10 случаях отмечалось повышение и еще в одном — нормальная экскреция альдостерона при снижении экскреции ренина. Что касается нейромедиаторов, то у 10 больных экскреция серотонина и 5-ОИУК с мочой была повышена, и только у одной пациентки отмечалось повышение суточной экскреции 5-ОИУК при нормальной экскреции серотонина.
Компьютерная томография надпочечников выявила наличие двусторонней гиперплазии у 6 больных.
На основании полученных результатов всем больным был поставлен диагноз ПИГА на фоне внутричерепной гипертензии.
Как уже сообщалось выше, одним из клинических вариантов ПИГА является дексаметазонзависимый гиперальдостеронизм. Возможно, данный вариант ПИГА связан с образованием ПОМК, который находится под влиянием серотонина и дофамина и одновременно является предшественником АКТГ. Кортиколиберин, стимулирующий синтез и секрецию АКТГ, из срединного возвышения выделяется одновременно с аргинин-вазопрессином и с разной степенью чувствительности подавляется глюкокортикоидами. С учетом вышесказанного для подавления секреции АКТГ при лечении больных мы использовали дексаметазон в дозе 0,25 мг на ночь. При этом учитывался не только АКТГ-подавляющий эффект препарата, но и его супрессивное влияние на серотонин и аргинин-вазопрессин.
Из 11 больных у 6 на фоне приема дексаметазона нормализовались показатели электролитного баланса, снизился уровень альдостерона и, самое главное, снизилось или нормализовалось артериальное давление. Масса тела у двух больных уменьшилась за 10 дней на 3 кг, еще одна больная за 20 дней похудела на 8 кг, другая — за 8 мес на 20 кг. Кроме того, у всех пациентов улучшилось общее состояние, исчезли судороги.
Для остальных больных подбиралась индивидуальная терапия с учетом рассмотренных выше клинико-патогенетических особенностей артериальной гипертонии данной категории больных. Предлагаемый антигипертензивный препарат должен воздействовать на ключевые патогенетические механизмы данного варианта артериальной гипертонии.
С учетом задержки натрия у наших пациентов и повышенной экскреции калия препаратом выбора является верошпирон, который обладает антиальдостероновым эффектом. Нами препарат назначался в дозе от 25 до 150 мг/сут. Иногда было достаточно только монотерапии этим препаратом (у 3 больных). В двух случаях клинически значимого эффекта удалось добиться при использовании комбинации верошпирона и дексаметазона. Больным, у которых была снижена суточная экскреция кальция с мочой, проводилось лечение антагонистами кальция (кордафлекс ретард) с хорошим эффектом.
Наряду с гипотензивными препаратами больным, не получавшим дексаметазон, назначался ацетазоламид (диакарб) 250 мг 2 раза в неделю. Данный препарат уменьшал внутричерепную гипертензию и положительно влиял на общее состояние пациентов.
Препараты, улучшающие функцию и метаболический фон мозга, также показаны для данной категории больных.
С учетом инсулинорезистентности возможно назначение больным с ожирением метформина (сиофор). В связи с выявлением у данной категории больных нарушений серотонинергической регуляции в гипоталамических структурах целесообразно назначение препаратов из группы сибутрамина (меридиа) в дозе от 10 до 15 мг в сутки. Фармакологическое действие данной группы препаратов заключается в ингибировании обратного захвата серотонина и норадреналина в ЦНС.
Таким образом, ПИГА представляет собой сложную цепочку нарушений синтеза и секреции альдостерона со стороны гипоталамических структур, травмированных в результате какого-либо патологического процесса (инфекция, травма). Все это приводит к нарушению обмена нейромедиаторов (В. М. Кеттайл, Р. А. Арки, 2001). Изменения нейромедиаторных взаимодействий вызывают соответствующие нарушения нейроэндокринных процессов.
Последнее обстоятельство объясняет клиническую картину, которая требует анализа причинно-следственных связей, диагностического поиска, назначения патогенетической терапии.
З. И. Левитская, кандидат медицинских наук
Е. В. Перистая
ММА им. И. М. Сеченова, Москва
Что такое гиперальдостеронизм? Причины возникновения, диагностику и методы лечения разберем в статье доктора Матвеева М. А., эндокринолога со стажем в 10 лет.
Определение болезни. Причины заболевания
В силу стёртой клинической картины данный синдром диагностируется редко. Однако его выявление имеет огромное значение как из-за своей распространённости, так и в связи с возможным своевременным лечением причины артериальной гипертензии и предотвращением тяжёлых сердечно-сосудистых осложнений, улучшая прогноз и качество жизни пациентов.
Кора надпочечников выделяет большое количество альдостерона либо автономно, либо в ответ на стимулы вне надпочечников.
Причинами автономной секреции альдостерона являются заболевания надпочечников:
Вненадпочечниковыми причинами синдрома являются:
Крайне редко возможно развитие псевдогиперальдостеронизма — артериальной гипертензии и низкого уровня калия в крови, имитирующих симптомы гиперальдостеронизма. Причиной тому является существенная передозировка солодки или жевательного табака, которые влияют на метаболизм гормонов в надпочечниках.
Симптомы гиперальдостеронизма
Обычно гипертония при данном синдроме устойчива к препаратам, нормализующим давление. Однако этот признак гиперальдостеронизма далеко не всегда становится определяющим, поэтому его отсутствие не исключает диагноз и может привести к диагностической ошибке. Течение артериальной гипертензии при наличии синдрома может быть умеренным и даже мягким, поддающимся коррекции небольшими дозами препаратов. В редких случаях артериальная гипертензия носит кризовый характер, что требует дифференциальной диагностики и тщательного клинического разбора.
Третий признак гиперальдостеронизма, встречающийся не менее чем в 50-70 % случаев, — почечный синдром. Он представлен, как правило, невыраженной жаждой и учащённым мочеиспусканием (часто в ночное время).
Выраженность всех вышеперечисленных проявлений напрямую связана с концентрацией альдостерона: чем выше уровень этого гормона, тем выраженнее и тяжелее проявления гиперальдостеронизма.
Патогенез гиперальдостеронизма
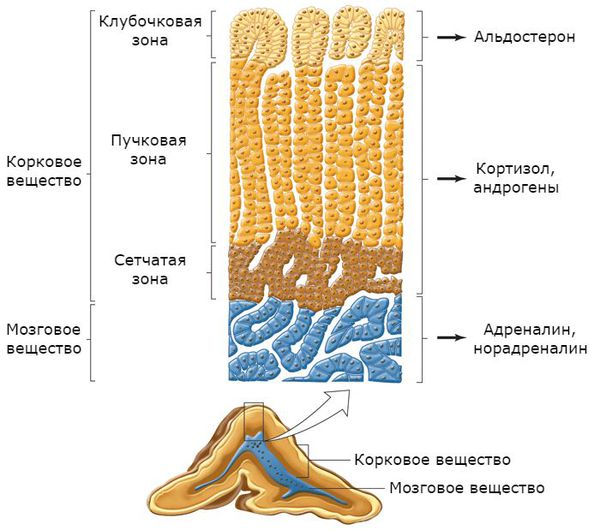
Надпочечники состоят из коркового и мозгового вещества. В корковом веществе, которое составляет до 90 % всей ткани надпочечника, выделяют три зоны:
Главным органом-мишенью для альдостерона являются почки. Именно там данный гормон усиливает всасывание натрия, стимулируя выделение фермента Na + /K + АТФазы, таким образом повышая его уровень в плазме крови. Второй эффект воздействия альдостерона — выделение почками калия, снижая его концентрацию в плазме крови.
При гиперальдостеронизме, т.е. при повышенной альдостерона, натрия в плазме крови становится чрезмерно много. Это приводит к повышению осмотического давления плазмы, задержке жидкости, гиперволемию (увеличение объёма жидкости или крови в сосудистом русле), в связи с чем развивается артериальная гипертензия.
Из всего выше сказанного можно сделать вывод о том, что основная жизненно важная функция альдостерона — это поддержание физиологической осмолярности внутренней среды, т. е. баланса суммарной концентрации растворённых частиц (натрия, калия, глюкозы, мочевины, белка).
Классификация и стадии развития гиперальдостеронизма
В зависимости от причин гиперсекреции альдостерона выделяют первичный и вторичный гиперальдостеронизм. Подавляющее большинство случаев данного синдрома являются именно первичными.
Первичный гиперальдостеронизм — это повышенная секреция альдостерона, независящая от гормональной системы, которая контролирует объём крови и кровяное давление. Он возникает из-за заболеваний надпочечников.
Вторичный гиперальдостеронизм — это повышенная секреция альдостерона, вызванная вненадпочечниковыми стимулами (заболеваниями почек, застойной сердечной недостаточностью).
Осложнения гиперальдостеронизма
Неотложным состоянием, связанным с гиперальдостеронизмом, является гипертонический криз. Его клинические проявления могут ничем не отличаться от обычных гипертонических кризов, проявляющихся головными болями, тошнотой, болями в области сердца, одышкой и т. д. Заподозрить нетипичный гипертонический криз в такой ситуации поможет наличие брадикардии (редкого пульса) и отсутствие периферических отёков. Эти данные в корне изменят тактику лечения и направят диагностический поиск в правильном направлении.
Диагностика гиперальдостеронизма
Для того чтобы не пропустить гиперальдостеронизм, вначале крайне важно выделить основные факторы риска, которые помогут заподозрить это заболевание. К ним относятся:
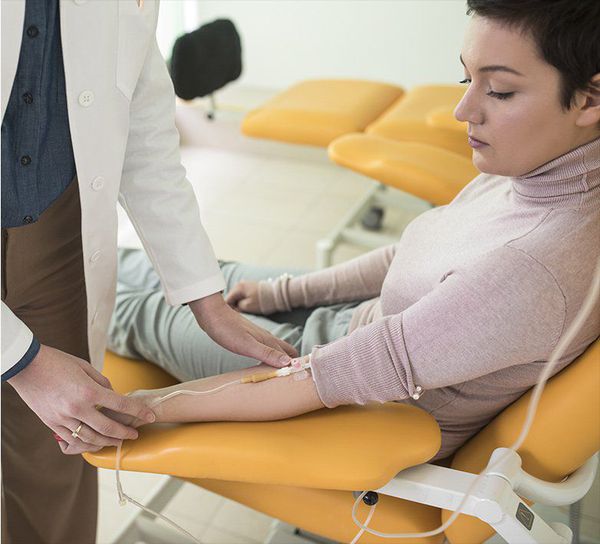
Следующий этап диагностики — лабораторное подтверждение. Для этого исследуется альдостерон-рениновое соотношение (АРС). Данное исследование является наиболее надёжным, информативным и доступным. Оно должно проводиться в ранние утренние часы: в идеале не позднее чем через два часа после пробуждения. Перед забором крови необходимо спокойно посидеть 5-10 минут.
ВАЖНО: некоторые препараты могут повлиять на концентрацию альдостерона и активность ренина плазмы, что, в свою очередь, изменит АРС. Поэтому за две недели до сдачи данного анализа важно отменить такие препараты, как спиронолактон, эплеренон, триамтерен, тиазидные диуретики, препараты из группы ингибиторов АПФ, БРА (блокаторов рецепторов ангиотензина) и другие. Врач должен проинформировать об этом пациента и временно назначить другую схему лечения гипертонии.
При положительном АРС необходимо провести подтверждающий тест с физиологическим раствором. Он проводится в условиях стационара, т. к. имеет ряд ограничений и требует исследование уровня альдостерона, калия и кортизола исходно и после 4-часового вливания двух литров физиологического раствора. В норме в ответ на большое количество вводимой жидкости выработка альдостерона подавляется, однако при гиперальдостеронизме подавить гормон таким способом не удаётся.
Низкий уровень калия в крови отмечается лишь в 40 % случаев синдрома, поэтому он не может быть надёжным критерием диагностики. А вот щелочная реакция мочи (вследствие повышенного выведения калия почками) является довольно характерным признаком патологии.
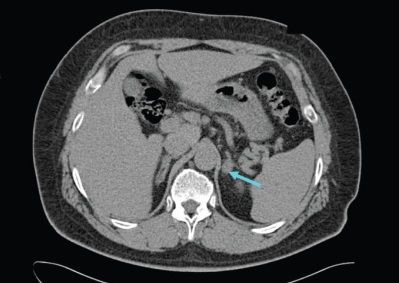
Третий этап диагностики — топическая диагностика. Она направлена на поиски очага заболевания. Для этого используются различные способы визуализации внутренних органов.
Лечение гиперальдостеронизма
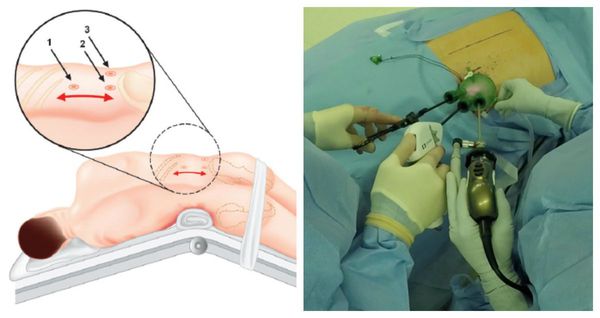
Оперативное лечение
Методом выбора при аденоме надпочечника, синтезирующей альдостерон, и односторонней гиперплазии надпочечника является эндоскопическая адреналэктомия — удаление одного или двух надпочечников через небольшие разрезы.
Противопоказания к удалению надпочечника:
Консервативное лечение
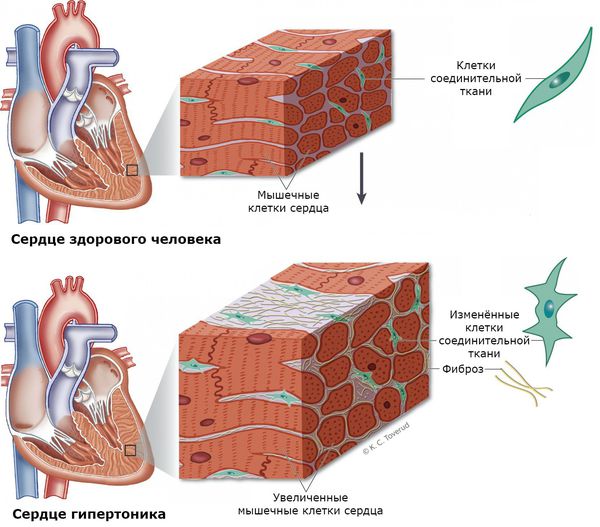
К этой группе препаратов относится калийсберегающий диуретик спиронолактон, который блокирует минералокортикоидные рецепторы и препятствует развитию фиброза миокарда, связанного с альдостероном. Однако он обладает рядом побочных эффектов, воздействуя ещё и на рецепторы андрогенов и прогестерона: может привести к гинекомастии у мужчин, снижению либидо, вагинальным кровотечениям у женщин. Все эти эффекты зависят от дозы препарата: чем больше доза препарата и длительность его применения, тем побочные эффекты более выражены.
Прогноз. Профилактика
При запоздалой диагностике гипертония и осложнения могут сохраняться даже после терапии.
Гиперальдостеронизм может довольно долго протекать только с симптомами гипертонии.
Постоянно высокие цифры артериального давления (более 200/120 мм рт. ст.), нечувствительность к антигипертензивным препаратам, низкий уровень калия в крови — далеко не обязательные признаки синдрома. А ведь именно на это, зачастую, ориентируются врачи, чтобы заподозрить заболевание, «пропуская» гиперальдостеронизм с относительно «мягким» течением на ранних этапах.
Чтобы решить эту проблему, врачам, которые работают с пациентами с артериальной гипертензией, необходимо выявлять группы высокого риска и прицельно обследовать их на предмет наличия гиперальдостеронизма.