Альфа адренергические антагонисты что это
Адреналин и компания
Обзор адреномиметиков — механизм действия, побочные эффекты и особенности приема препаратов этой группы
Адреномиметики — это обширная фармакологическая группа лекарственных препаратов, связывающихся с адренергическими рецепторами человеческого организма. Ее представители имеют различный механизм действия, а, следовательно, фармакологические и побочные эффекты у них тоже различаются. Вспомним, как именно работают препараты этой группы, какие неблагоприятные реакции могут возникать при их применении и о чем необходимо предупреждать покупателей при отпуске таких ЛС.
Общая информация об адреномиметиках
Известно, что в адренергических синапсах возбуждение осуществляется за счет нейромедиатора норадреналина. В ответ на импульс он высвобождается в синаптическую щель и взаимодействует с адренорецепторами постсинаптической мембраны. В зависимости от чувствительности к химическим соединениям выделяют α- и β-адренорецепторы. Их, в свою очередь, подразделяют на подклассы — α1-, α2-, β1-, β2-, β3‑адренорецепторы [1].
Современная классификация адреномиметиков предполагает их систематизацию на основе их тропности в отношении α- и β-адренорецепторов [1–3]:
Стимулирующие α- и β-адренорецепторы (неселективные адреномиметики):
Стимулирующие преимущественно α-адренорецепторы:
Стимулирующие преимущественно β-адренорецепторы:
β3‑рецепторы на сегодняшний момент не имеют клинического значения.
Таблица 1: Основные эффекты, связанные со стимуляцией α- и β-адренорецепторов [1–3]
| α-адренорецепторы | β-адренорецепторы | |||
| α1-адренорецепторы (постсинаптические) | α2-адренорецепторы (пресинаптические, постсинаптические, внесинаптические) | β1-адренорецепторы | β2-адренорецепторы | β3-адренорецепторы |
| Сужение сосудов (особенно сосудов кожи, почек, кишечника, коронарных сосудов) | Повышение частоты и силы сердечных сокращений | Активация липолиза | ||
| Сокращение радиальной мышцы радужной оболочки (мидриаз) | Снижение тонуса мышц бронхов | |||
| Сокращение миометрия (при беременности) | Расслабление матки (при беременности) | |||
| Снижение моторики и тонуса кишечника | Блокирование высвобождения медиаторов воспаления из тучных клеток | |||
| Сокращение сфинктеров желудочно-кишечного тракта | Расслабление сфинктера мочевого пузыря | |||
| Сокращение капсулы селезенки | ||||
Следует отметить, что многие адреномиметики, особенно неселективные, используются, как правило, при интенсивной терапии и оказании неотложной помощи. Так, адреналин показан для лечения остановки сердца, анафилаксии, норадреналин применяется при шоке и гипотонии, а дофамин применяют при блокаде и остановке сердца и брадикардии. Очевидно, что первостольникам отпускать такие препараты приходится довольно редко.
Гораздо чаще провизорам и фармацевтам приходится сталкиваться с селективными адреномиметиками. Им мы и уделим особое внимание.
Препараты, стимулирующие преимущественно α-адренорецепторы
Агонисты α1‑адренорецепторов (α1‑адреномиметики)
Связывание агонистов с α1‑адренорецепторами приводит к индукции выработки инозитол трифосфата и диацилглицерола и, как следствие, высвобождению кальция Ca2+ [3, 4].
Фенилэфрин — стимулятор постсинаптических α1‑адренорецепторов, проявляет общий и местный эффекты.
При системном применении влияет в основном на сердечно-сосудистую систему. Повышает артериальное давление, оказывает стимулирующее действие на головной и спинной мозг. На сердце непосредственно не влияет.
При местном применении в офтальмологии расширяет зрачок, улучшает отток жидкости и сужает сосуды конъюнктивы. При местном использовании в ЛОР-практике уменьшает отек и гиперемию слизистой оболочки носа, а также восстанавливает дыхание.
Селективное связывание с α1‑адренорецепторами может привести к повышению артериального давления. Кроме того, фенилэфрин способен вызывать как тахикардию, так и брадикардию [3].
О чем предупредить клиента?
Отпуская препараты фенилэфрина, нужно подчеркнуть, что при их применении следует соблюдать дозировку и рекомендуемую кратность применения во избежание развития сердечно-сосудистых эффектов — повышения артериального давления и рефлекторной брадикардии. Кроме того, необходимо предупредить о важности хранения препарата вдали от детей: при случайном приеме деконгестантов внутрь возможно резкое повышение артериального давления, развитие желудочковой экстрасистолии и брадикардии, требующих реанимационных мероприятий.
Агонисты преимущественно α2‑адренорецепторов: системные α2‑адреномиметики
Возбуждение постсинаптических α2‑адренорецепторов центральных адренергических нейронов и ядер солитарного тракта имеет тормозящее влияние на сосудодвигательный центр продолговатого мозга и сосуды. Это приводит к снижению давления, замедлению сокращений сердца, снижению периферического тонуса сосудов почек.
Метилдопа — α2‑адреномиметик, который влияет на центральные механизмы регуляции артериального давления. В организме после прохождения через гематоэнцефалический барьер превращается в альфа-метилнорадреналин, стимулирует α2‑адренорецепторы пресинаптической мембраны вазомоторного центра продолговатого мозга и тормозит симпатическую импульсацию к сосудам [5].
Применяется для лечения артериальной гипертензии легкой и средней степени тяжести. Однако метилдопа, как и другие α2‑адреномиметики, не относится к препаратам выбора для лечения этого заболевания и назначается сугубо индивидуально, под контролем врача и при оценке соотношения «польза от применения/риск побочных эффектов».
К недостаткам метилдопы, которые значительно сужают возможности ее применения как антигипертензивного препарата, относятся:
В то же время, метилдопа, в отличие от многих препаратов первой линии для лечения артериальной гипертонии, может применяться во время беременности при гестационной гипертензии [6]. Он относится к категории В по действию на плод — изучение репродукции на животных не выявило неблагоприятного действия на ребенка.
Наиболее распространенные неблагоприятные реакции: артериальная гипотензия, сухость во рту, седация. При повышении дозировок может возникать угнетение дыхания и сонливость.
О чем предупредить клиента?
Отпуская препарат метилдопа, следует рассказать покупателю, что при резком снижении дозы или прекращении приема ЛС может развиваться синдром отмены. Для его предупреждения необходимо постепенно снижать дозу (в соответствии с рекомендациями врача).
Также нужно обратить внимание клиента на то, что во время лечения препаратом не рекомендовано вождение транспортных средств и занятие требующими повышенного внимания видами деятельности. В дальнейшем степень ограничений определяется индивидуально, в зависимости от переносимости препарата.
Агонисты преимущественно α2‑адренорецепторов: местные
Известно, что α2‑адренорецепторы регулируют объем сосудистой сети носовых раковин. Именно влияние на этот тип рецепторов считается наиболее эффективным рычагом воздействия на размер носовых раковин и объем полости носа [7].
За счет возбуждения адренорецепторов в слизистой носа α-адреномиметики вызывают сужение сосудов, уменьшая местную гиперемию и отек. Облегчают носовое дыхание. Действие наступает, как правило, через несколько минут, но его продолжительность варьируется у разных препаратов.
Таблица 2: Продолжительность антиконгестивного эффекта агонистов α2‑адренорецепторов [8]
| Продолжительность эффекта | Препарат |
| Короткое действие (до 4–6 часов) | Нафазолин, тетризолин, инданазолин |
| Средняя продолжительность (до 8–10 часов) | Ксилометазолин |
| Длительное действие (до 12 часов) | Оксиметазолин |
При местном применении практически не абсорбируются, а концентрация в плазме, как правило, аналитически не определяется. Исключение составляет нафазолин: по некоторым данным, он оказывает существенное резорбтивное действие, однако сведения о его биодоступности и концентрациях в сыворотке отсутствуют. Также пока неясно, чем вызван возможный системный эффект нафазолина — непосредственной абсорбцией со слизистой оболочки полости носа или всасыванием проглоченной части препарата в желудке [7].
Наиболее распространенные побочные эффекты местных сосудосуживающих препаратов — раздражение слизистой оболочки носа, жжение, сухость, покалывание. При длительном применении в высоких дозах возможно нарушение сердечного ритма, повышение артериального давления.
Все топические сосудосуживающие препараты способны вызывать синдром «рикошета». При длительном и частом их применении угнетается эндогенная выработка норадреналина, синтезируемого в адренорецепторах, что вызывает снижение чувствительности гладкой мускулатуры сосудов полости носа к эндогенному норадреналину. Традиционно считается, что длительное (свыше 14 дней) использование топических сосудосуживающих препаратов вызывает выраженный отек в полости носа, назальную гиперреактивность и ремоделирование слизистой оболочки [7].
О чем предупредить клиента?
Отпуская местные сосудосуживающие препараты, необходимо напомнить покупателю о:
Агонисты β-адренорецепторов (β-адреномиметики)
Препараты этой группы можно разделить на три подгруппы:
Механизм действия β2‑адреномиметиков основан на стимуляции β2‑адренорецепторов и активации аденилатциклазы с последующим увеличением образования цАМФ, который, в свою очередь, стимулирует работу кальциевого насоса, перераспределяющего ионы кальция. В результате концентрация кальция в миофибриллах снижается. β2‑адреномиметики расширяют бронхи, кровеносные сосуды, способствуют дегрануляции тучных клеток и эозинофилов, прекращая выделение гистамина, а также снижают проницаемость кровеносных сосудов и тормозят секрецию слизи в бронхах.
Таблица 3: Сравнительная характеристика основных β-адреномиметиков [9]
Альфа-адреноблокаторы в урологии
Кальфа-адреноблокаторам (альфа-АБ) относят вещества, конкурентно ингибирующие альфа-адренорецепторы (альфа-АР) фентоламин, троподифен, гидрированные производные алкалоидов спорыньи и другие вещества.
К альфа-адреноблокаторам (альфа-АБ) относят вещества, конкурентно ингибирующие альфа-адренорецепторы (альфа-АР) фентоламин, троподифен, гидрированные производные алкалоидов спорыньи и другие вещества. Действие альфа-АБ не совпадает полностью с блокадой нервных импульсов, поступающих по постганглионарным симпатическим волокнам, так как эти вещества блокируют главным образом стимулирующие эффекты, связанные с возбуждением альфа-АР (сужение сосудов, сокращение мышцы радужной оболочки глаза и т. п.). Тормозящие же эффекты (например, расслабление гладкой мускулатуры бронхов и кишечника) сохраняются. Альфа-адренорецепторы равномерно распределены в организме человека. Имеется два основных подтипа альфа-АР. Это альфа1 и альфа2-АР. Подтип альфа2 расположен пресинаптически и вызывает снижение выработки норэпинефрина через отрицательный механизм обратной связи. Альфа1-подтип расположен постсинаптически и является мишенью консервативной терапии заболеваний мочевых путей, в большей степени доброкачественной гиперплазии предстательной железы (ДГПЖ). Применение неселективных альфа-АБ (воздействующих на альфа1 и альфа2-АР) ограничено в связи с тем, что эти препараты блокируют как пре-, так и постсинаптические альфа-АР. Следует учитывать, что блок пресинаптических альфа-АР нарушает физиологическую авторегуляцию выделения медиатора норадреналина. В результате нарушения отрицательной обратной связи происходит избыточное высвобождение норадреналина, способствующее восстановлению адренергической передачи. Последнее объясняет недостаточную стойкость блока постсинаптических рецепторов альфа1-АР при использовании неселективных альфа-АБ. Повышенная тахикардия является результатом повышенного высвобождения норадреналина. Благодаря функционирующим альфа2-АР сохраняется механизм отрицательной обратной связи, и, следовательно, повышенного выделения норадреналина не происходит. При этом блок постсинаптических альфа1-АР становится более стабильным. Кроме того, не возникает выраженной тахикардии. С учетом данных особенностей были разработаны препараты, оказывающие избирательное блокирующее действие на постсинаптические (периферические) альфа1-АР, например, празозин.
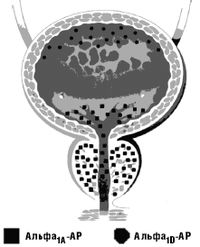
Терапия альфа1-АБ в целом переносится хорошо, нежелательные эффекты относительно редки. По данным ведущих исследователей, чаще всего встречается ортостатическая гипотензия, головокружение, общая слабость и нарушения эякуляции. Внутри фармакологической группы альфа1-АБ различаются по степени выраженности и длительности альфа1А-, альфа1В- и альфа1D-рецептор-блокирующего действия (табл. 1). Применение альфа-АБ сопряжено с нормализацией уродинамики, снижением выраженности ирритативных симптомов, улучшением качества жизни, а также предотвращением прогрессии заболевания (в частности, острой задержки мочи и необходимости оперативного лечения). В табл. 2 и табл. 3 представлены обобщенные данные разных исследователей по эффективности наиболее часто применяемых альфа1-АБ, доксазозина и тамсулозина.
При лечении ДГПЖ альфа1-АБ являются препаратами первой линии терапии. Они используются как в монотерапии, так и в комбинации с ингибиторами 5-альфа редуктазы (5АРИ). В одном из фундаментальных исследований последнего десятилетия — MTOPS было показано наибольшее преимущество от комбинированного применения финастерида и доксазозина в лечении симптомов нижних мочевых путей и увеличении максимальной скорости мочеиспускания, чем этих препаратов по отдельности. В нем было продемонстрировано, что применение комбинированной схемы лечения препаратами группы альфа1-АБ и 5АРИ не приводит к увеличению числа нежелательных явлений. По нашим собственным данным комбинированное применение доксазозина и финастерида в течение 6 месяцев терапии приводит к статистически значимому снижению как обструктивных, так и ирритативных симптомов нижних мочевых путей (СНМП), описываемых шкалой I-PSS. Значительно улучшается максимальная скорость мочеиспускания, качество жизни пациентов. Средний объем ПЖ к концу указанного срока снизился на 18%.
Альфа-АБ отводится немаловажная роль в лечении впервые возникшей острой задержки мочеиспускания. Наибольший эффект от терапии наблюдается при сочетании альфа-АБ и дренирования мочевого пузыря уретральным катетером в течение нескольких суток. Опыт применения доксазозина и тамсулозина у 273 пациентов в возрасте от 52 до 74 лет в предоперационной подготовке указывает на то, что включение альфа-АБ в схему предоперационной подготовки может предупредить развитие послеоперационной острой задержки мочи.
Не меньшее значение отводится использованию альфа-АБ в лечении хронического простатита (ХП) и хронического синдрома тазовой боли (ХСТБ). По данным различных авторов признаки ХП выявляются у каждого 10-го мужчины. Большинство из них на протяжении жизни имеют несколько случаев обострения ХП, а также проявления ХСТБ. Фармакологическая стратегия включает эмпирическую антибактериальную терапию, несмотря на то, что до 90% всех случаев имеют абактериальную природу. Даже учитывая, что большинство урологов имеют дело с абактериальным простатитом, тем не менее более 50% этих пациентов получает антибактериальную терапию. Снижение тонуса предстательной железы и гладкой мускулатуры мочевого пузыря может улучшить скорость мочеиспускания и облегчить СНМП, что указывает на точку приложения альфа-АБ в лечении ХП и простатодинии. Последние исследования показывают, что добавление альфа-АБ к антибактериальной терапии может уменьшить риск рецидива хронического бактериального простатита (ХБП). Однако оптимальная длительность терапии альфа-АБ до сих пор не определена. Феноксибензамина гидрохлорид, являясь неселективным альфа-АБ, показал улучшение симптомов ХП, несмотря на значительные побочные эффекты. Другие исследования показывают, что 6-месячный курс альфа-АБ значительно снижает болевой синдром, связанный с ХП, по сравнению с плацебо и традиционной терапией, но не улучшает скорость мочеиспускания и качество жизни согласно опроснику I-PSS. Схожее исследование, сравнивающее различные альфа-АБ между собой, показало, что доксазозин по сравнению с плацебо более эффективен и вызывает значительное улучшение в виде уменьшения выраженности болей у данной группы пациентов. Дальнейшие исследования показывают, что альфа-АБ снимают болевой синдром и улучшают качество жизни у пациентов с хроническим простатитом. Говоря об особенностях различных селективных альфа-АБ, нужно отметить, что, обладая сравнимой с доксазозином эффективностью и безопасностью, тамсулозин является более удобным препаратом для пациентов в связи с отсутствием необходимости титрования дозы. Использование альфа1-АБ может снижать специфические симптомы у пациентов с ХБП и СХТБ, в случае назначения антибактериальной терапии и без нее. Практически все исследователи сходятся во мнении, что комбинация альфа1-АБ с антибактериальными препаратами не только может усилить эффект от терапии путем снижения болей и других симптомов, ассоциированных с ХП, но также может снизить риск рецидива ХП.
Другой, не менее важной областью применения АБ может стать лечение гиперактивного мочевого пузыря (ГАМП). На сегодняшний день в мире насчитывается до 100 миллионов человек, страдающих теми или иными проявлениями ГАМП. В. Г. Гомберг с соавт., наблюдая 30 пациенток, принимавших доксазозин в качестве монотерапии по поводу ГАМП, отмечают, что через 2 месяца приема препарата частота императивных позывов на мочеиспускание снизилась на 49%, а частота эпизодов ургентной инконтиненции — на 70%. Также авторами было отмечено увеличение емкости мочевого пузыря на 35%.
Как и активное применение альфа1-АБ в лечении ХП, начало XXI века ознаменовалось внедрением альфа1-АБ в схемы литокинетической терапии камней мочеточника, что поначалу встретило естественную критику. На сегодняшний день применение альфа1-АБ вполне оправдано у больных с мелкими конкрементами мочеточника, однако до сих пор некоторые специалисты ставят его под сомнение или просто говорят о том, что выигрыш от такой терапии не настолько высок, как его представляют. Losek R. L. и соавт., проанализировав поисковые системы PubMed и MEDLINE, обнаружили пять проспективных исследований, касавшихся использования тамсулозина в литокинетической терапии после однократного сеанса дистанционной ударно-волновой литотрипсии (ДУВЛ). В одном из них пациенты наблюдались в течение 12 недель после сеанса ДУВЛ. Как оказалось, отхождение фрагментов конкрементов наступило в 60% в контрольной группе по сравнению с 78,5% группы, принимавшей тамсулозин. Среди исследований, оценивавших полное отхождение конкрементов, доля их отхождения в контрольной группе составила 33,3–79,3% по сравнению с 66,6–96,6% в группе, принимавшей тамсулозин. В случае применения тамсулозина дозы анальгетиков также были ниже по сравнению с контрольной группой. К сожалению, в большинстве исследований не указывалось, в каком числе случаев в последующем выполнялись дополнительные сеансы ДУВЛ и уретероскопии. Авторы заключают, что назначение тамсулозина после сеанса ДУВЛ является безопасным и эффективным средством, улучшающим отхождение конкрементов почек от 10 до 24 мм. Другими исследователями, наблюдавшими 56 пациентов, перенесших ДУВЛ, было отмечено, что применение тамсулозина уменьшает количество назначаемых нестероидных анальгетиков в процессе лечения больных после ДУВЛ. Авторы полагают, что комплексное применение тамсулозина при электрофорезе с Новокаином у этой категории больных усиливает литокинетический эффект. В другом исследовании, оценивая эффективность тамсулозина в дозе 0,4 мг в литокинетической терапии мелких конкрементов мочеточника как с, так и без применения ДУВЛ, B. Kupeli показал, что в случае назначения альфа1-АБ у пациентов с мелкими конкрементами мочеточника (3–5 мм) отхождение конкрементов наступало чаще и составило 53,3% случаев по сравнению с контрольной группой — 20%. В случае выполнения сеанса ДУВЛ пациентам с конкрементами мочеточника более 5 мм (6–15 мм) в группе тамсулозина в 70,8% случаев наступало полное отхождение конкрементов по сравнению с контрольной группой — 33,3%. E. Yilmaz продемонстрировал сопоставимую эффективность применения теразозина, доксазозина и тамсулозина в литокинетической терапии дистальных конкрементов мочеточника. Несмотря на большое число данных, демонстрирующих преимущества литокинетической терапии в сочетании с альфа1-АБ, необходимы исследования, оценивающие различные дозы альфа-АБ и их способность уменьшения вероятности дополнительных сеансов ДУВЛ и таких инвазивных манипуляций, как уретероскопия.
Заключение
Подводя итог сказанному, можно заключить, что использование альфа-АБ оправдано при многих урологических состояниях, а блокада альфа1А-АР и альфа1D-АР предпочтительна при ДГПЖ и в схемах литокинетической терапии конкрементов мочеточника. Благодаря многочисленным международным исследованиям, а также появляющимся отечественным публикациям, показавшим безопасность и высокую эффективность альфа1-АБ, учитывая невысокую стоимость препаратов данной группы и их повсеместную доступность, в распоряжении уролога появился важный, высокоэффективный инструмент, позволяющий улучшить качество жизни пациентов с ДГПЖ и ХСТБ, снизить число рецидивов хронического простатита, а также уменьшить время нахождения в стационаре больных с мелкими конкрементами мочевых путей.
По вопросам литературы обращайтесь в редакцию.
А. Б. Богданов*, И. В. Лукьянов, кандидат медицинских наук, доцент Е. И. Велиев, доктор медицинских наук, профессор *ГКБ им. С. П. Боткина, РМАПО, Москва.
Альфа адренергические антагонисты что это
Офтальмологический центр Федерального медико-биологического агентства, ул. Гамалеи, 15, Москва, Российская Федерация, 123098
Селективные α2-агонисты в лечении глаукомы: фармакологические свойства, эффективность и безопасность
Журнал: Вестник офтальмологии. 2019;135(2): 144-150
Курышева Н. И. Селективные α2-агонисты в лечении глаукомы: фармакологические свойства, эффективность и безопасность. Вестник офтальмологии. 2019;135(2):144-150.
Kurysheva N I. Selective α2-agonists in the treatment of glaucoma: pharmacology, efficacy and safety. Vestnik Oftalmologii. 2019;135(2):144-150.
https://doi.org/10.17116/oftalma2019135021144
Офтальмологический центр Федерального медико-биологического агентства, ул. Гамалеи, 15, Москва, Российская Федерация, 123098
Глаукома — главная причина необратимой слепоты в мире. Среди препаратов, направленных на снижение офтальмотонуса, важное место занимает селективный α2-агонист Бримонидин. В данной части обзора рассматриваются ключевые фармакотерапевтические характеристики Бримонидина и его механизм действия. Также обсуждаются побочные эффекты его применения и пути их предупреждения.
Офтальмологический центр Федерального медико-биологического агентства, ул. Гамалеи, 15, Москва, Российская Федерация, 123098
Глаукома — главная причина необратимой слепоты в мире. Ожидается, что количество больных с этой патологией к 2020 г. возрастет до 79,6 млн [1]. В Российской Федерации по состоянию на 2017 г. насчитывают 1,329 тыс. больных глаукомой, а доля заболевания в структуре слепоты составляет 28% [2]. Глаукомная оптиконейропатия (ГОН) — это хроническое прогрессирующее заболевание, сопровождающееся характерными морфологическими изменениями в слое нервных волокон, ганглиозных клетках сетчатки (ГКС), головке зрительного нерва и снижением светочувствительности сетчатки. Повышение уровня внутриглазного давления (ВГД) — ведущий фактор риска развития ГОН. В настоящее время существует несколько групп препаратов для его снижения. К ним относятся аналоги простагландинов, блокаторы β-адренорецепторов, ингибиторы карбоангидразы, парасимпатомиметики и агонисты α2-адренергических рецепторов [3—5].
Известно, тем не менее, что заболевание может прогрессировать, несмотря на нормальный офтальмотонус [6]. Это связано с тем, что первичное поражение ГКС при глаукоме вовлекает в патологический процесс окружающие нейроны (вторичное поражение). Таким образом, лечение глаукомы, которое на сегодня сводится к снижению офтальмотонуса, не может остановить этот процесс. Поэтому возникает необходимость в других терапевтических воздействиях, которые принято называть нейропротекцией и нейрорегенерацией.
Настоящий обзор литературы посвящен Бримонидину — α2-агонисту, который зарекомендовал себя как эффективное средство с точки зрения не только гипотензивного действия, но и прямого нейропротекторного эффекта в лечении ГОН.
1. Фармакокинетика и гипотензивная эффективность бримонидина
1.1. Механизм действия α2-агонистов
Механизм действия всех адреномиметиков связан с их воздействием на α-адренорецепторы. Стимуляция α2-адренорецепторов приводит к сужению сосудов цилиарного тела [7] и снижению уровня внутриклеточного циклоаденозинмонофосфата [8], что в результате уменьшает продукцию внутриглазной жидкости (ВГЖ) и увеличивает увеосклеральный отток [9]. В дополнение к этому возбуждение α2-адренорецепторов изменяет активность матриксных металлопротеиназ (MMPs) и их ингибиторов (TIMPs), что в конечном итоге ведет к деградации экстраклеточного матрикса в трабекулярной сети и способствует снижению сопротивления оттоку ВГЖ по увеосклеральному пути [10]. Дополнительным эффектом является благоприятное воздействие на заживление тканей конъюнктивы, что может иметь значение в хирургии глаукомы, в частности для формирования полноценной фильтрационной подушечки [11].
Подобно другим α-агонистам, Бримонидин влияет на размеры зрачка, приводя к его миозу, а также оказывает антимидриатическое действие [12]. Этот эффект носит дозозависимый характер и может быть использован в лечении первичной закрытоугольной глаукомы и пигментного дисперсионного синдрома [13].
1.2. Фармакокинетика Бримонидина
Бримонидин — это основной α2-агонист, используемый для лечения глаукомы в настоящее время [14]. (К другим препаратам, избирательно стимулирующим α2-адренорецопторы, относятся также клонидина гидрохлорид и апраклонидина гидрохлорид, различающиеся между собой выраженностью системных побочных эффектов вследствие различной степени селективности к адренорецепторам (Примечание автора)). Бримонидин в 30 раз более селективен для α2-, чем для α1-рецепторов [15], и, подобно другим α-адреномиметикам, снижает уровень ВГД за счет сокращения выработки ВГЖ и увеличения ее увеосклерального оттока [16].
Доклинические исследования на мышах, кроликах и обезьянах, в которых концентрация Бримонидина в плазме в 118 раз превышала терапевтические уровни для человека, выявили высокую безопасность препарата, причем его концентрации 0,08, 0,2 и 0,5% оказались одинаково безопасными и эффективными в снижении уровня ВГД [17].
Всасывание Бримонидина происходит преимущественно через роговицу и конъюнктиву. Его гипотензивное действие начинается уже через 20 мин после инстилляции, достигая максимума через 2 ч, и сохраняется в течение 12 ч [18]. Средние показатели снижения пикового уровня ВГД через 2—3 ч после применения составляют приблизительно 6 мм рт.ст., а через 10—14 ч — около 4 мм рт.ст. [14, 16]. Клинические исследования не показали статистически достоверного снижения значений ВГД в ночное время на фоне закапывания Бримонидина [19, 20].
Метаболизм Бримонидина происходит в печени, а выводится вещество преимущественно почками, сохраняясь в плазме в течение 2 ч. Благодаря быстрому метаболизму и системному клиренсу он не дает серьезных побочных эффектов со стороны сердечно-сосудистой системы и легких. В отличие от β-блокаторов он не противопоказан при патологии сердечно-сосудистой системы или легких. При быстром всасывании препарат распределяется в радужной оболочке, цилиарном теле, стекловидном теле, сосудистой оболочке, сетчатке и зрительном нерве. Бримонидин можно применять 2—3 раза в сутки, но большинство исследований его использования и эффективности основываются на двукратной суточной дозе [14, 18].
Бримонидин применяется в виде как 0,15%, так и 0,1% раствора с консервантом «Пурит» 0,005%, при этом pH составляет 7,7, так и в концентрации Бримонидин 0,2% с консервантом бензалкония хлоридом (в пересчете на вещество 0,052 мг и поливиниловым спиртом). Согласно некоторым авторам, применение Бримонидина в концентрации 0,2% дает более выраженный гипотензивный эффект и позволяет снизить частоту закапываний до 2 раз в сутки [21]. В других исследованиях не было отмечено различия в степени гипотензивного эффекта разных концентраций Бримонидина на пике действия препарата [22]. Несмотря на разную концентрацию, все формы препарата одинаково хорошо проникают через роговицу [23].
1.3. Гипотензивная эффективность Бримонидина в сравнительном аспекте с другими антиглаукомными препаратами
Снижение значений ВГД при использовании Бримонидина составляет в среднем 20—30%, при этом число пациентов без лечебного эффекта не превышает 10%. В течение многих лет Бримонидин эффективно применялся как основной препарат для профилактики повышения уровня ВГД после проведения аргоновой лазерной трабекулопластики и факоэмульсификации катаракты [24, 25].
Эффективность Бримонидина в снижении показателей ВГД аналогична тимололу [26]. По результатам крупного популяционного исследования, Бримонидин дает наибольшую эффективность в снижении уровня ВГД при использовании его в качестве монотерапии (–20,2%), чем в комплексном лечении глаукомы (–16,9%) или при ее заместительной (–9,8%) терапии [27]. Препарат эффективен также в лечении нормотензивной глаукомы [28].
Немало клинических исследований посвящено сравнению эффективности Бримонидина и β-блокаторов. Было установлено, например, что трехкратное суточное использование Бримонидина 0,2% обеспечивает более низкие показатели среднего дневного ВГД (18,0±2,2), чем его двукратное суточное использование (19,2±2,4), и средние дневные значения ВГД при двукратном его закапывании аналогичны двукратному суточному применению тимолола 0,5% (17,7±2,7) [29]. Ретроспективное исследование на 926 пациентах с внутриглазной гипертензией или глаукомой показало, что в отличие от пациентов, получавших тимолол одновременно с системными β-блокаторами, пациенты, лечившиеся Бримонидином, не испытывали значительного изменения средней частоты сердечных сокращений или систолического и диастолического артериального давления. Бримонидин также является более безопасной альтернативой β-блокаторам у пожилых пациентов с глаукомой. Двукратное суточное применение Бримонидина дополнительно снижает среднее ВГД на 8,2%, когда он заменяет β-блокаторы у пожилых больных [30].
В литературе есть данные о том, что, хотя гипотензивная эффективность Бримонидин сопоставима с таковой у тимолола при краткосрочной терапии, он эффективнее тимолола в долгосрочных исследованиях, длившихся от 1 года [31] до 4 лет [32].
По сравнению с бетаксололом Бримонидин снижает уровень ВГД на 20% у более значительного количества пациентов [33]. Обеспечивая более выраженное снижение пикового давления (5,8 мм рт.ст.), чем бетаксолол (3,8 и 3,2 мм рт.ст. соответственно), он оказался неэффективным лишь в 2,9% случаев по сравнению с бетаксололом (в 4,2% случаев) [34].
В качестве монотерапии эффективность Бримонидина в снижении уровня ВГД эквивалентна дорзоламиду [35].
Сравнение монотерапии Бримонидином 0,2% 2 раза в сутки с латанопростом 0,005% 1 раз в сутки выявило более высокую эффективность Бримонидина [36]. Однако в другом исследовании были получены иные результаты, согласно которым закапывание Бримонидина приводило к менее выраженному снижению уровня ВГД (с 23,7±5,6 до 21,9±5,7 мм рт.ст.), чем латанопроста (с 21,6±5,1 до 17,1±3,3 мм рт.ст.) (p=0,001) [37].
Добавление Бримонидина к тимололу дополнительно снижает показатели ВГД от 15,5 [38] до 25% [39], а добавление к латанопросту — на 32% [38]. Применение комбинации бримонидина с латанопростом обеспечивает более существенное снижение уровня ВГД (39,0%) по сравнению с фиксированной комбинацией дорзоламида с тимололом (25,1%) через 1 и 3 мес — 33,4 и 26,3% соответственно [40]. В то же время, согласно данным других исследователей, Бримонидин не столь эффективен, как другие препараты, при комбинации с латанопростом и обеспечивает дополнительное снижение уровня ВГД лишь в пределах 15,5 (3,63 мм рт.ст.) — 20,1% (6,62 мм рт.ст.) [38].
У пациентов с нормотензивной глаукомой Бримонидин был менее эффективен в снижении значений ВГД, чем латанопрост, особенно в утренние часы (11,7±2,2 против 13,7±2,1 мм рт.ст., р=0,004), но в равной степени эффективен для снижения уровня ВГД в 12 ч дня (11,5±2,6 против 11,5±2,3 мм рт.ст., p=0,967) [28].
Последние данные литературы свидетельствуют о том, что назначение Бримонидина в качестве четвертого препарата при ежедневном закапывании позволяет дополнительно (на 20%) снизить показатели ВГД при краткосрочном исследовании (50 дней) и в долгосрочном периоде (более 1 года) [41].
2. Безопасность и переносимость Бримонидина
Для адренергических препаратов характерны местные побочные эффекты, которые включают раздражение и гиперемию конъюнктивы, расширение зрачка, фолликулярный конъюнктивит, адренохромные отложения и риск развития кистозного макулярного отека в афакических или псевдофакических глазах [42]. Такие побочные реакции, как фолликулярный конъюнктивит и контактный дерматит, гиперемия и дискомфорт в глазах, нередко являются причиной отмены закапывания α-адреномиметиков.
Аллергические реакции на Бримонидин могут возникать у 25% пациентов [43], при этом развитие фолликулярного конъюнктивита — у 10—12% больных в течение первого года лечения. Это число снижается до 4% новых случаев в год к 3-му году наблюдения. Особенно высок риск развития аллергических реакций в течение первых 2 нед после начала лечения (среднее время от 14,8 до17,9 дня). Наличие в анамнезе аллергических реакций на глазные капли (p=0,048) и местные β-блокаторы (p=0,019), а также сниженное образование слезы (p=0,044) часто ассоциируются с развитием аллергической реакции глаз на Бримонидина тартрат 0,2% [44]. Более того, у пациентов, страдающих от аллергии на Бримонидин, нередко развиваются аллергии на последующее применение других местных гипотензивных препаратов [45]. В литературе описано несколько клинических случаев развития переднего гранулематозного увеита и папиллярного конъюнктивита на фоне лечения Бримонидином [46, 47]. Данное осложнение может возникнуть даже спустя год после начала лечения Бримонидином или его фиксированной комбинацией с тимололом [48]. Процесс благополучно разрешается в сроки от 4 дней до 8 нед после отмены препарата [47]. Причины подобного осложнения до сих пор не известны. Тот факт, что процесс развивается отсроченно и/или, как правило, является продолжением конъюнктивита, может свидетельствовать об активации Т-лимфоцитов и макрофагов. Было также замечено, что увеиту в этих случаях чаще подвержены артифакичные глаза. Это может быть следствием большего проникновения препарата через роговицу, ранее подвергнутую хирургической травме.
В некоторых случаях могут наблюдаться контактный дерматит, раздражение глаз, передний увеит и гиперемия. Однако, согласно клиническим испытаниям, только у 1—2% пациентов с такими побочными эффектами требовалась отмена Бримонидина [49]. Вероятность развития аллергической реакции, связанной с эффектами α-агонистов, обусловлена их способностью уменьшать объем клетки, увеличивать скорость движения межклеточной жидкости и обеспечивать более легкий доступ провоспалительных медиаторов к субконъюнктивальной ткани.
К системным побочным эффектам α-адреномиметиков относятся гипертония или, напротив, гипотензия, головная боль и сердечная аритмия. Часто пациенты отмечают головокружение и усталость [50]. Практически каждый 3-й пациент страдает от сухости во рту, но этот побочный эффект редко является причиной отмены препарата.
Бримонидин не показан в последний триместр беременности из-за угрозы побочных действий со стороны центральной нервной системы (ЦНС) у плода [51].
Подробно изучены побочные эффекты при использовании Бримонидина у детей. Они включают брадикардию, гипотензию, гипотермию, гипотонию, заторможенность и апноэ [35, 52]. Сонливость отмечается в 40,9% случаев. Менее выраженными симптомами являются атаксия, бледность, раздражительность, гипотензия, брадикардия, сужение зрачков и дыхательная недостаточность. S. Al-Shahwan и соавт. (2005) провели проспективное исследование побочных эффектов применения Бримонидина у 83 детей с первичной и вторичной врожденной глаукомой. У 76% пациентов были выявлены повышенная сонливость и заторможенность, у 49% — зуд и покраснение глаз, у 39% — чувство жжения в глазах. Заторможенность отмечалась только у детей с массой тела менее 20 кг и в возрасте младше 6 лет [53].
R. Bowman и соавт. (2004) провели ретроспективную оценку данных амбулаторных карт 23 детей, которым был назначен Бримонидин 0,2%. Длительность лечения варьировала от 1 дня до 75 мес. У 2 пациентов наблюдалось местное раздражение/аллергия, у 2 — усталость и у 2 — обморочные состояния, связанные с низким артериальным давлением [54]. Ретроспективный обзор данных о побочных эффектах Бримонидина 0,2% у 32 детей младше 2 лет с врожденной глаукомой выявил заторможенность в 7 случаях, что привело к дальнейшей отмене лекарственного препарата [55]. Применение Бримонидина у детей до полугода опасно из-за высокого риска развития угнетения деятельности сердца, легких и ЦНС [56]. В этой связи данный препарат им противопоказан.
Чтобы предотвратить вредные последствия, вызванные побочными эффектами местных гипотензивных препаратов, включая Бримонидин, врачам крайне важно иметь полную информацию обо всех лекарственных средствах, принимаемых пациентом. Для этого необходимы не только сбор анамнеза, но и детальное его документирование в амбулаторных картах. Анализ медицинских карт 100 пациентов одного специалиста по глаукоме выявил, что наименование глазных капель присутствовало в картах только в 55% случаев. Применение α-агонистов указывалось значительно реже (13%), чем β-адреноблокаторов (47%) и аналогов простагландинов (44%) [57]. Заслуживает также внимания использование поливинилового спирта в качестве консерванта. Это обусловлено тем, что поливиниловый спирт смешивается с остатками нативной слезы и стабилизирует прероговичную слезную пленку, преимущественно за счет восстановления ее водного компонента. Поливиниловый спирт может использоваться как лубрикант для глазных капель и контактных линз, а также для улучшения доставки и высвобождения действующего вещества глазных препаратов [58]. В этой связи 0,2% раствор Бримонидина тартрата, содержащий в своем составе дополнительный увлажняющий компонент в виде поливиниловаого спирта, что может смягчить проявление синдрома сухого глаза, сопровождающего лечение пациентов с глаукомой. Для дополнительного увлажнения глаз могут быть использованы различные слезозаменители. Особого внимания среди них заслуживает Артелак Баланс Уно, который благодаря содержащемуся в нем витамину В12 защищает клетки конъюнктивы и роговицы от окислительного стресса, что особенно важно при лечении глаукомы [59].
В заключение следует подчеркнуть, что, несмотря на широкое применение Бримонидина в практике офтальмолога, данный препарат до сих пор воспринимается врачами только как гипотензивное средство. В следующей части обзора будут рассмотрены нейропротекторные свойства Бримонидина, а также его влияние на глазную гемодинамику, что позволит пересмотреть место данного препарата в спектре антиглаукомной терапии.
Автор заявляет об отсутствии конфликта интересов.
Сведения об авторах
Курышева Наталия Ивановна — д-р мед. наук, профессор, руководитель консультативно-диагностического отдела (КДО) Центра офтальмологии ФМБА России
