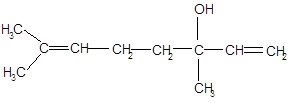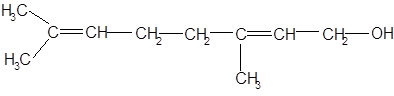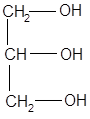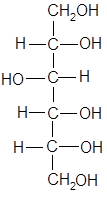Алифатические спирты что это
Алифатические спирты
Этиловый спирт (этанол, винный спирт) С2Н5ОН. Бесцветная жидкость с характерным слабым запахом и жгучим вкусом. Хорошо растворяется в воде. При смешении его с водой уменьшается объем полученного раствора и выделяется тепло. Явление уменьшения объема при смешивании спирта и воды получило название контракции. При смешивании, например, 100 л Н2О + 100 л спирта, контракция – 7,2 л. Явление контракции имеет важное производственное значение и его необходимо учитывать при спиртовании вин, составлении купажей вин и коньяков.
При сбраживании 1 г сахара теоретически должно получится 0,6479 мл спирта, однако получается 0,6 мл. Фактический выход зависит от исходной сахаристости сусла, длительности брожения и расы дрожжей.
При выдержке вина, в процессе технологической обработки вин (теплом, оклейке и др.) содержание спирта уменьшается вследствие окисления и этерификации (до 0,2 % об). Потери спирта при получении ряда специальных вин – хереса, мадеры могут составлять до 1 % об.
Алифатические спирты: пропиловый, бутиловый, амиловый, гексиловый и другие, а также их изомеры относятся к так называемым «высшим спиртам». Они слабо растворимы в воде, дают красное окрашивание с салициловым альдегидом или парадиметиламинобензальдегидом. Эта реакция используется для их количественного определения.
При выдержке и обработке вин содержание высших спиртов уменьшается в результате окисления и этерификации. Если первая переливка задерживается, то количество высших спиртов в нем может заметно увеличиться.
Ненасыщенные алифатические спирты в винограде и вине представлены главным образом терпеновыми спиртами. К ним относятся следующие.
В винограде и вине, помимо вышеперечисленных терпеновых спиртов, содержатся также нерол, фарнезол, цитронеллол.
Алифатические многоатомные спирты.
бутиленгликоль глицерин сорбит
В вине содержание многоатомных спиртов:
Обычно на 100 г спирта при брожении образуется 6-12 г глицерина, как вторичного продукта. Глицерина и 2,3 бутиленгликоля больше в винах, полученных из сульфитированного сусла или из винограда пораженного Ботритис цинерия. Маннит накапливается в результате маннитного брожения под действием бактерий.
В винах инозит при хранении полностью исчезает, так как с Н3РО4, образует инозитфосфорную кислоту. Кальциевые и магниевые соли этой кислоты называются фитином. В семенах винограда фитина содержится до 0,35 %. Фитин используется для удаления железа и меди из вин и коньячных спиртов.
Дата добавления: 2015-07-24 ; просмотров: 3489 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Алифатические спирты. Общая характеристика, химико-токсикологический анализ.
Метиловый спирт (метанол) — бесцветная жидкость (т. кип. 64,5 °С, плотность 0,79), смешивающаяся во всех соотношениях с водой и многими органическими растворителями. Метиловый спирт ядовит, он горит бледно-голубым некоптящим пламенем, с хлоридом кальция дает соединение СаС1 2 •4СН 3 ОН, а с оксидом бария образует кристаллы ВаО•2СН 3 ОН. Метиловый спирт по запаху и вкусу почти не отличается от этилового. Известны случаи отравления метиловым спиртом, ошибочно принятым вместо этилового.
В природе метиловый спирт в свободном состоянии почти не встречается. Распространены его производные — эфирные масла, сложные эфиры и др. Раньше метиловый спирт получали путем сухой перегонки дерева. Поэтому и до сих пор неочищенный метиловый спирт, полученный сухой перегонкой дерева, называют древесным спиртом. В настоящее время используется несколько промышленных синтетических способов получения метилового спирта.
Применение. Действие на организм. Метиловый спирт широко используется в промышленности как растворитель лаков, красок, как исходное вещество для получения хлористого метила, диметилсульфата, формальдегида и ряда других химических соединений. Он применяется для денатурации этилового спирта, входит в состав антифриза.
При помощи этой реакции можно обнаружить еще 0,3 мг метилового спирта в пробе.
Окисление метилового спирта. Большинство реакций обнаружения метилового спирта основано на окислении его до формальдегида и определении последнего при помощи реакций окрашивания.
Прежде чем приступить к окислению метилового спирта до формальдегида, необходимо проверить наличие этого альдегида в исследуемом растворе.
Обнаружение метилового спирта после его окисления. После окисления метилового спирта до формальдегида последний определяют при помощи реакций с хромотроповой кислотой, фуксин-сернистой кислотой и с резорцином.
Этиловый спирт С2Н5ОН (этанол, этиловый алкоголь, винный спирт) — бесцветная, летучая жидкость с характерным запахом, жгучая на вкус (пл. 0,813—0,816, т. кип. 77—77,5 °С). Этиловый спирт горит синеватым пламенем, смешивается во всех соотношениях с водой, диэтиловым эфиром и многими другими органическими растворителями, перегоняется с водяным паром.
Этиловый спирт получают путем брожения крахмалсодержащих продуктов (зерно, картофель), фруктов, сахара и т. д. Полученный брожением этиловый спирт отгоняют и получают спирт-сырец, который очищают путем ректификации. Спирт-сырец и самогон, изготовленные в домашних условиях, содержат некоторое количество сивушных масел. Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство. Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым воздухом.
Выводы о степени опьянения и о смертельных отравлениях этиловым спиртом делают на основании результатов определения этого спирта в крови. При обнаружении в крови менее 0,3 % 0 этилового спирта делают вывод об отсутствии влияния этого спирта на организм. Легкое опьянение характеризуется наличием в крови 0,5—1,5 % 0 этилового спирта. При опьянении средней степени в крови обнаруживается 1,5—2,5 % 0, а при сильном опьянении— 2,5—3,0 % 0 этилового спирта. При тяжелом отравлении в крови содержится 3—5 % 0, а при смертельном отравлении — 5—6 % 0 этилового спирта.
Часть этилового спирта (2—10 %) выделяется из организма в неизмененном виде с мочой, выдыхаемым воздухом, потом, слюной, калом и т. д Остальное количество этого спирта подвергается метаболизму. Причем метаболизм этилового спирта может происходить несколькими путями. Определенное количество этилового спирта окисляется с образованием воды и оксида углерода (IV). Несколько большее количество этого спирта окисляется до уксусного альдегида, а затем до уксусной кислоты.
При исследовании органов трупов (желудок с содержимым, печень, почки и др.) на наличие этилового спирта его отгоняют с водяным паром. Обнаружение этилового спирта производят при помощи описанных ниже реакций. Для обнаружения этилового спирта в крови и моче применяют метод газожидкостной хроматографии.
Реакция образования йодоформа. При нагревании этилового спирта с раствором иода и щелочью образуется йодоформ (CHJ 3 ), имеющий специфический запах:
специфична на этиловый спирт. Ее дают ацетон, молочная кислота и др.
Реакция этерификации. Для этерификации этилового спирта применяют ацетат натрия и хлористый бензоил.
1. Реакция образования уксусно-этилового эфира. Этиловый спирт с ацетатом натрия в присутствии серной кислоты образует уксусно-этиловый эфир, имеющий характерный запах:
Запах уксусно-этилового эфира более отчетливо ощущается, если содержимое пробирки вылить в 20—25-кратный объем воды.
2. Реакция образования этилбензоата. При взаимодействии этилового спирта с бензоилхлоридом (хлористым бензоилом) образуется этилбензоат, имеющий характерный запах:
Распознаванию запаха этилбензоата мешает избыток бензоилхлорида, имеющего неприятный запах. Поэтому для разложения избытка бензоилхлорида прибавляют раствор щелочи:
Реакция образования ацетальдегида. Этиловый спирт окисляется дихроматом калия, перманганатом калия и некоторыми другими окислителями до ацетальдегида:
Окисление этилового спирта и обнаружение его по ацетальдегиду. Ацетальдегид, образующийся при окислении этилового спирта, можно обнаружить при помощи реакции с нитропруссидом натрия и морфолином. С этой целью 2—3 капли раствора 4, содержащего ацетальдегид, наносят на капельную пластинку или на фильтровальную бумагу и прибавляют каплю реактива (свежеприготовленная смесь равных объемов 20 %-го водного раствора морфолина и 5 %-го водного раствора нитропруссида натрия). При наличии ацетальдегида в растворе появляется синяя окраска.
Предел обнаружения: 1 мкг ацетальдегида в пробе.
Эту реакцию дают акролеин и некоторые другие альдегиды. Реакцию с морфолином и нитропруссидом натрия дает пропионовый альдегид только при высокой его концентрации. Формальдегид не дает этой реакции. Поэтому реакцию окисления этилового спирта до ацетальдегида и обнаружение его с морфолином и нитропруссидом натрия можно использовать для различия метилового и этилового спиртов.
Обнаружение этилового спирта в напитках и растворах методом газожидкостной хроматографии
Количественное определение этилового спирта в крови и моче методом газожидкостной хроматографии
Изоамиловый спирт (СН 3 ) 2 —СН—СН 2 —СН 2 —ОН (2-метил-бутанол-4 или изобутилкарбинол) представляет собой оптически неактивную жидкость (т. кип. 132,1 °С, пл. 0,814 при 20 °С), имеющую неприятный запах.
Изоамиловый спирт (2-метилбутанол-4) является главной составной частью сивушных масел. В состав сивушных масел входят также оптически активный изоамиловый спирт СН 3 —СН 2 —СН(СН 3 )—СН 2 —ОН (2-метилбутанол-1), изобутило-вый спирт и нормальный пропиловый спирт. Кроме этих спиртов в сивушных маслах в незначительных количествах содержатся жирные кислоты, их эфиры и фурфурол. Наличием 2-метилбутанола-4 в сивушных маслах объясняется его резкий неприятный запах и высокая токсичность. Изоамиловый спирт (2-метилбутанол-4) является побочным продуктом спиртового брожения углеводов, содержащихся в свекле, картофеле, фруктах, зернах пшеницы, ржи, ячменя и других сельскохозяйственных культурах.
Часть дозы изоамилового спирта, поступившего в организм, превращается в альдегид изовалериановой кислоты, а затем в изовалериановую кислоту. Некоторое количество неизмененного изоамилового спирта и указанных выше метаболитов выделяются из организма с мочой и с выдыхаемым воздухом.
Реакция с салициловым альдегидом. Изоамиловый спирт с салициловым альдегидом в присутствии конц. серной кислоты дает окраску (реакция Комаровского). По одним данным, при этой реакции конц. серная кислота отнимает воду от изоамилового спирта, в результате чего образуется изоамилен (СН 3 ) 2 —СН—СН=СН 2, который взаимодействует с салициловым альдегидом. Согласно другим данным, конц. серная кислота окисляет изоамиловый спирт. Образовавшийся при этом альдегид изовалериановой кислоты вступает в реакцию конденсации с салициловым альдегидом.
Эту реакцию дают спирты, содержащие более трех атомов углерода в молекуле. Не дают этой реакции метиловый и этиловый спирты.
Эту реакцию не дают метиловый и этиловый спирты. Ее дают высшие спирты.
Реакция образования изоамилацетата. Эта реакция основана на том, что при взаимодействии ацетата натрия с изоамиловым спиртом в присутствии конц. серной кислоты образуется изоамилацетат, имеющий запах грушевой эссенции:
Реакция окисления изоамилового спирта. Изоамиловый спирт под влиянием перманганата калия в присутствии конц. серной кислоты окисляется до альдегида изовалериановой кислоты (СН 3 ) 2 —СН—СН 2 —СНО, а затем до изовалериановой кислоты (СН 3 ) 2 —СН—СН 2 —СООН.
Спирты и фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация спиртов
По числу гидроксильных групп:
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
Классификация по строению углеводородного радикала
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5 о С). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
Например, пропандиол-1,2 (пропиленгликоль):
Изомерия спиртов
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
| Таким образом, для спиртов характерны следующие свойства: 1. Кислотные свойства
1.1. Взаимодействие с раствором щелочейПри взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой. Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей. Многоатомные спирты также не реагируют с растворами щелочей. 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты. Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Многоатомные спирты также реагируют с активными металлами: 1.3. Взаимодействие с гидроксидом меди (II)Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
2. Реакции замещения группы ОН2.1. Взаимодействие с галогеноводородамиПри взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
|