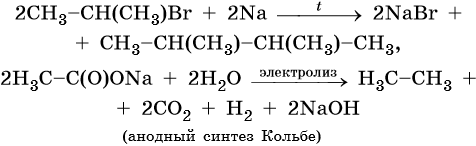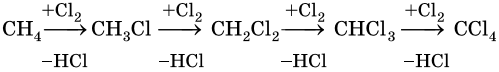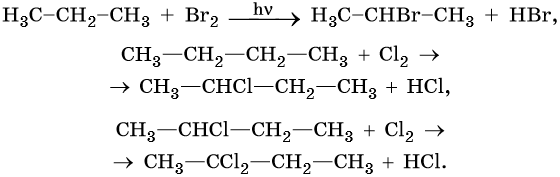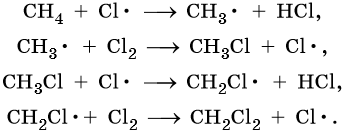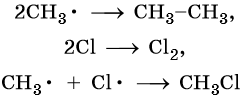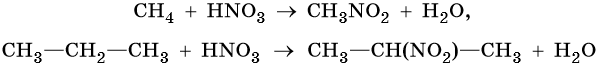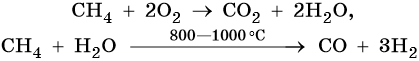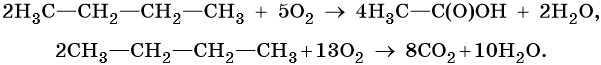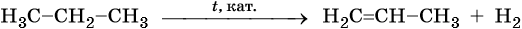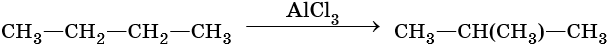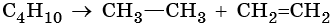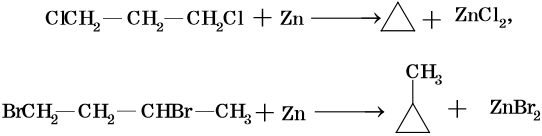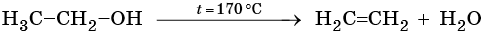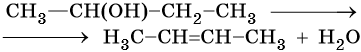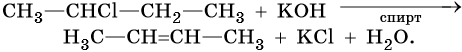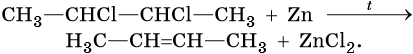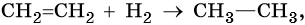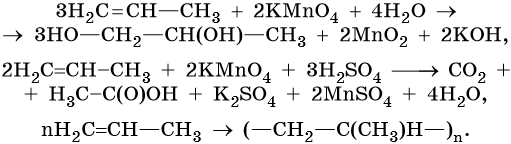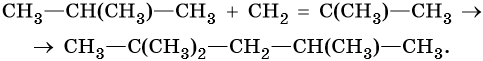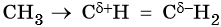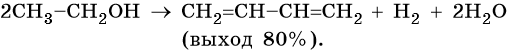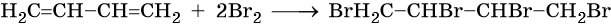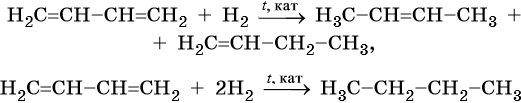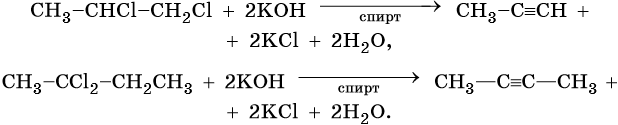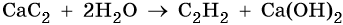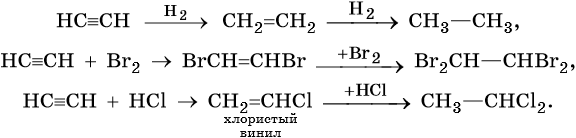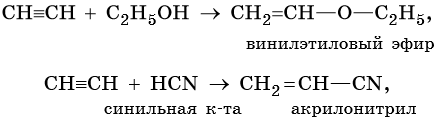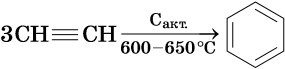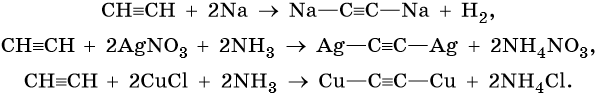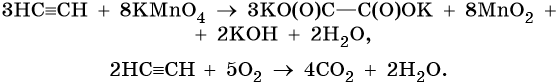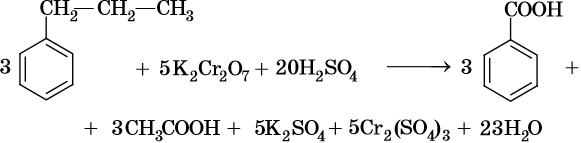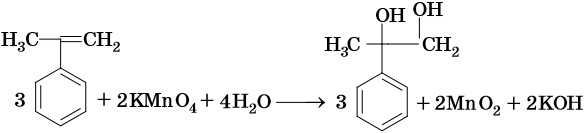Алифатические углеводороды что это
Алифатические углеводороды
Смотреть что такое «Алифатические углеводороды» в других словарях:
Жирные углеводороды, или алифатические углеводороды — ► aliphatics, aliphatic hydrocarbons Углеводороды с открытой цепью. Представлены следующими гомологическими рядами: ■ метановые углеводороды СnН2n+2 ■ олефиновые (этиленовые) углеводороды СnН2n с одной двойной связью ■ ацетиленовые углеводороды… … Нефтегазовая микроэнциклопедия
УГЛЕВОДОРОДЫ МЕТАНОВЫЕ (АЛКАНЫ, ПАРАФИНЫ) — насыщенные алифатические углеводороды (см. Соединения алифатические (жирные) общей формулы CnH2n+2. Низшие члены ряда У. м. до бутана (С4H10) включительно вещества газообразные при комнатной температуре, от С5Н12 до С15Н32 жидкости, от С16Н34… … Геологическая энциклопедия
углеводороды — см. алифатические углеводороды. карбоциклические углеводороды … Идеографический словарь русского языка
углеводороды — углеводороды: Смесь паров всех несгоревших и частично окисленных углеводородов топлива и масла, образующихся в процессах горения топлива и выпуска продуктов сгорания из цилиндра, обозначаемая символом СН. Источник … Словарь-справочник терминов нормативно-технической документации
Алифатические соединения — в органической химии соединения, не содержащие ароматических связей. Алифатические соединения могут представлять собой открытые цепи (ациклические соединения) или замкнутые (алициклические или циклоалифатические соединения).[1] Иногда к… … Википедия
УГЛЕВОДОРОДЫ — (УВ) органические соединения, молекулы которых состоят только из атомов углерода и водорода. Являются важнейшими компонентами нефти и природного газа, продуктов их переработки. Широко применяют как сырье в промышленности, как топливо и др.… … Российская энциклопедия по охране труда
Углеводороды — орг. соединения, состоящие только из углерода и водорода газообразные, жидкие и твердые в зависимости от молекулярного веса и от хим. структуры. Существуют У. с открытой цепью (см. Соединения алифатические (жирные) и циклические, Соединения… … Геологическая энциклопедия
Углеводороды суммарные — cmHn Углеводороды алифатические предельные С, С|0 (в пересчете на С), относящиеся к классу опасности IV Источник: ГОСТ Р 51206 98: Автотранспорт … Словарь-справочник терминов нормативно-технической документации
углеводороды — органические соединения, молекулы которых построены только из атомов углерода и водорода. Различают алифатические, или ациклические, углеводороды, в молекулах которых атомы углерода образуют линейные или разветвлённые «открытые» цепи (например,… … Энциклопедический словарь
алифатические соединения — (от греч. áleiphar, род. п. aléiphatos жир) (жирные соединения, ациклические соединения), органические соединения, в молекулах которых атомы углерода образуют «открытые» линейные (алифатические соединения нормального строения) или разветвлённые… … Энциклопедический словарь
Алифатические углеводороды: свойства, номенклатура, реакции, типы
Содержание:
В Алифатические углеводороды Все они не обладают ароматичностью, но не с запахом, а с точки зрения химической стабильности. Подобная классификация углеводородов в настоящее время является слишком неоднозначной и неточной, поскольку она не делает различий между различными типами углеводородов, которые не являются ароматическими.
Таким образом, мы имеем алифатические углеводороды и ароматические углеводороды. Последние распознаются по их основной единице: бензольному кольцу. Другие, с другой стороны, могут иметь любую молекулярную структуру: линейную, разветвленную, циклическую, ненасыщенную, полициклическую; до тех пор, пока у них нет сопряженных систем, таких как бензол.
Термин «алифатический» произошел от греческого слова «алейфар», что означает жир, которое также используется для обозначения масел. Поэтому в XIX веке эта классификация была отнесена к углеводородам, полученным из масляных экстрактов; в то время как ароматические углеводороды извлекались из древесных и ароматных смол.
Однако по мере того, как основы органической химии были укреплены, было обнаружено, что существует химическое свойство, которое дифференцирует углеводороды, даже более важное, чем их природные источники: ароматичность (а не запах).
Таким образом, алифатические углеводороды перестали быть только углеводородами, полученными из жиров, а не только теми, которые не имеют ароматичности. В этом семействе есть алканы, алкены и алкины, независимо от того, линейны они или циклические. Вот почему термин «алифатический» считается неточным; хотя полезно затронуть некоторые общие аспекты.
Свойства алифатических углеводородов
Свойства алифатических углеводородов различаются в разной степени в зависимости от того, какие из них рассматриваются. Есть вещества с низкой и высокой молекулярной массой, а также линейные, разветвленные, циклические или полициклические, даже с удивительной трехмерной структурой; как и у кубинца, кубовидной формы.
Однако можно упомянуть некоторые общие моменты. Большинство алифатических углеводородов являются гидрофобными и неполярными газами или жидкостями, причем некоторые из них более неполярны, чем другие, поскольку даже те, в углеродных цепях которых содержатся атомы галогена, кислорода, азота или серы, включены в список.
Точно так же они являются легковоспламеняющимися соединениями, поскольку они подвержены окислению на воздухе с минимальным источником тепла. Эта характеристика становится более опасной, если мы добавим ее высокую летучесть из-за слабых дисперсионных взаимодействий, которые удерживают вместе алифатические молекулы.
Мы видим это, например, в бутане, газе, который относительно легко сжижается, как пропан. Оба они очень летучие и легковоспламеняющиеся, что делает их активными компонентами кухонного газа или карманных зажигалок.
Конечно, эта летучесть имеет тенденцию к снижению по мере увеличения молекулярной массы, и углеводород создает все более вязкие и маслянистые жидкости.
Номенклатура
Номенклатура углеводородов отличается даже больше, чем их свойства. Если они представляют собой алканы, алкены или алкины, соблюдаются те же правила, установленные IUPAC: выберите самую длинную цепь, присвоив самые низкие индикаторные числа наиболее замещенному концу или наиболее реакционноспособным гетероатомам или группам.
Таким образом, известно, на каком углероде находится каждый заместитель, или даже ненасыщенности (двойные или тройные связи). В случае циклических углеводородов названию предшествуют заместители, перечисленные в алфавитном порядке, за которыми следует слово «цикл», считая количество атомов углерода, которые его составляют.
Например, рассмотрим следующие два циклогексана:
Циклогексан А называется 1,4-диметилциклогексаном. Если бы в кольце было пять атомов углерода, это был бы 1,4-диметилциклопентан. Между тем, циклогексан В называют 1,2,4-триметилциклогексаном, а не 1,4,6-циклогексаном, поскольку он стремится использовать самые низкие показатели.
Теперь номенклатура углеводородов с причудливой структурой может стать очень сложной. Для них есть более конкретные правила, которые нужно объяснять отдельно и внимательно; точно так же, как диены, терпены, полиены и полициклические соединения.
Реакции
Горение
К счастью, для этих углеводородов реакции менее разнообразны. Об одном из них уже упоминалось: они легко горят, образуя диоксид углерода и воду, а также другие оксиды или газы в зависимости от наличия гетероатомов (Cl, N, P, O и т. Д.). Однако СО2 и H2Или они являются основными продуктами горения.
Дополнение
Если они имеют ненасыщенность, они могут вступать в реакции присоединения; то есть они включают небольшие молекулы в свои основные цепи в качестве заместителей по определенному механизму. Среди этих молекул есть вода, водород и галогены (F2, Cl2, Br2 и я2).
Галогенирование
Растрескивание
Другой реакцией, которой могут подвергаться алифатические углеводороды, особенно длинноцепочечные алканы, является термический крекинг. Он заключается в подаче интенсивного тепла, так что тепловая энергия разрывает связи C-C, образуя, таким образом, небольшие молекулы, более ценимые на рынке топлива, из больших молекул.
Вышеупомянутые четыре реакции являются основными, через которые может пройти алифатический углеводород, причем горение является наиболее важным из всех, поскольку оно не дискриминирует какое-либо соединение; все будут гореть в присутствии кислорода, но не все будут добавлять молекулы или распадаться на маленькие молекулы.
Типы
Алифатические углеводороды группируют множество соединений, которые, в свою очередь, классифицируются более определенным образом, указывая степень их ненасыщенности, а также тип структуры, которую они имеют.
В зависимости от того, насколько они ненасыщенные, у нас есть алканы (насыщенные), алкены и алкины (ненасыщенные).
Это связано с тем, что двойные и тройные связи представляют собой энергетические и стерические ограничения при их вращении, «укрепляя» их структуру.
Алканы, алкены и алкины могут быть разветвленными, циклическими или полициклическими. Вот почему циклоалканы, циклоалкены, циклоалкины и соединения, такие как декалин (с бицикло-структурой), адамантан (похожий на бейсболку), гептален, гонан и другие, также считаются алифатическими углеводородами.
Другие типы углеводородов происходят из алкенов, таких как диены (с двумя двойными связями), полиены (с множеством чередующихся двойных связей) и терпены (соединения, полученные из изопрена, диена).
Приложения
Опять же, использование этих углеводородов может варьироваться в зависимости от того, какой из них рассматривается. Однако в разделах свойств и реакций было указано, что все они горят не только с выделением газообразных молекул, но также с выделением света и тепла. Таким образом, они являются резервуарами энергии, которые могут использоваться в качестве топлива или источников тепла.
Вот почему они используются в составе бензина, природного газа, в горелках Бунзена и вообще для разжигания огня.
Одним из наиболее ярких примеров является ацетилен, HC≡CH, горение которого позволяет возбуждать ионы металла в образце в атомно-абсорбционной спектрометрии, проводимой в аналитических испытаниях. Также возникший огонь можно использовать для сварки.
Жидкие алифатические углеводороды, такие как парафиновые, часто используются в качестве растворителей для экстракции жиров. Кроме того, его растворяющее действие может использоваться для удаления пятен, эмали, красок или просто для приготовления растворов определенного органического соединения.
Те, у кого самая высокая молекулярная масса, вязкие или твердые, используются для производства смол, полимеров или лекарств.
Что касается термина «алифатический», то он обычно используется для обозначения тех участков в макромолекуле, которые не имеют ароматичности. Например, асфальтены поверхностно описываются как ароматическое ядро с алифатическими цепями.
Примеры
То же самое касается этилена, CH2= CH2, пропен, CH3CH = CH2, бутен, CH3CH2CH = CH3, а для остальных алкинов. Если есть две двойные связи, они диены, а если их больше двух, полиены. Точно так же в одном каркасе могут быть двойные и тройные связи, что увеличивает сложность структуры.
Среди циклоалканов можно упомянуть циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, а также циклогексен и циклогексин. Разветвленные производные, в свою очередь, получают из всех этих углеводородов, количество доступных примеров (таких как 1,4-диметилциклогексан) еще больше.
Ссылки
24 части человеческого сердца (анатомия и функции)
Разница между алифатическими и ароматическими углеводородами
Углеводороды представляют собой соединения, которые состоят только из атомов углерода и атомов водорода, связанных друг с другом через ковалентные связи. Эти соединения могут быть разделены на две гр
Содержание:
Углеводороды представляют собой соединения, которые состоят только из атомов углерода и атомов водорода, связанных друг с другом через ковалентные связи. Эти соединения могут быть разделены на две группы в зависимости от расположения атомов. Это алифатические углеводороды и ароматические углеводороды. Алифатические углеводороды представляют собой органические соединения, состоящие из атомов углерода и водорода, расположенных в виде прямых цепей, разветвленных структур или неароматических кольцевых структур. Ароматические углеводороды представляют собой соединения, состоящие из атомов углерода и водорода в кольцевых структурах с делокализованными пи-электронами. Основное различие между алифатическими и ароматическими углеводородами заключается в том, что алифатические углеводороды имеют высокое отношение углерода к водороду, тогда как ароматические углеводороды имеют низкое отношение углерода к водороду.
Ключевые области покрыты
1. Что такое алифатические углеводороды
— определение, различные типы, общие свойства
2. Что такое ароматические углеводороды
— определение, общие свойства
3. В чем разница между алифатическими и ароматическими углеводородами
— Сравнение основных различий
Ключевые термины: алифатические, ароматические, ковалентные связи, делокализованные пи-электроны, углеводороды
Что такое алифатические углеводороды
Алифатические углеводороды представляют собой органические соединения, состоящие из атомов углерода и водорода, расположенных в виде прямых цепей, разветвленных или неароматических кольцевых структур. Атомы углерода и водорода связаны друг с другом через ковалентные связи. Алифатические углеводороды могут быть найдены в трех типах как алканы, алкены и алкины.
Алифатические углеводороды могут быть подразделены на две группы в виде насыщенных алифатических углеводородов и ненасыщенных алифатических углеводородов в зависимости от наличия или отсутствия двойных связей. Насыщенные углеводороды состоят только из одинарных связей. Поэтому они имеют только сигма-связи. Например, алканы являются насыщенными углеводородами. Ненасыщенные углеводороды состоят из одинарных и двойных связей; в этих молекулах присутствуют как сигма-связи, так и пи-связи. Некоторые молекулы также содержат тройные связи. Алкены и алкины являются ненасыщенными углеводородами.
Рисунок 1: Гексан является алифатическим углеводородом
Большинство алифатических углеводородов являются легковоспламеняющимися. Эти соединения могут быть найдены в сырой нефти и в виде природных газов. Циклические соединения также могут рассматриваться как алифатические углеводороды. Это потому, что эти циклические структуры не являются ароматическими (нет делокализованных пи-электронов).
Что такое ароматические углеводороды
Ароматические соединения представляют собой органические соединения, состоящие из атомов углерода и водорода, расположенных в кольцевых структурах с делокализованными пи-электронами. Ароматические углеводороды названы таковыми из-за их приятного аромата. Ароматические углеводороды представляют собой по существу циклические структуры. Это также плоские структуры.
Ароматические соединения обладают высокой стабильностью благодаря эффекту резонанса. Это означает, что ароматические соединения часто представлены в виде резонансных структур, содержащих одинарные и двойные связи, но фактическая структура имеет делокализованные электроны, общие для всех атомов кольца.
Как правило, ароматические соединения являются неполярными. Поэтому они не смешиваются с водой. Отношение углерода к водороду меньше в ароматических соединениях. Большинство ароматических соединений подвергаются реакциям электрофильного замещения. Из-за присутствия делокализованных пи-электронов ароматическое кольцо богато электронами. Следовательно, электрофилы могут атаковать это кольцо, чтобы поделиться электронами.
Рисунок 2: Пикен является ароматическим углеводородом
В большинстве случаев ароматические соединения получают из нефтяного масла. Полиароматические углеводороды (ПАУ) считаются загрязнителями окружающей среды и канцерогенами.
Разница между алифатическими и ароматическими углеводородами
Определение
Алифатические углеводороды: Алифатические углеводороды представляют собой органические соединения, состоящие из атомов углерода и водорода, расположенных в виде прямых цепей, разветвленных или неароматических кольцевых структур.
Ароматические углеводороды: Ароматические углеводороды представляют собой органические соединения, состоящие из атомов углерода и водорода, расположенных в кольцевых структурах с делокализованными пи-электронами.
запах
Алифатические углеводороды: Алифатические углеводороды не имеют приятного запаха.
Ароматические углеводороды: Ароматические углеводороды имеют приятный запах.
Соотношение углерода и водорода
Алифатические углеводороды: Соотношение углерода и водорода в алифатических углеводородах высокое.
Ароматические углеводороды: Соотношение углерода и водорода в ароматических углеводородах низкое.
Жжение
Алифатические углеводороды: Алифатические углеводороды горят не закопченным пламенем.
Ароматические углеводороды: Ароматические углеводороды горят сажным пламенем.
Непредельность
Алифатические углеводороды: Некоторые алифатические углеводороды являются насыщенными, тогда как некоторые являются ненасыщенными.
Ароматические углеводороды: Все ароматические углеводороды являются ненасыщенными.
Делокализованные пи электроны
Алифатические углеводороды: В алифатических углеводородах делокализованных пи-электронов нет.
Ароматические углеводороды: В ароматических углеводородах делокализованные пи-электроны.
Заключение
Алифатические и ароматические углеводороды представляют собой органические соединения, которые состоят только из атомов углерода и водорода. Эти соединения можно найти в основном в сырой нефти и природных газах. Основное различие между алифатическими и ароматическими углеводородами состоит в том, что алифатические углеводороды имеют высокое отношение углерод-водород, тогда как ароматические углеводороды имеют меньшее отношение углерод-водород.
Рекомендации:
1. Хельменстин, Энн Мари. «Что такое алифатический углеводород? Пересмотрите свои концепции химии ». ThoughtCo,
Углеводороды
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Для алканов характерна изомерия углеродного скелета.
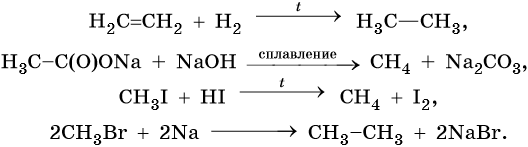
Способы получения алканов. Как правило, алканы получают из природного сырья, однако известно большое число синтетических методов их получения. Это реакции гидрирования алкенов и алкинов, декарбоксилирование натриевых или калиевых солей карбоновых кислот, восстановление йодалканов йодоводородом, реакция Вюрца:
Для алканов характерны реакции замещения, которые идут при нагревании или УФ-облучении. При этом происходит разрыв связи C—H с последующей заменой атома водорода на другой атом или группу атомов или же разрыв молекулы по связи C—С.
Большинство реакций алканов протекают по механизму радикального замещения SR. В этих реакциях реакционная способность атомов водорода убывает в ряду: третичные > вторичные > первичные.
Ниже приведены уравнения химических реакций, характерных для алканов.
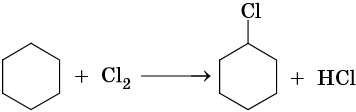
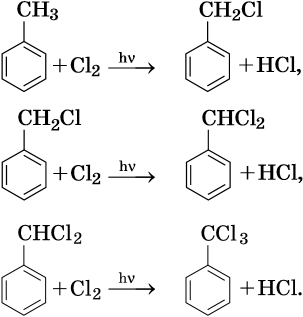
1. Галогенирование:
Реакция идет на свету или при температуре 250— 400 °С.
Реакционная способность галогенов в этой реакции уменьшается в ряду F2 > Cl2 > Br2 > I2.
Реакции замещения в алканах протекают по радикальному механизму. При этом легче всего происходит замещение атома водорода, связанного с третичным углеродным атомом, затем — со вторичным и наконец — с первичным. Это объясняют значением энергии связей C–H, имеющих величину для первичной около 419 кДж/моль, вторичной — 393,6 кДж/моль и третичной — 372,6 кДж/ моль.
Наиболее широко известны реакции галогенирования алканов. Эти реакции идут на свету или при нагревании в присутствии инициаторов радикальных реакций. Рассмотрим механизм реакции на примере хлорирования метана.
На первой стадии этой реакции происходит распад молекулы хлора на два свободных радикала:
Cl:Cl → 2Cl• — зарождение, или инициирование цепи. Затем начинается рост цепи, связанный с взаимодействием свободного радикала с молекулой метана, что приводит к образованию новых радикалов:
Реакция заканчивается обрывом цепи, который наступает в результате взаимодействия между собой свободных радикалов:
Механизм реакции галогенирования был установлен академиком Н.Н. Семеновым.
2. Нитрование:
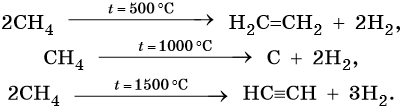
3. Термические превращения:
4. Окисление:
Каталитическое окисление бутана приводит к уксусной кислоте, а горение в кислороде — к углекислому газу и воде:
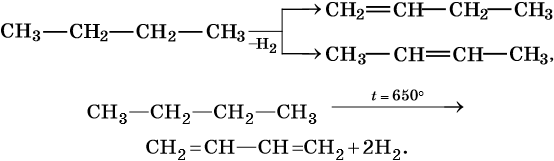
5. Дегидрирование:
Реакции дегидрирования (отщепления водорода) протекают по разным направлениям:
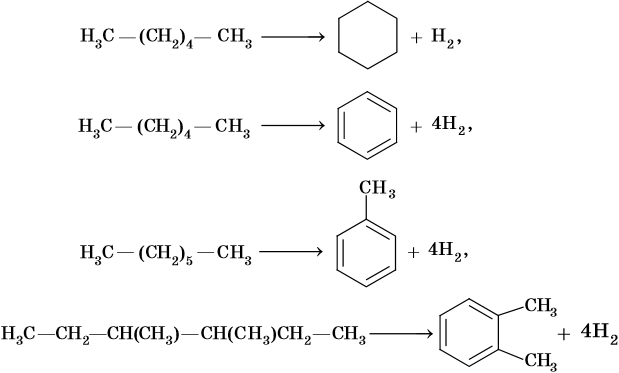
Реакции циклизации и ароматизации:
Последние две реакции идут при температурах 450–500 °С с использованием в качестве катализаторов оксидов хрома или алюминия.
Алициклическими называют углеводороды, которые содержат один или несколько циклов неароматического характера. По своим свойствам они схожи с соответствующими соединениями алифатического ряда. Термин «алициклические» означает «алифатические циклические» углеводороды. Несмотря на большое сходство между алифатическими и алициклическими соединениями, у последних имеются некоторые специфические свойства, обусловленные их циклической структурой. Общая формула гомологического ряда циклоалканов CnH2n.
Иногда циклоалканы называют нафтенами, т. к. производные циклопентана и циклогексана содержатся в некоторых сортах нефти.
Для гомологов и производных циклоалканов возможны следующие виды изомерии: изомерия, связанная с размером цикла, например, циклобутан является изомером метилциклопропана; изомерия положений заместителей в цикле; изомерия боковых цепей.
Циклопентан, циклогексан и их производные широко распространены в природе и составляют основную часть некоторых сортов нефти.
Низшие циклы синтезируют циклизацией дигалоидпроизводных, например:
Циклобутан и циклопентан получают циклизацией 1,4-дибромбутана и 1,5-дибромпентана под действием амальгамы лития. Циклогексан и его производные получают из нефти или гидрированием бензола и его производных.
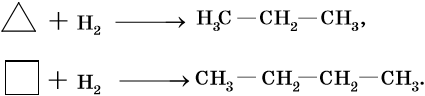
Химические свойства циклоалканов во многом определяются размерами цикла. Наибольшей химической стойкостью обладают пяти- и шестичленные циклы. Циклопропан склонен к многочисленным реакциям раскрытия цикла.
Гидрирование циклопропана и циклобутана идет над никелевым катализатором при температуре 80 и 120 °С соответственно. При этом образуются пропан и бутан.
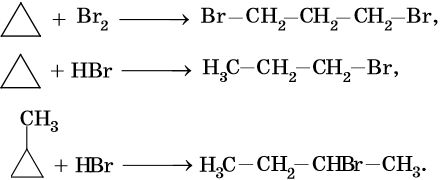
Циклопропановый цикл легко раскрывают при бромировании или гидробромировании, например:
В аналогичных условиях углеводороды от циклобутана до циклогексана вступают в реакции замещения:
Циклопропан используют в качестве анестезирующего средства. Циклогексан используют как растворитель. Окислением циклогексана получают циклогексанол C6H11OH, циклогексанон C6H10O и адиптиновую кислоту HOOC(CH2)4COOH. Циклогексанон является промежуточным продуктом при получении полиамидного волокна — капрона.
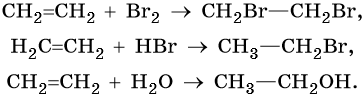
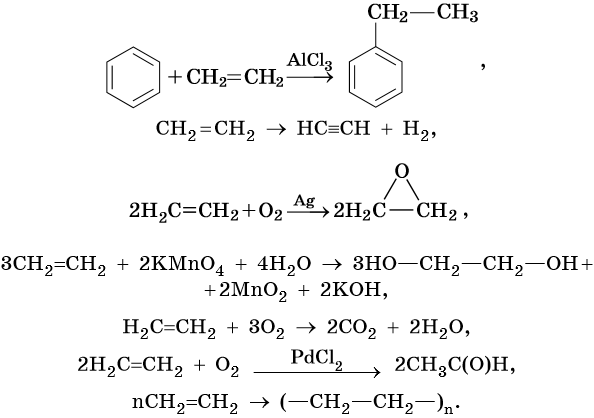
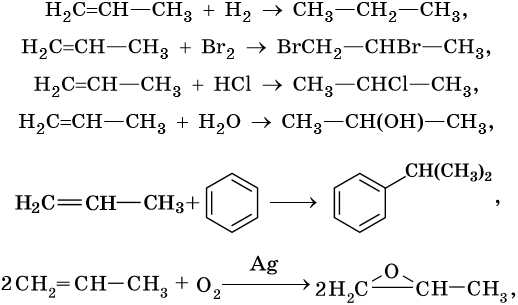
Алкенами, или олефинами, называют алифатические непредельные углеводороды, молекулы которых отвечают общей формуле CnH2n и имеют в своем составе одну двойную связь C=C. Родоначальником этого класса органических соединений является этилен CH2=CH2. Для алкенов характерна изомерия углеродного скелета, изомерия положения кратной связи, геометрическая изомерия, а также межклассовая изомерия с циклоалканами.
Способы получения алкенов. Этилен, пропилен и бутилены выделяют из газов нефтепереработки, образующихся при термическом крекинге. Алкены также образуются в большом количестве при пиролизе нефти.
Промышленным способом получения алкенов является дегидрирование алканов на катализаторе (K2O—Cr2O3—Al2O3), при температуре 560—620 °C из н-бутана образуются изомерные бутены. Еще легче этот процесс идет в случае изобутана:
Алкены получают дегидратацией спиртов при катализе серной или фосфорной кислотами, оксидом алюминия или хлоридом цинка:
При дегидратации спиртов атом водорода наиболее легко отщепляется от наименее гидрогенизированного атома углерода (правило Зайцева):
Алкены образуются при действии на галоидные алкилы спиртовой или измельченной твердой щелочи. Эта реакция дегидрогалогенирования также идет по правилу Зайцева:
Алкены можно получить обработкой цинковым или магниевым порошком вицинальных дигалоидалканов:
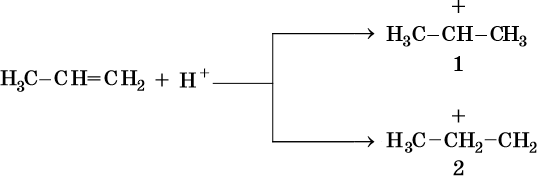
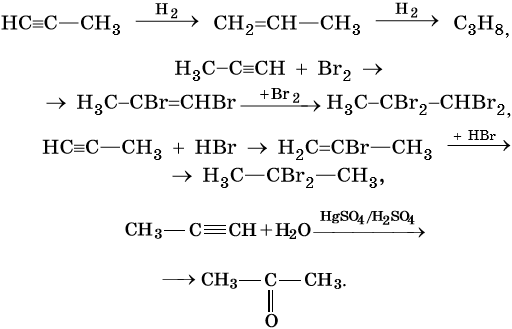
Алкены вступают в реакции соединения по двойной связи. Они протекают по механизму электрофильного присоединения, или AE. Присоединение галогеноводородов и воды к несимметричным алкенам идет по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному, т. е. связанному с наибольшим числом водородных атомов, атому углерода. По легкости присоединения к алкенам галогеноводороды можно расположить в ряд: HI > HBr > HCl > HF.
Ниже приведены реакции алкенов на примере этена и пропена:
Реакция гидратации катализируется кислотами.
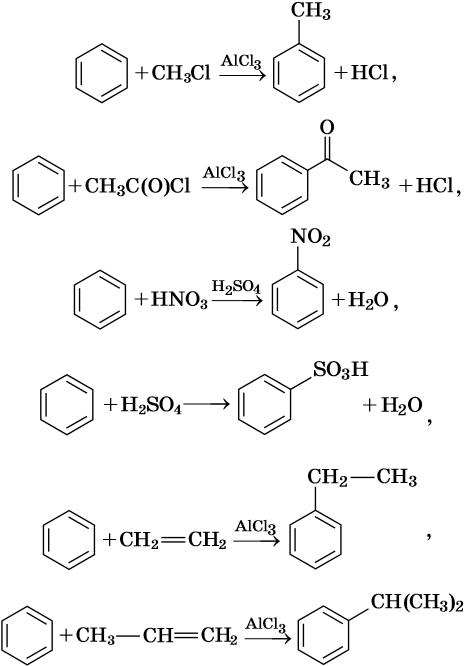
Реакция алкилирования протекает между алканами и алкенами в присутствии катализаторов:
Кроме реакций соединения для алкенов возможны отдельные реакции замещения, которые протекают по радикальному механизму, а также реакции разложения:
C позиции электронной теории правило Марковникова объясняют так: под действием метильного радикала в молекуле пропилена происходит перераспределение электронной плотности электронного облака π-связи в сторону крайнего ненасыщенного атома углерода, в результате чего на атомах углерода, связанных двойной связью, возникают частичные заряды:
При взаимодействии такой молекулы с галогенводородом присоединение положительно заряженного иона водорода идет по атому углерода с частичным отрицательным зарядом, а отрицательно заряженного галогенидиона — по атому углерода с частичным положительным зарядом.
Другое объяснение правила Марковникова следующее. В результате электрофильного присоединения возможно образование двух различных карбокатионов: из-за положительного индуктивного эффекта двух метильных групп карбокатион 1 более стабилен, чем карбокатион 2.
Таким образом, реакции электрофильного присоединения по двойной связи идут в направлении образования наиболее устойчивого промежуточного карбокатиона.
Существуют исключения из правила Марковникова. Это присоединение бромоводорода к алкенам в присутствии органических пероксидов или кислорода. В этом случае из пропена и бромоводорода образуется 1-бромпропан (перекисный эффект Хараша). Подчеркнем особо: перекисный эффект имеет место только в случае реакции алкенов с бромоводородом. При присоединении к алкенам HCl, H2O, HI пероксиды не влияют на направление реакции, и она идет по правилу Марковникова.
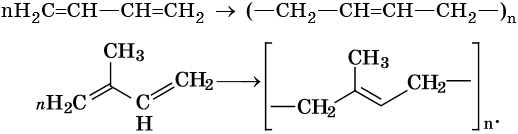
Диеновыми углеводородами называют класс химических соединений, молекулы которых отвечают общей формуле CnH2n–2 и содержат в своем составе две двойные углерод-углеродные связи. Для диенов характерна изомерия углеродного скелета, изомерия положения кратных связей, геометрическая изомерия, а также межклассовая изомерия с ацетиленовыми углеводородами.
Способы получения диенов. Дивинил и изопрен выделяют из продуктов пиролиза нефти. Основным промышленным способом получения бутадиена-1,3 является дегидрирование бутан-бутеновой смеси над катализатором, состоящим из окиси хрома, нанесенной на окись алюминия.
Метод получения дивинила по С.В. Лебедеву заключается в дегидрировании-дегидратации этилового спирта над катализатором MoO — ZnO при 450 °С.
Диены, у которых двойные связи разделены более чем одной одинарной связью, в химическом отношении ведут себя подобно алкенам.
Диены, у которых двойные связи разделены одной простой связью, называют конъюгированными или сопряженными диенами. Эти соединения обладают специфическими химическими свойствами и имеют важное практическое значение.
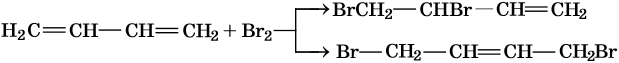
Своеобразные химические свойства диенов проявляются в реакциях присоединения, которые идут не только по одной или двум отдельным двойным связям (1,2-присоединение), но и по противоположным концам молекулы (1,4-присоединение). Выход продуктов 1,2- или 1,4-присоединения определяется характером реагента и условиями реакции.
При низких температурах преобладают продукты 1,2-присоединения, при повышенных — 1,4-присоединения.
Полное бромирование бутадиена-1,3 приведет к 1,2,3,4-тетрабромбутану:
Неполное гидрирование диенов приводит к смеси алкенов, а при полном образуются алканы:
Окисление сопряженных диенов, в зависимости от используемого окислителя и условий проведения реакции, может протекать с образованием различных кислородсодержащих соединений. При частичном окислении в нейтральной среде образуется щавелевая кислота, а действие перманганата калия в кислой среде при нагревании приведет к полному окислению диена до углекислого газа и воды.
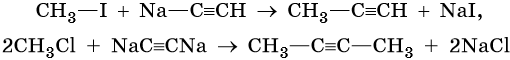
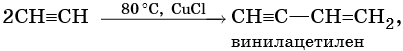
Ацетиленовыми углеводородами, или алкинами, называют класс органических соединений, которые соответствуют общей формуле CnH2n–2 и содержат в молекуле одну тройную связь. Родоначальником этого класса соединений является ацетилен, или этин, — HC≡CH. Для ацетиленовых углеводородов характерна изомерия углеродной цепи, изомерия положения кратной связи и межклассовая изомерия с диеновыми углеводородами.
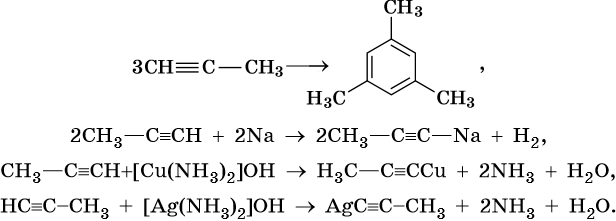
Общим методом получения алкинов является реакция спиртовых растворов щелочи с дигалоидалканами, содержащими два атома галогена при одном атоме углерода или двух соседних атомах углерода:
Производные ацетилена можно получить, действуя на его металлические производные галоидными алкилами:
Ацетилен получают действием воды на карбид кальция:
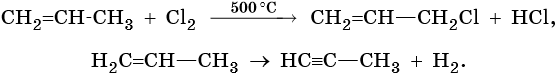
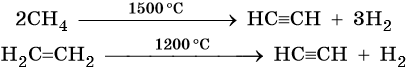
Кроме того, ацетилен получают термолизом метана и дегидрированием этилена:
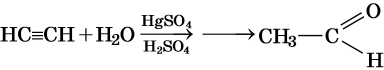
Для алкинов характерны реакции соединения и некоторые реакции замещения, которые приведены ниже на примере ацетилена и пропина. Катализаторами для реакций гидрирования алкинов являются Pd или PbO. Следует отметить, что реакции галогенирования и гидрогалогенирования алкинов идут медленнее, чем с алкенами.
Реакции ди- и тримеризации:
Ароматическими углеводородами, или аренами, называют класс химических соединений, который отвечает общей формуле CnH2n–6 и имеет в своем составе устойчивую циклическую группировку (бензольное кольцо), обладающую особыми химическими свойствами.
Получение ароматических углеводородов. Основным природным источником ароматических углеводородов является нефть. Для получения гомологов бензола разработаны многочисленные синтетические методы.
Некоторые сорта нефти содержат достаточное количество ароматических углеводородов, которые выделяют простой перегонкой, пиролизом или каталитическим крекингом.
Синтетические методы — это ароматизация алканов, алкилирование бензола и т.д.
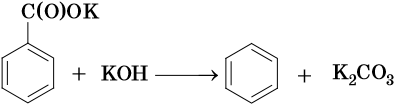
Так, например, бензол можно получить реакцией декарбоксилирования бензоата натрия или калия:
Для ароматических углеводородов наиболее характерны реакции замещения и некоторые реакции присоединения.
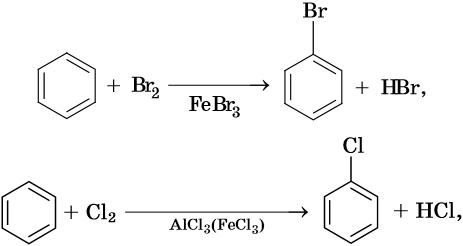
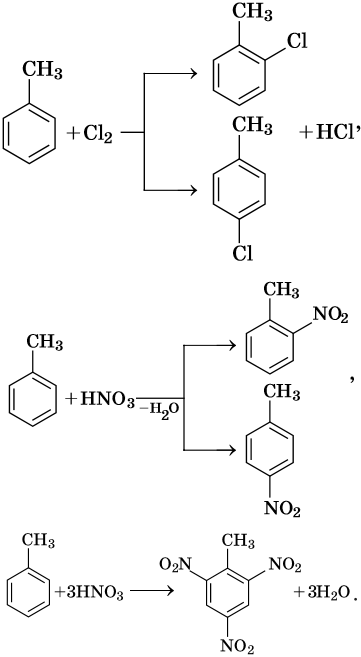
Как правило, все реакции замещения в ароматических соединениях протекают по электрофильному механизму SE. К таким реакциям относятся реакции алкилирования, галогенирования, нитрования, сульфирования, ацилирования и другие. Характерные химические свойства бензола:
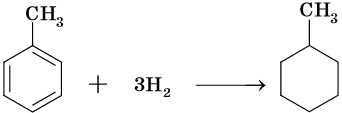
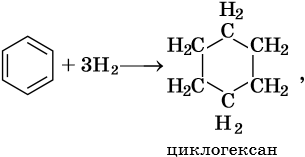
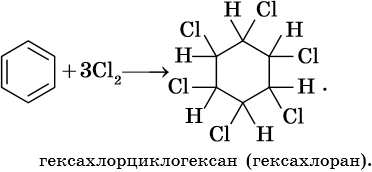
Гидрирование бензола до циклогексана идет при повышенной температуре, в присутствие катализатора (никель, платина), а хлорирование до гексахлорциклогексана — в газовой фазе под ультрафиолетовым излучением.
В молекуле толуола проявляется взаимное влияние метильного радикала на ароматическое ядро и ароматического ядра на метильный радикал. Толуол вступает в реакции замещения легче, чем бензол. При этом метильная группа ориентирует вхождение заместителей в орто— и пара-положения:
Галогенирование атомов водорода боковой цепи:
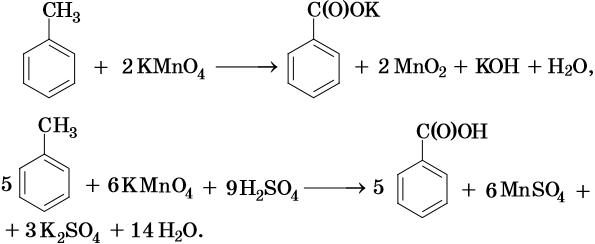
Окисление метильного радикала сильными окислителями, в зависимости от среды реакции, идет по разным направлениям:
В ходе реакций окисления алкилбензолов происходит окисление боковой цепи, а бензольное кольцо изменений не претерпевает:
Исключением являются третбутильные группы, связанные с бензольным кольцом — бензольное кольцо окисляется легче, чем эти группы.
При окислении жирноароматических соединений, содержащих ненасыщенные радикалы, соблюдаются общие закономерности, например:
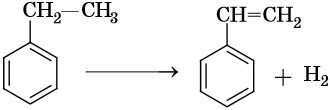
Этилбензол вступает в реакцию дегидрирования с образованием стирола:
Реакция протекает с высоким (92%) выходом при катализе оксидом цинка при температуре 600–650 °С.
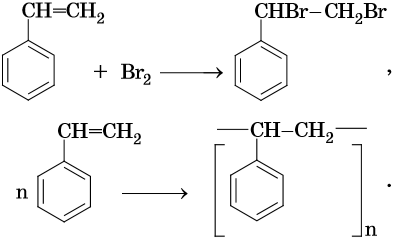
Стирол легко вступает в реакции по двойной связи и в реакции полимеризации и сополимеризации:
Свойства бутадиен-стирольных каучуков зависят от их состава. На их основе изготавливают шины и другие резинотехнические изделия.