Альвеолярные макрофаги это что
Альвеолярные макрофаги это что
Слизистый характер бронхиального секрета обусловлен сочетанным функционированием желез подслизистой оболочки бронхов и бокаловидных клеток эпителия. В ответ на инвазию инфекционными агентами эпителий бронхов выделяет цитоки- ны IL-8, IL-6, колониеобразующие факторы гранулоцитов, моноцитов, и др. Так, тучные клетки выделяют хемотаксические факторы «быстрого реагирования»: эозинофильный хемотаксический фактор анафилаксии; хемотаксический фактор нейтрофилов высокой молекулярной массы; хемотаксические факторы, направленные на лимфоциты, базофилы, моноциты; фактор, активирующий тромбоциты (ФАТ). Усиливается синтез и выделение простогландинов, простациклинов, Т-хелперов. Также увеличивается содержание альвеолярных макрофагов. Они осуществляют фагоцитоз, переработку антигена и «передачу» информации лимфоцитам, предотвращают развитие аллергических реакций. Иммунная защита, секреторная активность являются индукторами микроваскулярного просачивания и секреции слизи.
Цитологическое исследование мокроты позволяет выявить болезнетворные микроорганизмы (в том числе микобакте- рию туберкулеза), клетки злокачественных опухолей, примеси (кровь, гной и т.п.), характерные для определенных болезней, а также определить чувствительность бактериальной флоры к антибиотикам.
Возможно обнаружение в мокроте следующих клеток: эпителиальные клетки, или клетки цилиндрического мерцательного эпителия (при бронхитах, бронхиальной астме или злокачественных новообразованиях легких); бокаловидные клетки (при усиленной секреции); базальные или промежуточные клетки; альвеолярные макрофаги из нижних респираторных отделов. Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнен отделяемым из ротовой полости. Альвеолярные макрофаги локализуется в основном в межальвеолярных перегородках. Поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. При инфаркте легкого, застое в малом кругу кровообращения обнаруживаются «клетки сердечных пороков», т.е. альвеолярные макрофаги с включениями гемосидерина [2].
Встречаются также и макрофаги с липид- ными включениями (липофаги) при туберкулезе, хроническом заболевании легких. Отмечают повышение в мазке мокроты количества нейтрофилов, лимфоцитов, эозинофилов, моноцитов, «гигантских» клеток Пирогова-Лангерганса. Обнаружение более 25 нейтрофилов в поле зрения свидетельствует об инфекции (пневмония, бронхит). Единичные эозинофилы могут встречаться в любой мокроте; в большом количестве (до 50-90% всех лейкоцитов). Они обнаруживаются при бронхиальной астме, эози- нофильных инфильтратах, глистных инвазиях легких и т.п. Эритроциты появляются в мокроте при разрушении ткани легкого, пневмонии, застое в малом круге кровообращения, инфаркте легкого и т.д. Мокрота может содержать клетки злокачественных опухолей, особенно если опухоль растет эндобронхиально или распадается. Определять клетки как опухолевые можно только в случае нахождения комплекса атипичных полиморфных клеток, особенно если они располагаются вместе с эластическими волокнами.
В мазке мокроты могут встречаться волокнистые образования: эластические волокна, фибриновые волокна и спирали Куршмана (при туберкулезе, абсцессе легкого,раке). Эластические волокна имеют вид тонких двухконтурных волоконец одинаковой на всем протяжении толщины, дихотомически ветвящихся. Эластичные волокна исходят из легочной паренхимы. Выявление в мокроте эластичных волокон свидетельствует о разрушении легочной паренхимы (туберкулез, рак, абсцесс). Иногда их присутствие в мокроте используют для подтверждения диагноза абсцедирую- щей пневмонии.
Альвеолярные макрофаги это что
Воспалительные реакции играют исключительно важную роль в развитии большого количества заболеваний легких, таких как бронхиальная астма, острый респираторный дисстресс синдром и бронхолегочная дисплазия [4]. Известно, что одну из центральных ролей в инициации и развитии воспалительных реакций в легких играют альвеолярные макрофаги. При активации эти клетки продуцируют свободные радикалы, NO, цитокины, кемокины и другие медиаторы воспаления и благодаря этому запускают врожденный и адаптивный иммунный ответ и обезвреживают патогенные микробы.
В ходе иммунного ответа нативные макрофаги могут приобретать различные функциональные фенотипы [6]. Так, классический М1 фенотип характеризуется продукцией провоспалительных цитокинов и кемокинов, таких как TNF-α, IL-1ß, IL-6, IL-12, воспалительного белка макрофагов 1α (MIP-1α), а также повышенной генерацией оксида азота (NO) [6; 9]. М1 макрофаги являются эффекторными клетками, которые интегрированы в Th1 ответ. Этот фенотип убивает микроорганизмы и опухолевые клетки и продуцирует большие количества провоспалительных цитокинов [9]. Альтернативный М2 фенотип макрофагов характеризуется продукцией антивоспалительных цитокинов, таких как IL-10 и рецептор-ловушки IL-1 (IL-1ra). Функциональное предназначение М2 фенотипа состоит прежде всего в регулировании воспалительного ответа, участии в ангиогенезе, ремоделировании тканей и восстановлении иммунного гомеостаза, нарушенного воспалением.
Очевидно, что эффективность, с которой врожденный иммунитет будет удалять патогенные микробы и при необходимости стимулировать ангиогенез, ремоделирование и восстановление поврежденных тканей, существенно зависит от фагоцитарной активности макрофагов, и от того, как быстро эти клетки могут приходить в очаг воспаления, т.е. от их миграционной активности.
Таким образом, способность к фагоцитированию и миграционная активность макрофагов составляют важные компоненты врожденного ответа, от которого зависит, как быстро иммунная система сможет восстановить гомеостаз, нарушенный появлением инфекции и повреждением тканей. Однако до сих пор важный вопрос о том, каковы различия фагоцитарной способности и миграционной активности М1 и М2 фенотипов макрофагов остается открытым.
Цель данной работы состояла в том, чтобы ответить на этот вопрос.
Материалы и методы исследования
Выделение альвеолярных макрофагов
Альвеолярные макрофаги выделялись из бронхоальвеолярного лаважа (БАЛ) мышей. Предварительно мышам внутрибрюшинно вводился раствор хлоралгидрата (из расчета 32,5 нг на 100 г веса животного), впоследствии мыши умерщвлялись с помощью перерезания нижней полой вены и обескровливания. Для получения бронхо-альвеолярного лаважа (БАЛ) в легкие через внутритрахеальный катетер вводилось по 1 мл стерильного фосфатного буфера PBS 37 °С (у каждого животного выполнялось по 4 промывки) [7]. Полученный БАЛ центрифугировался при 1000 об./мин 4 мин. Клеточный осадок ресуспендировали в 3 мл среды RPMI 1640 с последующим определением количества макрофагов в камере Горяева и доведением концентрации клеток в среде RPMI 1640 до 1∙106/мл.
Определение фагоцитарной активности альвеолярных макрофагов
Определение миграционной активности макрофагов
В основе методики определения миграционной активности альвеолярных макрофагов лежит принцип метода Бойдена, основанный на прохождении лейкоцитов из одной половины камеры с взвесью клеток в другую половину камеры, содержащую хемоатрактант, и разделенных между собой мембранным фильтром. Анализ хемотаксиса проводился непосредственно по методике Neuro Probe Protocol [5].
В нижние промаркированные микроячейки камеры вносили по 30 мкл хемоаттрактанта (использовали БАЛ мышей линии С57/BL6 и Balb/c), помещали фильтр с диаметром пор 8 мкм, камеру закрывали и в верхние микроячейки камеры вносили по 100 мкл суспензии клеток (с концентрацией 1∙106/мл) в хемотаксической среде. Заполненную камеру инкубировали в течение 3 часов при температуре 37 ± 0,5 °С при 5 % СО2. Через 3 часа из верхних ячеек камеры проводилась аспирация клеток, ячейки заполнялись 2 мМ ЭДТА в 1∙PBS на 15 минут с последующей аспирацией ЭДТА. Камеру открывали и клетки с верхней стороны мембраны удаляли с помощью Q-наконечника. Затем мембрану центрифугировали при 1500 g 15 минут (при +4 °С). Окрашивание мембраны проводили азур-эозином по Романовскому в течение 15 минут. Подсчет количества мигрировавших клеток проводился в каждой ячейке под оптическим микроскопом.
Результаты исследования и их обсуждение
На рисунке представлены данные о фагоцитарной активности макрофагов двух фенотипов в зависимости от соотношения количества бактерий на один макрофаг.
Сравнительная оценка фагоцитарной активности макрофагов М1 фенотипа, выделенных
из мышей линии С57 и макрофагов М2 фенотипа, выделенных из мышей линии BABL/c
Видно, что при всех соотношениях среднее количество бактерий, поглощенных одним М1 макрофагом, было достоверно больше, чем у М2 макрофагов. Это означает, что М1 фенотип более эффективно фагоцитирует S.аureus, чем М2 фенотип. При этом фагоцитарная активность М1 фенотипа больше зависела от концентрации S. Aureus, чем у М2 фенотипа. На графике это отражается в более крутом подъеме кривой М1, по сравнению с М2.
Дальше в таблице представлены данные о миграционной подвижности макрофагов М1 и М2 фенотипов в ответ на два разных типа хемоаттрактантов: БАЛ, выделенный из мышей линии BALB/c (БАЛBALB/c), и БАЛ из С57 (БАЛС57).
Сравнительная оценка миграционной активности макрофагов М1 фенотипа, выделенных из мышей линии С57, и макрофагов М2 фенотипа, выделенных из мышей линии BABL/c. Миграционная активность количественно оценивалась по миграционному индексу, представленному как соотношение количества мигрировавших клеток к немигрировавшим
В качестве аттрактанта использовался БАЛ
от мышей линии BALB/c
Миграционный индекс альвеолярных макрофагов мышей линии BALB/с, М ± м
Миграционный индекс альвеолярных макрофагов мышей линии С57, М ± м
В качестве аттрактанта использовался БАЛ
от мышей линии C57
Эти данные позволяют сделать несколько важных выводов.
Во-первых, сравнительная оценка миграционной подвижности М1 и М2 фенотипов альтернативно отличается в зависимости от того какой тип хемоаттрактанта-БАЛ был использован. Действительно, в случае, когда в качестве хемоаттрактанта используется БАЛ BALB/c, активность макрофагов М2 существенно выше, по сравнению с М1 (1,88 ± 0,13 vs 1,12 ± 0,12, р
Альвеолярные макрофаги это что
Альвеолярные макрофаги ответственны за очищение от вдыхаемых чужеродных частиц различной природы. Взаимодействие альвеолярных макрофагов с удаляемыми частицами через определенные рецепторы определяет выраженность воспалительного ответа: от минимальной до активного воспаления с повреждением легочной ткани. Ответ альвеолярных макрофагов существенно различается в зависимости от рецепторов, задействованных при фагоцитозе частиц. Максимально выражен воспалительный ответ на захват опсонизированных частиц через Fc-peцепторы, от которых исходит сильнейший сигнал активации респираторного взрыва, секреции TNF-a и хемокинов. Опсонин-независимый фагоцитоз не сопровождается столь выраженной активацией метаболизма макрофагов. Захват неопсонизированных частиц альвеолярными макрофагами возможен через интегриновые рецепторы или через рецепторы для различных поверхностных компонентов частиц: лектиноподобные (MMR) для углеводов, рецепторы для обломков апоптотических клеток, скавенджер-рецепторы для модифицированных LDL и др. Экспрессия всех этих рецепторов регулируется провоспалительными цитокинами. Экспрессией их определяется роль альвеолярных макрофагов как барьера на пути проникновения в организм различных компонентов загрязнений воздуха (air pollutions), которые особенно опасны для людей с хроническими воспалительными заболеваниями бронхов и легких.
Особенностью альвеолярных макрофагов является слабая экспрессия CD14 по сравнению с моноцитами крови в сочетании с повышенной экспрессией особого мембранного полипептида РАМ-1. Альвеолярные макрофаги экспрессируют три класса рецепторов для Fc-фрагмента IgG: FcyRI(CD64), FcyRII(CD32), FcyRIII(CD16). Первые два из них экспрессируют и моноциты крови, а третий является особенностью альвеолярных макрофагов. Между моноцитами и альвеолярными макрофагами имеется различие и по экспрессии рецепторов для фракций комплемента. На альвеолярных макрофагах усилена экспрессия CR4 при ослабленной экспрессии CR3 и CR1. Альвеолярные макрофаги отличаются от моноцитов крови сниженной экспрессией адгезионных молекул LFA1 и отсутствием на мембране представителей семейства интегринов (VLA). По уровню экспрессии антигенов гистосовместимости МНСН альвеолярные макрофаги не уступают моноцитам крови.
Главными антиген-презентирующими клетками в респираторном тракте считаются дендритные клетки, расположенные в паренхиме легких. Что касается роли альвеолярных макрофагов в иммунном ответе, то оценки ее весьма противоречивы. Особое внимание привлекают литературные данные о супрессирующем действии альвеолярных макрофагов на индуцированный антигеном пролиферативный ответ Т-лимфоцитов.
На мембране макрофагов экспрессированы рецепторы для многих регулирующих цитокинов, главным активирующим среди которых является IFNy. Созревание, дифференцировка и активация макрофагов зависят от ростовых факторов: GM-CSF и M-CSF. Альтернативным регулирующим цитокином для макрофагов является IL-10, который ингибирует все свойства и функции макрофагов, которые стимулирует IFNy.
Промежуточное влияние на функции макрофагов оказывают IL-4, IL-13, M-CSF и TGF-P.
Среди продуктов секреции макрофагов главное место занимают провоспалительные (IL-1, IL-6, TNF-a, IL-8, IL-12) и противовоспалительные (ILIO, TGF-P) цитокины. Макрофаги продуцируют и секретируют факторы роста для аутокринной регуляции и для регуляции других клеток (фактор роста фибробластов). Среди монокинов обнаруживаются хемокины для разных клеток. Продукты макрофагов обеспечивают адгезию лейкоцитов к эндотелию сосудов и последующую трансэндотелиальную миграцию (TNF-a, IL-8 и др.хемокины).
Общий анализ мокроты
Мокрота – отделяемый из легких и дыхательных путей (трахеи и бронхов) патологический секрет. Общий анализ мокроты – лабораторное исследование, которое позволяет оценить характер, общие свойства и микроскопические особенности мокроты и дает представление о патологическом процессе в дыхательных органах.
Для чего используется этот анализ?
Когда назначается анализ?
Клинический анализ мокроты.
Мг/дл (миллиграмм на децилитр),
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Рекомендуется употребить большой объем жидкости (воды) за 8-12 часов до сбора мокроты.
Общая информация об исследовании
Мокрота – это патологический секрет легких и дыхательных путей (бронхов, трахеи, гортани), который отделяется при откашливании. У здоровых людей мокрота не выделяется. В норме железы крупных бронхов и трахеи постоянно образовывают секрет в количестве до 100 мл/сут., который проглатывается при выделении. Трахеобронхиальный секрет представляет собой слизь, в состав которой входят гликопротеины, иммуноглобулины, бактерицидные белки, клеточные элементы (макрофаги, лимфоциты, слущенные клетки эпителия бронхов) и некоторые другие вещества. Данный секрет обладает бактерицидным эффектом, способствует выведению вдыхаемых мелких частиц и очищению бронхов. При заболеваниях трахеи, бронхов и легких усиливается образование слизи, которая отхаркивается в виде мокроты. У курильщиков без признаков заболеваний органов дыхания также обильно выделяется мокрота.
Клинический анализ мокроты является лабораторным исследованием, которое позволяет оценить характер, общие свойства и микроскопические особенности мокроты. На основании данного анализа судят о воспалительном процессе в органах дыхания, а в некоторых случаях ставят диагноз.
При клиническом исследовании мокроты анализируются такие показатели, как количество мокроты, её цвет, запах, характер, консистенция, наличие примесей, клеточный состав, количество волокон, определяется присутствие микроорганизмов (бактерий, грибов), а также паразитов.
Мокрота по составу неоднородна. Она может содержать слизь, гной, серозную жидкость, кровь, фибрин, причем одновременное присутствие всех этих элементов не обязательно. Гной образуют скопления лейкоцитов, возникающие в месте воспалительного процесса. Воспалительный экссудат выделяется в виде серозной жидкости. Кровь в мокроте появляется при изменениях стенок легочных капилляров или повреждениях сосудов. Состав и связанные с ним свойства мокроты зависят от характера патологического процесса в органах дыхания.
Микроскопический анализ дает возможность под многократным увеличением рассмотреть присутствие различных форменных элементов в мокроте. Если микроскопическое исследование не выявило наличия патогенных микроорганизмов, это не исключает присутствия инфекции. Поэтому при подозрении на бактериальную инфекцию одновременно рекомендуется выполнять бактериологическое исследование мокроты с определением чувствительности возбудителей к антибиотикам.
Материал для анализа собирается в стерильный одноразовый контейнер. Пациенту необходимо помнить, что для исследования нужна мокрота, выделенная при откашливании, а не слюна и слизь из носоглотки. Собирать мокроту нужно утром до приема пищи, после тщательного полоскания рта и горла, чистки зубов.
Результаты анализа должны оцениваться врачом в комплексе с учётом клиники заболевания, данных осмотра и результатов других лабораторных и инструментальных методов исследования.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Количество мокроты при разных патологических процессах может составлять от нескольких миллилитров до двух литров в сутки.
Незначительное количество мокроты отделяется при…
Большое количество мокроты может выделяться при…
По изменению количества мокроты иногда можно оценить динамику воспалительного процесса.
Цвет мокроты
Чаще мокрота бесцветная.
Зеленый оттенок может свидетельствовать о присоединении гнойного воспаления.
Различные оттенки красного указывают на примесь свежей крови, а ржавый – на следы распада эритроцитов.
Ярко-желтая мокрота наблюдается при скоплении большого количества эозинофилов (например, при бронхиальной астме).
Черноватая или сероватая мокрота содержит угольную пыль и наблюдается при пневмокониозах и у курильщиков.
Мокроту могут окрашивать и некоторые лекарственные средства (например, рифампицин).
Запах
Мокрота обычно не имеет запаха.
Гнилостный запах отмечается в результате присоединения гнилостной инфекции (например, при абсцессе, гангрене легкого, при гнилостном бронхите, бронхоэктатической болезни, раке легкого, осложнившемся некрозом).
Своеобразный «фруктовый» запах мокроты характерен для вскрывшейся эхинококковой кисты.
Характер мокроты
Слизистая мокрота наблюдается при катаральном воспалении в дыхательных путях, например, на фоне острого и хронического бронхита, трахеита.
Серозная мокрота определяется при отеке легких вследствие выхода плазмы в просвет альвеол.
Слизисто-гнойная мокрота наблюдается при бронхите, пневмонии, бронхоэктатической болезни, туберкулезе.
Гнойная мокрота возможна при гнойном бронхите, абсцессе, актиномикозе легких, гангрене.
Кровянистая мокрота выделяется при инфаркте легких, новообразованиях, травме легкого, актиномикозе и других факторах кровотечения в органах дыхания.
Консистенция мокроты зависит от количества слизи и форменных элементов и может быть жидкой, густой или вязкой.
Плоский эпителий в количестве более 25 клеток указывает на загрязнение материала слюной.
Клетки цилиндрического мерцательного эпителия – клетки слизистой оболочки гортани, трахеи и бронхов; их обнаруживают при бронхитах, трахеитах, бронхиальной астме, злокачественных новообразованиях.
Альвеолярные макрофаги в повышенномколичестве в мокроте выявляют при хронических процессах и на стадии разрешения острых процессов в бронхолегочной системе.
Лейкоциты в большом количестве выявляются при выраженном воспалении, в составе слизисто-гнойной и гнойной мокроте.
Эозинофилы обнаруживаются при бронхиальной астме, эозинофильной пневмонии, глистных поражениях легких, инфаркте легкого.
Эритроциты. Обнаружение в мокроте единичных эритроцитов диагностического значения не имеет. При наличии свежей крови в мокроте выявляются неизмененные эритроциты.
Клетки с признаками атипии присутствуют при злокачественных новообразованиях.
Эластические волокна появляются при распаде ткани легкого, которое сопровождается разрушением эпителиального слоя и освобождением эластических волокон; их обнаруживают при туберкулезе, абсцессе, эхинококкозе, новообразованиях в легких.
Коралловидные волокна выявляют при хронических заболеваниях (например, при кавернозном туберкулезе).
Обызвествленные эластические волокна – эластические волокна, пропитанные солями кальция. Их обнаружение в мокроте характерно для туберкулеза.
Спирали Куршмана образуются при спастическом состоянии бронхов и наличии в них слизи; характерны для бронхиальной астмы, бронхитов, опухолей легких.
Кристаллы Шарко – Лейдена – продукты распада эозинофилов. Характерны для бронхиальной астмы, эозинофильных инфильтратов в легких, легочной двуустки.
Мицелий грибов появляется при грибковых поражениях бронхолегочной системы (например, при аспергиллезе легких).
Прочая флора. Обнаружение бактерий (кокков, бацилл), особенно в больших количествах, указывает на наличие бактериальной инфекции.
Что может влиять на результат?
Результаты анализа будут недостоверными при:
Прием антибактериальных, противогрибковых или противогельминтных препаратов, влияющих на возбудителей инфекционного процесса в легких, изменяет характер мокроты.
Кто назначает исследование?
Пульмонолог, терапевт, педиатр, врач общей практики, ревматолог, фтизиатр, аллерголог, инфекционист, клинический миколог, онколог, паразитолог
Литература
Подписка на новости
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
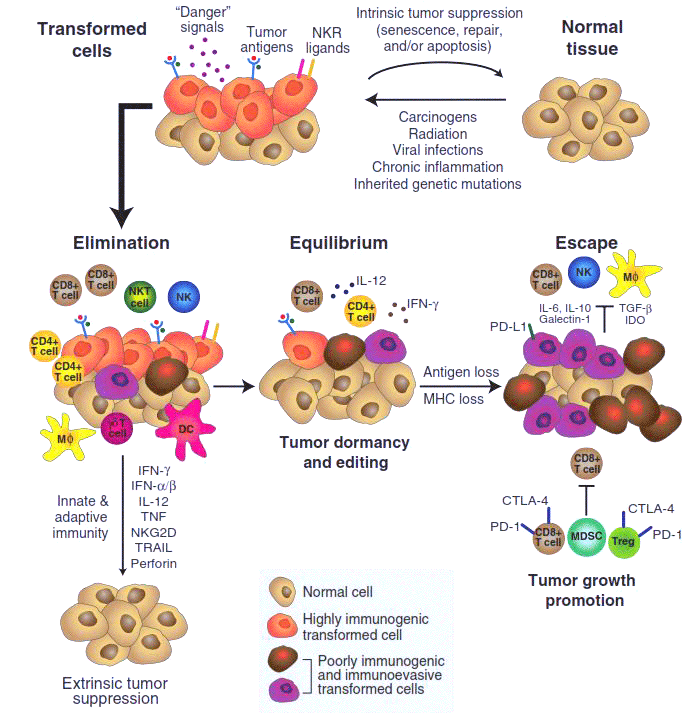
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
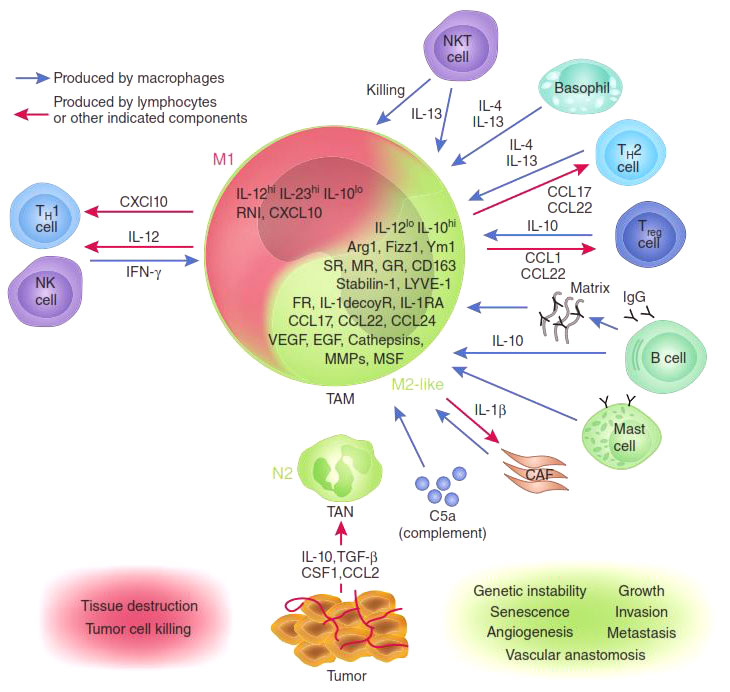
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.