Амфотерные свойства что это
Химия, Биология, подготовка к ГИА и ЕГЭ
Амфотерные соединения
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
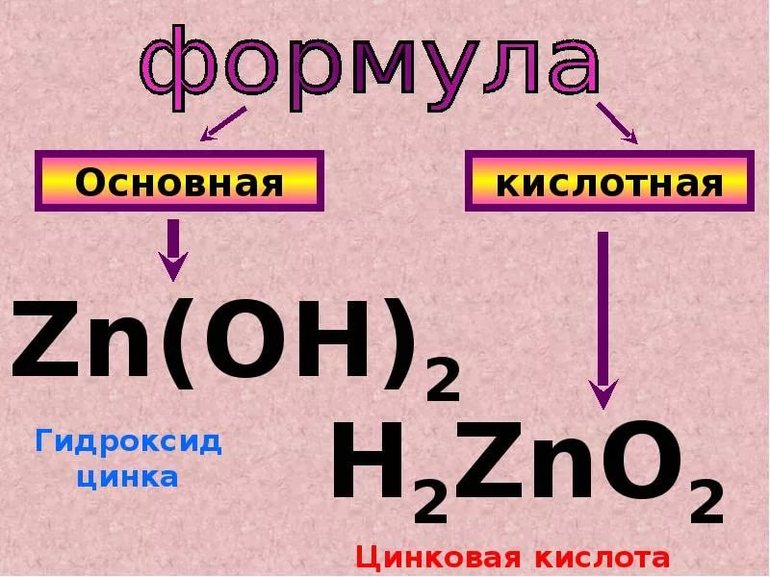
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Амфотерность
Амфоте́рность (от др.-греч. (ἀμφότεροι — «двойственный», «обоюдный») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Содержание
Амфотерность как химическое свойство
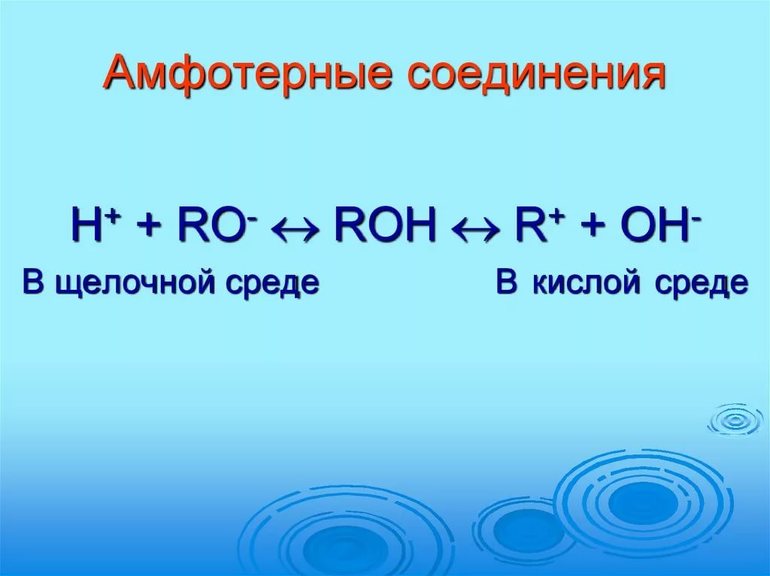
Амфотерность как химическое свойство вещества может проявляться по-разному:
H + + RO – 

Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
Идеальным амфолитом будет вода:
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротолиз [4] :
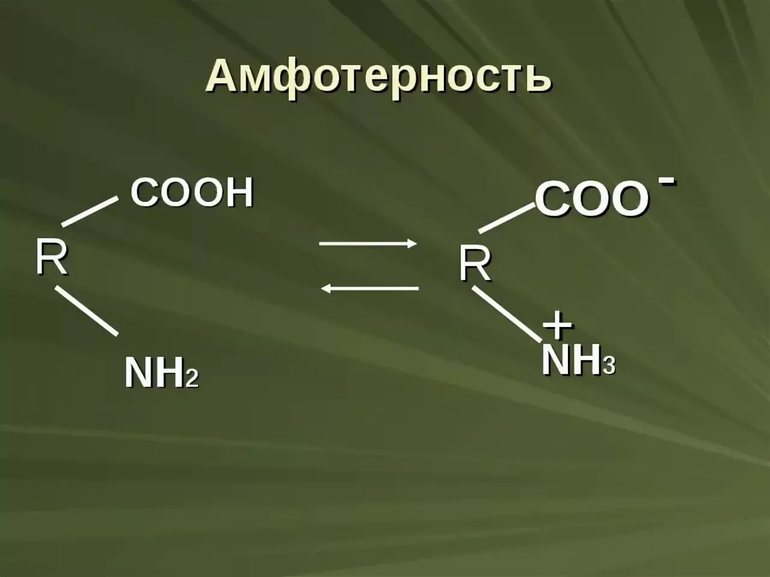
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3 + являются потенциальными кислотами (донорами протонов, катионов), а R–COO – и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
Cr(OH3) (тв) + 3HCl (р-р) 



Это определение было введено при изучении общей теоретической химии в области ведущих и кислотных взаимодействий при наступлении определенных условий.
Отмечается влияние смены растворяющего вещества на дуальные характеристики.
Амфотерные свойства
Гидроксиды элементов и их сцеплений из таблицы Менделеева, которые относятся к амфотерным соединениям:
Чаще всего вещества проявляют одно из взаимодействий, которое изменяет характер при перемене условий. Например, происходят процессы ионизации азотной кислоты, при этом получаются нитрозильные анионы и нитрит-катионы, в качестве амфолита выступает вода.
Амфотерность рассматривается в виде способности проводящего вещества быть донором и акцептировать протоны в рамках протеолитической концепции Бренстеда и Лоури. В этом случае вода проявляет свойства самоионизации в форме обратимой передачи молекул между жидкостями, в результате появляется одинаковое число анионов и катионов.
Амфолитами являются субстанции с содержанием структурных включений органических молекул, которые передают свойственные характеристики разного характера.
Такие вещества представлены пептидами, белками и аминокислотами. Эти группы частично ионизируются при помещении в раствор.
Молекулы и частицы аминокислот имеют равновесные состояния:
В этих случаях вещество представлено кислотой (воспроизводят катионы) и протоны или работает по основному свойству и акцептирует катионы и протоны.
Характеристики гидроксидов
Способность амфотерного элемента проявляется и в форме взаимодействия с кислотами и основаниями.
Так ведут себя оксиды, комплексные соединения, гидроксиды и отдельные р-элементы на средней стадии окисления. Для неорганических связей с присутствием гидроксильной группы ОН такое взаимодействие является общей характеристикой.
Традиционная теория об амфотерности гидроксидов в процессе разложения на ионы по основному и кислотному виду не подтверждается. Амфотерное поведение гидроксидов заключается в реакции обмена частицами среды с молекулами, имеющими связь с акцепторным центром. Гидроксиды обладают особенностью выделять соль и по-разному взаимодействовать в кислотной среде и растворе щелочи.
В первом случае они действуют по типу оснований, а вторая среда заставляет проявлять реакцию кислот.
Амфотерность гидроксидов и оксидов проявляется в продуцировании 2 рядов солей. Двойственность свойств используется при проведении качественного анализа и отделения веществ с подобными характеристиками от других элементов. Интервал появления осадка проявляется узким промежутком, поэтому внимание уделяется тщательности регулировки растворной среды.
Номенклатура и химические особенности
На особом положении в ряду амфотерных элементов находится алюминий, он стоит на границе между кислотами и основаниями. Это ведет к его диссоциации по двум типам поведения.
Амфотерные металлы и неметаллы обладают свойствами:
Гидроксиды с двойственными свойствами имеют физические промежуточные характеристики, доказать амфотерность можно на примере взаимодействия комплексных соединений из списка веществ 3 периода таблицы Менделеева.
В химии свойства однотипных сульфидов и оксидов, а также гидросульфитов и гидроксидов имеют разную реакцию в пределах отличающихся периодов. Свойство оснований проявляют сульфиды типичных металлов, а кислотные характеристики присутствуют в бинарных соединениях неметаллических субстанций. Различие химического происхождения наблюдается при обменной реакции между действующим веществом и растворителем, а также во взаимодействии сульфидов друг с другом.
Амфотерность гидроксидов металлических элементов объясняется тем, что в воде вещество распадается на отдельные ионы водорода по кислотному виду, а образование гидроксильных ионов проходит по типу основы.
Степени окисления
У некоторых веществ наблюдается несколько ступеней окисления, поэтому амфотерные свойства гидроксидов и оксидов подлежат разной классификации. Вещества с низкими окислительными характеристиками тяготеют к группе оснований, а сам элемент обладает свойствами металла, поскольку содержится в категории катионов. Субстанции с высокой степенью окисления являются участниками кислотных групп и проявляют неметаллические показатели, так как представляют собой анионы.
Например, у гидроксида и оксида марганца (2) главными являются основные свойства, а сам элемент входит в категорию катионов. У разновидности марганца (Vil) преобладают показатели кислоты, а само вещество относится к анионовой группы (тип МПО4).
Свойства оксидов и гидроксидов проявляются в зависимости от характеристики металла. Для элементов подвида бора (исключается таллий) типичной является 3-я степень перехода заряженных частиц от донора-восстановителя к окислительному акцептору. В результате свойства основания для элемента ослабляются.
При переходе к 3 группе встречаются вещества, которые образуют кислоты и неорганические кислоты. Последние обладают сочетанием химических и физических показателей, характерных для кислот и являются типовыми для многих элементов, за исключением щелочноземельных и щелочных металлов.
Рост свойств основного вещества происходит при увеличении радиуса движения ионов. Некоторые субстанции имеют почти одинаковую степень диссоциации с получением ионов, а у других аморфные показатели выражаются слабо.
В соединениях развитие основных свойств происходит медленно. Это объясняется тем, что атомы веществ 3 группы представляют собой аналоги с характерным строением внешней оболочки по типу благородных газов. Другие субстанции отличаются наружным слоем атома в форме электронной оболочки с 10 электронами. В таблице после алюминия наблюдается увеличение радиусов ионов, отмечается диагональное сходство, что ведет к постепенному усилению основных характеристик.
Процессы при диссоциации
В некоторых случаях амфотерные характеристики металлических гидроксидов проявляются не только в водной среде, но под действием кислотного и щелочного раствора. Если в случае с кислотой при продуцировании нейтральных частиц выделяется вода и появляется ион металла (свойство основания), то в щелочной среде не происходит отщепление протона.
При тяготении азота к висмуту степень окисления стабилизируется и усиливаются показатели основного характера. Такие соединительные субстанции выполняют одновременно окислительные и восстановительные функции. Двойственный процесс объясняется ионизацией молекулы воды, которая располагается во внутренней сфере, а протон перемещается к иону ОН.
В этом случае затрудняется определение развитости кислотных и основных показателей вещества, так как оно не имеет в составе подвижного водородного атома.
В результате из бокситов получаются другие элементы, что служит показателем использования химических характеристик при разделении. Метод основывается на применении свойства амфотерности алюминия. К этому же разряду относится выделение магния из воды морей и океанов.
Реакции взаимного действия с расплавами щелочей и кислотами ведут к появлению молекул воды и соли, а в результате степень окисления остается неизменной.
Двойственные показатели
Ионный потенциал вещества увеличивается в результате проявления двойственного механизма при диссоциации амфотерных соединений. Например, Мл (0Н) является неуравновешенным основанием, а Мп (0Н)4 представляет собой амфотерный элемент, который в равной степени проявляет кислотные особенности. НМПО4 переходит в категорию усиленных кислот, при этом снижаются свойства основания.
Щелочная среда используется для восстановления элементов с образованием гидросолей, например, гексагидроксоалюминат натрия. Если судить о тетрагидроксиде титана, то название подчеркивает возможность взаимной реакции с кислотами. Эта же субстанция гидроокиси называется ортокислотой при характеристике ее реагирования в условиях щелочной среды.
Активные металлические соединения образовывают сильнополярные ионные связи, поэтому относятся к группе оснований. Уменьшение динамичности характера вещества изменяется в сторону кислотного реагирования: НМпО, КОН, 5с (ОН)3, Са (ОН)2, НУО3 и другие.
Амфотерные оксиды М2О3 и соответствующие им гидроксиды М (ОН)3 (при этом исключается В2О3) плохо растворяются в водном растворе.
Гидроксиды характеризуются неравномерным изменением двойственных характеристик:
Другие вещества
Соединение гидроксида циркония является малорастворимым в воде и проявляет устойчивость к этой среде. Вещество относится к классу полимеров с положительно заряженными частицами, который содержит периодические цепи, расположенные в клеточном порядке. Материал не реагирует на основания, восстановительных и окислительных агентов.
В кислых растворах гидроксид циркония переводит анионы С1, НО3, СГО4, 8Ог на ионы ОН. Увеличение температурных показателей почти не сказывается на скорости обмена. В случае с цирконием не происходит образование определенных гидратов, термогравиметрические измерения показывают осадок полимерных частиц с образованием структурного слоя.
Германий находится ближе к группе металлов и образовывает связи, в которых его степень окисления расценивается по 2 категории. Соединения являются менее прочными, по сравнению с контактами германиевого аналога свинцовой группы, и отличаются восстановительными характеристиками. Амфотерный гидроксид с явно выраженными кислотными свойствами соответствует черному оксиду германия, молекулы которого не растворяются в жидкости. Последний носит название германистой кислоты, а его осадочные соли — германитов.
Если элемент в зависимости от условий образовывает несколько различающихся по составу оснований, то наиболее сильным признается то, которое отличается низкой окислительной степенью.
Качества основания в таких веществах выражаются ярко. Сильной является кислота, анионы которой содержат множество кислородных атомов в случае появления у элемента нескольких кислотосодержащих соединений.
Химия
План урока:
Основное понятие амфотерности
Что такое металлы и неметаллы – понять нетрудно. Металлы обладают восстановительными свойствами и в химической реакции отдают электроны. При этом, гидроксиды металлов – это основания. Неметаллы, напротив, являются окислителями и забирают электроны. Гидроксиды неметаллов – это кислоты.
Амфотерные соединения могут проявлять как окислительные, так и восстановительные свойства в зависимости от реакционной среды. Гидроксиды таких атомов могут выступать в качестве кислот или оснований.
Расположение амфотерных элементов в таблице Менделеева
В таблице Менделеева положение того или иного атома сообщает значительную часть информации о строении атома этого элемента и его химических свойствах. Периодической эта система называется, потому что в разных периодах (горизонтальные строчки) и группах (вертикальные столбцы) повторяется определенное качество элементов. Так, вся первая группа является щелочными металлами, а седьмая – галогенами (неметаллами), восьмая – инертными газами. Но, это характерно только для главной подгруппы. В побочной группе располагаются амфотерные элементы.
Строение атома амфотерных элементов
Особенность химических свойств амфотерных элементов связана со строением их атомов. У них происходит предзаполнение s-подуровня, из-за этого, незаполненным оказывается всегда d-подуровень. Все представители побочных подгрупп являются p- или d-элементами. В различных условиях может происходить перескок электронов с подуровней и увеличение неспаренных электронов.
Таблица. Строение атомов некоторых амфотерных элементов
Для некоторых из них характерен проскок электрона. Это состояние, при котором электрон с последнего уровня перескакивает на следующий. По этой причине оказывается неспаренным s-электрон.
Представители амфотерных элементов
Все элементы побочных групп являются амфотерными и проявляют сходные химические свойства. Наиболее распространены в природе три элемента: Al, Zn и Cr.
Цинк как амфотерный элемент
Цинк — это относительно мягкий светло-серый металл. Является одним из самых распространенных амфотерных элементов. В природе цинк встречается в составе 66 минералов, наиболее распространенные представлены в таблице.
Таблица. Минералы, в состав которых входит Zn
Цинк является d-элементом.
Алюминий как амфотерный элемент
Al является самым распространенных элементом не только среди металлов, но и во всей таблице Менделеева. Он занимает 3 место после кислорода (O2) и кремния (Si).
Это мягкое вещество серебристо-серого цвета с низкой температурой плавления. В природе встречается как в виде минералов, так и в виде самородков. Является примесью многих минералов.
Наиболее распространенные минералы, содержащие Al:
Последний минерал в зависимости от примесей имеет разный окрас. Применяется в ювелирном деле и считается полудрагоценным камнем.
Свойства металлов Al и Zn как простых веществ
Al – сильно пластичный легкий металл с низкой температурой плавления. Обладает высокой ковкостью и электропроводностью.
На воздухе он покрывается оксидной пленкой поэтому практически не подвергается коррозии. Благодаря этому он используется при изготовлении проводов и корпусов машинной техники.
Получение алюминия и цинка
Основной способ получения металлов – выделение их из состава руды. Для этого используется наиболее богатая металлом горная порода. Алюминий получают из боксита. Этот процесс состоит из трех этапов:
Получение цинка производится несколькими методами – электролитическим (так же как и Al) и пирометаллургический. Второй способ основан на восстановлении цинка из его оксида углеродом или оксидом углерода II (угарным газом):
Достоинство этого метода в том, что продукты первой реакции могут использоваться во второй, что снижает количество выбросов в атмосферу.
Химические свойства алюминия и цинка
Оба вещества способны реагировать как обычные металлы. Так же, есть ряд специфических реакций.
Взаимодействие с неметаллами
С неметаллами и оба вещества взаимодействуют с образованием бинарных соединений – солей. Как правило, скорость течения реакции и условия зависят от активности неметалла. Так, с кислородом реакция идет реакция образования оксида при нагревании с цинком:
с алюминием в обычных условиях:
Оксид алюминия покрывает изделие плотной пленкой (оксидная пленка) и доступ кислорода прекращается, поэтому, для полной реакции его нужно брать в порошке.
Zn не реагирует с Br, N2, Si, C, H2.
Al не вступает в реакцию только с H2.
Взаимодействие с металлами
С восстановителями оба металла образуют сплавы:
Это не является химической реакцией, так как не происходит передачи электронов или изменения химических свойств веществ.
Взаимодействие с кислотами и щелочами
С кислотами и алюминий, и цинк взаимодействуют при обычных условиях с образованием солей:
Результат реакции со щелочами зависит от условий реакции: если реакция идет в растворе (в присутствии воды), то образуются комплексные соли:
В безводной среде (сплавление) образуются соли металлических кислот:
2Al + 6KOH = 2KAlO2 + 2K2O + 3H2 (KAlO2 – алюминат калия).
Взаимодействие с водой
Алюминий активно взаимодействует с водой, если очистить оксидную пленку. Реакцию нужно проводить быстро, так как пленка образуется практически мгновенно:
Zn реагирует с водой при очень высокой температуре (при накаливании до красного состояния):
Оксиды цинка и алюминия
ZnO – оксид, широко используемый в химической промышленности. Он применяется для получения солей. В реакции со щелочами образуются комплексные соли, легко разрушаемые кислотами.
Al2O3 –глинозем. Имеет очень плотную кристаллическую решетку, из-за чего практически не реагирует при обычных условиях. При экстремально высоких температурах вступает в реакцию со щелочами:
Может вступать в реакцию с кипящими кислотами с образованием комплексных солей.
Применение алюминия и цинка
Al как самый распространенный элемент широко используется в химической промышленности. Он способен вытеснять восстановители из соединений, поэтому применяется для получения металлов. Такой метод называется алюмотермия.
Благодаря оксидной пленке и низкой плотности используется в автомобиле-, самолето- и ракетостроении для снижения массы изделия. В строительстве алюминий применяется для изготовления каркасов высотных зданий.
Zn применяется для снижения коррозии металлических изделий –цинкование. Порошок этого металла используется для изготовления масляных красок с металлическим блеском. Также, оксид служит в качестве антисептика. Мази на основе цинкового порошка используются в лечении лишаев и других инфекционных поражений кожи.
Сплавы алюминия и цинка
В металлургии практически не применяются в чистом виде из-за высокой пластичности. Для того чтобы сохранить достоинства металлов, но убрать недостатки осуществляют сплавление с другими металлами.
Сплавы алюминия
Сплавы алюминия делятся на две группы:
Таблица. Характеристика основных сплавов алюминия
Сплавы цинка
Самый используемый сплав цинка – латунь (Cu — Zn). Он обладает хорошими сварными свойствами, поэтому применяется в изготовлении кухонной утвари и различных изделий интерьера.
Если к этому сплаву добавляют свинец, этот сплав называется мунц-металл. Оба сплава применяются при литье труб и каркасов.