Амидопириновая проба для чего
Амидопириновая проба: правила проведения и оценки результата
Амидопириновая проба – один из методов контроля предстерилизационной очистки медицинских инструментов. После применения моющих растворов на медицинских инструментах не должно оставаться следов белка, жира, крови и других загрязнений. Определить это невооруженным глазом невозможно: на помощь приходят химические реакции. Амидопириновая проба позволяет с точностью определить наличие скрытой крови. В статье рассмотрим правила и порядок ее проведения.
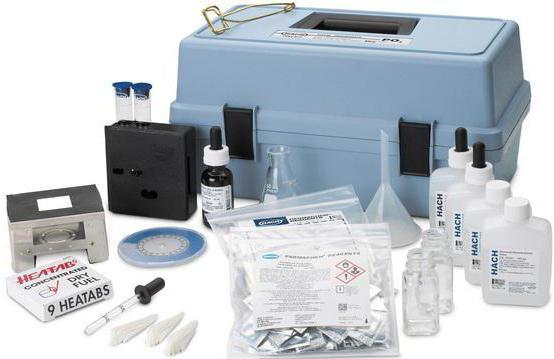
Реагенты
Раствор для амидопириновой пробы может изготавливаться непосредственно перед применением или же заранее. Поместив смесь во флакон с притертой пробкой в холодильник, ее можно хранить на протяжение одного месяца. Это достаточно удобно: не нужно каждый раз тратить время на приготовление раствора.
Для проведения амидопириновой пробы необходимы следующие вещества:
Перед использованием следует проверить срок годности каждого из реагентов. Дополнительно для проведения реакции понадобятся: мензурка, лоток с сухими инструментами, приготовленными для пробы, лоток с ватными тампонами и пипетки. Все используемые емкости должны быть стерильны.
Метод приготовления и использования
Амидопириновая проба довольно легко проводится: не требуется никаких особых навыков, только четкое следование инструкции. Приготовив все реактивы, емкости и приспособления, следует приступить к процедуре. Для этого используется следующий алгоритм:
На данном этапе важно соблюсти правила стерильности всех используемых для приготовления и нанесения раствора инструментов. Результаты пробы не должны быть искажены, потому как для соблюдения правил асептики необходима, в частности, амидопириновая проба. Инфекции, которые могут содержаться в остатках крови, нередко становятся серьезной угрозой для жизни и здоровья населения.
Завершение пробы
После нанесения реагента на инструменты в течение минуты необходимо оценить результат. Если за 60 секунд произошло окрашивание, проба считается положительной. Изменение цвета в промежуток времени после 1 минуты не засчитывается. Положительная амидопириновая проба определяется в том случае, если раствор окрасился в фиолетовый (сине-зеленый) цвет. Отрицательная – если оттенок раствора не изменился после нанесения его на инструментарий.
После получения результатов в случае обнаружения остатков крови (положительная проба) всю партию инструментов снова подвергают предстерилизационной очистке. Если цвет жидкости не изменился, то проверяемый инструмент опускают в мыльный раствор. Затем всю партию направляют на стерилизацию установленным методом.
Контроль качества проведения предстерилизационной очистки стоматологических инструментов
Контроль качества предстерилизационной очистки осуществляют до проведения стерилизации путем постановки азопирамовой или амидопириновой пробы, а также путем постановки фенолфталеиновой пробы.
Азопирамовая проба. Азопирам выявляет наличие следов крови, пироксидаз растительного происхождения, хлорсодержащих препаратов, стирального порошка с отбеливателем и ржавчины. Азопирам содержит 10% амидопирин, 0,1–0,15% солянокислый анилин и 95° этиловый спирт, хранится в плотно закрытом флаконе при комнатной температуре (10-23°С) не более 1 месяца. Перед постановкой азопирамовой пробы смешивают азопирам и 3% раствор перекиси водорода в равных по объему количествах и работают этим реактивом в течение 1-2 часа. Проба с азопирамом по чувствительности в 10 раз превышает амидопириновую.
Амидопириновая проба. Рабочий раствор для постановки амидопириновой пробы представляет собой смесь равных количеств 5% спиртового раствора амидопирина, 30% уксусной кислоты и 3% раствора перекиси водовода. С помощью этой пробы определяют качество отмывки инструментов от остатков крови.
Фенолфталеиновая проба позволяет выявить наличие остаточных количеств щелочных компонентов моющего препарата. Для реакции используют 1% раствор фенолфталеина.
На контролируемое изделие наносят 2-3 капли реактива и протирают его тампоном. При положительной азопирамовой пробе возникает фиолетовое окрашивание, быстро, в течение нескольких секунд, переходящее в розово- сиреневое и буроватое. Окрашивание, наступившее позже чем через 1 минуту, не учитывается. Буроватое окрашивание появляется при наличии ржавчины и хлорсодержащих окислителей, в остальных случаях окрашивание розово- сиреневое.
При положительной амидопириновой пробе возникает сине- зеленое окрашивание. Фенолфталеиновая проба при наличии неотмытых компонентов синтетических моющих средств дает розовое окрашивание.
При положительных пробах вся партия контролируемых изделий подлежит повторной обработке до получения отрицательных результатов.
Результаты контроля отражают по форме №366/У, утвержденной приказом МЗ СССР 04.10.1980г. №1030 «Журнал учета качества предстерилизационной обработки».
Медицинский образовательный портал kbmk.info

Фенолфталеин в щелочной среде
Азопирановая проба
Проводится на наличие гемоглобина, окислителей, хлорсодержащих средств, стирального порошка, ржавчины.
Состав азопирама:
100 мл амидопирина;
1 мл солянокислого анилина
Смешать в сухой посуде и залить 96%. спиртом до 1 литра. Смесь тщательно перемешать палочкой до полного растворения всех ингредиентов.
Хранить в плотно закрытом флаконе при температуре +4 С (в холодильнике) в течение 2 месяцев, при температуре от + 18 С до 4 — 20 ° С в течение 1 месяца.
ВНИМАНИЕ! Умеренное пожелтение реактива в процессе хранения без выпадения осадков не снижает его рабочих качеств.
Непосредственно перед проверкой качества очистки изделий, готовим рабочий раствор.
Смешивают в равных количествах азопирам и 3% раствор перекиси водорода (азопирамовая проба проводится так же, как амидопириновая). Реакция в течение 1 минуты.
При положительной реакции окрашивание:
сине-фиолетовое — наличие крови;
бурое — наличие хлор содержащих окислителей, ржавчина;
розовое — наличие моющего средства.
Температура исследуемого изделия от + 18 ° С до от +25 0 С. Рабочий раствор азопирама с перекисью водорода должен быть использован в течение 2 часов
Амидопириновая проба
Проводится на наличие КРОВИ.
Состав смеси:
5% спиртовой раствор амидопирина,
30% раствор уксусной кислоты,
3% раствор перекиси водорода.
Смешать в отдельной емкости в равных количествах все перечисленные ингредиенты.
Нанести смесь на инструмент в места, соприкасающиеся с раневой поверхностью, в места соединения подвижных частей инструмента. Индикация загрязнений, присутствия следов крови происходит немедленно или не позднее, чем через 1 минуту после контакта реактива с загрязненным участком. В данном месте появляется фиолетовое (сине-зеленое) окрашивание.
Окрашивание, наступившее в течение 2 минут не учитывается.
Рабочий раствор готовят непосредственно перед применением.
Внимание! При получении положительной реакции амидопириновой или азопирамовой пробы всю партию изделий медицинского назначения стерилизуют, а инструмент, на котором проводилась, проба промывают под проточной водой и помещают в емкость с моющим раствором для повторной обработки
Фенолфталеиновая проба
Качество отмывания с поверхности инструмента активных веществ моющего средства проверяют реакцией спиртового раствора фенолфталеина. Нанести 2-3 капли раствора на инструмент (на места соприкосновения инструмента с раневой поверхностью и на места соединения подвижных частей инструмента). При появлении розового окрашивания, свидетельствующего о наличие неотмытых веществ, всю партию изделий промывают повторно проточной водой, затем дистиллированной. Инструмент, на котором проводилась проба, промывают проточной водой от реактива и помещают в емкость с моющим раствором для повторной предстерилизационной очистки.
При проверке качества очистки игл, реактив набирают в чистый, не имеющий следов коррозии шприц, и, последовательно меняя иглы, пропускают реактив через них, выдавливая 3-4 капли на марлевую салфетку. Затем, для более тщательного контроля, на чистую иглу накручивают маленький кусочек ваты, смоченный реактивом, и протирают наружную часть иглы.
Качество очистки катетеров или других полых изделий оценивают путем введения реактива внутрь изделий с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия в течение 0,5-1 минуты. После этого его сливают на марлевую салфетку. В лечебно-профилактических учреждениях ежедневному контролю подвергают 1-4% предметов медицинского назначения из каждой обработанной партии, но не менее 3-5 единиц. Результаты заносят в журнал.
Стерилизацию предметов медицинского назначения проводят различными методами: паром, сухим горячим воздухом, растворами химических веществ. Выбор того или иного метода стерилизации зависит от особенностей стерилизуемого объекта
АМИДОПИРИНОВАЯ ПРОБА
Амидопириновая проба (синоним пирамидоновая проба) — дифференциально-диагностический тест при затяжной субфебрильной температуре невыясненной этиологии. Предложена Голло (J. Hollo) в 1917 году для оценки субфебрильной температуры у больных туберкулезом легких.
Детально изучена Б. А. Черногубовым, который расширил показания к ее применению. Затяжная нейро-вегетативная субфебрильная температура (по Черногубову) характеризуется устойчивостью к амидопирину, что отличает ее от гипертермии инфекционного генеза, при которой производные пиразолона (амидопирин и др.) оказывают выраженное противовоспалительное и жаропонижающее действие; механизм последнего не вполне ясен.
Амидопириновая проба проводится на протяжении 3 дней в условиях режима, соблюдавшегося больным до ее применения. Температура тела измеряется выверенным термометром с 6 до 18 часов ежечасно. В первый день проводится контрольное измерение температуры без приема амидопирина. На второй день измерение температуры проводится каждый час с одновременным приемом дробных доз амидопирина, назначаемого в суточной дозе по 1,5 г. Готовят 300 мл 0,5% раствора, то есть 15 доз по 20 мл. В 6 часов утра дают одномоментно 3 дозы (60 мл), каждый последующий час с 7 до 18 по 20 мл, то есть остающиеся 240 мл. На третий день повторяют контрольное ежечасное (с 6 до 18) измерение температуры. По окончании пробы сравнивают данные, полученные на протяжении 3 дней.
Нормализация температуры в день приема амидопирина наблюдается при субфебрильной температуре инфекционной природы. При лихорадке неинфекционной природы снижения температуры не отмечается.
Противопоказанием для проведения амидопириновой пробы является индивидуальная непереносимость производных пиразолона, выраженная лейкоцитопения.
Проводить амидопириновую пробу не рекомендуется женщинам в период менструации, когда возможны спонтанные колебания температуры.
Амидопириновая проба не имеет самостоятельного диагностического значения и может применяться лишь в комплексе с другими методами исследования.
Библиография: Калугина Л. Т. О «черногубовской» пирамидоновой пробе, в кн.: Вопр. ревм., под ред. М. Г. Малкина, с. 12, М., 1967; Holló J. Über eine neue Methode zur Beurteilung subfebriler Temperaturkurven im Verlaufe derLungentuberkulose, Beitr. Klin. Tuberk., Bd 36, S. 29, 1916—1917.
Алгоритм проведения гемотрансфузии
Правила клинического использования донорской крови и (или)ее компонентов.
Трудноопределимые группы крови
Неспецифическая агглютинация наблюдается при аутоиммунной гемолитической анемии и других аутоиммунных заболеваниях, сопровождающихся адсорбцией аутоантител на эритроцитах, при гемолитической болезни новорожденных, эритроциты которых нагружены аллоантителами матери.
Кровяные химеры. Кровяными химерами называют одновременное пребывание в кровяном русле двух популяций эритроцитов, отличающихся по группе крови и другим антигенам.
Трансфузионные химеры возникают в результате многократного переливания эритроцитной массы или взвеси группы 0 (I) реципиентам другой группы. Истинные химеры встречаются у гетерозиготных близнецов, а также после пересадки аллогенного костного мозга.
Другие особенности. Определение группы крови АВ0 и резус принадлежности может быть затруднено у больных в связи с изменением свойств эритроцитов при различных патологических состояниях (у больных циррозом печени, при ожогах, сепсисе).
Проба на совместимость на плоскости при комнатной температуре
для проведения проб на индивидуальную совместимось используется кровь ( сыворотка) больного, взятая перед трансфузией или не более чем за 24 часа, при условии хранения при температуре +4+2°С.
Проба на совместимость с применением 33%полиглюкина
В пробирку вносят 2 капли (0, 1 мл) сыворотки реципиента 1 каплю (0, 05) мл эритроцитов донора и добавляют 1 каплю (0, 1 мл) 33% полиглюкина.
Пробирку наклоняют до горизонтального положения, слегка потряхивая, затем медленно вращают таким образом, чтобы содержимое ее растеклось по стенкам тонким слоем. Контакт эритроцитов с сывороткой больного при вращении пробирки следует продолжать не менее 3 мин.
Результат учитывают, просматривая пробирки на свет невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
Ошибочный порядок расположения реагентов.
Температурные условия (определение группы крови производят при температуре не ниже 15°Си не выше 25°С)
Соотношение реагентов и исследуемых эритроцитов.
Продолжительность наблюдения. (позволяет выявить слабый агглютиноген А_2, характеризующийся замедленной агглютинацией)
Биологическую пробу проводят независимо от объема гемотрансфузионной среды и скорости ее введения.
При необходимости переливания нескольких доз компонентов крови биологическую пробу проводят перед началом переливания каждой новой дозы.
в течение 3 мин наблюдают за реципиентом, контролируя у него пульс, дыхание, артериальное давление, общее состояние, цвет кожи, измеряют температуру тела
такую процедуру повторяют еще дважды. Появление в этот период даже одного из таких клинических симптомов, как озноб, боли в пояснице, чувство жара и стеснения в груди, головной боли, тошноты или рвоты, требует немедленного прекращения трансфузии и отказа от переливания данной трансфузионной среды.
Экстренность трансфузии компонентов крови не освобождает от выполнения биологической пробы.
Врач, проводящий переливание компонентов крови обязан:
1.Определить показания для проведения гемотрансфузионной терапии с учетом противопоказаний.
2. Получить информированное добровольное согласие реципиента или его законного представителя на проведение гемотрансфузионной терапии по установленной форме.
3. Провести первичное определение групповой принадлежности крови больного по системе АВО.
КАТЕГОРИЧЕСКИ ЗАПРЕЩАЕТСЯ ИСПОЛЬЗОВАТЬ ДАННЫЕ О ГРУППОВОЙ ПРИНАДЛЕЖНОСТИ ПО СИСТЕМАМ АВО И РЕЗУС ИЗ ПАСПОРТА, ПРЕДШЕДСТВУЮЩЕЙ ИСТОРИИ БОЛЕЗНИ И ДРУГИХ ДОКУМЕНТОВ.
4. Внести в направление в клинико-диагностическую лабораторию (форма № 207/у), сведения о результате определения группы крови по системе АВО, серии диагностикумов, трансфузионный и акушерско-гинекологический анамнез. Подписать направление
5. Ознакомиться с заключением клинико-диагностической лаборатории. Перенести данные о групповой и резус-принадлежности больного на лицевую часть медицинской карты стационарного больного с указанием даты анализа и своей фамилии.
6. Оформить предтрансфузионный эпикриз.
7. Провести макроскопическую оценку лабораторного желатина и диагностикумов.
8. Провести макроскопическую оценку каждой дозы гемотрансфузионной среды.
9. Повторно непосредственно перед трансфузией определить группу крови реципиента по системе АВО
10. Определить группу крови по системе АВО с эритроцитсодержащей средой.
11. Проконтролировать соответствие паспортных данных.
12. Провести пробу на совместимость крови реципиента и крови донора (гемотрансфузионной среды) по системам АВО и резус.
13. Зафиксировать результат изосерологических исследований в протоколе операции переливания крови.
ПРОБЫ НА ИНДИВИДУАЛЬНУЮ СОВМЕСТИМОСТЬ ПО СИСТЕМЕ АВО И РЕЗУС НЕ ЗАМЕНЯЮТ ДРУГ ДРУГА.
ПРОВОДЯТСЯ ВО ВСЕХ СЛУЧАЯХ С ОБРАЗЦАМИ КРОВИ ИЗ КАЖДОГО КОНТЕЙНЕРА.
ОБЯЗАТЕЛЬНЫ, ДАЖЕ ЕСЛИ ЭРИТРОЦИТНАЯ МАССА ИЛИ ВЗВЕСЬ ПОДОБРАНЫ РЕЦИПИЕНТУ ИНДИВИДУАЛЬНО В СПЕЦИАЛИЗИРОВАННОЙ ЛАБОРАТОРИИ.
14. Провести биологическую пробу. Зафиксировать её результат в протоколе операции переливания крови.
15. Контролировать состояние реципиента, темп введения трансфузионной среды.
16. При изменении состояния больного в первую очередь исключить посттрансфузионное осложнение.
17. Оценить показатели артериального давления, пульса, результаты термометрии.
18. Зарегистрировать гемотрансфузию:
•в дневнике наблюдений медицинской карты стационарного больного;
•в журнале регистрации переливаний крови и её компонентов (форма № 009/у) ;
•заполнить протокол гемотрансфузии
19. Провести макрооценку первой порции мочи.
20. Назначить клинические анализы крови и мочи на следующие сутки после гемотрансфузии.
21. Провести оценку суточного диуреза, водного баланса, результатов анализов мочи и крови.
22. Наблюдать за больным с отражением результатов наблюдения в дневнике истории болезни. При изменении клинической симптоматики и лабораторных показателей до выписки больного из стационара в первую очередь исключить посттрансфузионное осложнение.
Осложнения
-Иммунные осложнения ( острый гемолиз, гипертермическая негемолитическая реакция, анафилактический шок, некардиогенный отек легких)
-Неиммунные осложнения (острый гемолиз, бактериальный шок, ОССН, отек легких)
-Непосредственные осложнения (аллоиммунизация антигенами эритроцитов, лейкоцитов, тромбоцитов или плазменными белками, гемолиз, реакция >, посттрансфузионная пурпура)
-Иммунные ( гемолиз, Реакция «трансплантат против хозяина», Посттрансфузионная пурпура, Аллоиммунизация антигенами эритроцитов, лейкоцитов, тромбоцитов или плазменными белками
А. Г. Румянцев, В. А. Аграненко. Клиническая трансфузиология-М.: ГЭОТАР МЕДИЦИНА, 1997.
Е. Б. Жибурт. Трансфузиология-С.: ПИТЕР, 2002.
Рагимов А. А. Трансфузиология. Национальное руководство-М.: ГЭОТАР Медиа, 2012.
Алгоритмы исследования антигенов эритроцитов и антиэритроцитарных антител в сложнодиагностируемых случаях. Методические рекомендации N 99/181 (утв. Минздравом России 17. 05. 2000)
Приказ Минздрава России от 25. 11. 2002 N363 » Об утверждении Инструкции по применению компонентов крови»
Приказ Минздрава России от 02. 04. 2013 N183н » Об утверждении правил клинического использования донорской крови и (или) ее компонентов»