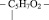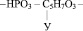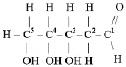Аминокислоты являются мономерами чего
Аминокислоты – чьи мономеры?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Мономеры – это повторяющиеся звенья макромолекул органических соединений под названием биополимеры. К биополимерам относят полисахариды, нуклеиновые кислоты и белки. Аминокислоты являются мономерами белков, моносахариды – полисахаридов, нуклеотиды – нуклеиновых кислот.
Полимеры могут разрушиться до мономеров, из которых сложена их молекула. Такой процесс происходит в пищеварительной системе живых существ. Крупные вещества расщепляются до мелких, которые способны всосаться в кровь. В дальнейшем они используются для формирования новых макромолекул, необходимых организму.
Состав аминокислот
В состав аминокислот входят по одной или по две аминогруппы и карбоксильной группы. Первые обладают щелочными, а вторые кислотными свойствами. Этим обусловлены амфотерные свойства аминокислот, за счет которых они выполняют функции буферных соединений.
Внимание! У большинства аминокислот есть 1 карбоксильная и 1 аминогруппа. Они являются нейтральными.
Как аминокислоты образуют белки?
При дальнейшем объединении аминокислот посредством пептидных связей образуется полипептидная цепь. Ее называют первичной структурой белка.
Сколько аминокислот образуют все многообразие белков?
Существует 26 аминокислот. В образовании всех белков участвуют лишь 20 из них. Протеиногенные, или мажорные аминокислоты бывают заменимыми и незаменимыми.
Аминокислоты заменимые
Заменимые аминокислоты поступают в организм с пищей и образуются в нем из других аминокислот. Всего их 12:
Аминокислоты незаменимые
Незаменимые аминокислоты организмом не вырабатываются, но необходимы ему для полноценной жизнедеятельности, поэтому должны поступать с пищей. Всего их 8:
Внимание! Без аминокислот невозможна жизнедеятельность организма. Без них он не сможет производить белки, которые составляют основу всех его тканей. Кроме того, белки участвуют почти во всех физиологических процессах.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Научная электронная библиотека
§ 2.1.11. Аминокислоты. Белки. Нуклеиновые кислоты
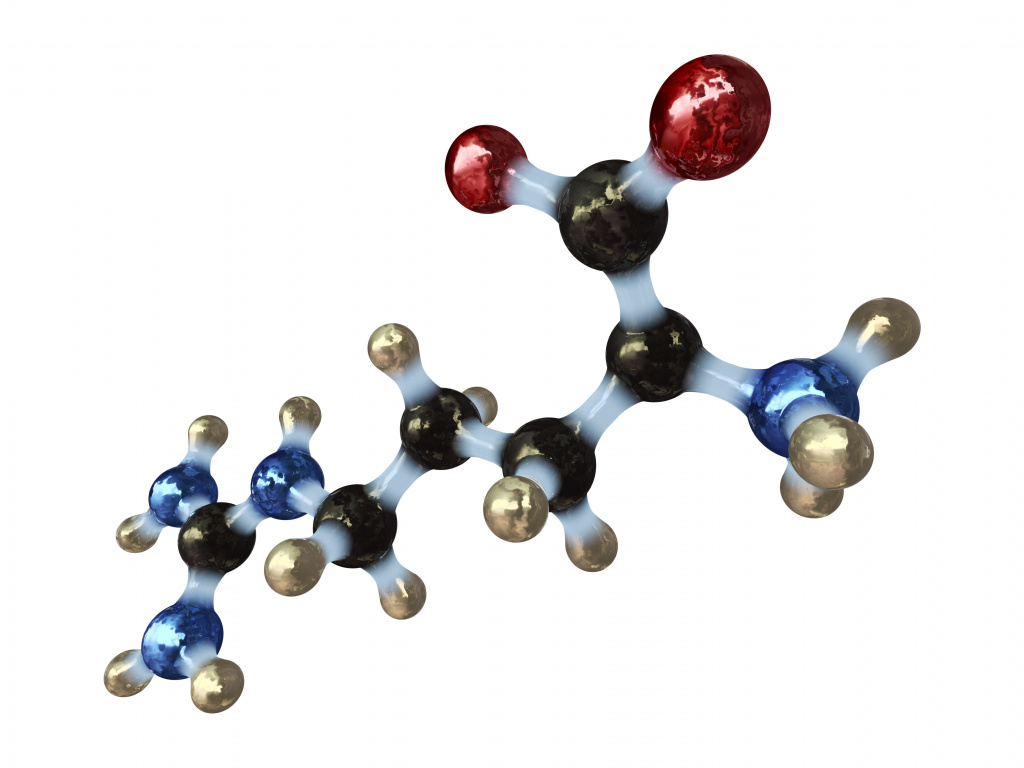
Аминокислотами называются органические соединения, содержащие аминогруппу и карбоксильную группу. Например:
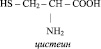
Аминокислоты относятся к веществам со смешанными функциями. Кроме того, они являются азотсодержащими и кислородсодержащими одновременно. Некоторые природные аминокислоты содержат также серу, как, например, цистеин:
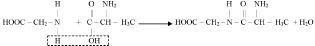
Наиболее характерным химическим свойством аминокислот является способность аминогруппы одной молекулы вступать в реакцию замещения с карбоксильной группой другой молекулы:
В результате образуется новая аминокислота, но уже с пептидной связью, способная взаимодействовать со следующей молекулой аминокислоты и образовать ещё одну пептидную связь. Последовательное увеличение количества пептидных связей в одной молекуле приводит к образованию полимеров, которые называются полипептидами, важнейшими представителями которых являются белки.
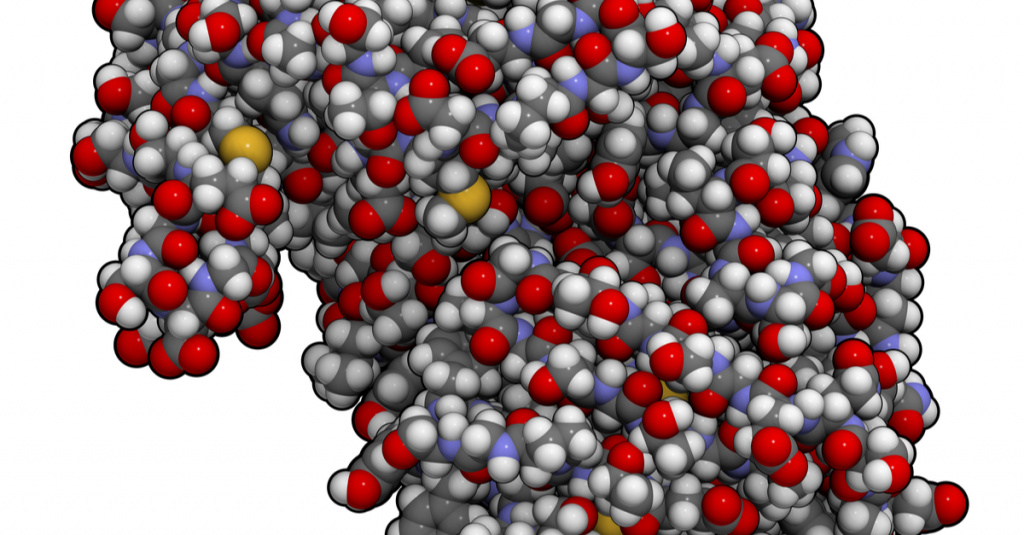
Белки – важнейшая составная часть клеток живых организмов – представляют собой полипептиды, составленные взаимодействием различных α-аминокислот. Таким образом, белки можно рассматривать как полимеры, мономером которых являются α-аминокислоты. Молекулярные массы природных белков колеблются от нескольких десятков тысяч до нескольких сот тысяч а.е.м. Аминокислотные остатки, являющиеся звеньями полипептида называют аминокислотными звеньями. Последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы (рис. 2.6).
Рис. 2.6. Первичная структура белков.
R1, R2, R3, R4 – радикалы остатков аминокислот
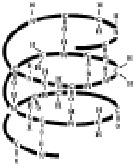
Благодаря многочисленным водородным связям между группами –СО– и –NH– первичная структура белков свёртывается в спираль, которая называется вторичной структурой белковой молекулы (рис. 2.7).
Рис. 2.7. Вторичная структура белков
В свою очередь, вторичная структура также способна свернуться, образовав третичную структуру (рис. 2.8).
Рис. 2.8. Третичная структура белков
Третичная структура поддерживается уже не только водородными связями, но также и ковалентными. В частности между атомами серы различных участков полипептида часто образуется дисульфидный мостик
Некоторые белковые макромолекулы могут соединяться друг с другом, образуя относительно крупные агрегаты. Подобные полимерные образования белков называются четвертичными структурами. Примером такого белка является гемоглобин, который представляет комплекс из четырёх макромолекул (рис. 2.9). Оказывается, что только при такой структуре гемоглобин способен присоединять и транспортировать кислород в организме.
Рис. 2.9. Четвертичная структура белков
Нуклеиновыми кислотами (полинуклеотидами) называют высокомолекулярные органические соединения, повторяющимся звеном которых являются нуклеотиды состоящие из
1. Остатка фосфорной кислоты – НРО3 –
2. Остатка рибозы 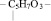
3. Радикалов азотистых оснований, а именно таких как: аденин, тимин, гуанин, цитозин, урацил.
Например, если радикал урацила обозначить У, то молекулярную формулу одного из нуклеотидов можно представить следующим образом:
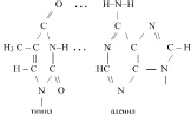
К нуклеиновым кислотам относятся рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Рибонуклеиновые кислоты – это полинуклеотиды, включающие в себя остаток рибозы, радикалы аденина, гуанина, цитозина и урацила. Поскольку различные нуклеотиды РНК отличаются только радикалами азотистых оснований, то нередко каждый нуклеотид обозначают прописной первой буквой названия этого нуклеотида. Поэтому фрагмент какой либо РНК можно представить так
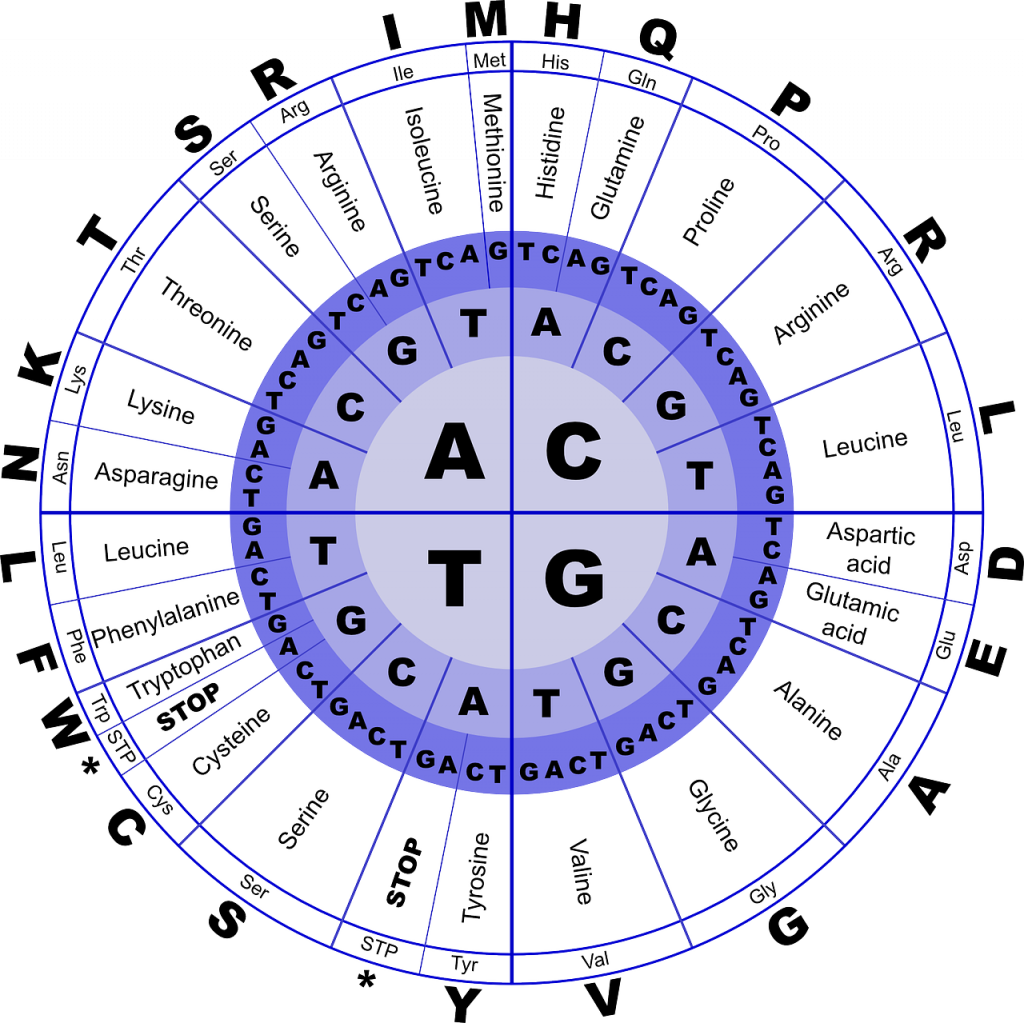
Первичная структура молекулы белка, синтезируемого на информационной (матричной) рибонуклеиновой кислоте (м-РНК) с помощью ферментов[31], определяется именно последовательностью нуклеотидов на этой РНК. Набору из трёх азотистых оснований, который называется триплет нуклеотидов или кодон, соответствует одна и только одна α-аминокислота. В настоящее время насчитывается 20 таких аминокислот (табл. х). Но одной аминокислоте может соответствовать несколько триплетов нуклеотида. Соответствие аминокислоты кодонам называется генетическим кодом. Реакции синтеза белка, у которого последовательность аминокислотных звеньев определяется последовательностью нуклеотидов м-РНК, называются реакциями матричного синтеза.
Последовательность нуклеотидов и-РНК в свою очередь определяется последовательностью азотистых оснований в дезоксирибонуклеиновой кислоте (ДНК), на которой и происходит синтез м-РНК
Дезоксирибонуклеиновые кислоты – это кислоты, состоящие из двух полинуклеотидных цепей, включающих в себя остаток дезоксирибозы, радикалы аденина, гуанина, цитозина, тимина и соединённых между собой по принципу комплементарности (совместимости) водородными связями. То есть, вместо радикала урацила, нуклеотиды ДНК содержат тимил, вместо остатка рибозы, остаток дезоксирибозы,
образующей замкнутый цикл соединением альдегидной группы с гидроксогруппой четвёртого атома углерода.
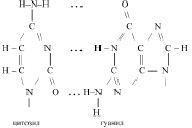
При этом А комплементарен Т, Г комплементарен Ц. То есть, фрагмент первичной структуры ДНК можно представить следующим образом:
Действительно, аденил в ДНК образует водородную связь только с тимилом, а тимил, только с аденилом. Гуанил только с цитозилом, а цитозил только с гуанилом:
Молекулярную формулу одного из нуклеотидов ДНК можно представить так
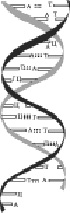
Вторичная структура ДНК представляет собой двойную спираль – две нити ДНК закручены одна вокруг другой (рис. 2.10).
Рис. 2.10. Вторичная структура ДНК
Ферментативный синтез м-РНК осуществляется на одной из цепей ДНК в соответствии с принципом комплементарности. При этом аденин ДНК комплементарен урацилу РНК, тимил ДНК коиплементарен аденину РНК, гуанил ДНК комплементарен цитозилу РНК, цитозил ДНК комплементарен гуанилу РНК. Затем с м-РНК осуществляется матричный синтез белка. К каждому кодону информационной РНК доставляется соответствующая аминокислота с помощью транспортной РНК (т-РНК).
Таким образом, основным хранителем информации о структуре всех белков, вырабатываемых организмом является ДНК.
Отрезок ДНК, содержащий информацию о первичной структуре одного определённого белка, называется геном.
Процесс переписывания информации, содержащейся в гене ДНК на м-РНК называется транскрипцией.
1. Приведите структурные формулы аминокислот, которые Вы знаете. Дайте им названия.
2. Дайте определения понятиям: полипептиды и белки.
3. Что представляют собой первичная, вторичная, третичная и четвертичная структуры белка?
4. В чём сходство и различия химического состава, строения ДНК и РНК? Что такое ген?
5. Каким образом в клетках живых организмов синтезируется м-РНК? Что такое транскрипция?
6. Что такое матричный синтез? Почему в качестве отдельной структурной единицы РНК рассматривают три соседних нуклеотида, а не два или, например, четыре?
Аминокислоты и биосинтез белка
АМИНОКИСЛОТЫ БЕЛКОВ
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
Известно более 200 природных аминокислот, которые можно классифицировать по-разному. Структурная классификация исходит из положения функциональных групп на альфа-, бета-, гамма- или дельта- положении аминокислоты.
Кроме этой классификации, существуют еще и другие, например, классификация по полярности, рН уровню, а также типу группы боковой цепи (алифатические, ациклические, ароматические аминокислоты, аминокислоты, содержащие гидроксил или серу, и т.д.).
В виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Общая структура аминокислот. Альфа аминокислоты. Изомеризация аминокислот.
Аминокислоты – биологически важные органические соединения, состоящие из аминогруппы (-NH2) и карбоновой кислоты (-СООН), и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод, водород, кислород и азот. Прочие элементы находятся в боковой цепи определенных аминокислот.
В структуре аминокислот боковая цепь, специфичная для каждой аминокислоты, обозначается буквой R. Атом углерода, находящийся рядом с карбоксильной группой, называется альфа-углерод, и аминокислоты, боковая цепь которых связана с этим атомом, называются альфа-аминокислотами. Они представляют собой наиболее распространенную в природе форму аминокислот.
По свойствам боковых цепей аминокислоты подразделяются на четыре группы. Боковая цепь может делать аминокислоту слабой кислотой, слабым основанием, или эмульсоидом (если боковая цепь является полярной), или гидрофобным, плохо впитывающим воду, веществом (если боковая цепь неполярна).
АЛЬФА-АМИНОКИСЛОТЫ
Аминокислоты, имеющие как амин-, так и карбоксильную группу, прикрепляются к первому (альфа-) атому углерода имеют особое значение в биохимии. Они известны как 2-, альфа или альфа-аминокислоты (общая формула в большинстве случаев H2NCHRCOOH, где R представляет собой органический заместитель, известный как «боковая цепь»); часто термин «аминокислота» относится именно к ним.
Это 22 протеиногенных (то есть «служащих для строительства белка») аминокислоты, которые сочетаются в пептидные цепи («полипептиды»), обеспечивая построение широкого спектра белков. Они являются L-стереоизомерами («левыми» изомерами), хотя у некоторых бактерий и в некоторых антибиотиках встречаются некоторые из D-аминокислот («правых» изомеров).
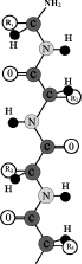
Рис. 2. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ АМИНОКИСЛОТ
Рис. 3. Оптические изомеры аминокислоты аланина
БИОСИНТЕЗ БЕЛКА НА РИБОСОМЕ
СТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(протеиногенные)
Прим.: В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты.
Аминокислоты являются структурными соединениями (мономерами), из которых состоят белки. Они объединяются между собой, формируя короткие полимерные цепи, называемые пептидами длинной цепи, полипептидами или белками. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединяется к двум соседним аминокислотам.
Рис. 5. Рибосома в процессе трансляции (синтеза белка)
Рис. 6 Стадии элонгации полипептида.
Двадцать две аминокислоты естественно включены в полипептиды и называются протеиногенными, или природными, аминокислотами. Из них 20 кодируются с помощью универсального генетического кода.
Белки имеют 4 уровня своей структурной организации: первичная, вторичная, третичная и четвертичная. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями.Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Рис. 8. Структурная организация белков
НЕСТАНДАРТНЫЕ АМИНОКИСЛОТЫ
(Не-протеиногенные)
Функции аминокислот
БЕЛКОВЫЕ И НЕ БЕЛКОВЫЕ ФУНКЦИИ
Из-за своей биологической значимости аминокислоты играют важную роль в питании и обычно используются в пищевых добавках, удобрениях и пищевых технологиях. В промышленности аминокислоты используются при производстве лекарств, биоразлагаемого пластика и хиральных катализаторов.
1. Аминокислоты, белки и питание
О биологической роли и последствиях дефицита аминокислот в организме человека см. информацию в таблицах незаменимых и заменимых аминокислот.
При введении в организм человека с пищей, 20 стандартных аминокислот либо используются для синтеза белков и других биомолекул, либо окисляются в мочевину и углекислый газ в качестве источника энергии. Окисление начинается с удаления аминогруппы через трансаминазу, а затем аминогруппа включается в цикл мочевины. Другой продукт трансамидирования – кетокислота, которая входит в цикл лимонной кислоты. Глюкогенные аминокислоты также могут быть преобразованы в глюкозу посредством глюконеогенеза.
БЕЛКИ
Рис. 9. Белки не только пища. Типы белковых соединений.
Каждый живой организм состоит из белков. Различные формы белков принимают участие во всех процессах, происходящих в живых организмах. В теле человека из белков формируются мышцы, связки, сухожилия, все органы и железы, волосы, ногти; белки входят в состав жидкостей и костей. Ферменты и гормоны, катализирующие и регулирующие все процессы в организме, также являются белками. Дефицит белков в организме опасен для здоровья. Каждый белок уникален и существует для специальных целей.
ПИТАНИЕ И БЕЛКИ
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Стоит подчеркнть, что современная наука о питании утверждает, что белок должен удовлетворять потребности организма в аминокислотах не только по количеству. Данные вещества должны поступать в организм человека в определенных соотношениях между собой.
2. Небелковые функции аминокислот
Нейромедиатор аминокислоты

В организме человека многие аминокислоты используются для синтеза других молекул, например:
Тем не менее, все еще известны не все функции других многочисленных нестандартных аминокислот. Некоторые нестандартные аминокислоты используются растениями для защиты от травоядных животных. Например, канаванин является аналогом аргинина, который содержится во многих бобовых, и в особо крупных количествах в Canavalia gladiata (канавалия мечевидная). Эта аминокислота защищает растения от хищников, например насекомых, и при употреблении некоторых необработанных бобовых может вызывать заболевания у людей.
Классификация протеиногенных аминокислот
Рассмотрим классификацию на примере 20 протеиногенных α-аминокислот, необходимых для синтеза белка
Среди многообразия аминокислот только 20 участвует во внутриклеточном синтезе белков (протеиногенные аминокислоты). Также в организме человека обнаружено еще около 40 непротеиногенных аминокислот. Все протеиногенные аминокислоты являются α-аминокислотами. На их примере можно показать дополнительные способы классификации. Названия аминокислот обычно сокращаются до 3-х буквенного обозначения (см. рис. полипептидной цепи вверху страницы). Профессионалы в молекулярной биологии также используют однобуквенные символы для каждой аминокислоты.
1. По строению бокового радикала выделяют:
Ароматические соединения (арены)
— циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения.
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность;
2. По полярности бокового радикала
Существуют неполярные аминокислоты (ароматические, алифатические) и полярные (незаряженные, отрицательно и положительно заряженные).
3. По кислотно-основным свойствам
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты.
4. По незаменимости
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е.их синтез происходит в недостаточном количестве, особенно это касается детей.