Амплификации нет что значит
Консультации: задать вопрос
На вопросы отвечает победитель номинации»ЛУЧШИЙ ОНКОЛОГ» Скворцов Виталий Александрович, врач высшей категории ГКОД, кмн, хирург-онколог, маммолог, пластический хирург
ВОПРОС: Здравствуйте, мастэктомия Т2n0m0 была в феврале 2019, последняя химиотерапия 4 курса АС в мае 2019 и вот только неделю назад сказали Her2+++ и надо герцептин, скажите, пожалуйста, не поздно уже начинать лечение, узи осмотр делаю раз в пол года.
ОТВЕТ: Здравствуйте! Достаточно много времени прошло после последней химиотерапии и поэтому сейчас назначение с моей точки зрения трастузумаба, возможно, уже неактуально. Надо этот вопрос обсудить с лечащим врачом.
ВОПРОС: Виталий Александрович, что означает her 2 в иммуногистохимии и на что это влияет?
ВОПРОС: Виталий Александрович, амплификация гена her2 не обнаружена, что это значит? Спасибо.
ВОПРОС: Виталий Александрович, здравствуйте! В иммуногистохимическом исследовании написано, что her2 +1 сверхэкспрессия негативная. Что это означает? Спасибо.
ОТВЕТ: Здравствуйте! Это означает, что у Вас не такой агрессивный рак и вам не показана таргетная терапия трастузумабом!!Если бы выл у вас her2 позитивный рак молочной железы, то вам бы вводился трастузумаб!
ВОПРОС: Виталий Александрович, что означает показатель her 2 в иммуногистохимическом исследовании (игх)?
ОТВЕТ: Подробно прочитать о her 2 (her2neu) Вы можете по ссылке her 2 (her2neu)
ВОПРОС: У нас HER2 отрицат. Что оно означает.
ОТВЕТ: Здравствуйте! Этот показатель определяется при раке молочной железы, и он определяет необходимость в назначении таргетной терапии Трастузумабом, в данном случае этот показатель отрицательный и таргетная терапия не показана.
ВОПРОС: Негативный Her2-статус что означает?
ОТВЕТ: Это означает, что данная форма рака молочной железы не требует назначения таргетного лечения Трастузумабом!
ВОПРОС: Рак молочной железы, до операции анализы HER были отрицательными, после операции стали положительными, возможно такое? И какое лечение требуется?
ОТВЕТ: Здравствуйте! Бывает и такое, потому что рак молочной железы гетерогенный. В данном случае я не могу рекомендовать лечение, т.к много факторов не хватает для рекомендаций. Нужен возраст, стадия, полная иммуногистохимия и др.
ВОПРОС: Доброго времени суток. У супруги 53 года 3с стадия, поражены 3 подмышечных, 3 надключичных л.у. ИГХ er 6 б, pgr 6 б, her2/neu +3, ki 67 30%. Каков прогноз при таком агрессивном раке?
ВОПРОС: Здравствуйте. В сентябре 2019 г. мама (63 года) обнаружила в груди новообразование. Обследована. T2N1M0. Инфильтративный протоковый рак молочной железы 3 степени злокачественности. BRCA1, CHEK2 мутаций не обнаружено. ИГХ: ЭР 0, ПР 0, cerbB2 2+, Ki 67 65 %, Fish-позитивная. Прошла 4 курса неадьювантной ПХТ в режиме АС с положительной динамикой по данным УЗИ. Проведено 4 курса таргетной терапии (Паклитаксел + трастузумаб +петрузумаб). Из-за перепрофилирования нашей больницы под Covid не смогли вовремя сделать операцию. Поэтому была сделана еще одна 9 химия. Проведена операция. Левую грудь удалили. После операции врач сказал, что в организме остались клетки. Назначена химиотерапия. Скажите, какой можно сделать прогноз?
ВОПРОС: Добрый день, Виталий Александрович! Рецепторы эстрогенов (клон SP1) 5PS+3IS=8TS, рецепторы прогестерона (клон 1E2) 5PS+2IS=7TS, HER2-статус: 1+ Ki67 26%, T4N2M1 метастазы в печени и костях. Какие прогнозы можете сказать о качественной жизни. Какие протоколы лучше. Благодарю.
ОТВЕТ: Здравствуйте! Проогнозы в данном случае не обсуждаются, это метастатическая форма рака молочной железы и это сложно для любого врача, надо данный случай оценивать со всех сторон. В данном случае стандарты лечения четко говорят как вас лечить и местные доктора Вам в этом помогут. Лечение может быть начато от химиотерапии для достижения стабилизации опухолевого процесса и потом назначение эндокринотерапии. Это лечение назначается онкологическим консилиумом.
ВОПРОС: Здравствуйте, уважаемый Виталий Александрович! В 2018 году органосберегающая операция. ИГХ: ЭР-7, ПР-7, HER-2-3+, G-3, KI-12%. Мне предлагали переделать анализ. Сомнения вызывало, что при kl-12% HER2 не может быть три плюс. Химиотерапевт увидела в этом несоответствие. Переделывать не стала, потому что боялась не получить должного лечения трастузумабом. Прошло столько времени, а я всё сомневаюсь в правильности своего решения. Почему вы по особенному относитесь к больным с HER2 3+++?
ОТВЕТ: Здравствуйте! Это неправда. При таком Ki 67 бывает HER2NEU 3+ рак и даже очень часто. Не сомневайтесь, а продолжайте наблюдение и то лечение, которое Вам рекомендовано ранее в прежнем режиме.
ОТВЕТ: Это значит, что у Вас her2neu позитивный рак, который помимо назначения химиотерапии 4АС+4Т, требует назначения таргетной терапии трастузумабом. Если будет органосохранная операция, то назначение лучевой терапии обязательно. При мастэктомии назначение лучевой терапии зависит от количества мтс с метастазами и этот вопрос в данном случае находится в компетенции врача радиолога.
Прогноз можно ожидать хорошим при правильном полностью проведенном лечении.
Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой
Многие молекулярно-биологические операции напоминают поиск иголки в стоге сена
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Современные биологи в большинстве своём работают с генами. Ген — участок молекулы ДНК, кодирующий белок или РНК. Изучая активность гена и изменения в его работе, чаще всего пользуются методом полимеразной цепной реакции (ПЦР) и различными её модификациями. Метод позволяет найти ген и сделать множество его копий. Однако прибор и реактивы для проведения ПЦР дóроги, а время, необходимое на реакцию, составляет около двух часов. В данной статье описывается аналог полимеразной реакции — LAMP (loop-mediated isothermal amplification), позволяющий провести то же исследование в 10 раз быстрее, дешевле и, что крайне важно, более специфично. Также рассмотрены перспективы применения LAMP в фундаментальных и клинических исследованиях.
Конкурс «био/мол/текст»-2014

Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Как это здорово звучит: я занимаюсь генетикой, работаю с ДНК, РНК, получаю ГМО. Как это странно выглядит: я добавляю прозрачные растворы к прозрачным растворам, ставлю в сложный прибор, который показывает, сколько у меня ДНК, или из каких нуклеотидов она состоит. Конечно, целая молекула ДНК, особенно в связи с белками, поддерживающими её структуру (aka хромосома), ещё видна в микроскоп, но представьте себе один ген, один небольшой участок хромосомы. Чтобы работать с одним геном, его нужно сначала найти. Представьте, найти определённый участок, состоящий из 10000 букв (нуклеотидов) среди 3 миллиардов таких же букв! Разница в пять порядков. Это действительно сравнимо с поиском иголки в стоге сена.
Первым механизм такого поиска в 1983 году запатентовал Кэри Мюллис (Kary Mullis) [1]. Он предложил наработать множество копий исследуемой ДНК. Чтобы понять метод Мюллиса, широко известный как полимеразная цепная реакция (ПЦР) [11] и используемый уже более 30 лет практически в каждой лаборатории мира, обратимся к истокам. Как происходит увеличение количества ДНК в живом организме в естественных условиях.
Репликация ДНК
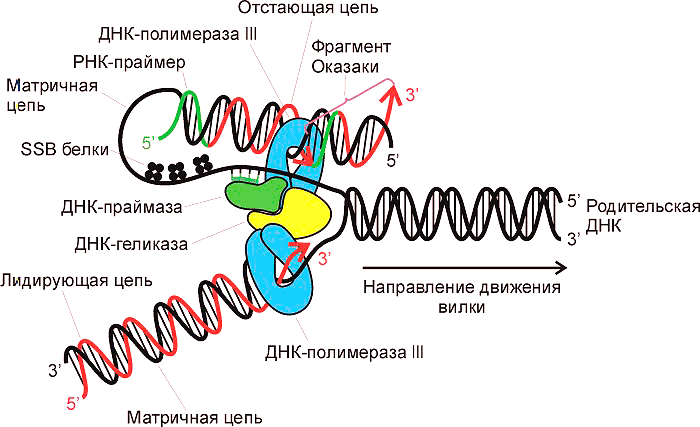
Природный механизм удвоения ДНК, который происходит перед делением каждой клетки, называется репликация (aka редупликация). Надо сказать, что до сих пор не все белки-участники данного процесса изучены, что говорит о его сложности. Главное, что происходит при репликации — сборка дочерней цепи ДНК на половине материнской. Напомню, что ДНК представляет собой двойную спираль, а информативная часть — азотистые основания — скрыта внутри спирали. Задача удвоения ДНК состоит в том, чтобы правильно собрать нуклеотиды в новую цепь и получить две идентичные молекулы. Собирает нуклеотиды фермент ДНК-полимераза. Но как ей добраться до азотистых оснований, скрытых в материнской цепи? Ответ прост — расплести цепи. Исполнение же трудно и требует участия целого ряда ферментов — гираз, лигаз, топоизомераз, белков, связывающих одиночную нить ДНК и препятствующих её повторному воссоединению (SSB белков). Тем не менее, ансамбль белков справляется с этой задачей (рис. 1). Итак, есть ДНК-полимераза, ей доступны азотистые основания матрицы, но что-то синтез не идёт.
Рисунок 1. Репликация ДНК. Обратите внимание, как много белков участвует в этом процессе.
Дело в том, что полимераза — фермент привередливый, синтез ДНК «с нуля» и не пойдёт: необходима затравка (праймер) — свободная OH-группа предыдущего нуклеотида или какого-либо белка. Теперь, присоединяя нуклеотиды к праймеру, ДНК-полимераза может копировать материнскую цепь.
Амплификация ДНК (ПЦР)
Амплификация — это искусственная многократная реплицкация. Итак, процесс репликации ДНК в клетке даже на настоящий момент изучен не до конца. Что же придумал Мюллис 30 лет назад? Как он смог скоординировать, по меньшей мере, десяток ферментов в один момент, о существовании части которых он даже и не знал? Представьте себе, никак. Он взял всего один фермент — ДНК-полимеразу. Доступ к азотистым основаниям обеспечил не белками, а плавлением. («Плавление» ДНК — неферментативное расхождение цепей при нагревании до 92–95 °C.)
Мы помним, что нужен праймер, чтобы «привередливая» полимераза начала работать. Добавляем 18—30-нуклеотидный фрагмент ДНК, комплементарный границе интересующей нас последовательности. Однако больших успехов все равно не получаем. Реакция идёт, но мы не можем сказать, что удваивается именно наш ген, потому что будут получаться фрагменты разной длины, зависящие от времени работы полимеразы и её активности. Как же понять, какой из образующихся продуктов — искомый?
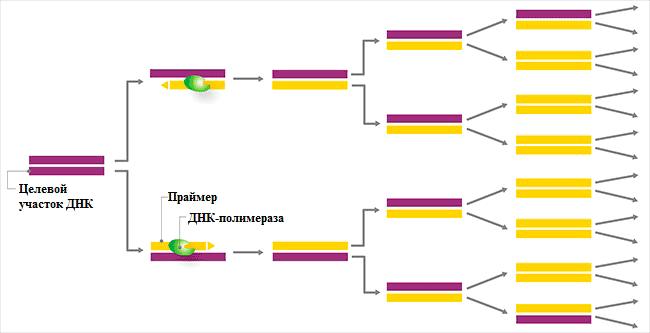
В ответе на этот вопрос и появилась гениальная идея Мюллиса — надо брать не один праймер, а два: прямой (F) и обратный (R). Тогда мы будем знать длину нашего фрагмента и быстро увеличим его количество. Также Мюллис предложил проводить реакцию не один раз, а циклом 30–45 повторов. Математический подсчёт показывает, что количество продукта будет расти как 2 n (рис. 2), где n — число циклов. (А если бы использовался один праймер, то число фрагментов увеличивалось бы просто как n.) То есть через 30 циклов мы получаем в 10 9 (в миллиард) раз больше продукта, чем содержалось в исходном образце (а не в 30 раз больше, как было бы при использовании одного праймера). Почему же такая огромная разница? Дело в том, что при использовании двух праймеров каждый образующийся фрагмент служит матрицей в ходе следующих циклов. В случае одного праймера продукт будет ему не комплементарен и не будет использоваться как матрица в дальнейшем.
Рисунок 2. Схематическое изображение процесса полимеразной цепной реакции. Фиолетовым цветом показана исходная молекула ДНК, жёлтым — образующиеся в ходе реакции молекулы ДНК, идентичные исходной. Видно, что уже после третьего цикла число молекул увеличивается в 8 раз.
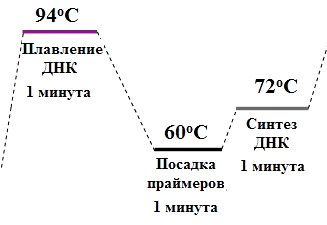
Рисунок 3. Цикл амплификации. Каждый цикл состоит из трёх ступеней: расхождение цепей ДНК, посадка праймеров и синтез новых цепей. Каждая ступень длится около 1 минуты. Таким образом, программа из 30 циклов будет длиться около 90 минут.
Сейчас проведение ПЦР занимает около 2 часов, благодаря использованию особой ДНК-полимеразы [2]. Дело в том, что каждый цикл ПЦР начинается с плавления ДНК на 95 °C (рис. 3), а «простая» полимераза — обычный белок — не выдерживала такой температуры и теряла функциональность, свернувшись, как белок варёного яйца. Поэтому по Мюллису после каждого цикла надо было добавлять новую порцию полимеразы. Рэнди Сайки (Randy Saiki) в 1986 году предложил использовать полимеразу из организма, живущего в термальных источниках — бактерии Thermophilus aquaticus (Taq-полимеразу), выдерживающую такой перегрев и работающую оптимально при 72 °C [3].
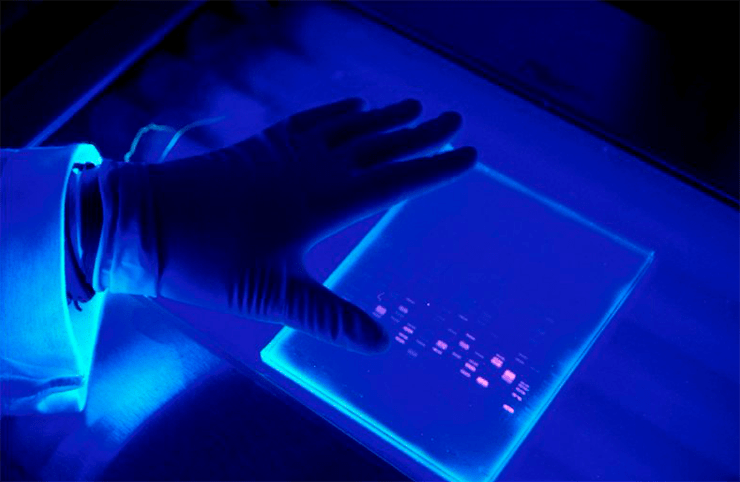
Как же теперь доказать, что, переливая прозрачные растворы, мы всё-таки не потеряли ДНК? Это можно увидеть глазами после 40-минутнтого разделения продуктов ПЦР в геле с помощью электрофореза. Гель — это, своего рода, молекулярное сито, сквозь которое под действием электрического тока идут молекулы: мелкие проходят быстро, крупные — медленно. Кроме того, фрагменты одинаковой длины концентрируются на одном уровне (а мы, следуя рекомендации Мюллиса, специально подбирали праймеры так, чтобы фрагменты были заданной длины). Всё это рассматривается в ультрафиолетовом (УФ) свете после добавления красителей, связывающихся с ДНК. В итоге мы увидим наш один ген или его фрагмент (или ничего не увидим, если искомой ДНК не было) (рис. 4).
Рисунок 4. Результат разделения продуктов ПЦР в агарозном геле. В качестве красителя, связывающего ДНК, использован бромистый этидий. Съёмка сделана в УФ-свете.
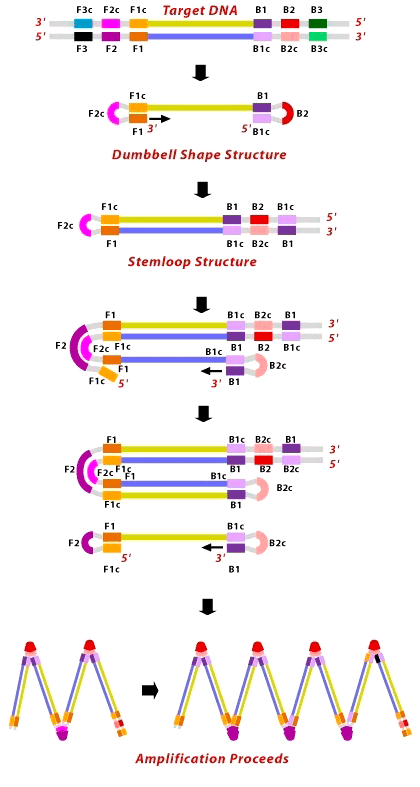
Итак, Мюллис предложил увеличить число иголок в разы, чтобы их блеск без труда можно было различить в сене не интересующей нас ДНК. В настоящее время существует множество модификаций ПЦР, применяемых для самых различных целей. Однако у этой реакции есть существенный минус — потребность в специализированном лабораторном оборудовании: термоциклере-амплификаторе (приборе, способном быстро менять температуру раствора столько раз, сколько нам нужно), камере для электрофореза и т.д. А если этого нет? Можно ли всё провести при одинаковой температуре — например, на водяной бане или в простом термостате? Оказалось, что это возможно, и есть целый ряд методов изотермической амплификации. Слово изотермическая означает, что реакция идёт при постоянной температуре. Наиболее быстрым, специфичным, дешёвым и часто используемым методом является опосредованная образованием петель изотермическая амплификация (loop-mediated isothermal amplification, LAMP). Итак, прольём свет этих LAMP.
Рисунок 5. Схематическое изображение метода LAMP. Для понимания метода вспомните, что синтез идёт от 3′- к 5′-концу (маленькие горизонтальные стрелочки), а обратно — никогда.
Метод LAMP, как и ПЦР, использует термостабильную полимеразу. Примечательно, что, когда искали полимеразу для реакции Мюллиса, нашли две — Taq, которая используется и по сей день для ПЦР, и Bst (из Bacillus stearothermophilus). Было показано, что Bst-полимераза нестабильна и быстро выходит из строя при 95 °C, да и документация к Taq была лучше. Однако у Bst есть преимущество перед Taq: она вымещает вторую цепь ДНК сама, без участия ферментов или использования высоких температур. Использование Bst в методе LAMP позволило проводить реакцию на 30–40 минут быстрее, поскольку исчезает потребность в первом шаге цикла, но это ещё далеко не всё.
В названии метода, кроме постоянства температуры, упоминаются ещё некие петли. Давайте разберёмся. Метод LAMP, описанный японским учёным Цугунори Нотоми (Tsugunori Notomi) в 2000 году [4], подразумевал использование четырех праймеров (пары внутренних и пары внешних), узнающих шесть различных участков искомой ДНК. Внутренние праймеры подобраны таким образом, чтобы сформировать те самые петли на концах искомого фрагмента (рис. 5). Чтобы это удалось, к 5′-концу праймера F2 прикреплена вторая часть, комплементарная F1 части матрицы, — F1c, то есть фрагмент F1c—F2 — это и есть внешний праймер, длинной до 50 нуклеотидов (F от forward, «прямой»). В результате, как только новая цепь ДНК останется одна, из-за вымещающей активности Bst-полимеразы её конец тут же замкнётся в петлю. То же происходит и с праймерами, садящимися на противоположный конец матрицы (B от backward, «обратный»). В конечном итоге, появится одноцепочечный фрагмент ДНК с петлями с обеих сторон — гантелевидная структура (dumbbell structure). На этом завершается первый шаг LAMP.
После получения «гантельки» с одного из её концов (3′) полимераза продолжает синтез к другому (5′), образуя «рукоятку» (stemloop). Концы «рукоятки», оказавшись в одноцепочечном состоянии, замыкаются в петли, продолжая синтез. Так постепенно формируются загзагообразные продукты.
Внешние праймеры (F3 и B3) необходимы лишь в самом начале реакции для разделения двух материнских цепей.
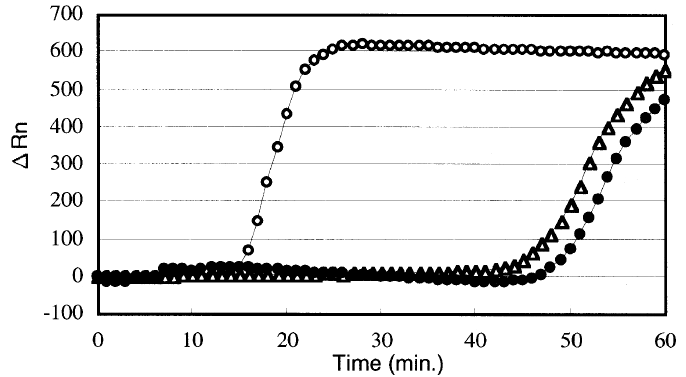
Такой метод позволяет быстрее нарабатывать продукт и длится от часа до получаса. Однако уже через два года этим же учёным удалось усовершенствовать свой метод, добавив ещё одну пару праймеров — петлевые праймеры [5]. При их использовании, предположительно, идёт наработка продукта с петель в обе стороны, а не в одну, как в оригинальном методе. Как показывает график из этой работы (рис. 6), уже через 10–20 минут можно было регистрировать продукт в достаточном количестве.
Рисунок 6. Сравнение эффективности LAMP с добавлением петлевых праймеров (пустые кружки) с классической LAMP (зачернённые кружки). По оси Х отложено время, по оси Y — изменение интенсивности флуоресценции (по нему можно судить об изменение количества ДНК в образце).
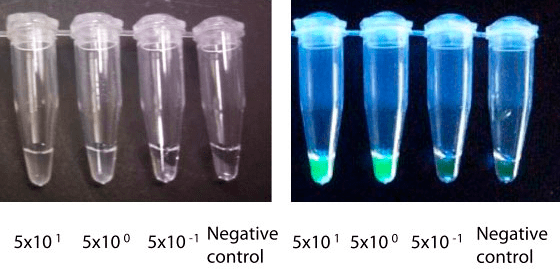
Да, как же регистрировать продукт в этой реакции? Представляете, просто взглянув на пробирку (не нужно ждать 40 минут), можно увидеть помутнение — это выпадает осадок пирофосфата магния. Ионы магния входят в состав реакционной среды, помогая работать Bst-полимеразе, а пирофосфат-ионы высвобождаются из нуклеотидов при синтезе цепи. Для верности можно также добавить краситель, связывающий ДНК и осветить УФ (рис. 7).
Рисунок 7. Визуализация результатов LAMP. Это одинаковые пробирки в естественном (слева) и УФ-свете (справа). В подписях указано исходное число молекул ДНК в пробе. Интересно, что даже 5 молекул ДНК в 25 мкл детектируются этим методом.
Сравнение ПЦР и LAMP
Таким образом, используя метод LAMP, можно ответить на вопрос «Присутствует ли интересующий нас ген в пробе?» за 5–20 минут [7], в то время как при использовании ПЦР ответа придётся ждать около двух часов, не считая времени на электрофоретическое разделение продуктов. Но, как известно, спешка хороша при ловле блох, а для научного исследования куда важнее точность и специфичность (то есть амплификация всегда и только той последовательности ДНК, которую мы задали, а не просто похожей).
Однако и тут LAMP опережает ПЦР. LAMP более специфичен, потому что ему необходимо узнать целых шесть участков в искомой молекуле ДНК, а ПЦР — только два (которые находятся непосредственно под праймерами). Но, что даже более важно, на LAMP не оказывает влияния присутствие биологических компонентов, зачастую не позволяющих провести ПЦР [8]. Исследуемый образец (например, слюну) можно заносить в реакционную смесь без очистки и искать гены вируса [6]. Благодаря этому свойству, LAMP используется в клинической практике для выявления патогенов человека и животных [9], определения пола коров до имплантации зародыша и даже нахождения метастазов прямо во время хирургической операции [10]. Метод прост в исполнении, дёшев (в отличие от других методов изотермической амплификации) и не требует ни сложной техники, ни обязательных биологических знаний.
| Критерий | ПЦР | LAMP |
|---|---|---|
| Необходимость плавления ДНК | + | − |
| Температура (°C) | 94; 55–60; 72 | 60–65 |
| Устойчивость к биологическим компонентам | − | + |
| Продолжительность (минут) | 90–120 | 5–20 |
| Регистрация продукта | электрофорез | невооружённым глазом |
Какой из методов лучше применять, зависит от эксперимента. Если исследователь постоянно меняет праймеры, условия или изучаемый ген, то ПЦР будет удобнее. Несмотря на то, что она занимает больше времени, на деле два часа едва хватает, чтобы приготовить смесь для следующей реакции и занести пробы в биохимический планшет. Если же речь идёт о предотвращении пандемии, и необходимо как можно быстрее определить присутствие известного вирусного агента, то, конечно, LAMP. Его можно применять, например, для мониторинга здоровья пассажиров в аэропортах стран, из которых возможно занесение вируса.
В заключение хочу отметить интересную тенденцию научных исследований, проявившуюся в эволюции методов амплификации нуклеиновых кислот. Как указано выше, во время создания ПЦР был выбор между двумя полимеразами: Taq и Bst. Мюллис выбрал Taq и построил свой метод на ней. А Нотоми спустя двадцать лет вернулся к Bst и придумал ещё более мощный метод LAMP.
Анти-HER2 терапия в лечении рака молочной железы
Анти-HER2 терапия в лечении рака молочной железы
Процессы роста и размножения всех клеток в организме находятся под жестким регулирующим контролем генов, которые способных запускать или останавливать их. В норме в организме поддерживается баланс между появлением новых клеток и гибелью старых. В опухолевых клетках процессы размножения клеток выходят из под контроля. Зачастую это происходит по причине возникновения «сбоев» в работе определенных генов, играющих наиболее важную роль в контроле над делением клеток.
HER2 (аббревиатура от английского human epidermal growth factor receptor 2 – рецептор фактора роста эпидермиса) является одним из таких генов. Этот ген может также обозначаться как «HER2-neu» или «ERBB2», эти названия являются синонимами. Его неправильная работа обнаруживается во многих случаях развития рака молочной железы и приводит к активной выработке в клетках одноименного белка (HER2), что заставляет клетки быстро делиться. Когда в клетке образуется избыточное количество белка HER2, говорят об амплификации этого гена. Амплификация HER2 обнаруживается примерно у 25% пациенток с диагнозом рака молочной железы. Её наличие приводит к повышению агрессивности опухолевых клеток. Вследствие высокой важности знания HER2-статуса опухоли, определение наличия амплификации HER2 является или избыточной выработки белка HER2 является одним из стандартных методов обследования, и проводится у всех пациенток с диагнозом рака молочной железы. Кроме того, в ряде исследований была продемонстрирована клиническая значимость выработки HER2 при раке желудка, по этой причине препараты, подавляющие активность этого белка также применяются для лечения рака желудка.
В чем особенности HER2-положительного рака молочной железы?
Изначально HER2-позитивный рак молочной железы был одним из наиболее агрессивных разновидностей этого заболевания, который характеризовался очень быстрым темпом роста опухоли, высоким риском развития рецидива болезни и появления отдаленных метастазов. Тем не менее, в настоящее время разработано множество препаратов, подавляющих активность этого белка (см. ниже). Они продемонстрировали высокую эффективность в лечении HER2-положительного рака молочной железы, превратив этот подтип рака в один из относительно благоприятных вариантов заболевания. Проведение целенаправленной («таргетной») терапии, блокирующей активность HER2, позволяет значительно повысить эффективность лечения и резко снизить риск развития рецидива рака молочной железы или добиться длительного контроля над болезнью в случае лечения её поздних стадий.
Кому назначаются препараты, блокирующие активность HER2?
Необходимо отметить, что применение препаратов, блокирующих активность HER2, целесообразно только в том случае, если в опухоли есть повышенная выработка этого белка вследствие наличия амплификации гена HER2. Если она отсутствует, раковые клетки не вырабатывают этот белок, следовательно, назначение препаратов, блокирующих активность этого белка не приведет к желаемому результату. По этой причине перед началом лечения всем пациенткам с диагнозом рака молочной железы перед началом лечения проводится специальное обследование, направленное на определение повышенной выработки HER2. Эта информация критически важна для правильного лечения рака молочной железы.
Как определяется HER2 статус опухоли?
В процессе диагностики рака молочной железы небольшой кусочек опухолевой ткани путем биопсии забирается для проведения иммуногистохимического исследования. Как правило, одновременно проводится определение наличия экспрессии (выработки) опухолевыми клетками рецепторов женских половых гормонов, HER2-статуса опухолевых клеток, а также темпов её роста (индекс Ki-67). При проведении этого исследования на опухолевые клетки наносятся специальные «красители», которые окрашивают HER2 в случаях, когда он содержится в клетках в большом количестве. Иммуногистохимическое исследование оценивает наличие гиперпродукции белка HER2 опухолевыми клетками.
По результатам иммуногистохимического определения HER2 статуса опухоли может быть получен один из следующих результатов:
0 баллов – в опухоли не отмечено признаков экспрессии HER2 (результат исследования отрицательный, назначение анти-HER2 препаратов нецелесообразно);
Если по результатам иммуногистохимического исследования была выявлена выраженная экспрессия HER2 (3+), пациентке показано назначение препаратов, блокирующих активность этого белка, так как опухолевые клетки активно вырабатывают этот белок и процессы их роста зависят от его функционирования. Если результат исследования отрицательный (0 или 1+) назначение такого лечения не приведет к желаемому результату.
Получение сомнительного результата (2+) означает, что по результатам иммуногистохимического исследования достоверно определить наличие экспрессии HER2 не удалось и необходимо проведение дополнительных методов исследования, например, т.н. «флюоресцентной гибридизации in situ» (FISH) или схожего с ней метода CISH. Эти методы позволяют напрямую оценить наличие амплификации HER2. По результатам проведения этих тестов может быть получен положительный или отрицательный ответ. Положительный ответ означает, что была выявлена амплификации HER2 и целесообразно назначение анти-HER2 терапии.
Какие существуют лекарственные препараты для лечения HER2-позитивного рака молочной железы?
На данный момент разработано и внедрено в клиническую практику 4 препарата, подавляющих активность HER2. Они несколько различаются по структуре и механизму действия, а также по показаниям к применению, эти лекарства могут назначаться как в комбинации с другими препаратами, например химиотерапевтическими агентами, так и самостоятельно (в монотерапии). В этом разделе представлено краткое описание этих препаратов.
Трастузумаб – лекарственный препарат, который представляет собой белок (моноклональное антитело), сконструированный таким образом, чтобы избирательно связываться с HER2 и «закрывать» его, не давая ему возможности нормально функционировать и провоцировать процессы роста и деления опухолевых клеток. Трастузумаб является препаратом, который наиболее часто назначается пациенткам с HER2-положительным раком молочной железы. Он применяется в сочетании с химиотерапией в качестве пред- или послеоперационной терапии данного заболевания, а также для первоначального лечения поздних его поздних стадий. Препарат выпускается как в виде раствора для внутривенных капельных введений, так и в виде раствора для подкожных введений. Трастузумаб-эмтанзин (T-DM1) – комбинированный препарат, который содержит молекулы трастузумаба, соединенные с противоопухолевым препаратом эмтанзином, который оказывает губительное действие на клетки. Препарат сконструирован таким образом, что молекулы трастузумаба связываются со своей мишенью на поверхности опухолевых клеток, после чего эмтанзин проникает в них и вызывает гибель раковых клеток. Помимо лечения рака молочной железы трастузумаб также применяется для лечения рака желудка в случае выявления в опухоли гиперэкспрессии HER2. Препарат вводится внутривенно капельно.
Пертузумаб – также как и трастузумаб, пертузумаб представляет собой моноклональное антитело к HER2, однако в отличие от трастузумаба он связывается с другим участком этого белка. Препарат назначается в комбинации с трастузумабом и позволяет повысить эффективность лечения. Препарат вводится внутривенно капельно.
Лапатиниб – препарат, блокирующий сигнальный путь, который проводит сигналы от HER2. Препарат применяется для лечения пациенток, у которых было отмечено прогрессирование на фоне применения режимов лечения с использованием трастузумаба, а также для лечения HER2-положительного гормонозависимого рака молочной железы, в этом случае лапатиниб применяется в комбинации с гормонотерапией. Препарат выпускается в виде таблеток и принимается внутрь.
Указанные препараты назначаются только пациенткам с HER2-положительными опухолями (экспрессия HER2 3+ при проведении иммуногистохимического исследования или выявленная амплификация гена при проведении FISH или схожего метода исследования).
Может ли HER2 статус изменяться в процессе проведения лечения?
Необходимо отметить, что HER2 статус опухоли может меняться в процессе проведения лечения как результат изменений, происходящих в раковых клетках. Клетки опухоли ищут способ выжить на фоне проводимой терапии и постоянно изменяются. Например, в случае, если произошел рецидив исходно HER2-положительной опухоли, во вновь выявленных опухолевых очагах может отмечаться исчезновение выработки этого белка и утрата зависимости опухолевых клеток от влияния этого гена. Возможно и обратное – появление гиперэкспрессии HER2 в опухолях, которые исходно не вырабатывали этот белок. По этой причине в случае развития рецидивов или появления метастазов врач может рекомендовать повторное проведение биопсии и проведение нового тестирования для определения HER2 статуса опухоли.