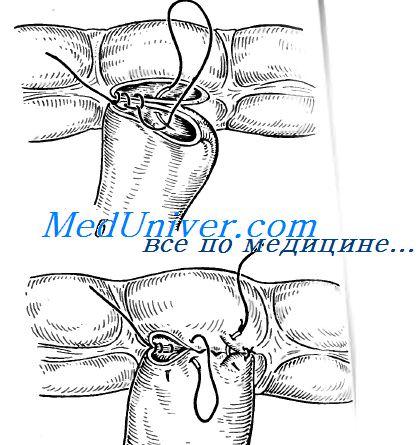
Анастомоз что это означает
Анастомоз что это означает
Лучшее — враг хорошего, а первое впечатление наилучшее, зачем же его портить?
Идеальный анастомоз
Идеален тот кишечный анастомоз, который герметичен, а утечки (относительно редкие) представляют собой смертельно опасную беду. Кроме того, анастомоз не должен быть сужен, он обеспечивает нормальное функционирование ЖКТ даже в первые дни после его сформирования.
Каждый опытный хирург полагает, что именно его техника наложения анастомозов, которую он усвоил от своих учителей и закрепил собственным опытом, — «наилучшая». В практике применяют много методов: конец в конец, конец в бок или бок в бок; одно- или двухрядный шов, узловой или непрерывный, с применением плетеных или монофиламентных, рассасывающихся или нерассасывающихся нитей; а также мы даже знаем хирургов зараженных навязчивой идеей наложения анастомоза трехрядным узловым швом. Ко всему перечисленному добавим степлеры. Чему же отдать предпочтение?
За и против анастомоза
Большое количество экспериментальных и клинических исследований позволяет сделать следующие заключения.
Утечки (несостоятельности) анастомоза. Расхождение анастомозов встречается независимо от методов их формирования, даже если они наложены без натяжения и при хорошем кровоснабжении анастомозируемой кишки.
Стриктуры (сужения) анастомоза. Однорядные анастомозы менее подвержены рубцовым сужениям, чем многорядные. Стриктуры чаще также осложняют анастомозы конец в конец, наложенные циркулярным степлером.
Неудачи наложения анастомоза. В целом степлеры более склонны к интраоперационным «осечкам»
Скорость наложения анастомоза. Механические анастомозы степлерами в среднем выполняются быстрее, чем ручным швом. Чем меньше слоев, тем быстрее накладывается анастомоз, а непрерывный шов занимает меньше времени, чем узловой. В целом на наложение двух кисетных швов для степлерного анастомоза нужно столько же времени, как для однорядного ручного непрерывного шва.
Шовный материал для анастомоза. Плетеные нити (шелк или викрил) пропиливают ткани и (по крайней мере в эксперименте) чаще вызывают воспаление и активацию коллагеназ, чем монофиламентный материал (полидеоксанон — ПДС или пролен). Хромированный кетгут слишком быстро рассасывается, чтобы обеспечить прочность анастомоза. Монофиламентная нить легче проскальзывает сквозь ткани и при непрерывном шве лучше распределяет натяжение вдоль всей окружности анастомоза.
Стоимость наложения анастомоза. Степлеры значительно дороже обычного шовного материала таким образом, материально более затратны. Вообще говоря, чем меньше используется шовного материала, тем дешевле обходится анастомоз, а наиболее экономичен однорядный непрерывный шов.
Анастомоз что это означает
Послеоперационные признаки (абсцесс, свищ, сепсис) выхода кишечного содержимого (или контрастного вещества) за пределы кишки, что может явиться результатом расхождения швов анастомоза или пропущенного дефекта стенки кишки. Диагноз основывается на клинических (таких как перитонит, сепсис, субфебрильная лихорадка, лейкоцитоз, необъяснимая тахикардия, продолжающаяся дисфункция кишечника) или рентгенологических данных (в бессимптомных случаях, например, при наличии проксимальной стомы).
Осложнения: прямая кишка (5-10%), ободочная кишка (2%), тонкая кишка (1%), илеоанальный резервуарный анастомоз (4—5%), континентная илеостома (12%).
а) Дифференциальный диагноз. Абсцесс, несвязанный с кишкой (например, нагноившаяся гематома после разлитого перитонита).
б) Причины. Технические погрешности, недостаточное кровоснабжение, натяжение, плохое состояние тканей (после лучевой терапии, мальнутриция, инфекция), действие лекарственных средств (стероидов, бевацизумаба, химиопрепаратов), курение.
в) Обследование несостоятельности анастамоза кишечника
Необходимый минимальный стандарт:
• Оценка общего состояния больного: тахикардия (изначально может быть единственным симптомом), сепсис с дисфункцией органов, нестабильность гемодинамики, нутритивный статус и т.д.
• Обследование живота: перитонеальные симптомы без четкой локализации, кишечные свищи, состояние раны.
• Несостоятельность заподозрена, но не подтверждена: ирригоскопия с водорастворимым контрастом, КТ.
Сопутствующие факторы, влияющие на принятие решения:
• Ретроспективный анализ интраоперационных трудностей.
• Текущее состояние больного (общее, местное)?
• Несостоятельность: отграниченный или разлитой перитонит?
• Шансы на успех при формировании повторного анастомоза?
• Время, прошедшее после последней лапаротомии?
г) Ведение пациента с несостоятельностью анастамоза кишечника
Консервативное ведение:
• Отграниченная несостоятельность => дренирование абсцесса под контролем КТ => отграниченный свищ.
• Несостоятельность при отключенной кишке => повторное обследование через 6-12 недель.
• Несостоятельность с сепсисом => поддерживающие меры в дополнение к операции: НГЗ, антибиотикотерапия, оптимизация сердечной деятельности и функции дыхания.
• Ранняя симптоматическая несостоятельность ( релапаротомия для поиска дефекта:
— Отключение и дренирование.
— Разобщение анастомоза, формирование стомы (по типу операции Гартссмана).
— Повторное формирование анастомоза (с/без отключения).
— Ригидность стенки кишки в результате воспаления => ни резекция, ни формирование стомы не выполнимы => ушивание дефекта/дренирование или установка дренажа в зоне несостоятельности с целью формирования хорошо отграниченного свищевого хода.
• Поздняя диагностика несостоятельности (> 10 дней) => неблагоприятные условия при релапаротомии:
— Проксимальная стома (если возможно).
— Попытка воздействия на сепсис => установка дренажей (открытая или под контролем КТ) => попытка формирования хорошо отграниченного свищевого хода.
— Разлитой перитонит/сепсис => санационная лапаротомия с широким дренированием.
Видео промывания желудка через назогастральный зонд у взрослого
(оставленный зонд может использоваться для трансназального питания)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Илеональный анастомоз. Анастомоз кишечника как метод лечения язвенного колита.
1. Что такое илеональный анастомоз?
2. Как проводится операция?
Иногда анастомоз кишечника проводится в два этапа. Вначале врач удаляет толстую кишку, делает отверстие в брюшной полости и присоединяет подвздошную кишку к отверстию. Через это отверстие переработанная пища выводится из организма в специальные мешки. Процесс называется илеостомией. На втором этапе анастомоза кишечника из подвздошной кишки формируют мешок (резервуар) и прикрепляют к анальному отверстию. Восстановление после каждой операции занимает от 1 до 2 недель. Две стадии можно объединить в одну операцию, если врач считает это допустимым.
Илеональный анастомоз при лечении неспецифического язвенного колита, как правило, дает хорошие результаты. 8 из 10 человек не имеют проблем после проведения процедуры. Большинство пациентов отмечают улучшение качества жизни после операции.
3. Когда операцию не проводят?
Операцию илеонального анастомоза не проводят пациентам, у которых мышцы прямой кишки не работают должным образом, а также людям с диагностированным раком прямой кишки.
4. Риски при анастомозе кишечника
Как и любая операция, илеональный анастомоз сопряжен с некоторыми рисками. У 25-30 человек из 100 после операции могут наблюдаться следующие осложнения:
У 10 из 100 пациентов могут возникнуть сексуальные проблемы. У женщин, перенесших эту операцию, меньше шансов забеременеть (риск бесплодия).
В большинстве случаев анастомоз кишечника проводят пациентам, которые склонны к развитию рака, и их заболевание не поддается лечению медикаментозными средствами.
Заболевания 
Область применения 
Диагностика 
Наши цены 
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.
Анастомоз что это означает
Цель — выбор оптимального с точки зрения безопасности хирургической техники, надежности, функциональности и простоты формирования пищеводно-тощекишечного анастомоза при раке желудка. Материал и методы. Представлен опыт лечения 145 пациентов с I—IV стадиями рака желудка, которые были разделены на две группы в зависимости от варианта сформированного анастомоза — ручного или аппаратного. Результаты. Не выявлено каких-либо статистически значимых различий между группами по частоте несостоятельности анастомозов, образования в отдаленном послеоперационном периоде стриктуры анастомоза, а также рефлюкс-эзофагита. Вместе с тем длительность выполнения реконструктивного этапа операции при аппаратном анастомозе составила 26±11,3 мин, тогда как при использовании ручного способа — 72±21,9 мин (р
В настоящее время продолжаются острые дискуссии на тему о способах реконструкции верхних отделов желудочно-кишечного тракта (ЖКТ) как при «стандартных», так и при расширенных и комбинированных операциях при раке желудка. Обсуждаются последовательность методологических приемов и безопасность хирургической техники с точки зрения надежности, функциональности и простоты сформированного соустья.
История современной желудочной хирургии берет начало в конце XIX века, когда в 1876 г. Czerny на собаке выполнил первую гастрэктомию. До первой гастрэктомии у человека прошло еще 12 лет, когда в 1883 г. эту попытку предпринял американский хирург Conner, но пациент умер на операционном столе. Первая успешная гастрэктомия, закончившаяся сшиванием пищевода с тощей кишкой, выполнена швейцарцем Shlatter в 1897 г., а уже в 1898 г. Brighman произвел вторую успешную гастрэктомию с формированием эзофагодуоденоанастомоза [1, 2]. За прошедшие почти полтора столетия хирургия совершила колоссальный рывок вперед с технических, молекулярно-генетических и множества других позиций современной медицинской науки, но пищеводно-кишечный анастомоз, как и сто с лишним лет назад, остается предметом споров и мучительных раздумий хирурга.
Многолетний опыт операций по поводу рака желудка никак не изменил два основных требования к пищеводно-кишечному анастомозу и способу реконструкции ЖКТ: 1) минимальное число осложнений в ближайшем послеоперационном периоде; 2) хорошие отдаленные функциональные показатели, обеспечивающие высокое качество жизни оперированных пациентов.
Все усилия хирургов направлены именно на выполнение этих условий. Пути повышения надежности соустья искали в многоэтапных операциях с отсроченным анастомозированием, исследованиях внутрипищеводной и внутрижелудочной гемодинамики, что привело к разработке методов интраоперационной искусственной оксигенации. Широко обсуждались варианты формирования дополнительных сосудистых, артериальных и венозных микрососудистых анастомозов. Рекомендовалась и симпатэктомия с целью ликвидации артериолоспазма. Сегодня сложно представить, что для сохранения васкуляризации дна желудка предполагалась его мобилизация вместе с хвостом поджелудочной железы и селезенкой со смещением всего этого органокомплекса в плевральную полость [1]. Эволюция хирургии и накопление коллективного опыта не позволили этим способам выдержать проверку временем. Аналогичная ситуация сложилась и с представлениями об оптимальном способе формирования пищеводно-кишечного анастомоза. Исторически ручной узловой многорядный шов послужил основой для формирования этого соустья. Эзофагоеюноанастомоз с минимальным количеством швов прошел эволюционный этап от различных сложных конструкций и вариантов и вновь стал считаться оптимальным [2]. С конца 50-х годов прошлого века в хирургии рака желудка стали применяться различные сшивающие аппараты. Идея механического формирования анастомоза получила «второе дыхание» в конце 80-х годов прошлого столетия в связи с бурным развитием лапароскопической хирургии во всем мире [5, 8]. Более того, не будет преувеличением сказать, что опыт использования малоинвазивных технологий не только вернул идею рутинной аппаратной реконструкции верхних отделов желудочно-кишечного тракта в открытую хирургию, но и позволил разработать варианты эзофагоеюноанастомоза линейными степлерами вместо циркулярных с удовлетворительными непосредственными и отдаленными результатами [6, 7].
Реконструкция на отключенной петле тощей кишки является одной из самых простых. Она была описана С. Roux еще в 1897 г. и практически всегда выполнима. Также предложено множество различных способов реконструкции с формированием тонкокишечных резервуаров и использованием «вставок» из тощей кишки с целью восстановления пассажа по двенадцатиперстной кишке, с применением илеоцекального клапана в качестве антирефлюксного механизма [4, 10]. Многоцентровыми современными контролируемыми исследованиями установлено лишь небольшое потенциальное преимущество в качестве жизни пациентов с хорошим прогнозом, их нутритивном статусе, частоте развития демпинг-синдрома, эзофагита и стриктуры анастомоза в отдаленном периоде после использования различных резервуарных методик по сравнению с таковым после «стандартной» реконструкции на изолированной петле [4, 10]. Таким образом, и в этом аспекте хирургии рака желудка в настоящий момент доминируют представления о самом «простом» варианте восстановления непрерывности ЖКТ как о самом оптимальном. Какой же должна быть рутинная методика реконструкции при раке желудка? Представляем наш взгляд.
Стандартная техника выполнения реконструкции верхних отделов ЖКТ
Этап мобилизации и лимфодиссекции завершаем пересечением пищевода. Первым техническим моментом является наложение двух швов-держалок на боковые стенки пищевода на 2,5—3 см выше места предполагаемого соустья. Лигатуры не завязываем. На пищевод накладываем инструмент для формирования кисетного шва проленовой нитью 3/0 на прямой игле. Пищевод пересекаем на 5 мм ниже с оставлением избытка слизистой, что совпадает с принципами формирования «универсального» пищеводного анастомоза ручным способом, разработанного в РОНЦ. Важным техническим моментом являются проведение прямых игл в аппарат до пересечения пищевода и мануальный контроль отсутствия в нем желудочного зонда. Сразу после снятия аппарата кисетного шва в просвет пищевода помещаем головку сшивающего аппарата, лигатуру завязываем без дополнительного обертывания стилета головки степлера [9]. После удаления препарата в заданном объеме и ушивания культи двенадцатиперстной кишки в изоперистальтическом направлении мобилизуем петлю тощей кишки на расстоянии 20—30 см от связки Трейтца, обычно на уровне второй аркады. Следующим обязательным техническим приемом считаем иссечение участка брыжейки тощей кишки на протяжении 4—5 см, что позволит не только надежно провести степлер, но и обеспечит дополнительную свободу мобилизованному участку тощей кишки. Кишку прошиваем линейным аппаратом типа УО-40 ближе к ее проксимальному краю. Циркулярный степлер вводим через культю кишки, на которую наложены зажимы Allise, на 7—8 см, аппарат открываем и по противобрыжеечному краю кишки вводим стилет (рис. 1). 
Несмотря на заверения производителей в надежности механического шва, при открытых операциях мы стремимся погрузить его отдельными узловыми швами. Начинаем погружение с прошивания ранее наложенным швом-держалкой серозной оболочки тощей кишки на расстоянии 5—7 мм от линии механического шва. Далее ушиваем переднюю стенку соустья редкими швами. Зажимом Федорова проводим первую лигатуру за задней стенкой анастомоза и тракцией за нее разворачиваем заднюю стенку анастомоза, что значительно облегчает наложение швов на нее. Последним этапом отдельным швом укутываем анастомоз культей тощей кишки. Затем проводим двухпросветный зонд ниже уровня межкишечного брауновского анастомоза. Последнее время мы используем назоеюнальное зондирование в первую очередь с целью проведения раннего энтерального питания. В ряде случаев без установки зонда в тощую кишку только с целью декомпрессии можно обойтись вовсе.
Наш опыт включал частое использование многоразовых циркулярных степлеров с одноразовыми кассетами различного диаметра. В таком случае мы усовершенствовали методику реконструкции с целью сокращения времени операции и уменьшения операционной травмы (рис. 2). 
В последующем операцию продолжаем, как было описано выше. Описанная методика отличается простотой, надежностью, высокой воспроизводимостью и скоростью выполнения. Кроме того, могут быть использованы и одноразовые аппараты для формирования кисетного шва типа Pursting 65, что делает метод реконструкции еще более универсальным.
Материал и методы
В исследование были включены 145 пациентов c I—IV стадиями рака желудка, прошедших хирургическое лечение в РНЦРР за период с 2002 по 2013 г. Всем пациентам на предоперационном этапе было проведено комплексное обследование, направленное на верификацию и уточнение распространенности рака желудка. Сопутствующие заболевания имелись у 93 (64%) пациентов. Избыточная масса тела (индекс массы тела более 25 кг/м 2 ) была отмечена у 23 (15,7%) пациентов. Пациенты были разделены на две группы: в 1-й группе (n=71) на реконструктивном этапе сформировано пищеводно-кишечное соустье ручным способом, во 2-й группе (n=74) — пищеводно-кишечный аппаратный циркулярный анастомоз. В большинстве наблюдений соустья формировали на отключенной по Ру петле тощей кишки по типу конец в бок, в двух наблюдениях эзофагоеюноанастомоз формировали на петле тощей кишки (в одном из них с созданием резервуара по Rodino) и еще в одном наблюдении был выполнен эзофагодуоденоанастомоз. Ручным способом анастомоз формировали отдельными узловыми двухрядными швами нерассасывающимися нитями на атравматической игле. Среди операционных доступов преобладала срединная лапаротомия — в 54 наблюдениях, комбинированный торакодиафрагмолапаротомный доступ был использован в 17 наблюдениях. Гастрэктомия выполнена в 47, гастрэктомия с резекцией нижней трети пищевода — в 17 наблюдениях. У 7 больных произведены комбинированные операции со спленэктомией, резекцией поджелудочной железы или поперечной ободочной кишки. По распространенности преобладали опухоли желудка IIIa—IIIc стадий по системе TNM — 63 наблюдения. Средняя продолжительность реконструктивного этапа операции в этой группе составила 72±21,9 мин.
Для наложения механических швов использовали циркулярные степлеры четырех разных производителей. Все анастомозы выполняли на отключенной по Ру петле тощей кишки. Методика формирования анастомоза подробно описана выше. Среди операционных доступов в этой группе пациентов также преобладала срединная лапаротомия — 59 наблюдений. Остальные операции производили из комбинированного торакодиафрагмолапаротомного доступа в шестом межреберье слева. Изолированную гастрэктомию выполняли у 49 пациентов, комбинированные операции с резекцией пищевода и/или соседних органов — в 26 наблюдениях. Распространенность рака желудка и общая характеристика пациентов представлены в табл. 1. 
В ближайшем послеоперационном периоде возник ряд осложнений (табл. 2). 
В сроки от 1 года до 10 лет прослежены 69 (47,6%) пациентов. Изучены осложнения, потенциально связанные с методикой формирования эзофагоеюноанастомоза (табл. 3). 
Обсуждение
Реконструкция желудочно-кишечного тракта после гастрэктомии на изолированной по Ру петле тощей кишки является самым распространенным вариантом в мире. Она надежна, проста, удобна и широко освоена. Дискуссии ведутся в основном по вопросу о способе формирования непосредственно самого пищеводно-кишечного анастомоза, при этом в результате естественного отбора из современной хирургии практически ушли варианты пищеводно-тощекишечного анастомозирования типа конец в конец. Способ конец в бок без преувеличения стал «золотым стандартом» реконструкции после гастрэктомии. Таким образом, нерешенные вопросы могут оставаться в двух технических аспектах: необходимости формирования кишечного резервуара с целью сохранения нутритивного статуса пациента и выборе варианта непосредственно самого шва анастомоза — механического или ручного. При этом сформировать кишечный резервуар также можно механическим или ручным швом. Так какой шов предпочесть?
Всегда ли формирование аппаратного анастомоза при передней резекции гарантирует восстановление непрерывности кишечника?
Отделение колопроктологии с хирургией тазового дна ФГБУ «Российский научный центр хирургии им. Б.В. Петровского РАМН»
Department of coloproctology with pelvic floor surgery, Federal state government-financed institution «Russian Research Center of Surgery named after acad. B.V. Petrovsky Russian Academy of Medical Science»
Цель исследования
Проанализировать причины и частоту оставления толстокишечных стом, созданных с профилактической или лечебной целью после выполнения передних резекций с формированием аппаратного колоректального анастомоза по поводу рака прямой кишки.
Материал и методы
Проанализированы результаты лечения 215 пациентов, перенесших переднюю резекцию прямой кишки с формированием аппаратного колоректального анастомоза в период с июня 2006 г. по июнь 2011 г.
Результаты
Aim of investigation
To analyze causes and frequency of non-closure of colonic stomas created for prophylactic or medical reasons after anterior resections with stapled colorectal anastomosis for cancer of the rectum.
Material and methods
Results of treatment of 215 patients after anterior rectal resection with formation of stapled colorectal anastomosis from June, 2006 to June, 2011 were analyzed.
Results
Creation of colorectal anastomoses after anterior and low anterior resections is quite often accompanied by formation of «temporary» protective stoma to reduce consequences of possible anastomotic leak (AL). Nevertheless, in some patients these «temporary» stomas are never reversed.. By the moment of discharge from hospital 111 (52%) patients had colostomies: in 103 of them were preventive double-barrelled transverse colostomies were created at primary surgical intervention, the remaining 8 patients underwent colostomy formation in postoperative period because of development of AL. Average follow-up was 32,3 months (12 to 70 months). Among 111 patients the restorative operations were done in 96 (86,5 %). At multivariant analysis the following factors were identified as predictors of non-closure of stoma after anterior resection: death due to disease progression (correlation coefficien = 0,24) and chemotherapy treatment (correlation coefficient = 0,22).
Conclusions
The risk of «temporary» stoma nonclosure even in specialized center is 13,5%. When sphincter-sparing operations are performed for all stages of rectal cancer the most essential risk factors of non-closure of stoma were progression of disease and chemotherapy treatment and patient death related to it, and patient’s death.
При временном выключении из пассажа участка кишечника, несущего анастомоз, формируется двуствольная стома, если же анастомоз разобщается, то отведение кишечного содержимого осуществляется путем формирования одноствольной стомы [9]. Между тем четкое представление о том, какова вероятность сохранения естественного хода кишечника в случае, если планируется проведение передней резекции, позволит мультидисципли-нарному консилиуму правильно спланировать возможные варианты лечения, а хирургу выстроить отношения с пациентом и его родственниками еще на дооперационном этапе. Актуальность такого рода знаний объясняется тем, что недооценка вероятности формирования и невозможности последующего закрытия стомы в процессе хирургического лечения первичной опухоли, часто в комплексе с переоценкой хирургом собственных сил, являются основными слагаемыми того, что несостоятельность анастомоза (НА) после резекции прямой кишки нередко становятся трагедией как для пациента и его близких, так и для врача, выполнявшего операцию.
Целью настоящего исследования является анализ причин и частоты оставления толстокишечных стом, созданных с профилактической или лечебной целью после выполнения передних и низких передних резекций с формированием аппаратного колоректального анастомоза по поводу рака прямой кишки.
Материал и методы исследования
Анализу подвергнуты материалы проспективно заполняемой базы данных, а также истории болезни пациентов, пролеченных в отделении колопроктологии с хирургией тазового дна РНЦХ им. Б.В. Петровского РАМН в период с июня 2006 г. по июнь 2011 г.
Критериями включения в исследование были: первичный гистологически подтвержденный рак прямой кишки и выполнение сфинктеросохраняющего резекционного вмешательства в объеме R0. Критериями исключения служили:
Таким образом, были отобраны больные, у которых выполнено вмешательство по поводу рака прямой кишки с сохранением анального сфинктера и формированием аппаратного колоректального анастомоза с применением различных циркулярных степлеров — DST (Covidien, США), KYGW (Kangdi, Китай), CDH (Ethicon Endosurgery, США). По способу сбора материала исследование является проспективно-ретроспективным, по типу наблюдения — когортным.
Для проведения анализа использовались следующие данные из электронной базы и архивных историй болезни: пол, возраст пациента, индекс массы тела (ИМТ), заболевание сахарным диабетом и дивертикулезом, индекс Американской ассоциации анестезиологов ASA, информация о проведении химио-, лучевой или химиолучевой терапии, высота расположения опухоли, параметры опухолевого процесса и его осложнения (непроходимость, анемия, гипопротеинемия), характер хирургического вмешательства (сочетанное, комбинированное), объем лимфодиссекции, формирование превентивной колостомы, частота и характер развития НА, объем лечебных мероприятий по ее устранению (консервативная терапия, малоинвазивные методы лечения, повторное хирургическое вмешательство), время закрытия стомы (если она формировалась), причины ее поздней ликвидации или отказа от закрытия, а также мероприятия, направленные на лечение полости в зоне несостоятельности швов анастомоза, дата последнего визита и наличие признаков возврата заболевания, при наступлении летального исхода — дата и причина смерти, при выявлении местного рецидива рака прямой кишки — дата, локализация и распространенность заболевания.
Для оценки НА использована классификация, предложенная в 2010 г. Международной исследовательской группой по изучению рака прямой кишки. Согласно классификации выделены три степени тяжести данного осложнения: степень А — соответствует несостоятельности без клинических проявлений, выявляемой, как правило, при контрольной проктографии; степень В — для купирования осложнения требуется проведение антибактериальной терапии и/или миниинвазивных (консервативных) мероприятий; степень С — необходимо повторное хирургическое вмешательство [17].
В случае подозрения на НА в раннем послеоперационном периоде выполнялась проктография с использованием водорастворимого контрастного вещества. По показаниям для определения скрытых затеков и абсцессов проводили компьютерную томографию органов малого таза. Состояние сформированного аппаратного колоректального анастомоза в поздние сроки наблюдения (более 30 дней после операции) определяли с помощью проктографии жидкой бариевой взвесью.
Учитывая, что работа основана на ретроспективном анализе проспективно собираемого клинического материала, подписание пациентом информированного согласия для участия в исследовании и одобрение этическим комитетом не требовались.
При сравнении межгрупповых параметров количественные признаки оценивали при помощи i-критерия Стьюдента, качественные признаки — с использованием точного теста Фишера. Для определения факторов риска отказа от выполнения восстановительной операции применяли метод множественной логистической регрессии и составление корреляционной матрицы с последующим многофакторным анализом и расчетом коэффициента корреляции (КК). Выживаемость пациентов рассчитывали по методу Каплана-Майера. Статистически значимыми считали различия при значениях р