Андрогенные рецепторы что это
Андрогенные рецепторы что это
Ген андрогенового рецептора (АР) был клонирован в 1988 г. и локализован в Х-хромосоме человека между центромерой и ql3. Как и прогестероновый рецептор (ПР), анрогеновый рецептор (АР) существует в двух формах: В-форме с нормальной длиной и укороченной А-форме (с молекулярными массами
110 и 87 кДа соответственно); обе формы кодируются одним и тем же геном.
Изоформа 87 кДа (АР-А) содержит интактный С-терминал, но в ней недостает 188 аминокислотных остатков N-терминала изоформы 110 кДа (АР-В). Соотношение АР-А/АР-В в фибробластах кожи гениталий здоровых людей составляет 10:1. Неизвестно, имеются ли функциональные различия между этими изоформами. ДНК-связывающий домен или TAF-2 андрогенового рецептора сходен с регионами TAF-2 других рецепторов к стероидным гормонам (прогестерону, эстрогену, глюкокортикоидам и минералокортикоидам), но более всего с прогестероновым рецептором (ПР).
Прогестерон проявляет перекрестную реактивность с андрогеновым рецептором (АР), но лишь в степени, которая становится значимой только при фармакологических дозировках.
В большинстве тканей тестостерон превращается в дигидротестостерон (ДГТ) под действием фермента 5а-редуктазы. Дигидротестостерон (ДГТ) связывается с андрогеновыми рецепторами с большей аффинностью, чем тестостерон, обеспечивая лучшую стабилизацию рецептора и более эффективную передачу сигнала, что усиливает андрогенный эффект. В связи с этим интенсивность локального превращения тестостерона в ДГТ является важным внутриклеточным фактором андрогенного ответа.
Описано множество мутаций андрогеновых рецепторов (АР), которые нарушают их функцию. Например, инактивирующие точечные мутации в гормонсвязывающем домене андрогенового рецептора (АР) могут обусловливать несколько фенотипов — от частичной до полной потери чувствительности к андрогенам. Точечная мутация в остатке 689 (замещение Про на Гис) может изменять конформацию лигандсвязывающего домена, что приводит к снижению аффинности андрогеновых рецепторов (АР) к дигидротестостерону (ДГТ) и лишает его способность к трансактивации гормонспецифических элементов (ГСЭ).
Замещение Сер на Про в остатке 865 препятствует связыванию андрогена и трансактивации; иными словами, эта мутация тоже приводит к полной потере чувствительности к андрогенам. Замещение Тре на Мет в остатке 807 вызывает частичную потерю чувствительности к андрогенам за счет снижения (но не устранения) связывания андрогена с рецептором. Однако замещение Вал или Арг в том же участке полностью препятствует связыванию с андрогеном и приводит к развитию синдрома отсутствия чувствительности к андрогенам.
— Вернуться в оглавление раздела «физиология человека»
Андрогенные рецепторы
Андрогенные рецепторы [ править | править код ]
Блокада рецепторов андрогенов оксендолоном — антагонистом рецепторов андрогенов — подавляет гипертрофию, стимулированную физическими упражнениями (Inoue et al., 1994). Хотя в процессах адаптации мышечных волокон к физическим упражнениям принимает участие несколько различных факторов, результаты этого исследования однозначно показывают, что рецепторы андрогенов являются важными посредниками в индуцированной физическими нагрузками мышечной гипертрофии.
Рецепторы андрогенов принадлежат к семейству гормончувствительных регуляторов превращения. В случае связывания гормонов с рецептором он переходит в активированное состояние и комплекс гормон-рецептор перемещается к гормончувствительному элементу в ядре. Связывание с определенными генами увеличивает уровень их транскрипции (Luke, Coffey, 1994). В ранних работах сообщалось, что андрогенные рецепторы локализуются в цитозоле мышечной клетки (Krieg, 1976; Max et al., 1981). Использование имммуногистохимии со специфическими поли- и моноклональными антителами позволило установить локализацию рецепторов андрогенов практически во всех типах тканей (Sar et al., 1990; Takedaetal., 1990; Ruizeveld-De-Winter et al., 1991; Kimura et al., 1993; Janssen et al., 1994). В скелетной мышце рецепторы андрогенов содержатся в ядрах мышечных волокон (Takeda et al., 1990; Kimura et al., 1993; Dorlochter et al., 1994; Kadi et al., 2000b) и в миосателлитоцитах (Doumit et al., 1996). В норме в покоящихся мышечных волокнах человека расположение рецепторов андрогенов происходит лишь в некоторых, а не во всех ядрах (Kadi et al., 2000b). Сообщалось также о различиях в содержании рецепторов андрогенов на мышечное волокно между трапециевидной и латеральной широкой мышцами бедра (Kadi, 2000). Похожие различия во внутримышечном содержании рецепторов андрогенов были также продемонстрированы для мышц лягушки (Dorlochter et al., 1994). С данными о различиях внутримышечного содержания рецепторов андрогенов согласуются результаты исследований, где было показано, что наибольшая чувствительность скелетных мышц морской свинки к стимуляции тестостероном наблюдается в области головы и шеи, а при перемещении к задней части туловища происходит ее постепенное снижение (Kochakian, Tillotson, 1957). Различия во внутримышечном содержании рецепторов андрогенов могут отражать различия в эмбриологическом происхождении, иннервации и функциональных потребностях различных мышц.
Физические тренировки оказывают влияние на количество мест связывания андрогенов в скелетных мышцах. Увеличение количества рецепторов андрогенов должно приводить к возрастанию чувствительности мышц к андрогенам, циркулирующим в системе кровообращения. Исследования на животных показали, что существенное увеличение количества рецепторов андрогенов происходит в результате тренировки мышечной силы и выносливости, а также электростимуляции мышц (Inoue et al., 1993; Deschenes et al., 1994). Амплитуда изменений количества рецепторов андрогенов, обусловленного физической тренировкой, варьирует в различных мышцах (Hickson, Kurowsky, 1986; Deschenes ct al., 1994; Kadi et al., 2000b). Занятия силовыми упражнениями в течение продолжительного времени влекут за собой изменения количества ядер мышечных волокон, содержащих рецепторы андрогенов, в трапециевидной мышце, но не в латеральной широкой мышце бедра человека (Kadi et al., 2000b). Аналогичные различия в регуляции количества рецепторов андрогенов после занятий физическими упражнениями существуют между длинным разгибателем пальцев ноги, камбаловидной, икроножной и подошвенной мышцами крысы (Hickson, Kurowsky, 1986; Salmons, 1992; Inoue etal., 1993; Bricout et al., 1994; Deschenes et al., 1994).
Было проведено изучение влияния силовой и аэробной тренировки на содержание рецепторов андрогенов и их сродство к дигидротестостерону в медленных и быстрых мышечных волокнах у крысы (Deschenes et al., 1994). Ни один из видов физической тренировки не вызывал изменений чувствительности рецепторов андрогенов к дигидротестостерону. Аэробная тренировка индуцировала увеличение способности связывать андрогены в медленных мышечных волокнах, тогда как силовая тренировка сопровождалась аналогичными изменениями в быстрых волокнах. Таким образом, характер изменений содержания рецепторов андрогенов зависит не только от типа мышцы, но и от вида двигательной активности (тренировка выносливости или силовые упражнения). Изменения количества рецепторов андрогенов в ответ на физическую тренировку происходят достаточно быстро. После трех дней электростимуляции икроножной мышцы у крыс наблюдается увеличение количества рецепторов андрогенов в стимулированной мышце на 25 %, которое сопровождается прогрессивной гипертрофией мышцы (Inoue et al., 1993).
Проведена также оценка влияния андрогенных анаболических стероидов на содержание рецепторов андрогенов. На животных моделях в культуре миосателлитоцитов было показано, что андрогенные анаболические стероиды могут повышать (Doumit et al., 1996) либо понижать (Lin et al., 1993; Bricout et al., 1994) количество рецепторов андрогенов в мышечной клетке. Установлено, что прием тестостерона усиливает иммунореактивность рецептора андрогенов в ядрах миосателлитоцитов свиньи (Doumit et al., 1996). Однако с помощью радиоактивного конкурентного анализа было показано, что после применения андрогенных анаболических стероидов происходит снижение концентрации рецепторов андрогенов в камбаловидной мышце и длинном разгибателе пальцев ноги (Bricout et al., 1994). В действительности, влияние андрогенных анаболических стероидов на содержание рецепторов андрогенов также может зависеть от типа клеток. Так, волокна скелетных мышц лягушки из плечевой области характеризуются наибольшей чувствительностью к тестостерону по сравнению с волокнами из других участков тела (Regnier, Herrera, 1993а, 1993b). Скелетные мышцы кролика, которые характеризуются сходным размером мышечных волокон, соотношением различных их типов, иннервацией и кровоснабжением могут сильно отличаться характером своего ответа на воздействие андрогенными анаболическими стероидами (Salmons, 1992). И наконец, у человека самостоятельный прием андрогенных анаболических стероидов на протяжении длительного времени вызывал изменения в ядрах, содержащих рецепторы андрогенов, мышечных волокон трапециевидной мышцы, при этом в латеральной широкой мышце бедра подобных изменений не наблюдалось (Kadi et al., 2000b). Очевидно, что для лучшего понимания изменения количества рецепторов андрогенов в скелетных мышцах в ответ на физиологические и нефизиологические воздействия необходимо проведение дальнейших исследований.
Волшебный андроген или отчего растут и выпадают волосы
Понаблюдаем за одной очень достойной семьей. Вот рождается очаровательный малыш. Если он поторопился появиться на свет раньше срока, то его тельце сплошь покрыто густой и мягкой порослью.
Позднее она сменится бесцветным, тонким и коротким пушком. Создается впечатление совершенно гладкой поверхности.
Но вот наступает пубертат, и вместо этой «прелести» начинает пробиваться темная и жесткая щетина в специфических зонах.
Сменяются времена года, человек живет насыщенной и счастливой жизнью, и в одно однажды он обращает внимание на то, что предмет его гордости, роскошная шевелюра, вдруг поредела, а там, глядишь, и лысина начала просвечиваться.
А теперь переведем взгляд на его немолодую, но горячо любимую супругу. У нее вдруг после климактерического периода появились отчетливо выраженные терминальные ростки на лице, шее и груди.
А у подружки их внучки ни с того, ни с сего появилась растительность на лице вместе с акне.
Что же объединяет всех наших персонажей? Родственно-дружеские связи? Безусловно. Но есть и еще один важный момент, который задает тон в организме всех участников событий.
Именно он господствует над всеми трансформациями волос у мужчин и у женщин. Но вот незадача – элемент один, а действует совершенно по-разному.
В каких-то местах он повышает активность фолликулов (лицо), другая часть остается совершенно безразличной к его действию (брови и ресницы), а вот на голове он и совсем «бесчинствует», снабжая своего владельца лысиной.
Что это за волшебник, и отчего его работа столь разнообразна? Давайте познакомимся с этим главным героем и раскроем механизмы его волшебства.
Фото с сайта www.shutterstock.com
Влияние андрогенов на рост и потерю волос
Уверена, что вы догадались о ком идет речь. Конечно, это мужской гормон или андроген.
Прежде всего, следует отметить, что роль его в развитии организма, внешности и здоровья огромна.
Тут вам и приятный низкий мужской голос, и развитие половых органов вкупе с интимным влечением, и построение мышечной массы, рост костей и многое другое.
Однако он же заведует оволосением. И, как было отмечено выше, заведующий он довольно парадоксальный: кого-то милует, другого казнит в буквальном смысле слова, а на остальных не обращает внимания.
Но начнем по порядку.
Андрогены у мужчин и женщин
Интересно отметить тот факт, что синтез стероида происходит из холестерина. Да, да, именно из того самого «вредного» продукта, который в последнее время стало модно исключать из рациона.
Может быть, этот холестерин и не так уж и вреден в небольших количествах?
А вы знали, что гормоны «мужественности» живут не только у джентльменов, но и у прелестных дам? Более того, основной гормон женственности (эстроген) вырабатывается именно из андрогенов.
То есть, нет андрогенов – не будет и эстрогенов.
Вспомним Библейскую историю о том, что женщина была создана из ребра мужчины. Вероятно, подобная последовательность все же не случайна! Что-то в этом есть 🙂
Фабрики по производству «сильного» соединения располагаются в яичках или яичниках (в зависимости о какой половине человечества идет речь).
А вот еще один неожиданный факт. Оказывается, что в этих местах создается не только конечный продукт, но и его неактивный «полуфабрикат», который потом активизируется в самых разных частях тела. Это может быть кожа, жировая ткань, печень и даже мозг.
Чем так интересно воздействие этого элемента именно на волосы?
Дело в том, что растительность играет чрезвычайно значимую социальную роль. Лысеющие мужчины и дамы с редеющей прической зачастую находятся не в самом оптимистичном настроение.
Фото с сайта www.shutterstock.com
А девушки, у которых постепенно формируется самая настоящая борода, и вовсе могут погрузиться в серьезную депрессию.
По этой самой причине было уделено особое внимание изучению воздействия тестостерона на волосяные фолликулы с целью восстановить природную красоту и душевное благополучие.
Занятная демонстрация способностей «сильного» гормона была замечена при наблюдении за пациентами с синдромом тестикулярной феминизации (не путать с феминистками).
Что это такое? Это когда ребенок рождается с мужским генным набором XY (напомним, что у девушек генный набор XX), но восприимчивых рецепторов к этому веществу у индивидуума нет. В результате развивается женщина.
Следует отметить, что количество андрогенов здесь в полном порядке, просто организм их «не видит».
Терминальных волос у этого человека не будет нигде, даже в местах, свойственных женщинам (лобок, подмышки). Борода и усы, соответственно, тоже будут отсутствовать. А вот шевелюра на голове будет очень густой.
А вот еще одна демонстрация способностей нашего «героя». Если мужчину кастрировать (прошу не повторять этот эксперимент), то его борода прекращает расти, а облысение полностью останавливается.
Не запутались еще? Не волнуйтесь, это не столь важно. Главное, что не все определяется андрогенами. В теле присутствует еще кое-что, что определяет, каким образом он будет работать.
О рецепторах волосяных фолликулов
Действительно, оказалось, что определяющую роль играет непосредственно сам волосяной фолликул.
В его структурах можно найти «включатель и выключатель» синтеза волос. При этом сам тестостерон играет роль исключительно рычага.
Фото с сайта www.shutterstock.com
Чтобы этот рычаг смог запустить тот или иной процесс, необходим рецептор – «посредник». Мы уже знакомы с тем, какую важную роль играет этот посредник на примере превращения женщины из генетического мужчины.
Пусть даже продукция вещества зашкалит, но если нет рецепторов, то весь этот массив останется в буквальном смысле бесполезным балластом «за бортом».
Сверх того, каждая волосяная структура абсолютно независима друг от друга.
На этом основана успешная процедура пересадки волос. Суть лечения состоит в том, что фолликулы с включателем пересаживаются в редеющую область. При этом андрогены уже не будут повреждать пересаженный материал.
Фото с сайта www.shutterstock.com
Почему же в одном случае речь идет про интенсивное оволосение, а в другом случае все те же компоненты ведут к прямо противоположному результату?
Как андрогены, рецепторы и гены работают вместе
Основа всех процессов – генетика. Есть особый ген потери локонов, который может наследоваться. Кстати сказать, совершенно необязательно, что он неминуемо приведет к залысинам.
Для того чтобы он начал работать, необходимо его «разбудить»: не все мужчины обречены терять прическу.
Кто-то до самой глубокой старости может похвалиться густым покровом. А другому повезло меньше: кожа на его голове начала «просвечивать» с юных лет.
Представители южных кровей отличаются куда большей растительностью, чем их северные оппоненты. К слову заметить, если мальчик унаследовал «лысый» ген, то это еще не означает неминуемую лысину.
Однако «проснуться» ген должен в строго определенном фолликуле. Грубо говоря, существуют наследуемые встроенные «киллеры», которые при благоприятных обстоятельствах «прикончат» волос, вызвав регрессию или гибель.
Локализация этих «убийц» находится исключительно в волосяных структурах кожи головы. Опять же, следует повториться, что даже присутствие подобных киллеров еще не означает появление симптома.
Клетки волосяного сосочка, прародителя волоса, будут либо возрождать стержень при помощи факторов роста, либо начнут вырабатывать протеиновых убийц, которые разрушат фолликул.
К этому сосочку подходят кровеносные капилляры. Через них к волоску доставляется сам гормон.
Далее он активно начнет поиск рецептора – «ключика», который откроет дверь в потайную комнату – клеточное ядро с генетическим материалом.
В итоге атака пойдет на определенный участок ДНК, который начнет продуцировать «оружие» против волосяного мешочка. Результатом всей этой «операции» станет постепенное уменьшение размеров вместилища с превращением терминального стержня в веллюс.
Чтобы этот механизм заработал, следует, чтобы вся волосяная конструкция была предрасположена к потере растительности.
Фото с сайта www.shutterstock.com
В другом случае цепочка событий будет практически та же самая: наличие специфического гена в фолликуле – присутствие неактивного тестостерона – превращение его в активный ингредиент при помощи фермента – соединение активного компонента с соответствующим рецептором – активация гена при помощи комплекса «гормон-рецептор» – производство факторов роста.
Следовательно, итогом этой последовательности будет превращение толстого и жесткого стержня из пушка.
Причиной тому станет другая локализация с другим генетическим материалом. Вместо киллеров, произойдет продуцирование факторов роста с последующим созданием нового ростка.
Подводим итоги
Чтобы растительность на голове начала выпадать необходимо совпадение нескольких факторов: наследственная предрасположенность, наличие восприимчивых ключиков – рецепторов, присутствие неактивного тестостерона вместе с определенным ферментом.
Любое колебание какого-либо из вышеперечисленных компонентов оборвет цепочку событий и предотвратит облысение.
Верно и обратное: например, повышенная чувствительность рецепторов способна нивелировать невысокую концентрацию тестостерона.
На этом базируется опровержение довольно распространенного мифа по поводу сексуальности лысых субъектов. Совсем необязательно в организме у него будет «зверское» количество мужских гормонов, но, за счет исключительной восприимчивости «рецепторов», процесс будет запущен.
А почему у женщин растут терминальные «элементы» в подмышечной и лобковой области, но их нет на лице, груди, животе, бедрах?
Как мы уже знаем, в женском теле также синтезируются андрогены. Основная часть из них используется в построении эстрогена, а небольшой остаток отпускается в свободное плаванье в кровоток.
Именно этот остаток влияет на волосяные фолликулы. Лобковая и подмышечная области наделены природой очень высокой чувствительностью к андрогенам, и за счет этого даже минимального количества тестостерона хватает для появления обширной растительности в этих местах.
А для стимуляции роста на лице, груди и прочих зонах требуется очень высокая концентрация гормона, которая в норме присутствует у мужчин.
У прекрасных дам такая ситуация может случиться по причине заболевания. Появление волосков у леди на «мужских местах» именуется гирсутизмом.
Зная механизм действия и особенности симптомов, я уверена, что вы и сами в состоянии предположить, что следует делать. Если мы хотим убрать лишнюю «волосатость», или приостановить облысение, то следует либо снизить гормональную нагрузку, что не всегда возможно, либо воздействовать на тот фермент, который занимается превращением «мирного» андрогена в агрессивного «киллера».
Поэтому влиять на эти процессы в организме можно только с помощью врача-трихолога и эндокринолога. Самостоятельное необдуманное употребление любых лекарств или народных рецептов может негативно повлиять на другие сферы жизни, даже если проблема облысения будет решена.
Фото с сайта www.shutterstock.com
А вот в случае наличия лишних волос, можно воспользоваться методом электроэпиляции, который эффективен даже при гормональных нарушениях.
Конечно, следует запастись приличным терпением, как для восстановления, так и для удаления волос. Дело это всегда длительное, но поправимое. А если вы смогли дочитать до конца статьи, то с терпением у вас точно все хорошо))) Удачи и красоты.
Medically written and reviewed by: Julia Nicholson, dermatologist, physiotherapist Опубликовано: Олеся Смагина, помощник директора центров эпиляции «Вселенная красоты»
Андрогенные рецепторы что это
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Чувствительность к андрогенам: за пределами общеизвестного
Журнал: Проблемы эндокринологии. 2018;64(5): 315-320
Хрипун И. А., Воробьев С. В. Чувствительность к андрогенам: за пределами общеизвестного. Проблемы эндокринологии. 2018;64(5):315-320.
Khripun I A, Vorobyev S V. Sensitivity to androgens: beyond the well-known facts. Problemy Endokrinologii. 2018;64(5):315-320.
https://doi.org/10.14341/probl9596
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Гонадные и внегонадные эффекты тестостерона у мужчин активно исследуются в последние годы. На сегодняшний день не вызывает сомнения увеличение рисков ожирения, сахарного диабета 2-го типа, артериальной гипертензии и атеросклероза у мужчин с дефицитом тестостерона. Одним из механизмов, посредством которых реализуется действие тестостерона, является чувствительность к андрогенам, определяемая длиной CAG-повторов в гене андрогенного рецептора. Увеличение количества CAG-повторов снижает их активность и проявляется низкой чувствительностью к тестостерону. Напротив, уменьшение числа тринуклеотидных повторов сопровождается повышением чувствительности рецепторов к андрогенам. В этом обзоре рассмотрены данные о влиянии полиморфизма гена андрогенного рецептора на эмбриогенез и дифференцировку пола, регуляцию сперматогенеза, прогрессирование рака и доброкачественной гиперплазии предстательной железы, симптоматику гипогонадизма, контроль углеводного и липидного обменов, минеральную плотность костной ткани, эндотелий сосудов, ответ на заместительную терапию тестостероном, а также на психосоциальные аспекты личности мужчин. Внедрение исследования полиморфизма гена рецептора андрогенов в клиническую практику позволит не только прогнозировать фертильность мужчины или риск развития рака простаты, но и подбирать индивидуальную терапию дефицита тестостерона.
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Действие андрогенов затрагивает практически все органы и системы. Формирование половых признаков в процессе эмбриогенеза, становление и функционирование репродуктивной системы и обеспечение фертильности — это лишь малая часть эффектов тестостерона (Т) и его метаболитов. Гораздо шире внегонадное действие андрогенов, представленное их влиянием на сердечно-сосудистую систему, липидный и углеводный обмены, минерализацию костной ткани, стимуляцию кроветворения, формирование и функционирование когнитивных функций, психосоциальную адаптацию и сексуальность. Одним из наиболее важных вопросов клинической практики является различная выраженность симптомов гипогонадизма, а также разный ответ на заместительную терапию у пациентов с одинаковым уровнем сывороточного Т. Ответ на этот вопрос кроется в определении чувствительности к андрогенам и является на сегодняшний день крайне малоизученным. Данный обзор содержит анализ наиболее актуальных исследований, опубликованных в рецензируемых журналах баз данных PubMed и eLibrary.
Структура и функции андрогенного рецептора
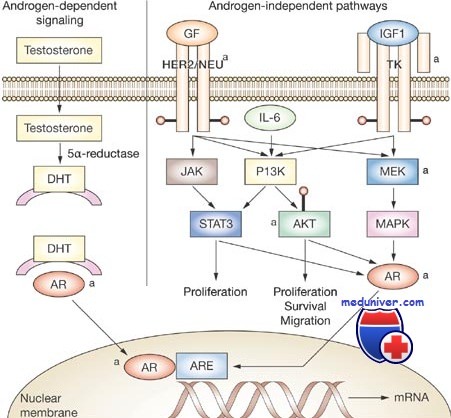
Многогранное действие Т реализуется через андрогенные рецепторы (AR), расположенные внутриклеточно и структурно относящиеся к рецепторам стероидных гормонов. AR присутствуют в клетках семенников, простаты, кожи, нервной системы и других тканей. Генетический контроль за активностью этих рецепторов осуществляется геном AR, который и обусловливает чувствительность к андрогенам и реализацию действия Т. Широта и разносторонность эффектов, реализуемых через ген AR, впечатляют — от дифференцировки пола в эмбриогенезе, регуляции сперматогенеза, прогрессирования рака и доброкачественной гиперплазии предстательной железы (ДГПЖ), симптоматики гипогонадизма до влияния на углеводный и липидный обмены, минеральную плотность костной ткани, эндотелий сосудов и даже психосоциальные аспекты личности.
Ген AR локализован на длинном плече Х-хромосомы и состоит из 8 экзонов, кодирующих 3 структурно-функциональных белковых домена. N-концевой домен участвует в гомодимеризации рецептора и связывании с ко-активаторами или ко-репрессорами и представлен экзоном 1. Второй — ДНК-связывающий домен содержит петлевой участок из двух «цинковых пальцев» (экзоны 2 и 3). С-концевой домен обеспечивает связывание со стероидными гормонами и представлен экзонами 4—8 [1].
В последние годы внимание исследователей особенно сосредоточено на изучении первого экзона гена AR, для которого характерны повторы последовательности из трех нуклеотидов — цитозина, аденина и гуанина — CAG. Триплет CAG кодирует аминокислоту глутамин, поэтому от числа тринуклеотидных повторов зависит количество глутамина в белке. Так, меньшему числу CAG-повторов соответствует меньшая степень конформационных изменений рецептора, что делает связь гормона и рецептора прочнее и приводит к повышению транскрипционной активности AR. Напротив, с увеличением числа CAG-повторов связь между андрогенами и рецептором становится слабее и транскрипционная активность AR снижается. Таким образом, чем больше длина CAG-повторов, тем слабее оказывается эффект андрогенов при одинаковым уровне Т [2]. Слабая активность андрогенов, вызванная удлинением триплета, находит отражение в механизме обратной связи в пределах гипоталамо-гипофизарно-гонадной оси. У здоровых мужчин удлинение CAG-повторов сопровождается усилением секреции лютеинизирующего гормона (ЛГ) [3], что при интактных клетках Лейдига вызывает повышенную продукцию Т и, следовательно, компенсирует ослабление действия андрогенов. Результатом гипертестостеронемии будет повышенная ароматизация Т в эстрадиол, концентрация которого возрастет. По-видимому, именно с этим связана гинекомастия у пациентов с увеличенным числом CAG-повторов [4]. Высокие концентрации эстрадиола у мужчин с удлинением CAG-повторов и сохраненной обратной связью в оси гипоталамус-гипофиз-гонады может усиливать эффекты этих гормонов в эстроген-зависимых тканях, например в костной [3]. Рядом исследователей обнаружена отрицательная корреляция между длиной CAG—повторов и минеральной плотностью костной ткани [5—7]. Эта связь прослеживалась и у молодых субъектов, но с увеличением возраста мужчин негативное влияние полиморфизма гена AR на минеральную плотность костной ткани усиливалось.
Для мужчин европейской популяции нормальным считается количество CAG-повторов от 9 до 37. Однако в этом нормативе существуют популяционные различия. Так, среднее число CAG-повторов в гене AR у мужчин-европейцев составляет 21, у африканцев — 17, у азиатов — 23. При этом, например 25 CAG-повторов хотя и укладывается в нормативные значения, зачастую бывает связано с ослаблением действия андрогенов, проявляющимся соответствующей клинической симптоматикой [8].
Эмбриогенез и дифференцировка пола
Клеточный каскад нормальной дифференциации мужского пола также моделируется молекулярным взаимодействием Т и дигидротестостерона (ДГТ) с AR в андроген-зависимых тканях-мишенях. От этого взаимодействия еще на 7—8-й неделе эмбриогенеза зависит правильность формирования мужского пола. Наиболее ярким примером участия AR в формировании пола является синдром тестикулярной феминизации, возникающий вследствие мутации гена AR с развитием нечувствительности к андрогенам [1]. У эмбриона с генотипом 46, XY при выпадении эффектов Т и ДГТ бипотенциальные закладки внутренних и наружных половых органов развиваются по базовому пути с формированием женского фенотипа. Такие пациенты в постпубертатном периоде зачастую имеют достаточно развитые молочные железы и распределение жировой ткани по женскому типу, что связано с ароматизацией синтезирующихся в яичках андрогенов в эстрогены.
Предстательная железа
Одним из наиболее андроген-чувствительных органов является простата, имеющая большое число рецепторов к андрогенам. Предполагается, что полиморфизм гена AR с его способностью моделировать эффекты андрогенов влияет на долю злокачественных клеток в предстательной железе (ПЖ) [9]. Согласно метаанализу множества исследований [10], отношение шансов возникновения рака ПЖ при снижении частоты тринуклеотидных повторов составляет 1,19.
Возможная связь между ДГПЖ и CAG-полиморфизмом гена AR имеет также другой аспект: ДГПЖ представляет собой разрастание ткани переходной зоны и периуретральной области ПЖ (эпителиальная и фибромышечная гиперплазия). В 2 крупных исследованиях сравнивали сопоставимые когорты здоровых добровольцев и пациентов с ДГПЖ. Отношение шансов увеличения размеров простаты до необходимого хирургического вмешательства в группе с частотой CAG-повторов 24 составляло 1,92. Более того, при снижении длины CAG-повторов увеличивалась частота средних и тяжелых обструктивных симптомов нижних мочевых путей. Также была найдена обратная корреляция между частотой аденом и размером простаты, с одной стороны, и длиной CAG-повторов — с другой [11, 12]. Помимо этого, была выявлена связь полиморфизма гена AR с сексуальной активностью мужчин с ДГПЖ [13].
Фертильность
Установлена связь числа CAG-повторов в гене AR с олигозооспермией [14, 15]. Хорошо известно, что для осуществления сперматогенеза необходима стимуляция клеток Сертоли фолликулостимулирующим гормоном (ФСГ). Так, интратестикулярная активность андрогенов опосредуется важным кофактором, положительно влияющим на функцию клеток Сертоли. Установлена отрицательная связь числа CAG-повторов с эффективностью сперматогенеза [16]. Наиболее тяжелые формы нарушений сперматогенеза наблюдаются у пациентов со спинобульбарной атрофией Кеннеди — редким наследственным заболеванием, характеризующимся яркой неврологической симптоматикой в сочетании с гипогонадизмом и бесплодием. При этом число тринуклеотидных повторов в гене AR достигает 36 и более [17].
Клинические проявления гипогонадизма и психосоциальные аспекты личности
Анализируя клинические проявления андрогенного дефицита, следует подчеркнуть их тесную связь с полиморфизмом гена AR. Так, среди пациентов с нормальными концентрациями Т у мужчин с большим числом CAG-повторов увеличен риск развития симптомов андрогенного дефицита [18, 19]. Регрессионный анализ данных международного опросника Aging Males’ Symptoms выявил нарастание симптомов дефицита Т по двум шкалам (психологической и соматической) по мере увеличения длины CAG—повторов в гене AR, тогда как симптомы сексуальной шкалы были связаны непосредственно с уровнем эндогенного Т [18]. Азиатское исследование с участием 702 мужчин, не выявив связи между уровнем Т и распределением в популяции полиморфизма гена AR, показало, что при уровне Т выше 340 нг/дл пациенты с числом CAG-повторов более 25 имели достоверно более высокий риск развития симптомов андропаузы, чем лица со значением тринуклеотидных повторов менее 22 [19]. Иными словами, мужчины с нормотестостеронемией, имеющие большую длину CAG—повторов в гене AR, подвержены более высокому риску возникновения симптомов андрогенного дефицита.
Кроме того, установлена связь между длиной CAG—повторов в гене AR с неспецифическими проявлениями андрогенного дефицита, такими как тревожность и депрессия [20, 21]. Регрессионный анализ выявил положительную связь числа CAG-повторов с выраженностью депрессии у мужчин старше 50 лет. Это демонстрирует нарастание симптомов депрессии синхронно с увеличением длины тринуклеотидных повторов по мере ослабления чувствительности рецепторов к андрогенам независимо от уровня эндогенного Т [21]. Показано также, что генетически детерминированное удлинение CAG—повторов в гене AR является независимым фактором риска высокой тревожности, панических атак и фобических расстройств [20].
Удивительными кажутся данные о связи полиморфизма гена AR с интеллектуальной одаренностью мальчиков [22]. Так, установлено, что высокий уровень интеллекта (IQ более 130) у мальчиков ассоциирован с малой длиной CAG-повторов в гене AR, даже при допубертатно низких уровнях Т. Другими словами, высокая чувствительность к андрогенам является фактором, предрасполагающим к интеллектуальной одаренности вне зависимости от уровня самого Т.
Представляют интерес данные о полиморфизме гена AR у мужчин с синдромом Клайнфельтера, имеющих дополнительную Х-хромосому, на которой и расположен обсуждаемый ген [23]. Длина тринуклеотидных повторов имела положительную связь с ростом, но в то же время была отрицательно связана с минеральной плотностью костной ткани и отношением размаха рук к росту, что отражает негативное влияние андрогенов на эпифизарные зоны роста кости. Кроме того, удлинение CAG—повторов способствовало развитию гинекомастии и уменьшению размеров тестикул, тогда как укорочение длины триплета ассоциировалось со стабильными партнерскими отношениями и профессиями, требующими более высокого уровня образования.
Поразительно, что чувствительность к андрогенам может обусловливать и такое явление, как транссексуализм. Установлено, что удлинение цепи CAG—повторов в гене AR является одной из трех изученных генетических причин мужского транссексуализма [24].
Метаболический статус
Выявлена положительная независимая корреляция числа CAG—повторов в гене AR с содержанием жировой ткани тела, уровнем лептина и инсулина. Малое число CAG-повторов было независимо ассоциировано с протективными параметрами (низкая жировая масса, низкий уровень инсулина плазмы), но одновременно и с нежелательными факторами (низкий уровень липопротеинов высокой плотности) [25]. Сходные данные в отношении дислипидемии были получены и в исследовании больных сахарным диабетом 2-го типа [26].
Еще одним интереснейшим аспектом влияния полиморфизма гена AR является эффективность заместительной терапии тестостероном (ЗТТ) у пациентов с различными формами гипогонадизма. Крупное исследование TIMES 2 показало, что высокая чувствительность к андрогенам, моделируемая малым числом CAG-повторов в гене AR, независимо положительно связана с более значимой динамикой уровня инсулина натощак, триглицеридов, диастолического артериального давления и индекса инсулинорезистентности НОМА на фоне ЗТТ. Однако связи полиморфизма гена AR с уровнем гликированного гемоглобина, другими показателями липидограммы, ожирением или распределением жировой ткани не выявлено [10]. Негативное влияние удлинения CAG—повторов было обнаружено и в другом исследовании [27], показавшем более высокие цифры артериального давления и худшие значения липидограммы на фоне ЗТТ в сочетании с более низкими значениями гематокрита, находящегося под контролем андрогенов. Еще одним параметром, реагирующим на ЗТТ, является размер ПЖ [28]. Выявлена негативная связь между длиной тринуклеотидных повторов и изменением объема ПЖ на фоне терапии Т [10]. Причем 20 триплетов гена AR и менее повышают риск увеличения размеров ПЖ и темпы роста уровня простат-специфического антигена (ПСА) [27].
Терапия Т у пациентов с синдромом Клайнфельтера при коротких триплетных повторах вызывает более глубокое подавление уровня ЛГ, выраженный рост концентрации ПСА и повышает уровень гемоглобина [23].
Эндотелий
Одной из важнейших точек приложения внегонадного действия Т является эндотелий, причем данное взаимодействие моделируется полиморфизмом гена AR. Этот вопрос наименее изучен. Ранее у здоровых добровольцев была обнаружена связь низкого числа CAG-повторов в гене AR с нарушениями артериальной вазореактивности вне зависимости от уровня общего и свободного T [29]. Некоторыми исследованиями [30, 31] доказано ухудшение функции эндотелия у больных сахарным диабетом 2-го типа. В то же время существуют данные о негативном влиянии дефицита Т на сердечно-сосудистую систему у мужчин [32, 33]. При исследовании влияния полиморфизма гена AR на формирование нарушений функции эндотелия у мужчин с сахарным диабетом 2-го типа [34] было установлено, что большее количество CAG-повторов в гене рецептора AR через ослабление чувствительности к андрогенам обусловливает снижение выраженности эндотелий-зависимой вазодилатации в ходе пробы с реактивной гиперемией одновременно с усилением продукции таких маркеров дисфункции эндотелия, как P-селектин и резистин. Таким образом, увеличение числа CAG-повторов в гене AR ухудшает как сосудодвигательную, так и секреторную функцию эндотелия и может рассматриваться как предиктор развития и прогрессирования сердечно-сосудистых поражений у мужчин с сахарным диабетом.
Заключение
Нарастающий интерес исследователей к изучению биохимических и молекулярных механизмов действия Т диктует необходимость расшифровки генетических аспектов функционирования AR. Изучение чувствительности к андрогенам, определяемой длиной тринуклеотидного повтора CAG в гене AR, не только объясняет феномен различного ответа на ЗТТ у пациентов с одинаковым уровнем эндогенного Т, но и необходимо для понимания половой дифференцировки, психологического статуса, сексуальности и репродуктивного потенциала, а также рисков развития рака ПЖ и ДГПЖ, остеопороза, нарушений углеводного, липидного обменов и даже сердечно-сосудистых заболеваний у мужчин. Наиболее важной в клинической практике является возможность прогнозирования ответа пациента на ЗТТ. У лиц с малым числом CAG-повторов в гене AR из-за высокой чувствительности к андрогенам могут быть использованы более низкие дозы препаратов Т, тогда как неэффективность стартовой дозы ТЗТ у мужчин с большим числом тринуклеотидных повторов, свидетельствует о необходимости повышения дозы вводимого Т. На сегодняшний день определение CAG-полиморфизма гена AR не рекомендовано для рутинной практики, однако в ближайшем будущем оно может быть использовано, в частности для подбора индивидуальной терапии андрогенного дефицита.
Дополнительная информация
Источник финансирования. Работа выполнена при поддержке Российского научного фонда (грант РНФ № 14−25−00052).
Конфликт интересов. Авторы статьи заявляют об отсутствии финансовой заинтересованности и других потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Сбор и анализ материала, написание текста — Хрипун И.А.; написание и редактирование текста — Воробьев С.В. Оба автора внесли существенный вклад в проведение поисково-аналитической работы и подготовки статьи, прочли и одобрили финальную версию текста перед публикацией.