Андростендион повышен у женщин чем лечить
Повышен Андростендион
Добрый день! У меня проблема. Был повышен Андростендион (4,03)+ мультифолликулярные яичники. Врач-эндокринолог прописала Ярина+. Пропила данный препарат 9 месяцев. Запланировали с мужем ребенка. Отстановила прием Ярина+. Прошло 5 месяцев после отмены. Заново сдала на гормоны, картина та же: Повышен Андростендион+мультифолликулярные яичники. Врач прописала Метипред. Скажите, верно ли назначено лечение и можно как то еще помочь организму. До этого месячных не было три месяца+выпадают волосы и прыщи.
На сервисе СпросиВрача доступна консультация эндокринолога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Интересует регулярность цикла вне приема Ярины
17ОН ПГ в нг/мл? на 2-3 день менструального цикла сдавали?
Нерегулярные всю жизнь? Или с какого-то периода стали неркгулярными?
Ваш диагноз в карте звучит как синдром поликистозных яичников?
На самом деле мало информации предоставлено.
Сам андростендион снижать, чтобы забеременеть не нужно. Даже Ваш 17ОН Прогестерон в условно серой зоне не может быть помехой к этому.
Вы в течение какого времени не предохраняетесь и пытаетесь забеременеть? Естественно, не считая приема Ярины в течение 9 месяцев.
Ваши анализы нормальны, повышение андростендиона клинически не имеет никакого значения.
Терапия метипредом показано только при наличии врожденной дисфункции коры надпочечников (ВДКН), уровень 17ОН Прогестерона абсолютно и на 100% опровергает этот диагноз (норма
«Пить ли мне назначенный Метипред? Если да, то не принесет ли он мне существенного вреда?»
У Вас исключена ВДКН, при которой показана терапия глюкокртикоидами.
Вы не считаетесь бесплодной парой. Еще не прошло года, если Ваши знакомые беременеют сразу после отсутствия предохранения, это не значит, что так у всех. Статистически, здоровая пара «имеет право» в норме пытаться забеременеть в течение 1 года. И только после прошествия этого срока пара обращается к врачам для установления причин (мужчина сдает «свои» анализы, женщины «свои»).
Что такое гиперандрогения? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Васильевича, уролога со стажем в 27 лет.
Определение болезни. Причины заболевания
Гиперандрогения — это состояние, при котором у женщины в крови значительно повышен уровень мужских половых гормонов (андрогенов): тестостерона, дигидротестостерона, андростендиона и других.
Распространённость
Причины
Симптомы гиперандрогении
Патогенез гиперандрогении
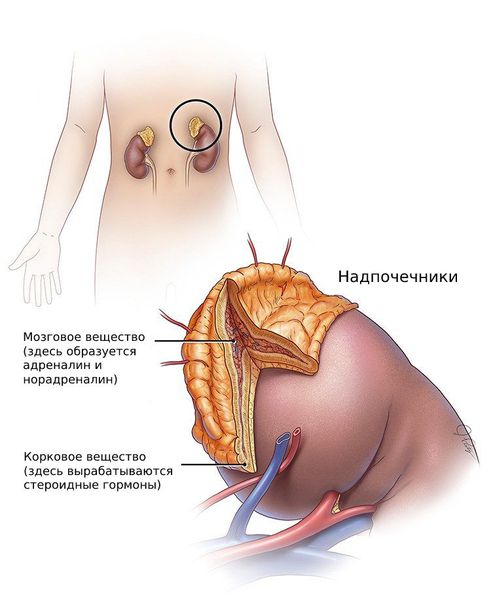
Андрогены — стероидные половые гормоны, которые вырабатываются из холестерина в коре надпочечников, а также в клетках фолликулов и соединительной ткани яичников.
К андрогенам относятся:
Роль андрогенов
В женском организме андрогены поддерживают гормональный баланс и после начала полового созревания инициируют рост волос на лобке и в подмышечных впадинах. Также они необходимы для выработки эстрогена и возникновения полового влечения.
Андрогены замедляют потерю кальция в костях и регулируют работу внутренних органов и систем: репродуктивной, почечной, мышечной и сердечной.
Гормональная регуляция происходит почти мгновенно с малым количеством активного вещества — гормона. Другая её особенность заключается в дистанцировании: гормон может вырабатываться в одной железе, а попадать в орган-мишень, находящийся в другой части организма.
В плазме крови андрогены взаимодействуют с глобулином, связывающим половые гормоны (ГСПГ). Он выполняет транспортную роль: вместе с ним андрогены доставляются с кровью в клетки органов-мишеней.
Избыток андрогенов
К избытку андрогенов могут приводить различные патологические механизмы:
Повышать уровень андрогенов могут и другие внешние факторы, например приём стероидов и гормональных препаратов. Интересно, что при всех гиперандрогенных состояниях, андрогены происходят более чем из одного источника. Так, при поликистозе яичников увеличен синтез тестостерона, но большая часть этого гормона образуется вне яичников — в надпочечниках.
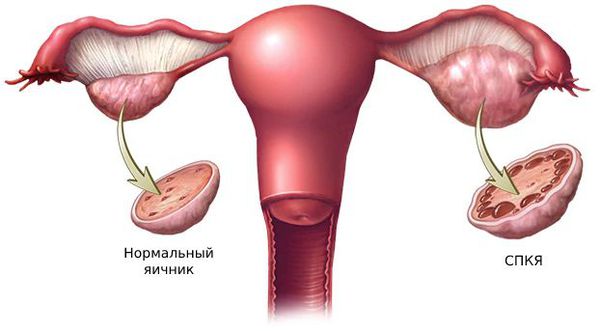
Большую роль в развитии первичной гиперандрогении играют генетические факторы. Одной из причин синдрома поликистозных яичников (СПКЯ) является генетически предопределённый избыток лютеинизирующего гормона (ЛГ). ЛГ стимулирует образование мужских половых гормонов: тестостерона и андростендиона. Их чрезмерная выработка нарушает процесс развития фолликулов: они преждевременно перерождаются в жёлтое тело и в этой области образуются фолликулярные кисты.
Другая причина развития СПКЯ — генетически обусловленное нарушение выработки инсулина и развитие инсулинорезистентности, то есть недостаточный ответ тканей на его действие.
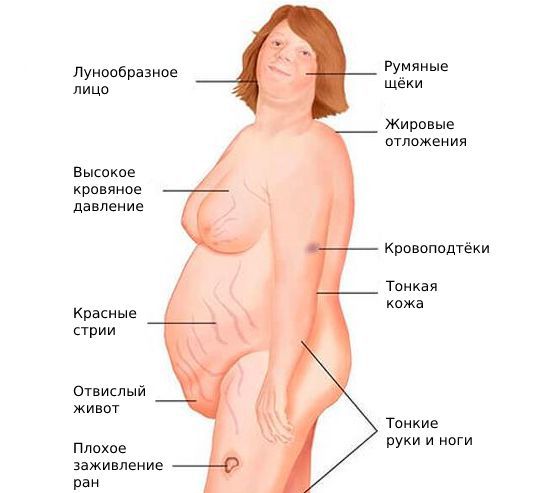
К гиперандрогении, как было сказано выше, может приводить врождённая гиперплазия коры надпочечников. Причина её развития — мутации генов, которые отвечают за синтез ферментов или транспортных белков, участвующих в выработке кортизола.
Классификация и стадии развития гиперандрогении
Согласно Международной классификации болезней (МКБ-10), гиперандрогения кодируется как Е.28.1 Избыток андрогенов. Выделяют истинную гиперандрогению и другие её формы.
Истинная гиперандрогения
Истинная гиперандрогения бывает яичниковой и надпочечниковой
Яичниковая гиперандрогения:
1. Синдром поликистозных яичников. Первичный СПКЯ (синдром Штейна — Левенталя) возникает при нарушении в системе гипоталамус-гипофиз-яичники. Вторичный СПКЯ развивается при эндокринной патологии, например на фоне сахарного диабета, заболеваний щитовидной железы или под воздействием внешних факторов: интоксикации, стресса, травмы и инфекции.
2. Стромальный текоматоз яичников (синдром Френкеля) — тяжёлая форма овариальной неопухолевой гиперандрогении. При заболевании разрастается соединительная ткань и возникает синдром HAIR-AN (высокий уровень андрогенов, инсулинорезистентности, ожирение и чёрный акантоз). Это редкая патология выявляется преимущественно в постменопаузе.
3. Андроген-продуцирующая опухоль яичников:
Надпочечниковая гиперандрогения:
Другие формы гиперадрогении
Осложнения гиперандрогении
Наиболее частые осложнения гиперандрогении: бесплодие, инсулинорезистентность и ожирение. Нарушение обмена липидов, сахарный диабет, сердечно-сосудистая патология возникают как следствие этих процессов.
Механизмы развития гиперандрогении и гиперинсулинемии до конца не изучены. Теоретически возможны три варианта взаимодействия: гиперандрогения вызывает гиперинсулинемию, гиперинсулинемия приводит к гиперандрогении и есть третий фактор, ответственный за оба феномена.
Предположение о том, что гиперандрогения вызывает гиперинсулинемию, основано на следующих фактах:
О том, что гиперинсулинемия вызывает гиперандрогению, свидетельствует следующее: инсулинорезистентность сохраняется у пациенток с удалёнными яичниками и при длительном приёме препаратов, подавляющих выработку андрогенов.
Диагностика гиперандрогении
Диагностика проводится эндокринологом или гинекологом-эндокринологом.
Этапы:
1. Опрос (сбор анамнеза). Врач беседует с пациенткой и выясняет следующие факты:
2. Осмотр. Доктор обращает внимание на следующие симптомы:
3. Лабораторные исследования:
Направление на анализы выписывает врач, так как часть из них нужно проводить в определённые дни менструального цикла.
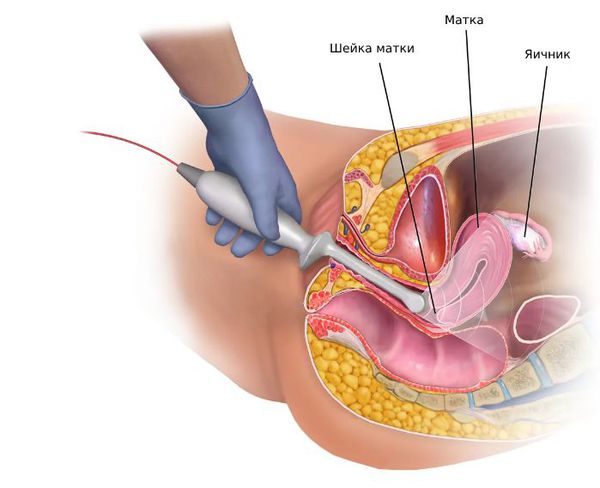
4. Инструментальная диагностика:
Лечение гиперандрогении
Заболевание лечит врач-эндокринолог или гинеколог-эндокринолог.
Лечение поможет устранить симптомы и достичь основных целей:
Нормализация менструального цикла уменьшает риск гиперплазии эндометрия и рака тела матки, маточных кровотечений и постгеморрагической анемии.
В редких случаях выполняют операции на яичниках.
Комбинированные оральные контрацептивы (КОК) снижают уровень гонадотропинов, а значит и концентрацию андрогенов, которые производятся в яичниках. Содержащиеся в КОК эстрогены увеличивают синтез глобулина, связывающего половые гормоны и, следовательно, снижают уровень свободного тестостерона. Кроме того, прогестагены в составе КОК уменьшают синтез андрогенов в надпочечниках, подавляют фермент 5-альфа-редуктазу и блокируют связывание андрогенов с рецепторами.
Оптимальными будут КОК, содержащие прогестаген с антиандрогенным действием: ципротерон, хлормадинон, диеногест и дроспиренон. Также предпочтительны оральные контрацептивы с этинилэстрадиолом.
Наиболее известные КОК, применяемые для лечения гиперандрогении:
Прогестагены нормализуют менструальный цикл при циклическом или постоянном приёме. Однако есть гипотезы, что прогестерон сам обладает андрогеноподобным действием. Его, как правило, не назначают для лечения гиперандрогении, но применяют для нормализации второй фазы менструального цикла.
Блокаторы андрогенных рецепторов из–за выраженной тератогенности (влияния на внутриутробную закладку органов будущего ребёнка) беременным принимать запрещено.
Основные препараты из группы блокаторов андрогенных рецепторов:
Дозировку и режим приёма препаратов врач назначает индивидуально.
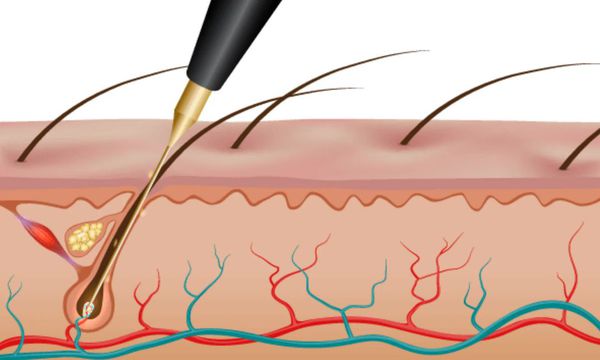
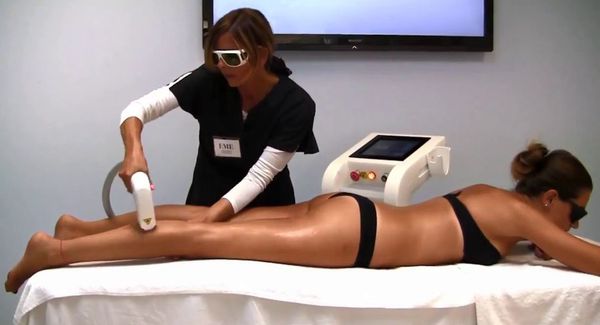
Способы удаления волос при гирсутизме
Существуют три вида электроэпиляции:
Побочные эффекты электроэпиляции: ожоги, раздражение кожи, редко — образование рубцов.
Лазерная эпиляция позволяет повредить волосяной фолликул, не разрушив окружающие его ткани. Процедуры нужно проводить многократно, но полностью избавиться от волос удаётся редко. В зависимости от источника светового излечения лазеры для удаления волос делятся на три группы:
Прогноз. Профилактика
Если своевременно обратиться к врачу и правильно подобрать лечение, то можно уменьшить неприятные симптомы и избежать серьёзных осложнений.
Результаты терапии следует оценивать через 3–6 месяцев, потому что антиандрогенные препараты действуют медленно: они постепенно накапливаются в организме и встраиваются в обмен веществ. Их приём требует адекватного дозирования, а также регулярной оценки результатов и возможных побочных действий.
Лечение позволяет избавиться от симптомов, поэтому для грамотной коррекции терапии пациентке необходимо регулярно посещать врача-эндокринолога
Профилактика:
Андростендион повышен у женщин чем лечить
Кафедра акушерства и гинекологии №1
Городская клиническая больница №53, Москва
Городская клиническая больница №53, Москва
Кафедра акушерства и гинекологии факультета последипломного профессионального образования врачей Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва
Кафедра акушерства и гинекологии №1 Первого Московского государственного медицинского университета им. И.М. Сеченова
Кафедра акушерства и гинекологии №1 ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова»
Синдром гиперандрогении: вопросы патогенеза, диагностики, клиники и терапии (клиническая лекция)
Журнал: Российский вестник акушера-гинеколога. 2014;14(2): 101-106
Унанян А. Л., Аракелов С. Э., Полонская Л. С., Гуриев Т. Д., Коссович Ю. М., Бабурин Д. В. Синдром гиперандрогении: вопросы патогенеза, диагностики, клиники и терапии (клиническая лекция). Российский вестник акушера-гинеколога. 2014;14(2):101-106.
Unanian A L, Arakelov S, Polonskaia L S, Guriev T D, Kossovich Iu M, Baburin D V. Hyperandrogenism: The pathogenesis, diagnosis, and therapy (a clinical lecture). Russian Bulletin of Obstetrician-Gynecologist. 2014;14(2):101-106.
Кафедра акушерства и гинекологии №1
Синдром гиперандрогении обусловливает многообразие вариантов клинических проявлений гиперандрогении у женщин, которое варьирует от акне и гирсутизма до явно выраженной вирилизации и нарушения репродуктивной функции. Несмотря на значительный арсенал различных средств, применяемых для лечения синдрома гиперандрогении, после отмены у большинства женщин возникает рецидив клинической симптоматики. Оральные контрацептивы, содержащие комбинацию этинилэстрадиола с хлормадинона ацетатом, являются эффективным средством для долгосрочной терапии женщин с синдромом гиперандрогении.
Кафедра акушерства и гинекологии №1
Городская клиническая больница №53, Москва
Городская клиническая больница №53, Москва
Кафедра акушерства и гинекологии факультета последипломного профессионального образования врачей Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва
Кафедра акушерства и гинекологии №1 Первого Московского государственного медицинского университета им. И.М. Сеченова
Кафедра акушерства и гинекологии №1 ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова»
Нарушение биосинтеза, транспорта и метаболизма андрогенов обусловливает многообразие вариантов клинических проявлений гиперандрогении у женщин, которые варьируют от акне и гирсутизма до явно выраженной вирилизации и нарушения репродуктивной функции.
Различают следующие виды андрогенных половых стероидов: тестостерон, дигидротестостерон (ДГТ), андростендион, андростендиол, дегидроэпиандростерон (ДГЭА) и дегидроэпиандростерон-сульфат (ДГЭА-С).
Исходным веществом для синтеза стероидных гормонов, в том числе и андрогенов, является холестерин, поступающий в организм преимущественно с продуктами животного происхождения или синтезирующийся в печени. Из холестерина образуется прегненолон, который под действием фермента 17α-гидроксилазы преобразуется в 17-гидроксипрегненолон, а затем в ДГЭА. ДГЭА, в свою очередь, может преобразовываться в тестостерон, андростендиол, андростендион и в ДГЭА-С.
Тестостерон характеризуется небольшой биологической активностью и слабым связыванием с андрогенными рецепторами (АРц). Тестостерон в незначительном количестве также может секретироваться надпочечниками. Синтез, секреция и регуляция уровня тестостерона осуществляются под контролем ЛГ и ФСГ.
В клетках внутренней оболочки фолликула тестостерон может превращаться в эстрогены, способствуя развитию молочных желез. Концентрация тестостерона во время беременности увеличивается.
Андростендион образуется в яичниках, а в небольших количествах гормон секретируется корой надпочечников. Андростендион является промежуточным продуктом при образовании как тестостерона, так и эстрона в жировой ткани и в печени. Андростендион имеет относительно слабую андрогенную активность (примерно, менее 20% от активности тестостерона).
Повышенные уровни андростендиона могут свидетельствовать о врожденной вирилизирующей гиперплазии надпочечников, синдроме поликистозных яичников, стромальном гипертекозе яичников, дефиците 3β-гидроксистероиддегидрогеназы и др. Высокие концентрации андростендиона распространены при вирилизирующих опухолях надпочечников или яичников.
В пучковой и сетчатой зонах надпочечников синтезируются андрогены из предшественника 17α-гидроксипрегненолона. Наиболее распространенными андрогенами надпочечников являются ДГЭА и ДГЭА-С, которые могут превращаться друг в друга. Важно отметить, что андрогенная активность надпочечниковых гормонов ДГЭА и ДГЭА-С в основном обусловлена их возможностью трансформироваться в тестостерон, хотя в самих надпочечниках тестостерон образуется в незначительном количестве.
ДГЭА оказывает действие на АРц, слабый андроген. Метаболизм ДГЭА очень интенсивен. Концентрация ДГЭА в крови примерно в 300 раз ниже таковой ДГЭА-С.
ДГЭА характеризуется циркадным типом секреции с максимальным уровнем в утренние часы. Важно отметить, что изменение концентрации связывающих белков не влияет на содержание ДГЭА. ДГЭА является источником половых стероидов за счет периферической конверсии в период менопаузы.
ДГЭА-С обладает относительно слабой андрогенной активностью (слабее ДГЭА), но его активность усиливается благодаря относительно высоким концентрациям в сыворотке, намного превосходящим уровни тестостерона, а также вследствие слабой аффинности к стероидсвязывающему β-глобулину.
Следует иметь виду, что у пациенток с врожденной гиперплазией надпочечников глюкокортикоидные препараты угнетают секрецию ДГЭА-С, но уровень ДГЭА-С не подавляется у больных с опухолями надпочечников и нейэндокринными АКТГ-продуцирующими опухолями. Низкие уровни ДГЭА-С могут иметь место при гипофункции надпочечников и щитовидной железы.
ДГЭА, ДГЭА-С и андростендион в большей степени связаны с альбумином, а тестостерон и ДГТ, главным образом, связываются с ГСПГ.
Клинические проявления
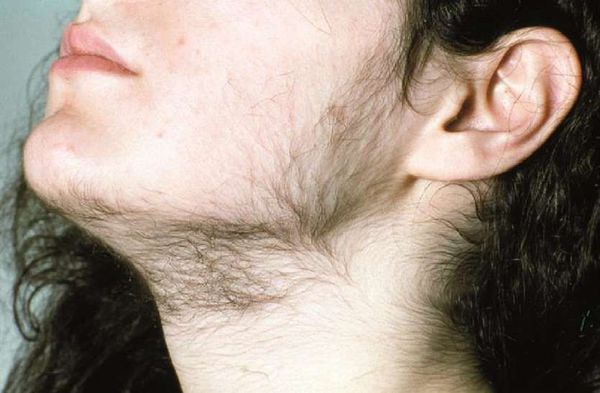
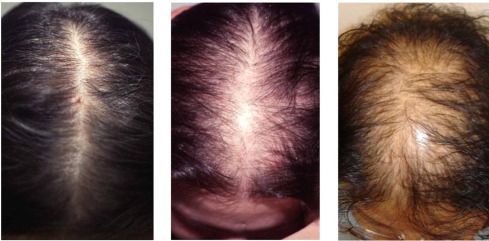
Синдром ГА характеризуется комплексом симптомов, которые могут встречаться в различных сочетаниях: огрубение голоса (барифония), атрофия молочных желез, невынашивание беременности, дисменорея, ановуляция, аменорея, бесплодие, маскулинизация, гипертрофия клитора, выраженный гирсутизм, андрогенная алопеция, себорея, гипертекоз и др.
ГА приводит к серьезным нарушениям женской репродуктивной системы. В частности, при ГА часто отмечаются невынашивание беременности, ановуляция и эндокринное бесплодие, нарушения менструального цикла и др. Нарушение менструальной функции проявляется в виде дисменореи, олиго-, аменореи, опсоменореи, не исключается и развитие менометроррагии и др.
Мишенями андрогенов в коже являются волосяные фолликулы и сальные железы.
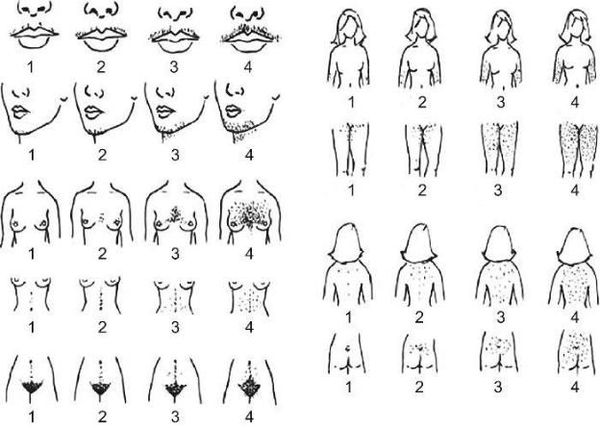
Оценка степени выраженности гирсутизма и лечебный мониторинг осуществляются с использованием шкалы Ferrimana-Gallwey (1961) и ее модификации, о наличии гирсутизма свидетельствует сумма 8 баллов и больше.
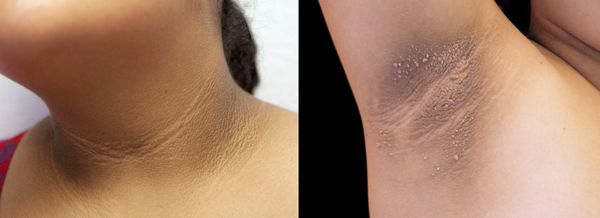
Сальные железы наиболее чувствительны к повышенной активности андрогенов. ГА способствует избыточной секреции кожного сала (себум) и закупорке волосяного фолликула, степень выраженности которых зависит от генетически детерминированного различия в чувствительности волосяного фолликула к андрогенам.
Андрогены, стимулируя рецепторы, расположенные на поверхности сальной железы, приводят к повышенной секреции кожного сала и изменению его состава. Кожа приобретает неприятный «жирный» блеск. Себорея на волосистой части головы создает условия для активации условно-патогенных грибов Pityrosporum ovale или Malassezia furfur. Результатом этого процесса является изменение цикла развития эпидермальных клеток и накопление большого количества жирных белесовато-желтых чешуек, которые являются ни чем иным, как перхотью.
ГА ускоряет образование новых клеток в сальной железе (кератонизация). Увеличивается количество слущенных клеток внутри фолликула. Кожное сало, массы кератина и слущенных клеток могут закупоривать устье фолликула. Вышеописанное способствует формированию пробки-комедона (угри). В дальнейшем образование кожного сала нарастает, при этом пробка-комедон не дает ему выхода на поверхность, фолликул разбухает от сала и в нем накапливаются бактерии, которые вызывают воспаление фолликула, таким путем появляются воспалительные элементы угревой сыпи.
Следует иметь виду, что в отсутствие ГА развитие алопеции у женщин может быть обусловлено генетической предрасположенностью, дефицитом массы тела, анемией, нарушением функции щитовидной железы, алиментарным фактором, а также применением некоторых лекарственных препаратов.
На синтез андрогенов в тека-клетках влияют инсулиноподобный фактор роста, эпидермальный фактор роста и др. Факторы роста под действием инсулина и соматотропного гормона гипофиза стимулируют продукцию андрогенов, что предопределяет развитие инсулинорезистентности/гиперинсулинемии, ожирения. В связи с чем необходимо выявление и коррекция факторов риска метаболических нарушений у женщин с ГА: артериальная гипертензия и сердечно-сосудистые заболевания, инсулинорезистентность, гиперинсулинемия, нарушение толерантности к глюкозе и сахарный диабет 2-го типа, дислипидемия и прогрессирующий атеросклероз.
ГА бывает опухолевого и неопухолевого (или функционального) генезов. Последний вариант может быть яичникового, надпочечникового или смешанного происхождений, а также может быть обусловлен повышением периферической чувствительности тканей к андрогенам.
Существуют следующие формы ГА: истинная, рецепторная, транспортная, ятрогенная. Истинная ГА характеризуется повышением содержания андрогенов, подтвержденным лабораторными исследованиями. При рецепторной ГА ее клинические проявления обусловлены количеством и чувствительностью рецепторов тканей-мишеней к андрогенам. Транспортная ГА развивается вследствие нарушения связывания тестостерона белками крови и повышением вследствие этого концентрации свободного гормона. Ятрогенная ГА обусловлена приемом лекарственных препаратов, обладающих андрогенными свойствами.
Причиной развития идиопатического гирсутизма может быть увеличение активности 5α-редуктазы в периферических тканях или повышение количества и чувствительности рецепторов к андрогенам.
Андрогенпродуцирующие опухолевые процессы яичников и/или надпочечников (опухоли клеток Лейдига, гонадобластома, опухоли клеток Сертоли-Лейдига, опухоли тека- и гранулезных клеток и др.) относятся к редким случаям ГА и, как правило, проявляются в раннем подростковом или репродуктивном возрасте и редко в постменопаузе.
Диагностика
Особенности диагностики ГА заключаются в определении степени, источника и патогенеза гиперпродукции андрогенов, а также в оценке степени влияния на репродуктивную функцию, наличия метаболических и сердечно-сосудистых рисков.
Для определения направления диагностического поиска необходимо детальное изучение анамнеза: особенностей менструального цикла; возраста менархе; возраста проявления акне, гирсутизма, себореи, алопеции; реализации репродуктивной функции; выявления наследственной отягощенности и др.
При осмотре оценивают особенности строения наружных половых органов; наличие Acanthosis nigricans (ворсинчатые, бородавчатые, ороговевшие разрастания аспидно-черного цвета); выраженность и распределение гирсутизма по шкале Ferrimana-Gallwey; степень выраженности алопеции, акне; показатели роста, массы тела, индекса массы тела, окружности талии и бедер; наличие галактореи и др.
Оценка гормонального профиля может включать определение следующих показателей: ФСГ, ЛГ, пролактина, эстрадиола, прогестерона (анализ проводится на 22-23-й день менструального цикла); 17-гидрооксипрогестерона (17-ОНП), андростендиона, андростендиола глюкуронида, ДГЭА-С, тестостерона общего и свободного, ДГТ, ГСПГ.
При синдроме ГА и нормальном показателе уровня общего тестостерона следует рассмотреть целесообразность определения и показателя свободного тестостерона. Ожирение может сопровождаться высоким уровнем свободного тестостерона за счет уменьшения показателя ГСПГ, нередко на фоне гиперинсулинемии и инсулинорезистентности.
В качестве маркера продукции андрогенов надпочечниками в настоящее время целесообразнее определять ДГЭА-С в крови, а не 17-кетостероиды в моче. Повышение показателя ДГЭА-С может свидетельствовать о надпочечниковом генезе синдрома ГА, а при значительном увеличении уровня ДГЭА-С следует исключить опухоль надпочечника.
Для определения источников повышенной продукции андрогенов могут проводиться различные нагрузочные тесты. Соотношение ЛГ/ФСГ более 2,5 характерно для СПКЯ. Но СПКЯ может иметь место и при соотношении ЛГ/ФСГ менее 2,5. Для диагностики адреналовой ГА вследствие дефицита 21-гидроксилазы (поздняя форма ВДКН) используется исследование 17-ОНП. Диагноз неклассической или поздней формы ВДКН подтверждается при уровне 17-ОНП выше 8 нг/мл. Если показатель 17-ОНП оказывается в диапазоне от 2 до 8 нг/мл, для исключения ВДКН необходимо провести нагрузочный тест с АКТГ.
Лечение
Терапия при синдроме ГА направлена на уменьшение кожных проявлений (гирсутизм, акне, себорея, алопеция), нарушения менструальной и репродуктивной функций, коррекцию метаболических нарушений. Тактика терапии должна определяться, исходя из установления источника повышенной секреции андрогенов.
На фоне проводимой медикаментозной терапии уровень андрогенов необходимо определять каждые 3-4 мес в течение года.
Варианты проведения немедикаментозной терапии включают нормализацию массы тела, оперативное лечение (удаление опухолей).
Ниже представлены основные направления медикаментозной терапии.
1. Подавление синтеза андрогенов в яичниках проводится с помощью:
2. Подавление синтеза андрогенов в надпочечниках проводится с применением глюкокортикоидов. В результате у пациенток с ВДКН уменьшается концентрация сывороточных андрогенов за счет АКТГ-индуцированного синтеза их в надпочечниках.
3. Коррекция метаболических нарушений: гиполипидемическая и гипотензивная терапия при необходимости; применение метформина, тиазолидиндионов (при наличии нарушенной толерантности к глюкозе).
Используют следующие блокаторы действия андрогенов.
В настоящее время эффективной и распространенной терапией андрогензависимых состояний является применение оральных контрацептивов, обладающих антиандрогенным эффектом. Среди них наиболее активно применяемым является препарат Белара (фирма «Гедеон Рихтер»), содержащий 2 мг хлормадинона ацетата (ХМА) и 30 мкг этинилэстрадиола.
В основе антиандрогенного эффекта ХМА лежит конкурентное его связывание с рецепторами андрогенов в клетках-мишенях, включая волосяные фолликулы и кожные сальные железы [4].
ХМА снижает чувствительность клеток волосяных фолликулов и кожных сальных желез к андрогенам вследствие подавления в них активности 5α-редуктазы [10].
ХМА подавляет синтез андростендиона и ДГЭА-С, т.е. снижение уровня андрогенов при приеме ХМА-содержащих оральных контрацептивов достигается в основном за счет подавления их выработки яичниками и надпочечниками.
Эстрогенная составляющая орального контрацептива способствует повышению синтеза ГСПС, приводя к достоверному снижению в крови уровня активного тестостерона.
Более чем у половины пациенток с кожными проявлениями вирильного синдрома в виде гирсутизма, жирной себореи и угревой сыпи на лице, спине и в зоне декольте уже через 6 мес регулярного приема ХМА-содержащего орального контрацептива происходит полное восстановление состояния кожных покровов и уменьшение роста волос на открытых участках кожи, что в свою очередь способствует значительному повышению самооценки и качества жизни этих женщин [6, 7].
Улучшение состояния кожных покровов на фоне приема ХМА-содержащего орального контрацептива достигается за счет восстановления их pH, усиления барьерной функции эпидермиса, проявляющейся в снижении трансэпидермальной потери воды, а также за счет увеличения гидратации рогового слоя кожи и уменьшения содержания липидов на его поверхности [8].
Кроме того, применение ХМА-содержащего орального контрацептива эффективно у женщин с облысением и идиопатическим гирсутизмом, не сопровождающимися ГА, а также при наличии дерматопатии на фоне склерополикистозных яичников.
Ввиду отсутствия у ХМА минералокортикоидной и глюкокортикоидной активности его переносимость большинством женщин оценивается как «хорошая» и «очень хорошая» [9].
Стабильность массы тела при использовании ХМА-содержащих оральных контрацептивов достигается в результате их нейтрального воздействия на углеводный и липидный обмен, что подтверждено отсутствием изменений толерантности к глюкозе, уровня тощаковой инсулинемии, периферической инсулинорезистентности и патологической дислипидемии у пациенток через 1 год после начала регулярного приема препарата.
Благодаря описанным выше особенностям влияния ХМА на углеводно-жировой обмен, его применение в составе КОК оправданно у женщин с синдромом склерополикистозных яичников, имеющих предрасположенность к развитию инсулинорезистентности и усугублению на этом фоне изменений в яичниках.
Неоспоримым преимуществом ХМА-содержащих КОК является их нейтральное воздействие на свертывающую систему крови при одновременном наличии у них антиатерогенного эффекта, что позволяет считать их препаратами выбора у пациенток с метаболическим синдромом, СПКЯ и системными заболеваниями, сопровождающимися гиперкоагуляцией.
В заключение следует отметить, что несмотря на значительный арсенал различных средств, применяемых для лечения синдрома ГА, подход к терапии данной патологии должен быть комплексным и последовательным, учитывающим ключевое звено патогенеза.
Пациентки с синдромом ГА должны ясно представлять, что лечение эффективно только на фоне приема препарата, поскольку после его отмены у большинства женщин возникает рецидив клинической симптоматики.