Анемия шейки матки что такое
Что такое миома матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лубнин Д. М., гинеколога со стажем в 21 год.
Определение болезни. Причины заболевания
Миома матки — это хроническое заболевание матки, проявляющееся образованием в ней единичных или множественных узлов различной локализации, ограниченное во времени репродуктивным периодом.
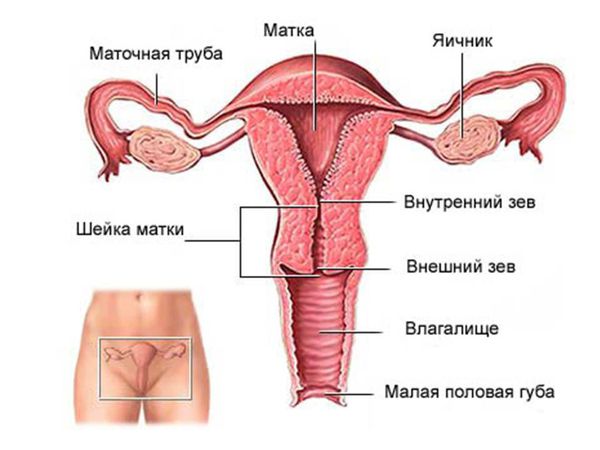
Как устроена женская репродуктивная система:
Миома матки не встречается до начала менструаций и регрессирует после менопаузы. Ранее миому матки считали истинной доброкачественной опухолью матки, однако в результате исследований было установлено, что она не в полной мере соответствует критериям опухоли, поэтому миому стали называть опухолеподобным образованием.
Миома матки — довольно распространенное заболевание, частота встречаемости достигает 70-80%, однако в большинстве случаев заболевание протекает бессимптомно. Только в 30-40% случаев наблюдаются клинические проявления миомы. [1] [2]
До сих пор неизвестны причины возникновения миомы матки. Ранее предполагалось, что к её развитию миомы приводят гормональные нарушения, однако эта теория была полностью опровергнута. Миома матки образуется в гормонзависимой ткани и поэтому чувствительна к влиянию половых гормонов, но её рост не запускается нарушением гормонального фона.
Кто подвержен наибольшему риску
Предполагается, что существует наследственная предрасположенность к развитию миомы матки. Миома матки никогда не превращается в злокачественную опухоль и не имеет никакого отношения к развитию злокачественных заболеваний матки.
Миома матки чаще всего диагностируется в возрасте 30-40 лет, однако может встречаться у более молодых женщин в 16-18 лет.
Чем миома отличается от фибромы
Фиброма матки и миома матки — два названия одного и того же заболевания. Если в миоме преобладает фиброзная ткань, такую миому могут называть фибромой, но термин «фиброма» в этом случае будет «просторечным», правильнее всего все миомы называть миомами, независимо от состава. Структура миомы никак не влияет на выбор метода лечения.
Чем опасна миома матки
К осложнениям миомы матки относятcя железодефицитная анемия, сложности с зачатием и вынашиванием, нарушение оттока мочи и повреждение почек.
Симптомы миомы матки
Симптомы на ранних стадиях:
В большинстве случаев на ранних стадиях миома матки никак себя не проявляет. Только в 30-40 % случаев она может нарушить качество жизни женщины.
Развитие симптомов миомы матки зависит от локализации узла или узлов, а также от их размера. Чем дальше узел от полости матки, тем больше вероятность того, что заболевание будет протекать бессимптомно. Даже условно небольшие, сантиметровые узлы, деформирующие или полностью расположенные в полости матки, могут приводить к обильным менструациям, в то время как узел такого размера в стенке матки или снаружи нее сделает заболевание бессимптомным. Крупные узлы по 6-8-10 и более сантиметров уже начинают увеличивать общие размеры матки, то есть проявляться увеличением живота, а также давлением на мочевой пузырь или прямую кишку. При этом могут быть и обильные менструации за счет увеличения размеров полости матки и нарушения процессов сокращения матки в конце менструации.
Клиническая картина миомы матки:
Патогенез миомы матки
Миома матки представляет из себя округлое образование различного размера, состоящее из разного сочетания гладкомышечных и соединительнотканных волокон. Крупные узлы миомы могут достигать 20 см, а сама матка с узлами — размера, соответствующего доношенной беременности.
Миома матки бывает единичной и множественной, то есть в матке может быть несколько небольших узлов или сочетание небольших узлов и нескольких больших или единичный большой узел.
Известно, что каждый узел в матке растет независимо друг от друга из одной-единственной клетки, которая получает дефект, запускающий процесс деления. Женские половые гормоны являются основным фактором роста миомы матки. Эстрогены стимулируют образование рецепторов прогестерона на клетках миомы, в то время как прогестерон запускает деление клеток. Другими словами, два женских гормона дополняют друг друга, но основным гормоном, стимулирующим рост узлов миомы матки, является прогестерон.
Узлы миомы матки растут с непредсказуемой скоростью: одни могут расти достаточно быстро — до нескольких сантиметров в месяц, другие очень медленно — 5-7 мм в год. Часть узлов может прекратить рост и несколько лет не увеличиваться в размере. Некоторые узлы способны самостоятельно нарушить свое кровоснабжение и вызвать некроз, в результате чего узел погибает, уменьшается в размере и больше не растет.
Нет никаких научных доказательств влияния внешних факторов на рост миомы матки. То есть бани, сауны, массажи, загар и физиопроцедуры не оказывают стимулирующего воздействия на рост миомы матки.
В целом поведение миомы матки непредсказуемо, известно лишь, что часть узлов начинает активно расти во время беременности, а после родов уменьшаются в размере, миома матки не растет после наступления менопаузы и подвергается обратному развитию и не встречается до начала менструаций (менархе).
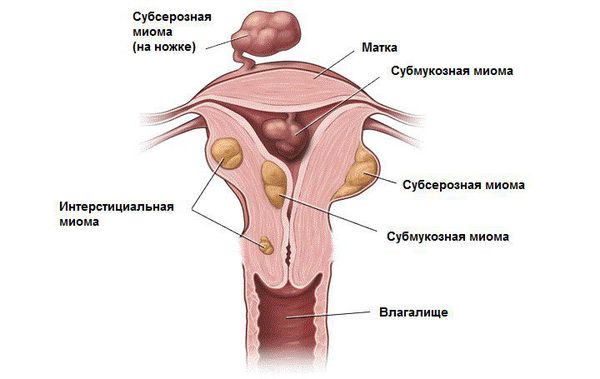
Классификация и стадии развития миомы матки
В зависимости от локализации миома матки бывает:
Существуют смешанные локализации, к примеру: интрамурально-субсерозная миома, то есть узел растет из стенки матки, но частично смещен наружу. Кроме этого у узлов описывают направление роста относительно полости матки. Так, миома матки может быть с центрипетальным ростом, то есть расти в сторону полости, или с центрифугальным, то есть наружу.
До сих пор в нашей стране применяют классификацию миомы матки, основанную на соответствии размеров матки срокам беременности в неделях. К примеру, можно встретить такое заключение: “миома матки 11-12 недель”. Эта классификация крайне субъективна и совершенно не информативна. Матка с наличием нескольких мелких узлов или при наличии небольшого субмукозного узла может не увеличиваться в размере. Крупные узлы несимметрично увеличивают в размере матку, и разные доктора будут по-разному оценивать общий размер матки, что может привести к неправильной интерпретации динамики роста узлов. Эта классификация не описывает количество и локализацию узлов, что определяет тактику лечения заболевания.
Миома матки бывает единичной и множественной. От чего зависит, сколько узлов образуется, и с какой скоростью они будут расти — неизвестно. В целом динамика роста узлов непредсказуема. Кроме периода беременности, когда большая часть узлов начинает расти под воздействием прогестерона, нет ни одного научно доказанного фактора, влияющего на рост миомы матки. После наступления менопаузы миома матки подвергается обратному развитию — узлы должны начать уменьшаться в размерах, в них наступают дистрофические изменения.
Некоторые узлы могут самостоятельно погибнуть за счет нарушения своего кровоснабжения. Такого рода “суицид” узла следует рассматривать как благоприятный исход заболевания.
Осложнения миомы матки
Наиболее распространенным осложнением миомы матки является железодефицитная анемия, которая развивается на фоне постепенного увеличения объема менструальной кровопотери. Её проявления не всегда вовремя замечаются пациенткой. На фоне анемии нарастает слабость, снижается трудоспособность, когнитивные функции, ухудшается состояние кожи, ногтей, волос. Нередко именно с этими жалобами пациентка обращается к терапевтам, которые диагностируют анемию и отправляют ее на осмотр к гинекологу, где диагностируется миома матки.
Наличие миомы матки может осложнять реализацию репродуктивной функции. При локализации в полости матки или существенно деформируя ее, миома может препятствовать зачатию или вынашиванию беременности. При крупных узлах или множественной миоме увеличенная в размере матка может занимать большую часть брюшной полости, сдавливая мочеточники, что приводит к нарушению оттока мочи и повреждению почек.
Беременность с миомой матки в ряде случаев может сопровождаться отставанием в развитии плода, преждевременными родами, преждевременным разрывом плодных оболочек, низким весом плода, слабостью родовой деятельности.
Диагностика миомы матки
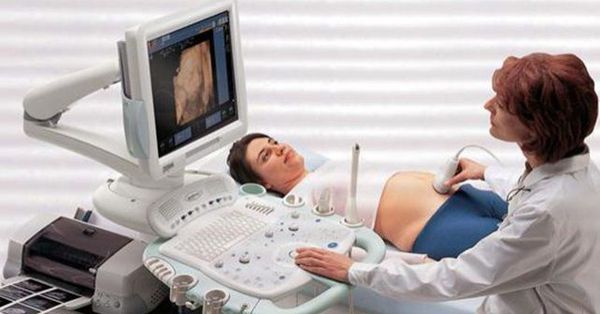
Диагностика миомы матки не представляет трудностей. Уже во время осмотра на кресле доктор может заподозрить наличие миомы матки, обнаружив увеличение матки и ее бугристость, но осмотр руками не информативен в плане количества, размера и локализации узлов. Золотым стандартом диагностики миомы матки является УЗИ.
В подавляющем большинстве случаев этого метода бывает достаточно, чтобы описать заболевание. УЗИ обязательно следует выполнять двумя датчиками: влагалищным и абдоминальным (через живот), чтобы не пропустить субсерозные узлы, которые могут располагаться на небольшом удалении от матки. Помимо подробного описания размеров и локализации всех узлов необходимо выполнить графическое изображение расположения узлов миомы матки относительно стенок матки и ее полости, проще говоря, нарисовать, как эти узлы располагаются в матке. Это важно для выбора правильной тактики лечения заболевания, так как только словесное описание может быть истолковано по-разному.
Если размер матки настолько велик, что возможности УЗИ не позволяют полностью оценить ее — рекомендуется проведение МРТ малого таза. Этот метод подробно отображает всю картину заболевания и позволяет оценить размер и точную локализацию узлов.
В некоторых случаях для уточнения локализации узла прибегают к гистероскопии — эндоскопическому методу, при котором в полость матки вводят камеру и визуально оценивают полость матки.
Лечение миомы матки
Не во всех случаях миомы матки требуется проводить лечение. Бессимптомные миомы матки в лечении не нуждаются, но только при соблюдении следующих критериев:
Во всех остальных случаях требуется лечение.
Какой врач лечит миому матки
Диагностикой и медикаментозным лечением миомы матки занимается гинеколог. Удаление миомы выполняется только эндоваскулярными хирургами, роль гинекологов заключается в определении показаний, подготовке и последующему ведению пациентов.
Так как сама по себе миома матки не опасна, еще раз повторю: она никогда не превращается в злокачественную опухоль.
Вот основные цели в лечении миомы матки:
Таким образом, перед началом лечения миомы матки надо четко решить, какую задачу вы преследуете, так как от этого будет зависеть выбор метода лечения.
Для лечения миомы матки сегодня оптимально применять следующие методы:
Все остальные методы лечения или не имеют научных доказательств эффективности (пиявки, гомеопатия, фитотерапия, БАДы), или недостаточно эффективны, то есть эффект временный (ФУЗ аблация, агонисты ГнРГ ) или неэффективны совсем (спираль “Мирена”, контрацептивы).
При выборе метода лечения важно учитывать следующие данные:
Ультразвуковой метод, или ФУЗ (фокусированный ультразвук)
Когда метод только появился на него возлагали большие надежды, так как можно было воздействовать на миому без нарушения кожного покрова. Суть метода в фокусированном тепловом расплавлении узла. Однако в процессе использования оказалось, что метод себя не оправдал и от него сейчас практически отказались. После ФУЗ аблации практически во всех случаях возникают рецидивы, так как узел расплавляется не полностью, кроме этого существует множество ограничений для этого метода, которые не позволяют его использовать у большинства пациентов.
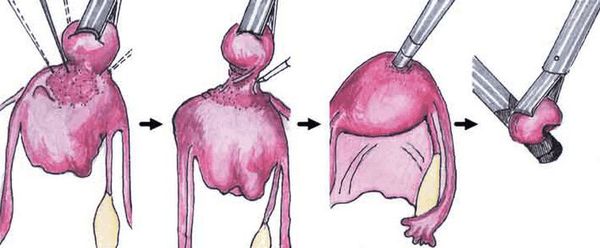
Хирургическое лечение миомы матки
Хирургическое лечение подразумевает удаление из матки миоматозных узлов различными способами: лапароскопически (под контролем камеры через несколько небольших проколов в животе), гистероскопически (так удаляются узлы, расположенные в полости матки. Инструмент и миниатюрная камера вводятся в полость матки через шейку со стороны влагалища) и лапаротомически (через разрез в животе, сейчас применяется все реже и реже). В зависимости от мастерства хирурга из матки можно удалить любое количество узлов практически любого размера, но само удаление узлов не является задачей в лечении миомы матки, так как во многих случаях наличие узлов в матке ничему не мешает.
Показания к операционному лечению миомы матки:
1. Наличие симптомов миомы матки — обильные менструации, анемия, выявленная в анализах крови, давление на смежные органы (мочевой пузырь, прямую кишку), увеличение живота.
2. Невозможность забеременеть или выносить беременность с имеющимися узлами.
3. Прогрессивный рост узлов.
4. Рост узлов после наступления менопаузы.
Противопоказания к оперированию миомы матки: воспалительные заболевания органов малого таза, пограничные или злокачественные заболевания органов малого таза, нарушения свёртывающей системы, нарушения функции почек, сердечная недостаточность.
Гистерэктомия
Полное удаление матки — гистерэктомия также относится к хирургическим методам лечения миомы матки. Удаление матки объективно показано только в случае гигантских миом, когда общий размер матки соответствует 20-25 неделям беременности, однако бывают исключения. Во всех остальных случаях миому матки можно вылечить без удаления органа, используя описанные выше три метода лечения.
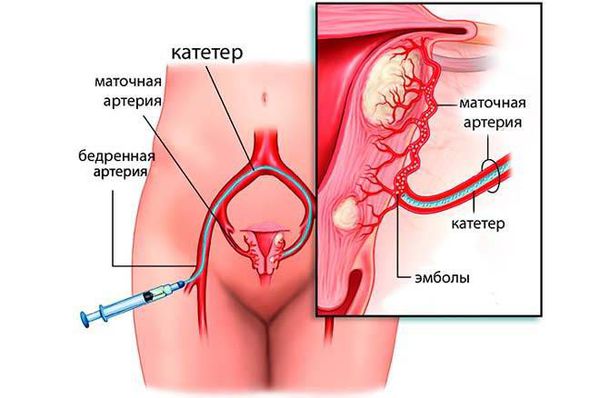
Метод эмболизации маточных артерий (ЭМА)
Эмболизация маточных артерий — малоинвазивный метод лечения миомы матки, заключающийся в прекращении кровоснабжения всех миоматозных узлов в матке, что вызывает гибель этих узлов. Суть метода в следующем: под местным обезболиванием производится пункция бедренной артерии, в сосуд вводят катетер, через который под рентгеновским контролем поочередно вводят микрошарики (эмболы), размером 700-900 микрон, состоящие из инертного полимера, которые блокируют патологический кровоток в матке, в результате чего кровоснабжение узлов миомы матки прекращается и все узлы погибают. Эффективность данного метода составляет 94-96%, все узлы необратимо уменьшаются в размере на 30-60%, проходят обильные менструации и давление на мочевой пузырь.
Появление новых узлов после ЭМА случается крайне редко, менее 0,1%. Эта процедура выполняется под местной анестезией, занимает не более 15-20 минут и требует не более 3х дней госпитализации. ЭМА способна решить любую из описанных выше задач в лечении миомы матки. Оптимально применять ЭМА при множественных узлах, узлах глубокого залегания в тело матки, крупных субмукозных узлах. ЭМА не влияет на репродуктивную функцию женщины, поэтому может быть рекомендована пациенткам, планирующим беременность, особенно если беременность планируется отсроченно. В этом отношении ЭМА имеет преимущество перед миомэктомией, так как не сопряжена с рецидивом заболевания и при ЭМА нет риска повреждения маточных труб спаечным процессом. [13] [17]
Прогноз. Профилактика
Прогноз у миомы матки в большинстве случаев благоприятный. Только при запущенных случаях не удается сохранить орган или восстановить репродуктивную функцию. Миома матки чаще всего растет медленно. Как правило, сами пациенты годами не посещают гинеколога, что не позволяет вовремя диагностировать заболевание на начальном этапе и провести лечение. В то же время нередко и сами доктора длительно наблюдают за постепенным ростом узлов, не предпринимая никаких мер, а после предлагают только удаление органа.
Так как причина развития миомы матки неизвестна, никаких профилактических мероприятий не предложено. Некоторые исследования показали, что прием гормональных контрацептивов снижает вероятность появления миомы матки на 24%. [18] Воздержание от массажа, загара, спорта и посещения бань не снижает вероятность заболеть миомой матки.
Если проходить УЗИ органов малого таза 1 раз в год начиная с 21 года, можно вовремя выявить начальную стадию заболевания и провести превентивное лечение.
Анемии при заболеваниях женской репродуктивной системы
Н.И. Стуклов
д.м.н., профессор кафедры госпитальной терапии с курсом клинической лабораторной диагностики Российского университета дружбы народов, руководитель курса гематологии
Статья посвящена исследованию причин развития анемий и их характеристик у больных гинекологическими и онкогинекологическими заболеваниями. Автором описываются изменения в анализах крови у 309 пациенток с патологией женской репродуктивной системы. По полученным данным следует, что вероятность выявления анемии зависит не от патологической кровопотери, характерной для некоторых заболеваний, а от локализации патологического процесса и его формы. В общем, анемии при доброкачественных заболеваниях соответствуют критериям железодефицитной анемии и адекватно лечатся препаратами железа. Наоборот, при злокачественных заболеваниях у женщин, несмотря на гипохромный характер анемии, лечение эффективно только при использовании препаратов эритропоэтина в сочетании с перепаратами железа, что связано с неадекватной продукцией эндогенного эритропоэтина.
Ключевые слова: анемия у женщин, гинекологические заболевания, онкогинекологические заболевания, железодефицитная анемия, препараты железа, неадекватная продукция эритропоэтина, лечение эритропоэтином.
NI Stuklov
MD, Professor, Department of hospital therapy with a course of clinical laboratory diagnostics of Peoples friendship university of Russia, course director of hematology
Key words: Anemia in women, gynecological diseases, gynecological cancer diseases, iron deficiency anemia, iron supplements, inadequate production of erythropoietin, treatment with erythropoietin.
Актуальность.
Женщины репродуктивного возраста являются группой риска по развитию анемии, что связано с наличием у них физиологической кровопотери, снижающей запасы железа в депо [1, 2]. В качестве основной причины развития железодефицитной анемии в указанной группе рассматриваются обильные менструации, которые, как правило, связаны с наличием гинекологической патологии [3]. Помимо гиперполименореи возможны также ациклические кровянистые выделения из половых путей и маточные кровотечения, которые могут быть клиническим проявлением заболеваний эндометрия, миомы матки, рака шейки матки, наблюдаются у 70% больных раком тела матки, в сочетании с анемией наиболее характерны для саркомы матки, являются частыми симптомами гранулезоклеточной опухоли яичников [4]. В настоящее время хорошо изучено угнетающее воздействие злокачественных опухолей на кроветворение [5]. Таким образом, анемии при гинекологической и онкогинекологической патологии развиваются по причине нарушения как гемоглобинообразования в связи с дефицитом железа, так и депрессии кроветворения. Для характеристики таких анемий в современной клинической практике используются понятия железодефицитной анемии (ЖДА), анемии хронической болезни (АХБ), анемии злокачественного новообразования (АЗН). Принципиально данные анемии отличаются наличием или отсутствием абсолютного дефицита железа, адекватностью выработки эндогенного эритропоэтина (ЭПО) и наличием того или иного заболевания 7.
Материалы и методы.
В исследование включены данные, полученные при обследовании и лечении 309 больных, которые разделены на пациенток с доброкачественными заболеваниями (гинекологические больные (патология эндометрия, миома матки, заболевания шейки матки, яичников), n=132), и пациенток со злокачественными заболеваниями женской репродуктивной системы (онкогинекологические больные (рак вульвы, шейки матки, эндометрия, саркома матки, опухоли яичников), n=177). Больные обследованы у гинеколога, онкогинеколога, проанализированы лабораторные данные: концентрация гемоглобина (Hb), среднее содержание гемоглобина в эритроците (МСН), сывороточное железо (СЖ), ферритин сыворотки (ФС), ЭПО, ретикулоциты (ret%o) 13.
Железодефицитные состояния при гинекологических заболеваниях и способы их коррекции
Рассмотрены роль железа в организме человека, механизмы его усвоения из пищи, клинические признаки железодефицитных состояний и железодефицитной анемии (ЖДА) у женщин, а также подходы к терапии и профилактике ЖДА с применением современных пероральных ферр
Железодефицитная анемия (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа. В основе анемии лежит тканевая гипоксия, развивающаяся в результате снижения количества гемоглобина вследствие кровопотери, нарушения образования эритроцитов, их деструкции или сочетания этих причин [1, 2].
Дефицит железа встречается почти у 1/3 жителей Земли, а железодефицитная анемия составляет 80–90% среди всех анемий. Распространенность анемий различается от пола, возраста, климато-географических и эколого-производственных причин [1, 3, 4].
Соответствующий дефицит развивается, когда потери железа превышают его поступление 2 мг/сут, и наблюдается при различных физиологических состояниях и заболеваниях [5, 6].
Железодефицитная (гипохромная, микроцитарная) анемия обычно возникает вследствие снижения ресурсов железа в организме при хронической кровопотере или недостаточном внешнем поступлении железа.
Наиболее уязвимы по развитию железодефицитных состояний женщины репродуктивного возраста вследствие ежемесячной физиологической кровопотери во время менструации, беременные по причине высокой потребности в микроэлементах, дети и подростки — из-за высоких потребностей растущего организма, пожилые люди, страдающие хроническими заболеваниями и имеющие плохое питание.
Железо является незаменимым микроэлементом, играющим важную роль в функционировании клеток многих систем организма, основная из которых — участие железа в процессах тканевого дыхания. Общее количество железа в организме женщины достигает 2–3 г, а его концентрация — 40–50 мг на кг массы тела.
Различают два вида железа: гемовое и негемовое. Гемовое железо входит в состав гемоглобина, содержится лишь в мясных продуктах, легко всасывается, и на его всасывание практически не влияет состав пищи.
Негемовое железо находится в свободной ионной форме — двухвалентного или трехвалентного железа. Абсорбция негемового железа (содержится преимущественно в овощах), на которое приходится до 90% железа всего рациона, находится в зависимости от целого ряда факторов. Основная часть железа входит в состав гемоглобина и миоглобина — 70%; депо железа — 18% (внутриклеточное накопление в форме ферритина и гемосидерина); функционирующее железо — 12% (миоглобин и содержащие железо энзимы); транспортируемое железо — 0,1% (железо, связанное с трансферрином) [7–9].
К наиболее важным железосодержащим соединениям относятся: гемопротеины, структурным компонентом которых является гем (гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза), негемовые ферменты (сукцинатдегидрогеназа, ацетил-КоА-дегидрогеназа, ксантиноксидаза), ферритин, гемосидерин, трансферрин.
В слизистой оболочке тонкого кишечника из продуктов питания усваивается только двухвалентное негемовое железо. Чтобы железо могло связаться с белками и поступить в клетку, трехвалентное железо восстанавливается в двухвалентное в присутствии кислой среды, основную роль в этом процессе в большинстве случаев играет аскорбиновая кислота [10–13]. Затем для поступления в плазму крови и связывания с трансферрином железо вновь окисляется до трехвалентного. В связанном с трансферрином состоянии железо доставляется тканям посредством эндоцитоза, где оно либо утилизируется клеткой, либо откладывается в составе ферритина. В составе ферритина железо хранится в легкодоступной и нетоксичной форме. Уровень ферритина является «золотым» стандартным показателем количества депонированного железа в организме. Каждый микрограмм ферритина соответствует 8 мг депонированного железа и для женщин в норме составляет 15–150 мг/мл [2, 14–16]. Концентрация же сывороточного железа подвержена значительным суточным колебаниям и составляет в среднем у женщин 6,6–26 мкмоль/л. Поэтому ее определение не имеет первостепенного значения [2].
Гемоглобин является транспортным белком для кислорода, содержащим гемовое железо. Гемы объединены в протопорфириновый каркас, в центре которого находится один двухвалентный атом железа. Одна молекула гемоглобина может перенести максимум 4 молекулы кислорода. Таким образом, количество эритроцитов и гемоглобина играет важную роль в транспортировке кислорода [2].
В течении железодефицита выделяют последовательные стадии: латентный дефицит железа, при котором потери железа превышают его поступление без изменений концентрации гемоглобина, и собственно железодефицитную анемию, которую в зависимости от степени выраженности подразделяют на компенсированную, субкомпенсированную и декомпенсированную формы [3].
Концентрация гемоглобина выражается в граммах на литр. Нормальным уровнем гемоглобина у женщин считается 115–145 г/л (MCHC, Mean Corpuscular Hemoglobin Concentration — средняя концентрация гемоглобина в клетке 320–360 г/л), об анемии говорят при снижении гемоглобина ниже 110 г/л. О тяжести течения анемии судят по уровню гемоглобина. По степени выраженности анемии выделяют легкую степень — 90–109 г/л, среднюю степень — 70–89 г/л и тяжелую степень — менее 70 г/л [3, 14, 15].
Кроме того, для железодефицитной анемии характерны снижение гематокрита, гипохромия (MCH, Mean Corpuscular Hemoglobin — среднее абсолютное содержание гемоглобина в одном эритроците), микроцитоз (MCV, Mean Corpuscular Volume — средний обьем эритроцита), гипосидероз (снижение количества сывороточного железа, увеличение общей железосвязывающей способности сыворотки крови, снижение уровня ферритина в сыворотке крови и в гемолизате) [3, 5]. Количество эритроцитов, гематокрита и гемоглобина составляют измеряемые величины, а MCV, MCH, MCHC являются производными этих величин [2].
Клиническая картина анемии обусловлена кислородным голоданием тканей, прогрессирующей гемической гипоксией с последующим развитием вторичных метаболических расстройств. Клинические симптомы появляются по мере возрастания тяжести заболевания: общая слабость, головокружение, головная боль, сердцебиение, одышка, обмороки, снижение работоспособности, бессонница. Симптомы, характерные ЖДА, заключаются в изменении кожи, ногтей, волос, мышечной слабости, извращении вкусовых ощущений. Кожа становится сухой, на ней появляются трещины. Вследствие нарушения обмена каротина при дефиците железа возникает желтизна кожи. Изменяется форма ногтей, они уплощаются, становятся вогнутыми и ломкими. Волосы истончаются, ломаются и обильно выпадают, появляется седина. При ЖДА также возможны симптомы поражения сердечно-сосудистой системы: сердцебиение, одышка, боли в груди и иногда отеки на ногах [6, 14].
Основными компенсаторными механизмами являются циркуляторная и вентиляционная адаптация, включающие увеличение сердечного выброса, вазодилатацию, снижение сосудистого сопротивления, увеличение перфузии тканей, перераспределение крови, увеличение минутного объема дыхания, усиление активности эритропоэтина. Острая, тяжелая и некомпенсированная анемия может привести к циркуляторному коллапсу и шоку [2].
Основной причиной развития железодефицитных анемий у женщин являются кровопотери различной этиологии. Дефицит железа у женщин встречается в 6 раз чаще, чем у мужчин. Значительное количество крови теряется во время менструации, беременности, в родах. При обильных менструациях возможна потеря железа в количестве 50–250 мг железа [2]. Чаще всего гиперполименорея связана с наличием миомы матки, аденомиозом, гиперпластическими процессами эндометрия, дисфункциональными маточными кровотечениями. Метроррагии при миоме матки чаще всего связаны с субмукозной локализацией узлов, при которой увеличивается менструирующая поверхность, повышается проницаемость кровоснабжающих миому сосудов, снижается сократительная способность матки. При миоме замедляется регенерация кровоточащей поверхности матки после десквамации эндометрия. При аденомиозе поражается миометрий матки, что приводит к длительным обильным менструациям и к вторичной железодефицитной анемии.
Нарушения менструального цикла возникают у женщин в различные возрастные периоды. К развитию гиперменструального синдрома могут привести разнообразные причины — сильные эмоциональные потрясения, нарушение питания, авитаминозы, ожирение, профессиональные вредности, инфекционные и септические заболевания, незрелость гипоталамических структур в пубертатном возрасте и инволютивная перестройка в пременопаузе. В значительной части случаев менометроррагии у женщин сопровождаются анемией различной степени тяжести, что способствует развитию трофических нарушений в различных органах и тканях. Профилактика и лечение анемий у женщин с нарушением менструального цикла и органическими гинекологическими заболеваниями являются важнейшими факторами восстановления их здоровья [1, 4, 17].
Независимо от причины менометроррагий (миома, эндометриоз, дисфункция яичников) и необходимости воздействия на соответствующий фактор, требуется длительная терапия препаратами железа для приема внутрь. Доза, режим дозирования и конкретный препарат подбираются индивидуально с учетом содержания железа в препарате, его переносимости и т. д.
При выборе конкретного препарата и оптимального режима дозирования необходимо иметь в виду, что адекватный прирост показателей гемоглобина при наличии ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг двухвалентного железа [18]. Одними диетическими мероприятиями нельзя возместить дефицит железа и достичь лечебного эффекта.
Антианемическая терапия должна проводиться препаратами для приема внутрь и не должна прекращаться после нормализации гемоглобина. Показания для парентерального введения достаточно ограничены: патология кишечника с нарушением всасывания, непереносимость препаратов для приема внутрь, социальные причины (использование у пациентов с изменениями личности, душевнобольных). По данным многих исследований парентеральные формы не имеют преимущества перед пероральными, при этом отмечается большое количество серьезных побочных эффектов [4, 10, 19]. Гемотрансфузии при ЖДА должны проводиться только по жизненным показаниям.
Современные пероральные ферропрепараты представляют собой соли двухвалентного железа (в пищеварительном тракте ионы трехвалентного железа не всасываются) или соединения, состоящие из гидроксид-полимальтозного комплекса трехвалентного железа (механизм всасывания отличается от такового ионных препаратов) [20].
Наивысшей биодоступностью обладает сернокислая соль железа, поэтому в основном в ферропрепаратах содержится сульфат железа [19, 21]. Сульфат железа это наиболее изученная, проверенная форма, хорошо зарекомендовавшая себя при длительном применении, поэтому чаще других входит в состав препаратов для приема внутрь. Обладает наибольшей степенью всасывания из всех препаратов железа.
В процессе всасывания двухвалентного железа в кишечнике большое значение имеет аскорбиновая кислота, которая способствует поддержанию железа в двухвалентной форме, поэтому очень важно ее наличие в препарате [22]. В гемопоэзе существенная роль принадлежит фолиевой кислоте, усиливающей нуклеиновый обмен. Для нормального обмена фолиевой кислоты необходим цианокобаламин, который способствует образованию из нее активной формы. Дефицит этих веществ, часто возникающий при анемиях, связанных с кровопотерями, приводит к нарушению синтеза ДНК в кроветворных клетках, тогда как включение этих компонентов в препарат увеличивает активную абсорбцию железа в кишечнике и его дальнейшую утилизацию. Наличие в лекарственном препарате аскорбиновой и фолиевой кислот, а также цианокобаламина значительно увеличивает скорость синтеза гемоглобина и повышает эффективность терапии железодефицитных состояний и железодефицитной анемии [14, 23, 24].
Перечисленные компоненты, повышающие биодоступность железа, входят в состав комплексного антианемического препарата Ферро-Фольгамма® [24], который был разработан и производится в соответствии с рекомендациями Всемирной организации здравоохранения (1998).
В 1 капсуле содержится 112,6 мг сульфата железа (элементарного железа 37 мг), что является оптимальной дозой для терапии и сокращает частоту побочных эффектов.
Абсорбция железа из препаратов солей (Fe2+) происходит в виде пассивной диффузии согласно градиенту концентрации, не зависит от рН и двигательной активности желудочно-кишечного тракта (ЖКТ), что обеспечивает быстрое насыщение.
Аскорбиновая кислота улучшает всасывание железа в кишечнике, предотвращает его переход из двухвалентной формы в трехвалентную, ускоряет транспортировку железа и его включения в гем, а также участвует в процессе высвобождения железа из депо.
Аскорбиновая кислота необходима для образования и сохранения восстановленной формы фолиевой кислоты — тетрагидрофолиевой кислоты.
В свою очередь фолиевая кислота является важнейшим фактором для синтеза ДНК и РНК, метаболизма белков и образования красных кровяных клеток, а также выступает дополнительным стимулятором эритропоэза и гемопоэза [21, 23, 25].
Цианокоболамин необходим для образования гемоглобина, эритроцитов, метаболизма белков, жиров, углеводов, производства энергии.
Ферро-Фольгамма® обладает высокой эффективностью, обеспечивая прирост гемоглобина в среднем 2,5 г/л/сут (наибольшая скорость прироста гемоглобина среди препаратов сульфата железа). При использовании препарата Ферро-Фольгамма® ослабление клинической симптоматики постгеморрагической анемии отмечается в течение первых 10 дней приема [6].
Ферро-Фольгамма® назначается по 1 капсуле 3 раза в день после еды в течение 3–4 недель при легкой форме анемии, при средней форме — по 1 капсуле 3 раза в день 8–12 недель, а при тяжелых формах анемии — по 2 капсулы 3 раза в день в течение 16 недель и более. Во время беременности назначается для профилактики недостаточности фолиевой кислоты и железа по 1 капсуле 3 раза в день во II и III триместрах, в послеродовом периоде во время кормления грудью.
После прекращения лечения препаратом Ферро-Фольгамма® положительный эффект и стабилизация показателей сыворотки крови (уровень гемоглобина, эритроцитов, сывороточного железа, общая железосвязывающая способность сыворотки крови) гарантированно сохраняются минимум на протяжении одного месяца [4].
Активные компоненты препарата Ферро-Фольгамма® находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание в верхнем отделе тонкой кишки, что исключает раздражающее действие на желудок. Компоненты растворены в рапсовом масле, которое позволяет улучшить всасывание железа и одновременно снизить раздражающее влияние железа на слизистую оболочку желудка, способствуя хорошей переносимости препарата со стороны пищеварительного тракта [1, 13]. Благодаря отсутствию агрессивного действия на слизистую оболочку ЖКТ Ферро-Фольгамма® может с успехом применяться для коррекции анемического синдрома, при дефиците витамина В12 и фолиевой кислоты на фоне нарушения всасывания в ЖКТ (атрофия слизистой желудка и двенадцатиперстной кишки).
Кроме того, Ферро-Фольгамма® эффективно применяется при сочетанных железо-фолиево-В12-дефицитных анемиях, вызванных хроническими кровопотерями, хроническим алкоголизмом, инфекциями, приемом противосудорожных и пероральных контрацептивных препаратов, анемии во время беременности и кормления грудью.
Эффективность препарата Ферро-Фольгамма® для лечения и профилактики железодефицитной анемии при хорошей переносимости и благоприятных фармакоэкономических характеристиках (стоимость/доза железа/эффективность) была доказана в нескольких российских исследованиях, которые включали широкий круг пациентов, в т. ч. беременных и женщин с гинекологическими заболеваниями [4, 18, 19]. Показаниями к назначению препарата Ферро-Фольгамма® являются анемии, вызванные сочетанным дефицитом железа, фолиевой кислоты и витамина B12, возникающие на фоне хронических кровопотерь (мено- и метроррагий и др.), а также при хроническом алкоголизме, инфекционных заболеваниях, приеме противосудорожных средств и пероральных контрацептивов. Препарат разрешен для профилактики и лечения дефицита железа и фолиевой кислоты во II и III триместрах беременности, в послеродовом периоде и во время лактации.
Таким образом, антианемическая терапия с применением препарата Ферро-Фольгамма® с оптимальным содержанием железа является высокоэффективной с быстрой скоростью прироста гемоглобина (полная клиническая и гематологическая ремиссия у 93% пациенток после 3 недель терапии). Отмечается хорошая переносимость — отсутствие побочных эффектов у 95% пациентов, аллергических реакций и отрицательного влияния на организм женщин, а также стабильность достигнутых результатов и сохранение положительного эффекта в течение месяца после лечения, что позволяет рекомендовать препарат Ферро-Фольгамма® широкому кругу пациентов.
Литература
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Abstract. The role of Ferrum in human organism has been analyzed, mechanisms of its digestion from food, clinical presentations of hypoferric conditions and women’s hypoferric anemia, as well as approaches to therapy and prophylaxis of hypoferric anemia with modern peroral preparations.