Ангиогенез что это такое
Ангиогенез что это такое
• Рост опухоли ограничивается доступностью питательных субстратов и механизмом выведения продуктов жизнедеятельности
• Опухоль может стимулировать рост кровеносных сосудов (ангиогенез), которые, в свою очередь обеспечивают увеличение ее массы
Способность клеток растущей опухоли к пролиферации зависит от ряда факторов, наиболее важным из которых является адекватная система кровоснабжения. Известно, что развивающаяся опухоль, т. н. первичная опухоль, может достигнуть размера лишь 0,2 мм, а затем начинает испытывать затруднения с доступом к питательным компонентам и кислороду; в то же время такой опухоли уже необходимо иметь систему выведения отходов жизнедеятельности и двуокиси углерода. Клетки, испытывающие гипоксию, могут вступить в апоптоз.
Проблем не возникает, если в опухоли развилась сосудистая система. Сосуды решают вопросы, связанные со снабжением опухоли кислородом и питательными компонентами, а также с выведением отходов жизнедеятельности. В отличие от здоровых тканей, патологическая ткань опухоли обычно не развивается вместе с артериально-венозной сетью. Вместо этого опухолевые клетки должны обеспечить рост сосудов de novo за счет примыкающих здоровых тканей.
Процесс образования новых кровеносных сосудов называется нео-ангиогенез или просто ангиогенез. Он начинается, когда клетки опухоли секретируют ростовые факторы, называемые ангиогенными, которые взаимодействуют с эндотелиальными клетками, образующими капилляры в соседних здоровых тканях. В ответ на воздействие ангиогенных факторов эти эндотелиальные клетки начинают пролиферировать и проникают в ткань опухоли, начиная формировать сосудистую сеть, которая в дальнейшем поддерживает рост опухоли.
Очевидно, что в небольшой первичной опухоли клетки в течение многих лет делятся с постоянной скоростью. Несмотря на это, на протяжении этого периода масса опухоли не увеличивается. В отсутствие системы кровоснабжения клетки в такой опухоли погибают с той же скоростью, с какой они образуются. Эта гибель вызывается нехваткой кислорода (аноксия) и отравлением отходами своей жизнедеятельности.
Действительно, такой может быть конечная судьба большинства первичных опухолей, образовавшихся в тканях человека. В течение этого периода равновесия процесс диффузии обеспечивает потребность небольшой опухоли в кислороде и питательных компонентах, используя находящиеся рядом хорошо васкуляризованные ткани.
После нескольких лет такого скромного клеточного деления некоторые клетки в небольшой массе опухоли внезапно приобретают способность стимулировать ангиогенез. Когда это происходит, масса опухоли вступает на путь быстрого роста. Такая быстрая смена характера роста опухоли, которая происходит в ходе многоэтапного опухолевого процесса, называется ангиогенное переключение. Этот процесс представляет собой еще один барьер, который здоровые ткани воздвигают на пути неограниченной экспансии опухолевых клеток.
В некоторых опухолях формирование кровеносных сосудов не происходит в ходе одного отдельного события при многоэтапном развитии опухоли (подобно ангиогенному переключению). Вместо этого в опухоли по мере ее роста происходит прогрессивное образование сосудов.
Процесс управления ангиогенезом включает сложные кооперативные взаимодействия между клетками опухоли и соседними здоровыми клетками, которые попадают в опухоль и начинают взаимодействовать с раковыми клетками. Считается, что наряду с ангиогенными факторами, которые непосредственно высвобождаются раковыми клетками, фибробласты и макрофаги высвобождают другие важные факторы.
Вместе они индуцируют образование сосудистой сети, которая отвечает всем потребностям опухоли и начинает обеспечивать ее практически неограниченным запасом питательных компонентов и кислорода. Также через опухоль могут прорасти лимфатические сосуды, которые служат для удаления отходов ее жизнедеятельности и интерстициальной жидкости. Однако по сравнению с системой кровоснабжения лимфатические сосуды в жизни опухоли играют довольно скромную роль.
В зависимости от плотности сети капилляров опухоли, различают несколько стадий ее развития. Про опухоли с плотной сетью капилляров говорят, что они сильно васкуляризованы; это часто служит причиной болей у раковых больных и указывает на агрессивно растущую популяцию раковых клеток. Наличие сосудов в опухоли создает еще более угрожающую ситуацию. Это говорит о том, что опухоль получила доступ к основным сосудам организма, что облегчило миграцию ее клеток и заселение ими отдаленных органов.
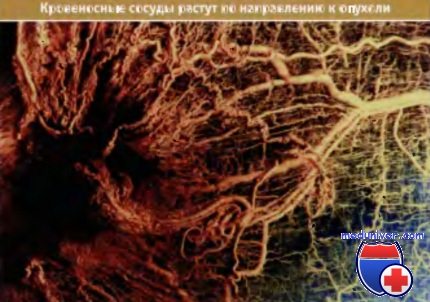
Сама опухоль находится слева в виде темной области.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ангиогенез в скелетных мышцах человека
Дается определение ангиогенезу и васкулогенезу. Описываются: стимулы ангиогенеза и ангиогенез в норме и патологии. Приводятся данные о скорости роста кровеносных сосудов в скелетных мышцах человека при тренировке на выносливость и силовой тренировке с ограничением кровотока.
Ангиогенез в скелетных мышцах человека
Определение
Ангиогенез – процесс образования новых кровеносных сосудов в органе или ткани, в ходе которого происходит реорганизация первичной капиллярной сети, которая сокращается до более простой и четкой системы капилляров, артерий и вен.
Ангиогенез и васкулогенез
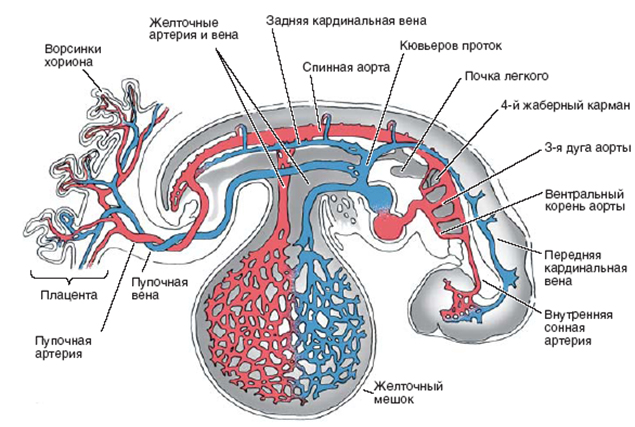
Под васкулогенезом понимается первая стадия образования кровеносных сосудов в эмбриональный период (рис. 1). Второй стадией является ангиогенез – образование новых кровеносных сосудов на основе имеющейся системы сосудов.
Рис.1. Система кровообращения у 4-недельного плода человека (Carlson, 1981)
Стимулы ангиогенеза
Основным стимулом для ангиогенеза является гипоксия, которая может быть связана как с ускорением потребления кислорода тканями (при активном росте организма, физических нагрузках, эндокринных расстройствах, ускорении обмена при анаболических процессах), так и с уменьшением его поступления (нарушение притока крови, анемия и другие причины).
Важными ангиогенными факторами являются VEGF (vascular endothelium growth factor) – фактор роста сосудов и HIF-1 (hypoxia-inducible factor) – регулятор генов млекопитающих, которые отвечают за реакцию на недостаток кислорода.
Ангиогенез в норме и патологии
В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и активизируются только при регенерации повреждённых тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма. В опухолевых же тканях, особенно в тканях злокачественных опухолей, ангиогенез протекает постоянно и очень интенсивно. Это является одной из причин быстрого роста злокачественных опухолей, поскольку они очень хорошо кровоснабжаются и получают значительные количества питательных веществ, лишая тем самым питания здоровые ткани организма. Кроме того, усиленный ангиогенез в опухоли является одним из механизмов её быстрого метастазирования, так как опухолевые клетки имеют свойство метастазировать по ходу кровеносных сосудов (вдоль стенок) или разносятся по всему организму с током крови.
Ангиогенез в скелетных мышцах человека при физических нагрузках
Вопросы протекания ангиогенеза при физических нагрузках изучали многие авторы. Одним из лимитирующим факторов спортивной деятельности является производительность сердца. При этом поддержание необходимого объема и скорости кровотока достигается как за счет нервной и гуморальной регуляции сосудистого русла, так и ангиогенеза, способствующего образованию новых микрососудов в различных тканях организма в том числе и скелетных мышцах. В результате этого увеличивается плотность капиллярной сети, доставка в ткани кислорода, пластических и энергетических субстратов.
Ангиогенез что это такое
В настоящее время не существует единой классификации регуляторов ангиогенеза, однако в соответствии с их природой все факторы, оказывающие влияние на рост кровеносных сосудов, могут быть разделены механические (биомеханические) и химические [5, 10, 31]. Химические факторы, в свою очередь включают широкий спектр биологически активных веществ, которые могут как стимулировать, так и угнетать ангиогенез, и метаболиты [3].
Биомеханические факторы, регулирующие ангиогенез
Эндотелиальные клетки подвергаются различным механическим воздействиям, связанных с током крови: напряжению сдвига, трансэндотелиальному току жидкости, циклической деформации и др. Было показано, что параметры гемодинамики регулируют ангиогенные реакции эндотелиальных клеток [8, 15]. Согласно современным представлениям постоянный ламинарный коровок (постоянное напряжение сдвига) способствует ангиогенной стабилизации сосудов, что обеспечивает как завершение активного ангиогенеза, так и поддержанию ангиогенного покоя. Напротив, турбулентный ток крови, неадекватные параметры напряжения сдвига, повышение трансэндотелиального тока жидкости представляют собой факторы, способствующие активации ангиогенеза. В настоящее время установлено, что биомеханические факторы изменяют экспрессию генов и регулируют не только миграцию, пролиферацию и апоптоз эндотелиальных клеток, но и продукцию ими химических ангиогенных факторов [14, 25, 33].
Биологически активные вещества, стимулирующие ангиогенез
Биологически активные вещества, оказывающие влияние на прорастание сосудов, в зависимости от оказываемого эффекта разделяют на стимуляторы и ингибиторы [3]. Стимулируют рост сосудов семейство факторов роста эндотелия сосудов (VEGF), близкие к нему плацентарные факторы роста (PlGF- 1,2), основной фактор роста фибробластов (FGF-2), ангиопоэтины (ANGPT-1,2), интерлейкин-8 (IL-8), тромбоцитарные факторы роста (PDGF), трансформирующий фактор роста-бета (TGF-бета) и другие [16].
Инсулиноподобный фактор роста (IGF-1) также оказывает стимулирующее влияние на прорастание кровеносных сосудов, через увеличение продукции IL-8. Кроме того, invitro была продемонстрирована способность IGF-1 стабилизировать новообразованные соcуды [21].
IL-8 является независимым VEGF-стимулятор ангиогенеза, который действует через рецепторы CXCR-2, стимулируя пролиферацию, миграцию и выживание эндотелиальных клеток [27].
Тромбоцитарный фактор роста PDGF-BB, малые дозы TGF-бета, гепаринсвязывающий подобный эпидермальному фактор роста (EGF-HB) способствуют стабилизации образованных сосудов [13].
Биологически активные вещества, ингибирующие ангиогенез
На сегодняшний день описан ряд биологически активных веществ, которые ингибируют ангиогенез. Тромбоспондины-1,2 (TSP-1,2), вазогибин-1 (VASH-1), ангиостатины, эндостатин являются примерами медиаторов, которые ингибируют ангиогенез.
Ангиостатины представляют собой протеолитические фрагменты плазминогена, которые обладают способностью подавлять ангиогенез опухоли [26]. Ангиостатины снижают миграцию, пролиферацию и увеличивает апоптоз эндотелиальных клеток, а также снижают продукцию VEGF в клетках опухоли [35]. Ангиостатины образуются в плазме, межклеточном матриксе и на поверхности клеток при участии матриксных металлопротеаз, катепсина, эластазы нейтрофилов [36].
Эндостатин представляет собой С-концевой фрагмент коллагена XVIII, который образуется в результате протезной активности, обусловленной прорастанием кровеносных сосудов. Эндостатин ингибирует пролиферацию эндотелиальных клеток и тубулогенез [9, 37].
Ингибирующее эффекты на ангиогенез были также выявлены у ряда цитокинов, в частности, у IL-4 и гамма-интерферона [19, 20].
Метаболическая регуляция ангиогенеза
Основной функцией сердечно-сосудистой системы является доставка тканям кислорода и питательных веществ, поэтому регуляция состояния сосудистой сети осуществляется рядом метаболических условий.При этом ключевое значение среди метаболитов имеет кислород, а гипоксия тканей является одним из основных индукторов образования новых кровеносных сосудов [23].
Активные формы кислорода также являются значимыми регуляторами ангиогенеза. [38]. Избыточная продукция активных форм кислорода представляет собой универсальный механизм возникновения патологических клеточных реакций, который реализуется при целом ряде заболеваний [1]. АФК стимулируют индукцию VEGF в различных типах клеток, включая гладкомышечные и эндотелиальные клетки, а также способствуют их пролиферации и миграции [38]. Кроме того, АФК являются одним из внутриклеточных сигнальных путей реализации эффектов VEGF, FGF и ANG-1 [11].
Продукты гликолиза также являются посредниками перехода эндотелиальных клеток от фенотипа ангиогенного покоя к активному ангиогенезу [7]. В частности, показано, что лактат является одним из стимуляторов ангиогенеза. Повышенная концентрация лактата потенцирует активацию Tie-2 (рецепторов ANGPT) и VEGFR-2 [29].
Проведенный анализ данных литературы позволяет заключить, что ангиогенез регулируется сложной системой сигнальных механизмов. Смена периодов ангиогенногопокоя и активного ангиогенеза обеспечивается комплексом гемодинамических и метаболических условий, а также балансом про- и антиангиогенных биологически активных веществ. Биомеханимческая и метаболическая регуляция ангиогенеза находится в тесном сопряжении с продукцией биологически активных веществ, влияющих на рост сосудов. Кроме того, биомеханические и метаболические условия способны изменять чувствительность эндотелиальных клеток к про- и антиангиогенным биологически активным веществам. Комплексная регуляция различными факторами обеспечивает четкую координацию ангиогенных процессов, что необходимо для ремоделирования сосудистого русла в соответствии с потребностями тканей в кровоснабжении. Коррекция дисрегуляцииангиогенеза в патологических условиях может выступать в качестве точки приложения терапевтических стратегий при различных заболеваниях, в том числе онкологических.
Рецензенты:
Антипова О.Н., д.м.н., профессор кафедры нормальной физиологии им. И.А. Чуевского, ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России, г.Саратов;
Пронина Е.А., д.м.н., зав. кафедрой медико-биологических дисциплин Саратовского медицинского института «РЕАВИЗ», г.Саратов.
Ангиогенин («рождающий сосуды»).
Основная молекулярная форма ангиогенина человека представлена одноцепочечным полипептидом из 123 аминокислотных остатков (молекулярная масса
14,5 кДа), продуцируется печенью.
Много ангиогенина в организме человека в раннем возрасте, при беременности, в области заживления ран. Основными мишенями действия ангиогенина являются эндотелиальные клетки, клетки гладкой мускулатуры, фибробласты, он участвует на всех этапах сложного многоэтапного процесса образования сосуда, включая клеточную миграцию, инвазию, пролиферацию и формирование капилляров.
Ангиогенез — процесс образования новых кровеносных сосудов в органе или ткани, позволяет продлить уже сформированные сосуды и стимулировать прорастание новых капилляров.
Он активирует эндотелиальные клетки, стимулирует деградацию межклеточного матрикса, пролиферацию и миграцию эндотелиоцитов, образование первичных высокопроницаемых сосудистых структур. Затем происходит стабилизация и «взросление» первичных сосудистых структур за счет привлечения клеток другого типа, в результате чего происходит организация сложной трехмерной сосудистой сети.
После формирования сосуда с помощью ангиогенина, насыщения участка кислородом и питательными элементами, происходит инактивация датчиков эндотелиальных клеток и блокируется восприимчивость к ангиогенным факторам.
2. Улучшает микроциркуляцию крови в районе раны, увеличивает активность фибробластов, из которых образуется молодая ткань.
3. Ускоряет заживление при нарушениях в соединительно-тканном аппарате, критических ишемических и послеоперационных состояниях и диабетических нарушениях в организме.
4. Снижает отечность и воспаление, повышает местный иммунитет в зоне повреждения, снижает вероятность образования келоидных рубцов.
· восстанавливает активность фибробластов;
· активный синтез гиалуроновой кислоты, коллагена, эластина;
· восстанавливает целостность капилляров и создает новые;
· активная микроциркуляция – одно из качеств молодой кожи;
· отличная регенерация после радикальных процедур.
В ходе доклинических исследований субстанции ангиогенина проводился полный набор тестов на безопасность.
Лаборатория «Ангиофарм» производит широкий спектр косметических и специализированных продуктов на основе уникальной технологии синтеза рекомбинантного ангиогенина и доведения его до необходимой степени чистоты, посредством встраивания его в генетический аппарат дрожжей pichia pastoris.
«Ангиофарм» основывается на более чем 35-летнем опыте Новосибирского Института биоорганической химии СО РАН, который в 1987 году после пяти лет исследований разработал препарат, позволяющий добиваться ускоренной регенерации тканей. Ген ангиогенина встраивается в генетический аппарат бактерий Escherichia coli и бактерии получают способность продуцировать человеческий АНГИОГЕНИН. При синтезе ангиогенина используется газо-вихревой биореактор для производства биомассы бактерий, аналогов которому не существует в мире!
Научные исследования по ангиогенину ведутся в институте химической биологии и фундаментальной медицины.
В рецептурах средств «Ангиофарм» используются активные компоненты производства ведущих мировых компаний (Франция, Испания, Бельгия), обеспечивая высокую эффективность конечных продуктов. Уникальные комплексы пептидов и биопептидов дополнены натуральными растительными компонентами: экстрактами трав, цветов, водорослей, вытяжками стволовых растительных клеток, витаминами, минералами, фруктовыми кислотами, натуральными и эфирными маслами.
Продукция «Ангиофарм» эффективна как в домашних и профессиональных процедурах косметологического ухода для чувствительной, жирной, склонной к пигментации кожи, для возрастного ухода, так и для решения широкого круга терапевтических задач:
· при себорее, угревой болезни, куперозе, розацеа;
· при травмах кожи и слизистых любого генеза: ожоги, раны, ссадины, укусы, порезы, обморожения, пролежни;
· при патологиях кожи, вызванных дефицитом кровоснабжения: истончение кожи в результате воздействия возрастных факторов, трофические изменения, вызванные сахарным диабетом;
· для ускорения восстановления при выполнении косметологических процедур: лазерное воздействие, мезотерапия, пилинги, лифтинг, косметологические хирургические вмешательства.
Положительное влияние ангиогенина было установлено в случаях: ишемическая болезнь сердца, инсульты, патология костной и хрящевой ткани, при лечении язв и эрозий в желудочно-кишечном тракте.
Влияние ангиогенина на патологии, связанные с недостатком кровоснабжения в тканях:
· пост-операционные раны;
· лечение гнойных ран;
· обморожения, порезы, трещины, пролежни;
· рубцы хирургических ран;
· варикозное расширение вен.
Неспецифическое действие ангиогенина:
· участвует в механизме регуляции иммунитета;
· просматривается перспектива использования против СПИДа человека.
Применение ангиостимулирующих технологий в медицине имеет очень большое будущее:
· Лечение длительно незаживающих язв (трофические нарушения, диабет).
· Уход за лежачими больными: лечение и профилактика пролежней.
· Применение к комбустиологии: лечение ожогов любой степени сложности.
· Лечение болезней, связанных с мышечной атрофией, в т.ч. БАС.
· Восстановление функций мышц при ишемии как конечностей так и ишемии сердечной мышцы.
Ангиогенез что это такое
Ангиогенез (а) – сложный процесс формирования новых кровеносных сосудов в органах либо тканях, предопределенный строго поочередной работой множества факторов в пространственно-временной позиции. Новые капилляры образуются из мелких кровеносных сосудов, путем активизирования эндотелиальной клетки, преобразования в них протеиназ, деградации внеклеточной структуры ткани, разрастания и передвижения клеточных структур. Впоследствии благодаря формированию клетками первичных высокопроницаемых сосудов, начинается стабилизация и «взросление» структур клетки с помощью притягивания перикапиллярных клеток и клеток гладких мышц. В результате чего строится многогранная сеть сосудов. В норме ангиогенез происходит в спокойном темпе, активируется он при условии тканевых ранений, наличия тромбов и других патологических процессах [1]. Физиологический ангиогенез – это реакция ткани на гормональную стимуляцию (ангиогенез в репродуктивной системе) или изменения в окружающей среде (в ответ на ишемию ткань может расширять сосудистую сеть). Исследования последних научных работ приходят к выводу, что главным стимулом ангиогенеза является дефицит кислорода, который вызывает гипоксию или ишемию, при этом HIF-1 содействует выразительности васкулярных факторов, а именно фактору роста внешнего сосудистого слоя VEGF и его нервных окончаний, который является основой регулирования роста сосудов в различных периодах развития организма [2]. Физиологический ангиогенез представлен реакцией адаптации к дефициту кислорода, поскольку VGEF считается стресс-индуцированным белком, регулируемый глюкозой и кислородом. Фактор роста индивидуально отбирает эндотелиальные клетки (ЭК) для активации их преобразования и передвижения. Увеличивает пропускаемость сосуда для прохода белков в периваскулярное пространство, необходимое для контролируемой миграции ЭК и развитию вазодилатации [3]. В этапе развития новой сети сосудов принимает участие проангиогенный фактор, который сдерживает эндотелиальную пролиферацию, снижает проницаемость сосуда и содействует притягиванию перикапиллярных клеток. Tie2 (тирозинкиназные рецепторы) играют ведущую роль в процессах роста, развития и дифференцировки клеток. Они вместе с ангиопоэтинами играют роль в корректировке сопряжения эндотелия с рядом лежащими клетками [4]. Для роста системы сосудов в эмбриональном периоде необходима система сигналов Tie/Ang, соединяемая с VEGF и его рецепторами, равно как и каскад сигнализации. Tie2/Ang1 является несамостоятельным, промотирующим ассоциацию перицитов и эндотелия, снижающим сосудистую проницаемость и обладающим противовоспалительной активностью каскадом сигнализации [5]. Ang1 помогает образовывать связь между перицитами и эндотелиальными клетками при связывании с экспрессируемым на поверхности клеток эндотелия рецептором Tie2, помогая стабилизации, находящегося в стадии развития сосудистой системы [6, 7]. 2. Тромбоцитарный ФР (PDGF), который привлекает перициты и ГМК. Это белок, синтезируемый в мегакариоцитах и находящийся в гранулах тромбоцита. Все элементы – это результат роста фактора около тысячи молекул тромбоцитов. Фактор – мощный стимул восстановления тканей. Рецепторы для этого находятся в стенке сосудов на поверхности фибробласта и клетках гладкой мускулатуры. PDGF активизирует пролиферацию таких клеток. Более того, PDGF усиливает выработку компонентов соединительной ткани (коллагена, гистамина и др.) [8]. 3. Трансформирующий ФР-β1 (TGF-β1) стимулирует синтез белков внеклеточной матрицы. Контролирующий пролиферацию полипептид (представитель цитокинов) в большинстве клеток также регулирует дифференциацию и другие функциональные особенности. Члены семейства TGF-β1 проявляют множественное воздействие на огромное количество видов клеток и способствуют контролю роста клеток, дифференциации и апоптоза, а также в модуляции иммунной системы [9]. Артериогенез способствует формированию коллатеральных сосудов из неактивных артериальных сетей, по которым кровь проходит в места замыкания. Главным катализатором такого процесса является увеличение напряжения сдвига выше места окклюзии, способствующего преобразованию молекул адгезии клетками эндотелия с последующей аккумуляцией моноцитов в стенке сосуда. Они секретируют функционирующие ФР, основными регуляторами артериогенеза являются фактор роста фибробластов (FGF), и PDGF, VEGF и CXC-хемокины (подсемейства, характеризующиеся наличием одной аминокислоты, которая разделяет N-концевые цистеины) [10]. Действия ангиогенеза контролируются ФР во временном пространстве, этот факт следует учесть во время терапевтического ангиогенеза. Стабильное состояние сосудистой сети в организме постнатального периода обеспечивается равноценным соотношением между активаторами ангиогенеза (в основном ФР и цитокинами) и его ингибиторами (тромбоспондином, ангиостатин, тумастин, эндостатином и др.), движение такого баланса в сторону активаторов, в большинстве случаев, непродолжительный, ведет за собой активацию ангиогенеза [11]. Примерами являются воспаление, заживление ран, ишемия.
Данный процесс и образование отростчатых сосудов проходит в несколько последовательных шагов. В первой фазе начинается активация перицитов, которые находятся в тесном контакте с эндотелием, они увеличиваются в объеме, укорачивая свои отростки. Таким образом, происходит ослабление межклеточных контактных соединений. Перициты проецируются в периваскулярное пространство, происходит деградация базальной мембраны и диссоциация перицитов и эндотелия [12]. Хотя процесс на начальных стадиях роста эндотелиоцитов в новообразованную васкуляризованную ткань может протекать без помощи перицитов, в последующей работе именно они локализуются по ходу прорастания эндотелия и формируют процессы, которыми направляются новообразованные сосуды [13]. Клетки эндотелиоциты берут начало своего роста в тканях по направлению Ang-1 продуцирующей ткани и, производя ферменты, катепсины и активаторы плазминогена, которые ведут к ухудшению базальной мембраны, так же матриксные металлопротеиназы (MMPs), являющиеся основными протеолитическими энзимами, принимающими участие в этом процессе. Внеклеточный матрикс, расщепляясь, формирует полипептиды, фрагменты этих белков имеют как про- так и антиангиогенные эффекты. Растворение белков внеклеточного матрикса проходит под контролем ингибиторов протеаз (UAP, PAI) [14]. При участии молекул клеточной адгезии и 17 интегринов, лигандами для которых служат белки внеклеточного матрикса (фибронектин, ламинин, витронектин), ослабление межклеточных контактных соединений эндотелиальных клеток и разрушение базальной мембраны дает начало далее следующему перемещению эндотелиальных клеток в околососудистый участок [15]. Клетки эндотелия начинают активно пролиферировать, сформировывая структуры в виде канала, далее преобразовываясь в зрелую сосудистую сеть. Некоторые сосуды микроциркуляторного русла объединяются в целостную сеть, посредством которой происходит перфузия тканей (рис. 1). До этого момента VEGF влияет на сохранение клеток эндотелия и их целостность [16].
Рис. 1. Этапы ангиогенеза
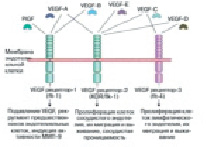
Момент подъема эндотелия сосудов. В процессе проницаемости сосудов лежит база регулировки А. VEGF – мощнейший индуктор ангиогенеза в целом ряде опытных моделей in vivo [17]. Он представляет собой гомодимерный, высокогликолизированный, митогенный белок, предназначенный для эндотелиальных клеток. Большинство ученых считают, что VEGF взаимодействует с цитокинами, которые имеют сенсоры с протеолитическими ферментами и растворимые антагонисты. Они, взаимодействуя, регулируют высвобождение цитокинов из внеклеточного матрикса [18]. Группа VEGF включает в себя ряд образцов: EGF-A способствует наращиванию проницаемости сосуда; VEGF-B регулирует спад внеклеточного матрикса, адгезии и клеточного передвижения; VEGF-C и VEGF-D играют главную роль в регуляции лимфатических кровеносных сосудов; так же VEGF-E является вирусным гомологом и способствует плацентарному подъему (PIGF). Он отвечает за построение сосудистой сети в плаценте (рис. 2).
Рис. 2. Семейство VEGF
Совместное взаимодействие VEGF с рецепторами VEGFR-2 подключает активацию всех имеющихся сигнальных путей каскада. Два таких примера показаны на рисунке. Такое взаимодействие приводит к выживанию клетки и проницаемости сосудов, путем поглощения генов, которые способствуют пролиферации и передвижению клеток эндотелия. К примеру, связывание VEGF с сенсором VEGFR-2 приводит к димеризации сенсора с дальнейшей активацией пути синтеза ДНК и подъема клеток PLC-PKC-Raf-MEK-митогенактивированной белковой киназы (MAPK), а еще дальнейшей инициацией синтеза ДНК и подъема клеток, за это время как активация фосфатидилинозита 3’-киназы (PI3K)-Akt-way обязана прирастить подъем эндотелиальных клеток. Передвижение клеток и изменения в цитоскелете актина вызывает ген Src. Рецепторы VEGF располагаются на поверхности эндотелиальной клетки, но не теряют способности стать внутриклеточными [19]. Они являются участниками процесса приспособления клетки для выживания. VEGFR-2 представлен полноразмерным сенсором, прикрепляющимся к плоскости клеточки. VEGF-CcVEGFR-3 связывание опосредует лимфангиогенез. VEGF имеет возможность вязать рецепторный нейропилин (NRP), который имеет возможность работать как coreceptor с VEGFR-2 (горизонтальная стрелка 1) и имеет возможность регулировать A [20]. Комбинированное внедрение VEGF в экспериментальных исследовательских работах, а еще фактора стабилизации сосудов ангиопоэтин-1, и тромбоцитов FR (PDGF-BB) в композиции с FGF-2 вызывает возникновение сосудистой сети, которая продолжает оставаться размеренной сквозь 1 год впоследствии остановки данных моментов [21, 22]. Иным раскладом к более равновесной стимуляции ангиогенеза, вполне вероятно, может быть создание генетических структур, основанных на консистенции геномной ДНК, а еще cDNA-форм гена VEGF, имеющие в для себя экзоны и интроны в иной области слияния. Другая стратегия имеет возможность основываться на применении генов, которые кодируют моменты, которые активируют поглощение множества ангиогенных молекул [23]. Фактором, обеспечивающим больше обобщенные сигналы ангиогенеза, имеет возможность быть активатор плазминогена наподобие урокиназы (urokinase) – протеаза серина, ведущей регулятор внеклеточного протеолиза, а еще моделирование тканей. Урокиназа инициирует составление капилляров и артериол и наращивает скопление макрофагов в зоне периинфаркции, сокращаяет величину возникших, увеличивает васкуляризацию, готовит более скорым восстановление перфузии и не позволяет развиваться некрозу в ишемической конечности [24].
Заключение
Дефицитность кровоснабжения приводит к гипоксии по причине понижения диффузии воздуха. Гипоксия считается более необходимым катализатором A, есть активация метаболических стезей, которые индуцируются белками, этими как момент гипоксии 1, собственно, что приводит к наращиванию экспрессии проангиогенных моментов, этих как моменты подъема VEGF и фибробластов [25]. Впоследствии подключения А случается перелом соединительнотканной пластинки и внеклеточного матрикса (ВКМ), вследствие увеличенной энергичности матрикса. Далее клетки организуются в канальцы, с просветами образуя свежую капиллярную металлопротеиназу (ММП). Во время сего процесса притягиваются перициты, которые прикрепляются к свежим кровеносным сосудам и стабилизируются. До сего этапа созревания единство и выживание эндотелиальных клеток находятся в зависимости от VEGF1.13. Другой методикой экспрессии считается втягивание воспалительных клеток, цитокинов ФНО (фактор некроза α-опухолей) и ИЛ-1, которые в собственную очередь индуцируют продукцию обычных клеток. Подъем микрососудов продолжается до тех пор, пока же не достигнется очень максимально вероятная близость к клеточке. Впоследствии А. перебегает в стадию спокойствия (в дамской репродуктивной системе ангиогенный цикл считается исключением). Каждое наращивание массы ткани сопрягается с уноваскуляризацией, которая поддерживает необходимую плотность сосудов. Например, А. индуцируется, когда метаболическая надобность выше перфузионную дееспособность имеющих место быть сосудов. По-видимому, устройство данной адаптивной реакции заключается в том, собственно, что условный недостаток воздуха приводит к ужесточению ангиогенных стимулов.