Антагонист серотониновых рецепторов что это
Нейромолекулы: серотониновые рецепторы
Долго у нас не было новых текстов из серии «нейромолекулы». Однако – свершилось. Мы писали много и охотно про нейромедиаторы, «ключах» к дверям синапсов. Однако до сих пор не было ни одной полноценной статьи о «замках» – их рецепторах. Исправляемся, и представляем вашему вниманию большой текст о рецепторах серотонина.
Рис. 1. Химическая формула серотонина (5-гидрокситриптамина)
Основные принципы работы клеточных рецепторов
По принципу действия клеточные рецепторы можно подразделить на две группы: ионотропные и метаботропные. Ионотропные рецепторы, по сути, представляют собой ионные каналы, которые могут открываться или закрываться при связывании с лигандом (то есть небольшой молекулой, которая специфично взаимодействует с рецептором, вызывая изменения в его конформации). Таким образом, ионотропные рецепторы при взаимодействии с лигандом изменяют мембранный потенциал клетки. Метаботропные рецепторы действуют более хитро. После связывания с лигандом они взаимодействуют с особыми мембранными белками — G-белками. Через G-белки опосредованно действуют множество регуляторных молекул организма, например, многие нейромедиаторы и гормоны. Молекулярная биология работы G-белков изучена достаточно подробно и очень сложна, поэтому мы остановимся лишь на некоторых аспектах. G-белки, активированные при взаимодействии с рецептором, запускают внутриклеточные сигнальные каскады, которые, в конечном итоге, изменяют экспрессию генов-мишеней. Источником энергии для G-белков является гуанозинтрифосфат (ГТФ) – молекула, очень похожая на АТФ, но имеющая гуанозин вместо аденозина. В активированном состоянии G-белок связан с ГТФ, однако в процессе работы он гидролизует ГТФ с образованием гуанозиндифосфата (ГДФ) и выключается. В большинстве случаев, после активации G-белки взаимодействуют с одним из двух ферментов: аденилатциклазой или фосфолипазой С. Аденилатциклаза занимается образованием молекул циклического аденозинмонофосфата (цАМФ) – важного вторичного посредника, через который сигнал передаётся дальше вглубь клетки (рис. 1). Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитол-4,5-бисфосфат на два вторичных посредника: диацилгрицерин (DAG), который остаётся в мембране, и инозитол-1,4,5-трисфосфат (IP3), который уходит вглубь клетки, передавая сигнал на всё более высокие уровни.
Рис.2. Схема передачи сигнала через серотониновый рецептор. После связывания серотонина с рецептором происходит активация G-белка, под действием которого аденилаткциклаза превращает АТФ во вторичный посредник – цАМФ. Далее сигнал передаётся вглубь клетки, в конечном счёте приводя к изменению экспрессии генов-мишеней. Источник: http://neuronovosti.ru/neuronbank.org/wiki
Помимо природного лиганда, активирующего рецептор, с рецептором может взаимодействовать множество веществ самой разной природы. Вещества, которые при связывании блокируют работу рецептора, называют антагонистами. Агонисты, как и естественный лиганд, активируют рецептор, причём некоторые из них (обратные антагонисты) изменяют действие рецептора на противоположное.
По месту расположения рецепторов относительно синаптической щели выделяют пресинаптические и постсинаптические рецепторы. Иногда пресинаптические рецепторы ведут себя как постсинаптические, то есть возбуждаются нейромедиаторами, которые выделяет тот же нейрон, на котором находятся эти рецепторы. Такие рецепторы называют ауторецепторами.
Мы разные – в этом наше богатство
Среди рецепторов серотонина есть как ионотропные, так и метаботропные, которые могут действовать как на аденилатциклазу, так и на фосфолипазу С. В наиболее распространённой в настоящее время классификации серотониновых рецепторов (деление на семь семейств) учитываются последовательности и структуры генов и белков, фармакологические свойства и способы дальнейшей передачи сигнала. Дополнительное разнообразие серотониновых рецепторов обеспечивается альтернативным сплайсингом и редактированием их мРНК. В таблице ниже представлены основные свойства разных семейств рецепторов серотонина.
| Семейство | Эффект | Тип | Механизм действия |
| 5-HT1 | Тормозящий | Метаботропный (аденилатциклаза) | Понижение внутриклеточной концентрации цАМФ |
| 5-HT2 | Возбуждающий | Метаботропный (фосфолипаза С) | Повышает внутриклеточную концентрацию IP3 и DAG |
| 5-HT3 | Возбуждающий | Ионотропный Na+/K+-канал | Деполяризация клеточной мембраны |
| 5-HT4 | Возбуждающий | Метаботропный (аденилатциклаза) | Повышение внутриклеточной концентрации цАМФ |
| 5-HT5 | Тормозящий | Метаботропный (аденилатциклаза) | Понижение внутриклеточной концентрации цАМФ |
| 5-HT6 | Возбуждающий | Метаботропный (аденилатциклаза) | Повышение внутриклеточной концентрации цАМФ |
| 5-HT7 | Возбуждающий | Метаботропный (аденилатциклаза) | Повышение внутриклеточной концентрации цАМФ |
Рецепторы серотонина нередко взаимодействуют друг с другом, формируя гетероолигомеры, а также с рецепторами других нейромедиаторов, например, ГАМК [7].
С чем может быть связано такое исключительное разнообразие рецепторов? Серотонин – одна из древнейших сигнальных молекул и, вероятно, его рецепторы прошли свой непростой эволюционный путь уже после того, как они приобрели способность связываться с серотонином. Рецепторы менялись – как структурно, так и функционально, но, несмотря на перемены, они сохраняли способность связываться с серотонином и изменять конформацию при взаимодействии с ним [6].
Ниже мы подробно рассмотрим каждое семейство серотониновых рецепторов.
5-HT1
В этом семействе выделяют пять подтипов: 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E и 5-HT1F. Практически все они подавляют работу аденилатциклазы, приводя к понижению уровня цАМФ в клетке. Любопытно, что в генах всех пяти подтипов рецепторов полностью отсутствуют интроны, что крайне редко встречается среди генов позвоночных [4] [6].
Наиболее многочисленны рецепторы подтипа 5-HT1A. В N-концевой части молекулы этих рецепторов, находящейся вне клетки, имеются два однонуклеотидных полиморфизма. Один из них ассоциирован с редким нервно-психическим расстройством, известным как синдром Туретта, а второй приводит к утрате чувствительности к серотонину. В центральной нервной системе они обнаруживаются в коре больших полушарий, гиппокампе, прозрачной перегородке, миндалине и ядрах шва, кроме того, небольшие их количества найдены в таламусе и базальных ганглиях. Вне ЦНС они обнаруживаются у нейронов, иннервирующих пищеварительный тракт [4] [6].
Рецепторы 5-HT1A функционируют как ауторецепторы и постсинаптические рецепторы. Они участвуют в регуляции поведения (в том числе пищевого), а также задействованы в развитии тревожности. Фармакологи активно исследуют возможность применения антагонистов этих рецепторов в лечении депрессии и тревожности [4].
Рецепторы 5-HT1B выявляются в ЦНС, где они опосредуют пресинаптическое ингибирование. Они влияют преимущественно на поведение, хотя имеются сведения, что они также регулируют сужение и расширение кровеносных сосудов. С рецепторами этого подтипа взаимодействует эрготамин – алкалоид спорыньи, который действует на них как агонист. Наибольшие количества этих рецепторов обнаруживаются в базальных ганглиях, полосатом теле и фронтальной коре. Функции 5-HT1B-рецепторов зависят от их локализации. В коре они подавляют высвобождение дофамина, а в полосатом теле и базальных ганглиях они функционируют как ауторецепторы и блокируют высвобождение серотонина. Показана их роль в контроле выделения других нейромедиаторов, таких как ацетилхолин, глутамат, дофамин, норадреналин и ГАМК [4]. Любопытно, что при блокировании рецепторов 5-HT1B происходит увеличение количества остеобластов, костной массы и скорости роста костей [8]. Мыши, у которых ген 5-HT1B был выключен, отличаются агрессивностью и тягой к алкоголю [9].
5-HT1D-рецепторы экспрессируются на очень низком уровне. Они функционируют как ауторецепторы в латеральных ядрах шва, однако они также были найдены в сердце, где контролируют выделение серотонина. Рецепторы, находящиеся в ЦНС, участвуют в регуляции движения и тревожности, кроме того, они вызывают сужение сосудов в мозге. Клиническое значение этих рецепторов ещё практически не исследовано. Существуют, однако, лекарства от мигрени, действующие на рецепторы 5-HT1B и5-HT1D [4]. В отличие от рецепторов 5-HT1B, на 5-HT1D эрготамин действует как антагонист.
Рецепторы 5-HT1E практически не исследованы, так как учёные пока не располагают методами очистки, фармакологическими инструментами и животными моделями, которые подходили бы для их изучения. Известно, однако, что гены этих рецепторов одинаковы у разных людей и практически не содержат однонуклеотидных полиморфизмов, поэтому, вероятно, они играют какую-то важную физиологическую роль, пока ещё нам не известную [4].
Рецепторы 5-HT1F представлены в мозге весьма ограниченно, однако они были обнаружены в матке и коронарных артериях. Вероятнее всего, эти рецепторы подавляют аденилатциклазу, однако детального исследования их функций ещё не проводилось [4].
5-HT2
Семейство 5-HT2 серотониновых рецепторов делится на три подтипа: 5-HT2A, 5-HT2B и 5-HT2C (рис. 3). Они представляют собой метаботропные рецепторы, действующие на фосфолипазу С и приводящие к усилению гидролиза фосфатидилинозитол-4,5-бисфосфата и повышению внутриклеточной концентрации кальция. Рецепторы этого семейства – важнейшие возбуждающие серотониновые рецепторы, хотя рецепторы 5-HT2A могут обладать тормозящим действием в некоторых зонах коры больших полушарий [4].
Рецепторы 5-HT2A экспрессируются в самых разных тканях и органах. В частности, они участвуют в сокращении гладких мышц. В ЦНС этот подтип представлен в основном в коре, ограде и базальных ганглиях. При активации 5-HT2A усиливается секреция ряда гормонов, в числе которых АКТГ, кортикостерон, окситоцин, ренин и пролактин, а ингибирование этих рецепторов сказывается на поведении. Разнообразные антагонисты 5-HT2A (например, популярный нейролептик кветиапин) используются или рассматриваются как потенциальные препараты, показанные при шизофрении. Наряду с 5-HT2C, 5-HT2A играют важнейшую роль в поведенческом ответе на галлюциногены [4]. Интересно, что рецепторы 5-HT2A, по-видимому, необходимы для проникновения внутрь клеток вируса Джона Каннингема. Этот вирус проникает в олигодендроциты, астроциты, B-лимфоциты и клетки почечного эпителия, вызывая прогрессирующую мультифокальную лейкоэнцефалопатию [10].
Активация 5-HT2B приводит к сокращению гладкой мускулатуры верхней части желудка. Эти рецепторы обнаружены в мозжечке, латеральной прозрачной перегородке, гипоталамусе и средней части миндалины. Антагонисты 5-HT2B только начинают разрабатываться и, возможно, они найдут применение в лечении и предотвращении мигрени. Есть сведения, что рецепторы этого типа каким-то образом задействованы в регенерации печени [4].
Функции рецепторов 5-HT2C исследованы мало из-за отсутствия селективных лигандов. Антагонист 5-HT2C, известный как агомелатин, является эффективным антидепрессантом, так как повышает уровни дофамина и норадреналина в некоторых отделах мозга. Флуоксетин неспецифично стимулирует рецепторы 5-HT2C за счёт повышения концентрации серотонина в синапсе. Некоторые атипичные антипсихотические препараты частично блокируют эти рецепторы [4]. Ген 5-HT2C располагается на X-хромосоме, которая у мужчин имеется в единственном варианте, а у женщин в каждой клетке одна из двух Х-хромосом инактивируется случайным образом, поэтому влияние однонуклеотидных полиморфизмов в этом гене на структуру и функции белка может быть различным.
5-HT3
Рис. 4. Пространственная структура 5-HT3 рецептора мыши, вид сверху. Разные субъединицы покрашены разными цветами. В центре канала видна пора. Структура получена методом криоэлектронной микроскопии. Изображение из Protein Data Bank (PDB ID: 6BE1)
5-HT4
Известно семь подтипов рецепторов этого семейства (5-HT4A-H), которые различаются своими С-концевыми частями. Тем не менее, все эти рецепторы фармакологически схожи и действуют на аденилатциклазу. Рецепторы 5-HT4 проявляют фоновую активность даже в отсутствие лиганда (то есть серотонина). Из-за этой особенности оценивать эффекты агонистов и антагонистов 5-HT4 очень непросто. Некоторые подтипы демонстрируют тканеспецифичность, например, 5-HT4D встречается только в кишечнике. Ряд подтипов влияет не только на аденилатциклазу, но также на калиевые каналы и потенциалзависимые кальциевые каналы. Функции 5-HT4-рецепторов очень разнообразны. Они влияют на моторику кишечника, сердечные сокращения, в ЦНС регулируют высвобождение серотонина и других нейромедиаторов (ацетилхолина, дофамина и ГАМК), а также усиливают синаптическую передачу, что может сказываться на работе памяти. Один из агонистов 5-HT4-рецепторов, цисаприд, некоторое время использовался в клинической практике для усиления моторики кишечника, но в настоящий момент его не применяют из-за негативного влияния на сердце. Частичный агонист этих рецепторов, тегасерод, начинают использовать как симптоматическое средство при раздражении толстой кишки. Разнообразные селективные лиганды рецепторов 5-HT4 рассматривают как потенциальные средства, эффективные при лечении самых разных заболеваний – артмий, нейродегенеративных заболеваний, недержании мочи. Однако использование сильных и высокоспецифичных агонистов 5-HT4-рецепторов сильно ограничено выраженными побочными эффектами на сердечно-сосудистую систему [4].
5-HT5
У грызунов имеется два подтипа рецепторов этого семейства: 5-HT5A и 5-HT5B. У человека, однако, в гене 5-HT5B имеется преждевременный стоп-кодон, делающий ген нефункциональным, поэтому в мозге человека экспрессируется только подтип 5-HT5A. Фармакологические особенности этих рецепторов практически не изучены. На основании локализации этих рецепторов в различных отделах мозга предполагается, что они могут участвовать в контроле движений и питания, развитии тревожности и депрессии, обучении, консолидации памяти, адаптивном поведении и развитии мозга. Они также могут быть задействованы в регуляции нейронами работы астроцитов. Нарушение этих взаимодействий наблюдается при ряде серьёзных патологий ЦНС, например, при болезни Альцгеймера, а также у больных синдромом Дауна [4].
5-HT6
У человека описаны два варианта рецептора 5-HT6. Первый подтип располагается преимущественно в лимбической и экстрапирамидной зонах коры, а второй – в хвостатом ядре и чёрной субстанции. Клиническое значение этих рецепторов до конца неясно. Возможно, они каким-то образом опосредуют действие некоторых антидепрессантов и антипсихотических препаратов. Имеются свидетельства их участия в холинергической передаче сигнала [4]. Антагонисты 5-HT6-рецепторов могут использоваться для лечения депрессии и нарушений памяти, а также ожирения, поскольку они уменьшают аппетит и вызывают снижение массы тела [11] [12].
5-HT7
У человека рецепторы 5-HT7 представлены несколькими изоформами (5-HT7A-D) и активируют аденилатциклазу, а также MAP-киназу. В центральной нервной системе 5-HT7-рецепторы наиболее многочисленны в таламусе, гипоталамусе, гиппокампе и коре. Эти рецепторы также обильно экспрессируются в сосудах и, по-видимому, участвуют в их расширении. Рецепторы 5-HT7 задействованы в регуляции сна, циркадных ритмах, обучении и памяти [13]. При остром (но не хроническом) стрессе количество 5-HT7-рецепторов увеличивается, а при длительном приёме антидепрессантов, напротив, уменьшается. Антагонисты этих рецепторов могут быть полезны при лечении депрессии и расстройств сна [4].
Мы вместе – в этом наша сила
Из описанного выше колоссального разнообразия серотониновых рецепторов может показаться, что их ничего не объединяет, кроме сродства к серотонину. По счастью (особенно для фармакологов), это совершенно не так. Почти все серотониновые рецепторы – метаботропные и почти все активируют аденилатциклазу. Таким образом, нисходящие эффекты у них принципиально похожи. Кроме того, структуры многих из них очень похожи – не только у рецепторов одного семейства, но и у рецепторов разных семейств. Благодаря этому существует немало соединений, неспецифичных в отношении серотониновых рецепторов и взаимодействующих почти со всеми из них. Скорее, специфичные агонисты и антагонисты серотониновых рецепторов – большая редкость.
Действие большинства антидепрессантов так или иначе связано с серотонином, и многие из них взаимодействуют с серотониновыми рецепторами с разной степенью сродства. Некоторые антидепрессанты связываются только с одним видом серотониновых рецепторов. Например, первый нетрициклический антидепрессант – тразодон – из всех серотониновых рецепторов взаимодействует только с 5-HT2А, действуя на него как агонист [2]. Однако гораздо чаще мишенями антидепрессантов являются разные серотониновые рецепторы. Так, амитриптилин – один из наиболее сильнодействующих антидепрессантов, введённый в клиническую практику ещё в 1961 году, — является антагонистом или агонистом рецепторов 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 и 5-HT7 [3]. Даже самые современные препараты бывают неспецифичны в отношении серотониновых рецепторов. Например, вортиоксетин, который был одобрен для клинического применения всего лишь в 2013 году в США и в 2014 году в Европе, действует как агонист рецепторов 5-HT1A, частичный агонист 5-HT1B и антагонист 5-HT1D, 5-HT3 и 5-HT7 [1].
В заключение можно отметить, что, хотя в наших знаниях относительно серотониновых рецепторов много белых пятен, многие препараты, применяющиеся в психиатрии, взаимодействуют с различными серотониновыми рецепторами – иногда блокируя их работу, иногда усиливая, а иногда вообще меняя их эффект на противоположный. Разработка новых, высокоспецифичных препаратов, обладающих малыми побочными эффектами, — безусловно, важнейшее направление в современной фармакологии, поэтому и детальное изучение серотониновых рецепторов сейчас важно как никогда.
Распространение серотониновых рецепторов в органическом мире
По-видимому, серотонин стал использоваться живыми организмами в качестве сигнальной молекулы очень давно, и его рецепторы обнаруживаются не только у позвоночных и других животных, но даже у растений и грибов [6].
Вероятнее всего, первые серотониновые рецепторы появились 700-800 миллионов лет назад у одноклеточных эукариот вроде инфузории-туфельки. От предковых рецепторов первыми отделились семейства 5-HT1, 5-HT2 и 5-HT6 примерно 750 миллионов лет назад. Рецепторы этих семейств имеются у самых разных животных: от червей (планарий и нематод) до насекомых и позвоночных. 650-700 миллионов лет назад от 5-HT1 отделились два других семейства: 5-HT5 и 5-HT7. Таким образом, большая часть эволюционного пути серотониновых рецепторов произошла ещё до разделения животных на первичноротых и вторичноротых (600-650 миллионов лет назад), поэтому значительная доля серотониновых рецепторов у всех животных примерно одинакова. Однако после расхождения первичноротых и вторичноротых эволюция серотониновых рецепторов в виде дупликаций генов и их дальнейшей специализации продолжилась независимо у этих двух групп животных [6].
Антагонист серотониновых рецепторов что это
Успешное лечение депрессии началось с появлением в 30-е годы электросудорожной терапии. Затем к этому методу добавилась фармакотерапия: в 50-е годы — гетероциклическими антидепрессантами и ингибиторами моноаминоксидазы, в 60-е годы — литием, а в 70-е годы — стабилизирующим настроение противосудорожным средством карбамазепином.
Чтобы ослабить побочные эффекты (например, сухость в носоглотке, запор, электрическую нестабильность миокарда, обмороки, седатацию), были разработаны вещества, повышающие концентрацию серотонина (5-гидрокситриптамина [5-НТ]) в соответствующих синапсах, в том числе флуоксетин.
Вслед за ним быстро появились флувоксамин и сертралин, а затем ряд агонистов и антагонистов серотониновых (5-НТ) рецепторов. Выяснилось, что эти рецепторы делятся на различные типы и подтипы со специфическими функциями.
Серотонин, или 5-НТ, является регуляторным нейромедиатором, приводящим главным образом к тормозным эффектам. Он синтезируется из L-триптофана, который проникает через гематоэнцефалический барьер (сам серотонин к этому не способен), поглощается клетками центральной нервной системы и в них превращается в 5-гидрокситриптамин, т. е. 5-НТ.
Тела нейронов серотонинергической системы расположены прежде всего в шве, или области срединной линии, ствола головного мозга. Они образуют самую крупную сеть с единым нейромедиатором в головном мозге млекопитающих.
Типы серотониновых рецепторов
Известно 4 главных типа серотониновых рецепторов: 5-НТ1, 5-НТ2, 5-НТ3 и 5-НТ4. Первый тип делится на подтипы А, В, С, D и Е, а второй — на подтипы А и В. Рецепторы 5-НТ3 локализованы как в периферической, так и в центральной нервной системе. Антагонисты периферических 5-НТ3-рецепторов, например ондансетрон, гранисетрон и закоприд, применяются для лечения тошноты и рвоты.
Избирательные ингибиторы поглощения серотонина не связываются с какими-либо его специфическими рецепторами, но обеспечивают антидепрессивный эффект, селективно блокируя обратное поглощение этого нейромедиатора пресинаптическими окончаниями, из которых он выделился.

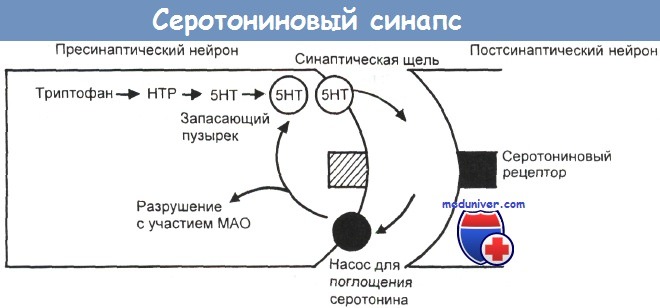
Серотонин (5-НТ), синтезируемый из триптофана через гидрокситриптофан (НТР), выделяется из пресинаптического нейрона в синаптическую щель.
Попав туда, его молекулы либо действуют на постсинаптический рецептор, обусловливая нервную передачу, либо возвращаются в пресинаптическую клетку с помощью поглощающего механизма насосного типа.
Вернувшись в пресинаптический нейрон, серотонин либо вновь запасается в синаптических пузырьках для будущего высвобождения, либо разлагается моноаминоксидазой (МАО). 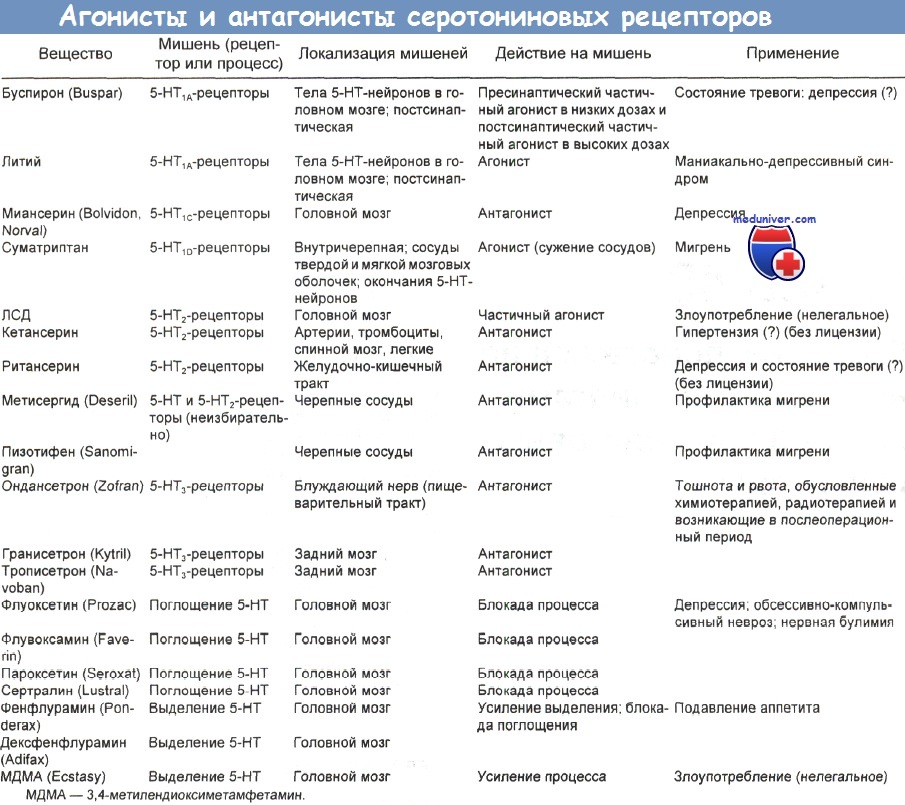
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Антагонист серотониновых рецепторов что это
Клиника психиатрии им. С.С. Корсакова; кафедра психиатрии и медицинской психологии Московской медицинской академии им. И.М. Сеченова
Мультимодальные серотонинергические антидепрессанты
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(9): 103-111
Данилов Д. С. Мультимодальные серотонинергические антидепрессанты. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(9):103-111.
Danilov D S. Multimodal serotonergic antidepressants. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2017;117(9):103-111.
https://doi.org/10.17116/jnevro201711791103-111
Клиника психиатрии им. С.С. Корсакова; кафедра психиатрии и медицинской психологии Московской медицинской академии им. И.М. Сеченова
В предлагаемой лекции на основе данных литературы представлена история создания селективных серотонинергических антидепрессантов, ингибирующих обратный захват серотонина и действующих на серотониновые рецепторы. Подробно анализируется история изучения нейрохимической активности и эволюции классификации этих средств. Обоснована рациональность отнесения всех представителей рассматриваемых антидепрессантов (тразодон, этоперидон, нефазодон, вилазодон, вортиоксетин) в единую группу мультимодальных серотонинергических антидепрессантов и целесообразность ее выделения в современной нейрохимической классификации психотропных средств.
Клиника психиатрии им. С.С. Корсакова; кафедра психиатрии и медицинской психологии Московской медицинской академии им. И.М. Сеченова
Широкой аудитории специалистов знакомы такие традиционно выделяемые группы серотонинергических антидепрессантов, как селективные ингибиторы обратного захвата серотонина (СИОЗС) (флуоксетин, циталопрам, пароксетин и др.), блокаторы серотониновых 5НТ2-рецепторов (тразодон, нефазодон) и селективные стимуляторы обратного захвата серотонина (тианептин, механизм действия которого, вероятно, далеко выходит за рамки серотонинергической активности).
В последнее время в клиническую практику были введены новые представители селективных серотонинергических антидепрессантов (вилазодон, вортиоксетин). Их нейрохимическую активность нельзя объяснить только влиянием на обратный захват серотонина или блокадой серотониновых 5НТ2-рецепторов. Получены данные об их сложном полифункциональном механизме действия. Отдельные представители этих препаратов все чаще обозначаются термином «мультифункциональные антидепрессанты». Семантика такого понятия подразумевает, что нейрохимическая активность этих средств должна сочетать в себе, по крайней мере, два нейрохимических дополняющих друг друга механизма в плане повышения эффективности или улучшения переносимости лечения.
Наиболее часто характеристика «мультимодальный антидепрессант» используется при описании действия вортиоксетина. Поэтому у части психиатров сложилось впечатление об уникальности его нейрохимической активности, а значит, и клинических эффектов. Однако анализ истории создания и изучения механизма действия целого ряда серотонинергических антидепрессантов свидетельствует об ошибочности такого мнения. Экскурс в историю доказывает, что сходной нейрохимической активностью обладают другие антидепрессанты. Этот факт ставит вопрос о правомерности выделения в современной классификации антидепрессантов группы «серотонинергические антидепрессанты мультимодального действия» и включения в нее не только новых, но и некоторых старых, хорошо известных серотонинергических средств.
Создание первых серотонинергических антидепрессантов (тразодон и этоперидон) и начало изучения их нейрохимической активности (60—70-е годы XX века)
История селективных серотонинергических антидепрессантов начала свой отсчет в 1966 г., когда психофармакологи итальянской фармацевтической компании «Angelini» во главе с B. Silvestrini создали фенилпиперазиновый антидепрессант тразодон [1]. Предполагалось, что депрессия ассоциирована с уменьшением болевого порога, а применение некоторых средств, повышающих его, должно приводить к развитию антидепрессивного эффекта. В 1971 г. тразодон стал применяться в Италии. В течение следующих 10 лет он стал использоваться в других европейских странах и был зарегистрирован в СССР [2].
В 1976 г. в Европе был зарегистрирован еще один антидепрессант из группы фенилпиперазинов — этоперидон, также созданный сотрудниками компании «Angelini». В отличие от тразодона, этоперидон широко не использовался в практике, хотя некоторое время включался в классификации антидепрессантов. Еще одним фенилпиперазиновым соединением, которое производилось немецкой фармацевтической компанией «Merck KGaA», был мепипразол. Первые сообщения о его эффективности появились в 1970 г. [3]. Однако считалось, что основное действие мепипразола связано с ослаблением тревоги, а не депрессивного аффекта.
В течение 10 лет нейрохимический субстрат антидепрессивного действия тразодона оставался не установленным. Данные о его влиянии на серотонинергическую систему были получены только в 1976 г., когда итальянские исследователи E. Stefanini и соавт. [4] выявили способность тразодона блокировать обратный захват серотонина. Было показано, что он ингибирует обратный захват серотонина в несколько сотен раз сильнее, чем захват норадреналина и дофамина, т. е. обладает селективным серотонинергическим действием. В 1976 г. появились данные о влиянии на серотонинергическую систему этоперидона [5] и было показано [6, 7], что таким же эффектом обладает метаболит тразодона и этоперидона мета—хлорфенилпиперазин (meta—сhlorophenylpiperazine — m-CPP). Причем оказалось, что он блокирует обратный захват серотонина в несколько раз сильнее, чем тразодон.
Открытие серотонинергической активности тразодона, этоперидона и m-CPP в 70-е годы соответствовало сформулированной в 1969 г. И.П. Лапиным и Г.Я. Оксенкругом серотонинергической теории патогенеза депрессии. Ее развитие обусловило появление в разных странах целенаправленных исследований по созданию антидепрессантов, обладающих серотонинергической активностью — СИОЗС. Они увенчались успехом в 1974 г. созданием флуоксетина. Но первым появившимся в клинической практике серотонинергическим антидепрессантом по праву можно считать тразодон.
Несмотря на популярность мнения о связи антидепрессивной активности тразодона с ингибированием обратного захвата серотонина, уже во второй половине 70-х годов европейские исследователи установили, что этот его эффект выражен гораздо слабее, чем аналогичная способность трициклических антидепрессантов (ТЦА) и флуоксетина [7], что было подтверждено и исследователями в США [8]. В этих исследованиях участвовали сотрудники одного из подразделений американской фармацевтической компании «Bristol-Myers», коллектив которой в это время приступал к созданию новых фенилпиперазиновых антидепрессантов.
Наряду с мнением о способности тразодона блокировать обратный захват серотонина, т. е. об усилении активности серотонинергической системы, в конце 70-х годов появились противоположные данные о его антисеротонинергическом действии. Тразодон даже называли «антисеротонинергическим средством». Было установлено, что однократное и постоянное введение тразодона устраняет поведенческие эффекты веществ, обладающих серотонинстимулирующим действием. Исходя из этого наблюдения впервые была выдвинута гипотеза о способности тразодона блокировать постсинаптические серотониновые 5НТ2-рецепторы [9]. После усовершенствования технологии изучения процесса связывания рецепторов с лигандами она была доказана.
Синтез нефазодона, появление первых доказательств влияния производных фенилпиперазина на серотониновые рецепторы и создание литоксетина (80-е годы XX века)
В конце 70-х — начале 80-х годов начался новый этап развития психофармакологии антидепрессантов — производных фенилпиперазина. В этот период клинические эффекты тразодона привлекли внимание исследователей в США. В результате в 1981 г. тразодон был разрешен для применения в США и стал первым антидепрессантом второго поколения, введенным в практику в этой стране. За год до этого события сотрудники фармацевтической компании «Bristol-Myers», усовершенствовав молекулу тразодона, синтезировали новый фенилпиперазиновый антидепрессант нефазодон. Период его испытаний длился около 15 лет, и в 1994—1996 гг. он был одобрен для применения в клинической практике.
Одновременно с созданием нефазодона появились первые доказательства того, что тразодон является антагонистом 5НТ2-рецепторов [10, 11]. В одном из экспериментальных исследований было установлено, что тразодон, m-CPP и миансерин обладают очень высоким и сопоставимым сродством к 5НТ2-рецепторам сосудистой стенки [11]. Эти находки стали прямым подтверждением косвенных свидетельств антисеротонинергической активности тразодона, полученных в 70-е годы. Во второй половине 80-х годов появились сообщения о способности нефазодона блокировать 5HT2-рецепторы [12].
Во второй половине 70-х годов американские и японские исследователи сформулировали новую теорию, объясняющую патогенез развития депрессии гиперсенситизацией постсинаптических 5НТ-рецепторов вследствие снижения концентрации серотонина в синаптической щели. Поэтому открытие у тразодона и нефазодона способности блокировать 5НТ2-рецепторы привело к появлению точки зрения, согласно которой именно такой их эффект приводит к развитию антидепрессивного действия [9]. В середине 80-х годов это мнение было подкреплено данными о том, что тразодон слабо воздействует на обратный захват серотонина, но является антагонистом 5НТ-рецепторов [13].
Наряду с данными о способности тразодона ингибировать обратный захват серотонина и блокировать 5НТ-рецепторы постепенно распространилось мнение о дозозависимости этих эффектов. В конце 70-х годов было показано, что использование невысоких доз тразодона ослабляет эффекты стимуляторов серотонинергической системы, а использование его высоких доз усиливает серотонининдуцированные двигательные феномены. В результате был сделан вывод, что при использовании в невысоких дозах тразодон проявляет свойства антагониста серотонинергической системы, а в высоких дозах (так же как m-CPP) обладает свойствами ее агониста [14]. Некоторые авторы акцентировали внимание, что при использовании высоких доз тразодона происходит одновременное ингибирование обратного захвата серотонина и 5НТ-рецепторов. В начале 90-х годов появились данные о том, что нефазодон ингибирует обратный захват серотонина и блокирует 5НТ-рецепторы, а его длительное применение сопровождается снижением плотности их кортикального пула [15].
В конце 80-х годов было установлено, что тразодон и m-CPP, в отличие от имипрамина и миансерина, обладают селективной серотонинергической активностью [16]. В этот период механизм действия тразодона стал объектом изучения и в СССР. Сотрудники Всесоюзного научного центра психического здоровья АМН СССР при сравнении нейрохимической активности тразодона и имипрамина установили, что серотонинергическое действие обоих антидепрессантов реализуется через различные механизмы, а при изучении механизма действия комбинаций тразодона и имипрамина, зимелидина (представитель группы СИОЗС) и имипрамина показали, что зимелидин и имипрамин конкурентно воздействуют на одни и те же звенья серотонинергической системы, тогда как тразодон и имипрамин — на различные ее звенья.
Вскоре после создания нефазодона в США в 1980 г. специалисты французской фармацевтической компании «Synthelabo» синтезировали соединение, получившее название литоксетин. Первые сообщения о нем появились в периодической печати во второй половине 80-х годов. Литоксетин разрабатывался как антидепрессант, ингибирующий обратный захват серотонина. Однако оказалось, что одновременно с этой способностью он блокирует серотониновые 5НТ3-рецепторы. Хотя в клинической практике литоксетин никогда не использовался, его можно считать прототипом антидепрессантов, одновременно блокирующих обратный захват серотонина и 5НТ3-рецепторы. В настоящее время применение таких средств считается перспективным направлением психофармакотерапии депрессии.
Первые попытки определения положения производных фенилпиперазина в классификации антидепрессантов (70—90-е годы XX века)
Поскольку тразодон не является трициклическим соединением, а механизм его действия не связан с ингибированием моноамикоксидазы (МАО), его нельзя было причислить к двум основным группам антидепрессантов, применявшихся в 70—80-е годы, — ТЦА и ингибиторы МАО (ИМАО). В тот период также не было весомого основания для выделения тразодона в группу селективных серотонинергических антидепрессантов, поскольку в течение 10 лет (с момента введения тразодона в практику и до момента начала использования первых СИОЗС зимелидина и индалпина) он был единственным их представителем, доступным для применения. Такое выделение произошло позднее.
При классификации антидепрессантов в 70—90-е годы тразодон и нефазодон обычно относились к группам антидепрессантов второго поколения или атипичных антидепрессантов. В эти группы объединялись средства разной химической структуры (но не ТЦА) и разного механизма действия (но не ИМАО). Некоторые исследователи выделяли нефазодон (вместе с венлафаксином) в группу антидепрессантов четвертого поколения, а тразодон — в группу антидепрессантов второго поколения [17]. Такое классификационное деление вряд ли имело практическое значение, а отражало лишь хронологию истории создания и введения в практику новых антидепрессантов.
Хотя в 80—90-е годы при характеристике строения молекул тразодона, этоперидона и нефазодона нередко указывалось, что они являются производными фенилпиперазина, их объединение в одну группу антидепрессантов на основании сходства химической структуры (подобно ТЦА) происходило казуистически редко. В доступной литературе обнаруживается лишь единственный источник, датированный 1994 г., в котором такое объединение было проведено [18]. Иногда на основании особенностей химического строения тразодон относился к группе бициклических антидепрессантов или объединялся с другими антидепрессантами в обширную и разнородную группу моно-, би-, тетра- и гетероциклических антидепрессантов.
Сразу после начала использования в клинической практике зимелидина и индалпина в 1982—1983 гг. тразодон был объединен с ними в группу СИОЗС [19]. Установление в конце 80-х годов способности нефазодона ингибировать обратный захват серотонина также позволило причислить его к группе СИОЗС [20]. Однако доказательства слабого влияния (по сравнению с СИОЗС, большинством ТЦА и венлафаксином) производных фенилпиперазина на обратный захват серотонина, полученные в 90-е годы, поставили под сомнение правомерность такого классификационного подхода.
Появление новой классификационной рубрики «блокаторы 5НТ2-рецепторов» и детализация данных о влиянии тразодона и нефазодона на этот тип серотониновых рецепторов (90-е годы XX века)
С начала 90-х годов исследователи все чаще стали объединять тразодон, нефазодон и другие фенилпиперазиновые антидепрессанты в одну группу на основании их способности ингибировать обратный захват серотонина и блокировать 5НТ2-рецепторы. Одними из первых такую точку зрения в 1990 г. высказали M. D’Amico и другие исследователи из фармацевтической компании «Bristol-Myers», изучавшие эффекты нефазодона. В дальнейшем такое классификационное выделение получило широкое признание [21, 22]. Поскольку отличительной от СИОЗС особенностью действия фенилпиперазиновых антидепрессантов считалась их способность блокировать 5НТ2-рецепторы, их стали обозначать как блокаторы 5НТ2-рецепторов. Данные, полученные в первой половине 90-х годов, свидетельствовали, что по силе аффинитета к этому типу 5НТ-рецепторов тразодон, нефазодон и этоперидон превосходят СИОЗС и большинство ТЦА, уступая только амитриптилину [18]. Классификационная рубрика «блокаторы 5НТ2-рецепторов» фактически подчеркивала наличие в спектре нейрохимической активности тразодона и нефазодона прямого рецепторного действия.
Выделению тразодона и нефазодона в группу блокаторов 5НТ2-рецепторов способствовало появление международной номенклатуры 5НТ-рецепторов. В 1986 г. коллектив западноевропейских и австралийских исследователей предложил их первую детальную классификацию. На основании результатов лигандных исследований были выделены 3 типа 5НТ-рецепторов: 5НТ1-, 5НТ2- и 5НТ3-рецепторы. Причем в это время уже было известно, что 5НТ1-рецепторы представлены несколькими подтипами — 5HT1A-, 5HT1B- и 5HT1С-рецепторами. В 1993—1994 гг. коллектив по изучению 5НТ-рецепторов, к которому присоединились исследователи из США, предложил их новую номенклатуру. На основании достижений молекулярной биологии (расшифровка структуры рецепторов и клонирование их генов) в ней выделялось уже 7 типов 5НТ-рецепторов: 5HT1- (в том числе 5HT1А-, 5HT1В-, 5HT1D-, 5HT1Е- и 5HT1F), 5HT2- (в том числе 5HT2А-, 5HT2В- и 5HT2С-), 5HT3-, 5HT4-, 5HT5-, 5HT6- и 5HT7-рецепторы.
Открытие различных подтипов 5НТ2-рецепторов позволило детализировать данные о влиянии на них тразодона и нефазодона. В первой половине 90-х годов было сообщено, что эти рецепторы являются антагонистами 5НТ2С-рецепторов [23, 24]. Специалисты швейцарской фармацевтической компании «Hoffmann-La Roche» [25] показали, что среди различных антидепрессантов наиболее высоким сродством (обычно антагонизмом) к 5НТ2С-рецепторам обладают тразодон, различные ТЦА, миансерин и флуоксетин. Во второй половине 90-х годов появились сообщения, что тразодон и нефазодон блокируют 5НТ2А-рецепторы [26] (хотя об этой их способности было известно и ранее в виде данных о влиянии на 5НТ-рецепторы, так как до 1993—1994 гг. 5НТ2А-рецепторы обозначались как 5НТ-рецепторы). Специалисты американского исследовательского университета Emori показали, что среди различных антидепрессантов наиболее сильный антагонизм к 5НТ2А-рецепторам проявляют нефазодон, тразодон и их метаболиты гидроксинефазодон и m-CPP (по этому показателю они уступают только амитриптилину).
Установление способности тразодона и нефазодона блокировать 5НТ2А- и 5НТ2С-рецепторы привело к появлению мнения, что такое нейрохимическое действие определяет выгодные отличия клинических эффектов производных фенилпиперазина от клинических эффектов СИОЗС. Популярность завоевала точка зрения, согласно которой эти отличия касаются профиля и тяжести побочных эффектов терапии, а именно редкости развития и слабой выраженности при применении блокаторов 5НТ2-рецепторов желудочно-кишечных расстройств, нарушений сексуальной функции, тревоги и бессонницы. Также указывалось, что блокада 5НТ2-рецепторов может вносить вклад в развитие антидепрессивного эффекта, поскольку в конце 90-х годов были получены данные о том, что использование тразодона приводит к повышению уровня внеклеточного серотонина не только за счет прямого ингибирования его обратного захвата, но и опосредованно — за счет блокады 5НТ2А- и 5НТ2С-рецепторов [27].
Изучение влияния блокаторов 5НТ2-рецепторов на 5НТ1А-рецепторы, создание любазодона и других экспериментальных средств (90-е годы XX века)
В первой половине 90-х годов появились данные о том, что тразодон, нефазодон, этоперидон и их метаболит m-CPP обладают сродством к 5НТ1А-рецепторам. Было показано, что среди различных антидепрессантов производные фенилпиперазина проявляют наибольшую активность по отношению к 5НТ1А-рецепторам [18]. Однако характер их аффинитета к 5НТ1А-рецепторам в этот период определен не был. Приводились данные, что нефазодон и m-CPP являются их агонистами или, напротив, что тразодон, нефазодон, этоперидон и m-CPP являются их антагонистами или частичными агонистами.
Во второй половине 90-х годов результаты ряда радиолигандных исследований [28] вновь показали, что тразодон, нефазодон и m-CPP обладают гораздо более высокой активностью в отношении 5НТ1А-рецепторов, чем многие другие антидепрессанты. Авторы этих исследований [28] установили, что m-CPP является агонистом 5НТ1А-рецепторов, но не смогли определить характер аффинитета к ним тразодона и нефазодона. Несмотря на это, они указали, что способность тразодона и нефазодона непосредственно воздействовать на соматодендритические 5НТ1А-рецепторы может играть важную роль в развитии антидепрессивного эффекта. Такая точка зрения была обоснована результатами исследований, свидетельствующими, что одновременное применение СИОЗС и частичных агонистов 5HT1A-рецепторов или антагонистов 5HT1A-рецепторов сокращает время наступления антидепрессивного действия [29] (по сравнению с использованием только СИОЗС) за счет более быстрого и гораздо большего повышения уровня внеклеточного серотонина [30, 31].
Внимание в 80—90-е годы было сосредоточено также на изучении нейрохимической активности m-CPP. Предполагалось, что она может играть роль в реализации клинических эффектов его «родительских» молекул — тразодона, этоперидона, нефазодона и мепипразола.
Уже в начале 80-х годов было известно, что m-CPP является антагонистом 5НТ2-рецепторов, а сила его аффинитета к ним сопоставима с силой аффинитета тразодона и миансерина [11]. Во второй половине 80-х годов были получены данные о том, что m-CPP блокирует 5HT2-рецепторы (в дальнейшем они стали обозначаться как 5НТ2А-рецепторы) и стимулирует 5-HT1С-рецепторы (в дальнейшем они стали обозначаться как 5НТ2С-рецепторы) [32]. В 1990 г. американские специалисты [33], обобщив результаты более ранних исследований, высказали мнение, что m-CPP является агонистом 5HT1C- (т.е. 5НТ2С-) и 5-HT1B-рецепторов и слабым антагонистом 5HT2-рецепторов (т.е. 5НТ2А-рецепторов). В 1994 г. исследователи, создавшие современную номенклатуру 5НТ-рецепторов, указывали, что m-CPP обладает агонистической активностью в отношении 5НТ2С-рецепторов. В дальнейшем данные о том, что m-CCP стимулирует 5HT2C-рецепторы и блокирует 5-HT2A-рецепторы, неоднократно подтверждались.
Особое положение в истории изучения нейрохимической активности m-CPP занимала оценка силы и характера его аффинитета к 5HT1A-рецепторам. Результаты исследований, проведенных в начале 90-х годов, показали, что сила сродства m-CPP к 5HT1A-рецепторам превышает силу сродства к ним тразодона и этоперидона. Предполагалось что m-CPP (так же, как тразодон и этоперидон) является их антагонистом или частичным агонистом [34]. Чуть позже появились данные о том, что m-CPP, подобно анксиолитику буспирону, стимулирует 5НТ1А-рецепторы, а сила этой активности у обоих соединений оценивалась как примерно сопоставимая [35].
Представление о том, что антидепрессивный эффект производных фенилпиперазина развивается благодаря их прямому влиянию на различные подтипы 5НТ-рецепторов, привело к тому, что в середине 90-х годов стали предприниматься попытки синтеза новых соединений этой химической группы. Исследователи из Института фармакологии Академии наук Польши синтезировали целый ряд «тразодоноподобных» соединений, оценили силу их активности в отношении 5НТ1А- и 5НТ2А-рецепторов и выделили среди них наиболее вероятных кандидатов в антидепрессанты. В этот же период специалисты японской фармацевтической компании «Yamanouchi» представили сообщение о антидепрессанте любазодоне. Его нейрохимическая активность заключалась в сильной способности ингибировать обратный захват серотонина и блокировать 5НТ2А-рецепторы и более слабой способности блокировать 5НТ2С-рецепторы. Однако в начале XXI века клинические испытания этого антидепрессанта были прекращены. В конце 90-х годов специалисты фармацевтических компаний «SmithKline Beecham» и «Roche Bioscience» создали ряд экспериментальных средств, которые блокировали 5НТ2С-рецепторы. В 1997 г. обе компании независимо друг от друга заявили о первенстве в синтезе селективных блокаторов 5НТ2С-рецепторов.
Формирование предпосылок для создания новых селективных серотонинергических антидепрессантов с рецепторной активностью и появление вилазодона (90-е годы XX века — 2011 г.)
Несмотря на активное изучение роли 5НТ-рецепторов в реализации антидепрессивного действия, с 1994 до 2011 г. в клиническую практику не было введено ни одного нового серотонинергического антидепрессанта с рецепторной активностью. Такой перерыв отчасти был связан с бурным развитием в течение нескольких десятилетий психофармакологии СИОЗС и стагнацией развития психофармакологии других групп антидепрессантов. Однако данные о возможности реализации антидепрессивного действия за счет прямого влияния на различные подтипы 5НТ-рецепторов привели к тому, что в конце XX — начале XXI века различные фармацевтические компании активизировали поиск новых соединений [36].
Следует заметить, что к этому времени некоторые специалисты стали придерживаться точки зрения о переоценке эффективности СИОЗС по сравнению с ТЦА [37—39], хотя признавали их гораздо лучшую переносимость и безопасность. Достойной альтернативой ТЦА благодаря высокой эффективности терапии они считали представителей группы атипичных антидепрессантов, особенно выделяя среди них блокаторы 5НТ2-рецепторов, бупропион и венлафаксин [37]. Одновременно блокаторы 5НТ2-рецепторов рассматривались в качестве альтернативы ТЦА из-за хорошей переносимости и высокой безопасности лечения [37], поскольку нейрохимические мишени их воздействия не ответственны за развитие тяжелых побочных эффектов и осложнений, которые возникают при приеме ТЦА.
Поиск новых серотонинергических антидепрессантов с прямой рецепторной активностью происходил примерно одновременно с распространением в фармакологии концепции множественности лигандов («Designed multiple ligands»), которая отчасти стимулировала исследователей к целенаправленному созданию серотонинергических антидепрессантов с более широким, чем у СИОЗС, спектром нейрохимической активности.
Во второй половине 90-х годов XX века специалисты немецкой фармацевтической компании «Merck KGaA» целенаправленно синтезировали соединение, которое впоследствии получило название вилазодон. Строение основной части его молекулы оказалось схожим со структурой молекул антидепрессантов тразодона и нефазодона и анксиолитиков буспирона и мепипразола, производимого этой же фармацевтической компанией. Интересно, что после завершения первой фазы клинических испытаний компания «Merck KGaA» передала право на дальнейшее изучение клинических эффектов вилазодона британской фармацевтической компании «GlaxoSmithKline», которая провела вторую фазу испытаний. Однако поскольку преимущество эффективности применения вилазодона перед эффективностью использования плацебо, по мнению специалистов «GlaxoSmithKline», оказалось неубедительным, право на изучение эффектов вилазодона было возвращено компании «Merck KGaA». Ее специалисты завершили клинические испытания, и в 2011 г. вилазодон был разрешен для лечения большого депрессивного расстройства в США.
Вилазодон создавался как средство, одновременно обладающее частичным агонизмом в отношении 5НТ1А-рецепторов и способностью ингибировать обратный захват серотонина. Замысел исследователей заключался в том, что частичный агонизм к соматодендритическим 5НТ1А-рецепторам будет препятствовать воздействию на них повышенного уровня внеклеточного серотонина. Предполагалось, что в результате такого взаимодействия нарушится механизм отрицательной обратной связи, при котором стимуляция серотонином соматодендритических 5НТ1А-рецепторов приведет к ослаблению его выброса в синаптическую щель. Ожидалось, что благодаря такому механизму терапия вилазодоном будет приводить к более быстрому наступлению более выраженного антидепрессивного эффекта, чем лечение СИОЗС [40]. Для обозначения особенностей нейрохимической активности вилазодона англоязычные исследователи стали использовать акроним SPARI (Serotonin Partial Agonist Reuptake Inhibitor). В настоящее время вилазодон является единственным представителем этой группы серотонинергических антидепрессантов.
Продолжение расширения группы селективных серотонинергических антидепрессантов с рецепторной активностью и создание вортиоксетина (2000—2013)
В 2000 г. специалисты американской фармацевтической компании «Eli Lilly» представили данные о соединении LY 367265, которое одновременно ингибировало обратный захват серотонина и блокировало 5НТ2А-рецепторы, причем эти эффекты проявлялись в большей степени, чем у нефазодона. Предполагалось, что LY 367265 будет обладать такой же силой антидепрессивной активности, как СИОЗС, но его применение не вызовет бессонницу и нарушение сексуальной функции. Хотя соединение LY 367265 так и не приобрело облика психофармакологического препарата, в дальнейшем исследователи компании «Eli Lilly» продолжили активные попытки создания антидепрессантов, одновременно блокирующих обратный захват серотонина и влияющих на различные 5НТ-рецепторы (5НТ1B-, 5НТ1D-, 5НТ2А-, 5НТ2B-).
В самом начале XXI века исследователи датской фармацевтической компании «Lundbeck» искали новые соединения, обладающие способностью одновременно блокировать обратный захват серотонина и воздействовать на 5НТ2С-рецепторы. Создание таких антидепрессантов оценивалось как перспективное направление в развитии психофармакологии [41]. Это мнение основывалось на уже известном факте, что многие антидепрессанты (некоторые ТЦА, миансерин, тразодон, нефазодон, флуоксетин и др.) являются сильными антагонистами 5НТ2С-рецепторов [25]. Оно подкреплялось экспериментальными данными о возможной связи между влиянием на 5НТ2С-рецепторы и развитием антидепрессивного действия [41]. Поскольку признавалось, что роль этих рецепторов в развитии антидепрессивного эффекта все-таки изучена мало [41], в 2004 г. специалисты компании «Lundbeck» провели новое исследование, результаты которого продемонстрировали связь между влиянием на 5НТ2С-рецепторы и развитием антидепрессивного действия [41]. Однако несмотря на активное изучение возможности создания новых молекул, одновременно блокирующих обратный захват серотонина и 5НТ2С-рецепторы, исследования компании «Lundbeck» не увенчались успехом.
Большего успеха специалисты «Lundbeck» достигли при целенаправленном поиске соединений, одновременно ингибирующих обратный захват серотонина, стимулирующих 5НТ1А-рецепторы и блокирующих 5НТ3-рецепторы. В результате скрининга различных молекул семейства арилпиперазинов было найдено соединение, обладающее наиболее оптимальным соотношением перечисленных свойств. Позже оно получило название вортиоксетин и было одобрено для применения в качестве антидепрессанта в 2013 г. Стоит отметить, что в XXI веке появились сообщения [42] о влиянии на 5НТ3-рецепторы нефазодона, однако эти данные нуждаются в подтверждении.
При создании вортиоксетина ожидалось, что его агонизм к 5НТ1А-рецепторам усилит серотонинергическую активность за счет десенситизации их соматодендритического пула и прямой стимуляции их постсинаптического пула [43], что приведет к быстрому развитию выраженного антидепрессивного эффекта. Предполагалось, что блокада постсинаптических 5НТ3-рецепторов ослабит тормозную активность ГАМКергических нейронов, что усилит высвобождение серотонина, норадреналина, дофамина и ацетилхолина [43] (такое взаимодействие между этими нейрохимическими системами к этому времени уже было описано), т. е. внесет вклад в развитие антидепрессивного и прокогнитивного действия. Рассчитывалось, что агонизм вортиоксетина к 5НТ1А-рецепторам (как у буспирона) позволит достичь развития анксиолитического действия, а антагонизм к 5НТ3-рецепторам (как у ондансетрона) ослабит желудочно-кишечные побочные эффекты, вызванные блокадой обратного захвата серотонина.
При проведении нейрохимических исследований было установлено, что, кроме влияния на 5НТ1А- и 5НТ3-рецепторы, вортиоксетин также является частичным агонистом 5НТ1В-рецепторов и антагонистом 5НТ7-рецепторов [43]. Предполагалось, что влияние на эти рецепторы внесет вклад в развитие антидепрессивного эффекта [43], поскольку уже были получены данные о том, что стимуляция пресинаптических 5НТ1В-рецепторов уменьшает обратный захват серотонина, а блокада постсинаптических 5НТ7-рецепторов приводит к усилению выброса серотонина за счет подавления активности ГАМКергической системы [44].
Результаты исследования, проведенного сотрудниками компании «Lundbeck» [43], показали, что концентрация внеклеточного серотонина при применении вортиоксетина увеличивается в гораздо большей степени, чем это происходит при использовании даже тех доз СИОЗС и ингибиторов обратного захвата серотонина и норадреналина, которые в максимальной степени блокируют белок-переносчик серотонина. Эта находка, по мнению исследователей, подтвердила роль — 5НТ1А-, 5НТ1В-, 5НТ3- и 5НТ7-рецепторов в развитии антидепрессивного эффекта вортиоксетина и позволила охарактеризовать его понятием «мультимодальный серотонинергический антидепрессант».
Современные представления о профиле рецепторной активности тразодона и новый взгляд на положение блокаторов 5НТ2-рецепторов в современной номенклатуре антидепрессантов (2000—2017)
В XXI веке, несмотря на создание новых серотонинергических антидепрессантов, интерес к изучению механизма действия тразодона не угас. Отчасти это было связано с появлением его новых лекарственных форм пролонгированного действия. Результаты современных исследований не только подтвердили данные об особенностях нейрохимической активности тразодона, полученные в XX веке, но и позволили изучить ее более детально. Большинство исследований было посвящено оценке взаимодействия тразодона с 5НТ1А-рецепторами, что было связано с популярностью в это время гипотезы о роли этого подтипа 5НТ-рецепторов в реализации антидепрессивного эффекта.
В начале XXI века было установлено, что систематическое введение тразодона приводит к снижению плотности 5НТ1А-рецепторов в головном мозге [45]. В эксперименте было показано, что тразодон является агонистом 5НТ1А-рецепторов, а его метаболит m-CPP обладает частичной агонистической активностью [46]. Результаты этого исследования фактически поставили точку в вопросе о характере взаимодействия (агонизм, антагонизм, частичный агонизм) тразодона и m-CPP с 5НТ1А-рецепторами, ответ на который не был получен в XX веке. Одновременно было окончательно установлено, что активность тразодона в отношении 5НТ1А-рецепторов выше, чем в отношении белка — переносчика серотонина [46]. Таким образом, было подтверждено предположение, высказанное в XX веке, что развитие антидепрессивного действия тразодона в большей степени связано с влиянием на 5НТ-рецепторы, а не с ингибированием обратного захвата серотонина. Также было показано, что «внутренняя активность» тразодона в отношении 5НТ1А-рецепторов выше, чем аналогичная активность сходного с ним по химическому строению анксиолитика буспирона, развитие противотревожного эффекта которого объясняется исключительно влиянием на этот подтип рецепторов [46].
В настоящее время развитие антидепрессивного эффекта тразодона также связывается с его прямым влиянием на 5НТ2А- и 5НТ2С-рецепторы. В 2004 г. итальянские исследователи показали, что блокада тразодоном 5НТ2А-рецепторов (в дозах, которые непосредственно не влияют на обратный захват серотонина) снижает активность ГАМКергической системы в коре головного мозга, что, в свою очередь, приводит к повышению концентрации внеклеточного серотонина [47] и развитию антидепрессивного действия. В 2007 г. североамериканские исследователи [48] установили, что блокада постсинаптических 5НТ2С-рецепторов (через воздействие на промежуточные ГАМК-нейроны) стимулирует высвобождение дофамина и норадреналина в префронтальной коре, что приводит к развитию антидепрессивного и прокогнитивного эффектов. Результаты еще одного исследования, проведенного в 2012 г. в Канаде [49], показали, что применение тразодона способствует активации дофаминергических нейронов в вентральной области покрышки и норадреналинергических нейронов в голубом пятне благодаря блокаде 5НТ2А- и 5НТ2С-рецепторов. Перечисленные результаты стали подтверждением данных, полученных на стыке XX и XXI веков, которые свидетельствовали, что блокада 5НТ2С-рецепторов приводит к повышению уровня дофамина в различных областях головного мозга. Ведущие зарубежные психофармакологи, например М. Millan [50] и S. Stahl [51] и признали надежность перечисленных фактов.
В 2010 г. на основании обобщения данных литературы канадские [52] и венгерские [53] специалисты пришли к заключению, что сила аффинитета тразодона к различным звеньям серотонинергической системы убывает в ряду: 5НТ2А-рецепторы > 5НТ1А-рецепторы > белок — переносчик серотонина > 5НТ2С-рецепторы. Обсуждалась роль в развитии антидепрессивного эффекта тразодона способности его метаболита m-CPP влиять на различные подтипы 5НТ-рецепторов. Обобщение результатов экспериментальных исследований, представленное в 2009 г., показало, что сила аффинитета m-CPP к 5НТ-рецепторам убывает в ряд






