Антиандрогенная терапия что это
Антиандрогенная терапия: за и против
В соответствие с данными статьи, опубликованной в июньском номере журнала New England Journal of Medicine, длительная супрессия андрогенов у больных местно распространенным раком предстательной железы, получающих лучевую терапию, имеет преимущества по показателям выживаемости по сравнению с андрогенной супресссией коротким курсом.
В соответствии с данными статьи, опубликованной в июньском номере журнала New England Journal of Medicine, длительная супрессия андрогенов у больных местнораспространенным раком предстательной железы, получающих лучевую терапию, имеет преимущества по показателям выживаемости по сравнению с андрогенной супресссией коротким курсом.
По данным исследования, в котором участвовали больные раком предстательной железы стадии Т2с и более, супрессия андрогенов в течение 3х лет позволяет добиться лучших показателей выживаемости, чем прием антиандрогенов в течение 6 месяцев.
Что также является важным, не было отмечено повышения риска смертельных сердечно-сосудистых осложнений при пролонгированном курсе антиандрогенной терапии, в отличие от предыдущего подобного исследования.
Таким образом, исследователи рекоммендуют сочетать лучевую терапию с длительным приемом антиандрогенов больным местнораспространенным раком предстательной железы (со стадией Т2с и более по классификации TNM)».
Однако антиандрогенная терапия также имеет достаточно широкий спектр побочных эффектов, которые могут значительно сказываться на качестве жизни пациентов. Необходимость проведения более длительных курсов лечения и расширения показаний к её использованию вызывает сомнения у многих специалистов. Так, доктор Вильям Дейл из Чикагского Университета пишет в статье Journal of Clinical Oncology: «Становится очевидным злоупотребление использованием антиандрогенной терапии при лечении рака простаты». Так же считает доктор Альбертсен из Университета при Connecticut Health Center, о чем пишет в статье New England Journal of Medicine. И доктор Дейл, и доктор Альбертсен отмечают, что применение антиандрогенной терапии у мужчин с диагнозом метастатического рака простаты, а также в сочетании с лучевой терапий при лечении местнораспространённого заболевания, действительно, увеличивает выживаемость, однако данные преимущества представляются сомнительными при других стадиях заболевания.
Таким образом, антиандрогенная терапия является эффективным, но достаточно токсичным методом лечения, требующим дальнейшего изучения. При её назначении врач-онколог должен принять в расчёт как её потенциальную пользу для пациента, так и влияние на качество жизни и возможное развитие осложнений. Каждый случай должен рассматриваться индивидуально с учётом стадии заболевания, возраста, наличия негативных или благоприятных прогностических факторов. В настоящее время есть наиболее чёткие показания для её назначения больным метастатическим раком простаты, молодым пациентам с агрессивными формами заболевания, а также в сочетании с лучевой терапией при его местнораспространённых формах.
Антиандрогенная терапия
Что такое антиандрогенная терапия?
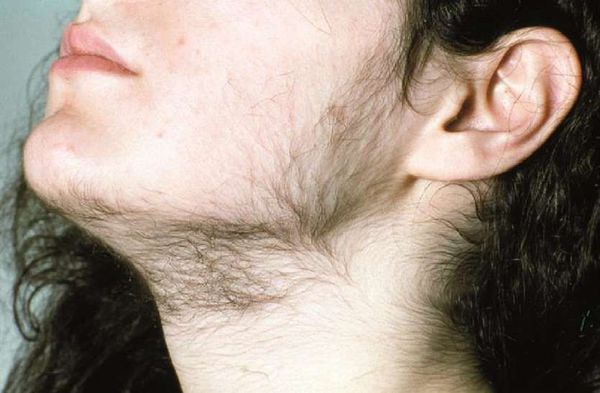
Антиандрогенная терапия относится к лекарствам, принимаемым женщинами для противодействия воздействию мужских половых гормонов, таких как тестостерон, на кожу. Антиандрогены не подходят для лечения проблем с кожей у мужчин.
Для чего используются антиандрогены?
Антиандрогенные препараты используются для лечения признаков гиперандрогении, включая следующие заболевания кожи и волос:
Как работает антиандрогенная терапия?
Антиандрогенная терапия может:
Какие препараты обладают антиандрогенным действием?
Блокаторы андрогенных рецепторов действуют на сальную железу и основание волосяного фолликула. Они включают в себя:
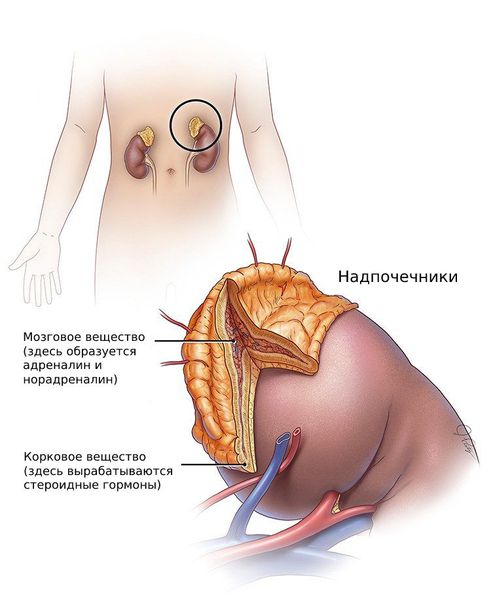
Низкодозированный пероральный кортикостероид (например, преднизолон 2,5 мг утром, 5 мг вечером) действует на снижение выработки андрогенов надпочечниками. При врожденной гиперплазии надпочечников уровень ДГЭАС должен снизиться до нормального.
Лимециклин, рокситромицин и кетоконазол (больше не выпускаемые в Новой Зеландии) являются антимикробными препаратами, которые также снижают синтез андрогенов.
Препараты, действующие на выработку андрогенов яичниками, включают:
Избыточный пролактин снижается бромокриптином, каберголином и хинаголидом.
Ингибиторы 5-альфа-редуктазы включают цинк, финастерид, азелаиновую кислоту, пальметто пилы и другие растительные экстракты. Спиронолактон слабо ингибирует 5-альфа-редуктазу. К сожалению, финастерид не снижает выработку кожного сала и не эффективен при лечении акне. Однако теперь мы знаем, что изотретиноин частично уменьшает выделение кожного сала, уменьшая выработку дигидротестостерона в сальной железе.
Резистентность к инсулину можно снизить с помощью метформина, в основном назначаемого при сахарном диабете 2 типа и ожирении / метаболическом синдроме. Он также может уменьшить признаки гиперандрогении. Метформин от 250 мг до 2 г в день безопасен, но может вызвать диарею и должен приниматься после еды в постепенно увеличивающихся дозах. Росиглитазон и пиоглитазон могут вызывать сердечную и печеночную токсичность.
Каковы клинические эффекты антиандрогенной терапии?
При акне эффекты антиандрогенов включают в себя:
Их можно комбинировать с другими местными и пероральными методами лечения акне.
При гирсутизме результаты:
Физические методы удаления волос, такие как восковая эпиляция, бритье, электролиз или лазерная эпиляция, могут использоваться одновременно с приемом антиандрогенов. Они часто работают лучше, чем до приема лекарств.
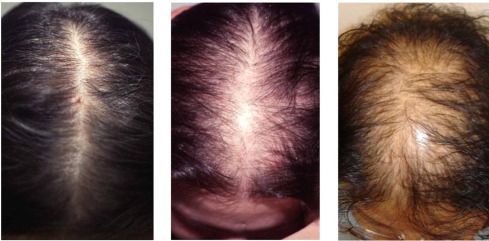
При выпадении волос по женскому образцу результаты таковы:
Эти эффекты не всегда клинически значимы.
Оральные контрацептивы
Оральные контрацептивы, содержащие только прогестерон, не эффективны при лечении андрогенно-опосредованных кожных заболеваний.
Комбинированные оральные контрацептивы содержат два гормона: этинилоэстродиол 20-35 мкг (эстроген) и прогестерон. Они предотвращают беременность, подавляя овуляцию и изменяя цервикальную слизь. Существуют различные виды прогестерона, которые могут быть андрогенными по своей природе и поэтому непригодны для тех андроген-опосредованных кожных заболеваний (особенно левоноргестерол и норгестрел). Антиандрогенные или минимально андрогенные прогестероны (см. выше) показаны у этих женщин.
Их действие при гиперандрогении заключается в снижении выработки андрогенов яичниками, надпочечниками и на уровне рецепторов в коже. Они также уменьшают циркулирующий тестостерон, увеличивая Глобулин, связывающий половые гормоны (SHBG).
Комбинированные оральные контрацептивы выпускаются в виде 21-дневных и 28-дневных упаковок; начинают с 1-го дня (условно 1-й день-первый день менструации) и принимают по одной в день в течение 21 дня. Затем сделайте 7-дневный перерыв (21-дневная упаковка) или примите таблетки плацебо в течение недели (28-дневная упаковка), прежде чем снова начать цикл. В течение этого времени вы можете ожидать кровотечения отмены (период).
Комбинированные оральные контрацептивы могут увеличить риск тромбоэмболии (тромбы, блокирующие кровеносные сосуды), особенно у лиц с наследственной склонностью («тромбофилия») или курящих. Пожалуйста, обратитесь к рекомендациям Министерства здравоохранения Новой Зеландии (Medsafe) по применению комбинированных оральных контрацептивов.
Комбинированный оральный контрацептив может оказаться непригодным, если пациентка:
Многие из этих женщин могут вместо этого использовать противозачаточные таблетки, содержащие только прогестерон, в то время как их лечат спиронолактоном или ципротероном.
Оральные контрацептивы иногда могут усугублять мигрень и нецелесообразны у людей со значительными заболеваниями печени. Они могут иногда увеличивать риск некоторых необычных форм рака молочной железы. Их нельзя принимать во время беременности.
С другой стороны, комбинированный оральный контрацептив снижает риск развития рака яичников и эндометрия, доброкачественных заболеваний молочной железы, внематочной беременности, болезненных периодов, железодефицитной анемии и воспалительных заболеваний органов малого таза.
Ципротерона ацетат/этинилоэстрадиол (ко-пиридиол) следует прекратить в следующих случаях:
Как и в случае с другими оральными контрацептивами, могут возникнуть незначительные побочные эффекты, особенно в первые несколько недель. К ним относятся:
Другие лекарства могут влиять на эффективность контрацепции.
Комбинированные оральные контрацептивы с антиандрогенными компонентами имеют преимущества:
Исследования показали, что состояние кожи продолжает улучшаться даже после того, как лекарство было принято в течение года. Комбинированные оральные контрацептивы обычно можно безопасно принимать в течение многих лет.
К сожалению, состояние кожи имеет тенденцию снова ухудшаться в течение нескольких месяцев после прекращения приема лекарств.
Время от времени вводятся новые формы оральных контрацептивов, чтобы повысить эффективность и уменьшить побочные эффекты.
Спиронолактон
Дозу спиронолактона обычно медленно увеличивают с 25 до 200 мг в сутки, принимают на ночь. Иногда его назначают циклически, чтобы уменьшить нарушения менструального цикла, например, в течение 3 недель из каждых 4 недель или дней 5-21 менструального цикла. Может потребоваться шесть или более месяцев, чтобы увидеть улучшение состояния кожи.
Побочные эффекты спиронолактона включают:
Уровень калия, других электролитов и креатинина в крови часто контролируется у пожилых женщин, если назначаются высокие дозы, у пациентов, принимающих другие лекарства (из-за лекарственного взаимодействия), а также у тех, у кого есть проблемы с сердцем или почками. Наблюдение не считается необходимым у здоровых женщин. Спиронолактон не следует принимать во время беременности или в период лактации.
Уровень калия в сыворотке крови должен быть ≤5,0 ммоль / л, а функция почек должна быть нормальной до начала приема спиронолактона.
Ацетат ципротерона
Более высокие дозы ацетата ципротерона показаны для более тяжелых случаев андрогенных кожных заболеваний. Он эффективен для 70% людей с гирсутизмом.
Назначается несколько различных режимов с дозами от 25 до 200 мг в сутки. До наступления менопаузы препарат обычно сочетают с ацетатом ципротерона/этинилоэстрадиолом или другим оральным контрацептивом:
Одна из систем заключается в приеме высокой дозы ципротерона в течение первых десяти дней цикла.
Женщины в постменопаузе и женщины, перенесшие гистерэктомию, могут принимать ципротерон каждый день. Возможно, будет целесообразно делать 7-дневный перерыв каждый месяц. Они также могут принимать спиронолактон.
Случайные значительные побочные эффекты включают:
Oral Spironolactone in Post-teenage Female Patients with Acne Vulgaris J Clin Aesthet Dermatol. 2012 March; 5(3): 37–50.
Lakshmi C. Hormone therapy in acne. Indian J Dermatol Venereol Leprol. 2013 May-Jun;79(3):322-37. doi: 10.4103/0378-6323.110765. Review. PubMed PMID: 23619437.
Spironolactone—potion or poison? DTB 2017;55:13
Что такое гиперандрогения? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Васильевича, уролога со стажем в 27 лет.
Определение болезни. Причины заболевания
Гиперандрогения — это состояние, при котором у женщины в крови значительно повышен уровень мужских половых гормонов (андрогенов): тестостерона, дигидротестостерона, андростендиона и других.
Распространённость
Причины
Симптомы гиперандрогении
Патогенез гиперандрогении
Андрогены — стероидные половые гормоны, которые вырабатываются из холестерина в коре надпочечников, а также в клетках фолликулов и соединительной ткани яичников.
К андрогенам относятся:
Роль андрогенов
В женском организме андрогены поддерживают гормональный баланс и после начала полового созревания инициируют рост волос на лобке и в подмышечных впадинах. Также они необходимы для выработки эстрогена и возникновения полового влечения.
Андрогены замедляют потерю кальция в костях и регулируют работу внутренних органов и систем: репродуктивной, почечной, мышечной и сердечной.
Гормональная регуляция происходит почти мгновенно с малым количеством активного вещества — гормона. Другая её особенность заключается в дистанцировании: гормон может вырабатываться в одной железе, а попадать в орган-мишень, находящийся в другой части организма.
В плазме крови андрогены взаимодействуют с глобулином, связывающим половые гормоны (ГСПГ). Он выполняет транспортную роль: вместе с ним андрогены доставляются с кровью в клетки органов-мишеней.
Избыток андрогенов
К избытку андрогенов могут приводить различные патологические механизмы:
Повышать уровень андрогенов могут и другие внешние факторы, например приём стероидов и гормональных препаратов. Интересно, что при всех гиперандрогенных состояниях, андрогены происходят более чем из одного источника. Так, при поликистозе яичников увеличен синтез тестостерона, но большая часть этого гормона образуется вне яичников — в надпочечниках.
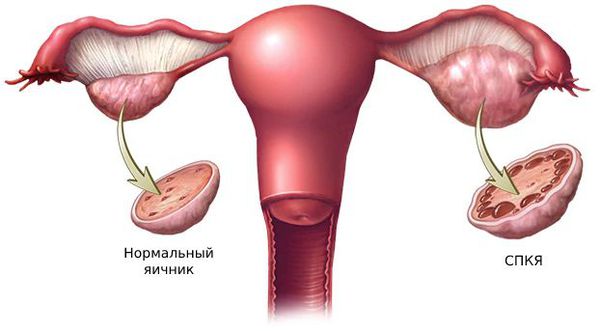
Большую роль в развитии первичной гиперандрогении играют генетические факторы. Одной из причин синдрома поликистозных яичников (СПКЯ) является генетически предопределённый избыток лютеинизирующего гормона (ЛГ). ЛГ стимулирует образование мужских половых гормонов: тестостерона и андростендиона. Их чрезмерная выработка нарушает процесс развития фолликулов: они преждевременно перерождаются в жёлтое тело и в этой области образуются фолликулярные кисты.
Другая причина развития СПКЯ — генетически обусловленное нарушение выработки инсулина и развитие инсулинорезистентности, то есть недостаточный ответ тканей на его действие.
К гиперандрогении, как было сказано выше, может приводить врождённая гиперплазия коры надпочечников. Причина её развития — мутации генов, которые отвечают за синтез ферментов или транспортных белков, участвующих в выработке кортизола.
Классификация и стадии развития гиперандрогении
Согласно Международной классификации болезней (МКБ-10), гиперандрогения кодируется как Е.28.1 Избыток андрогенов. Выделяют истинную гиперандрогению и другие её формы.
Истинная гиперандрогения
Истинная гиперандрогения бывает яичниковой и надпочечниковой
Яичниковая гиперандрогения:
1. Синдром поликистозных яичников. Первичный СПКЯ (синдром Штейна — Левенталя) возникает при нарушении в системе гипоталамус-гипофиз-яичники. Вторичный СПКЯ развивается при эндокринной патологии, например на фоне сахарного диабета, заболеваний щитовидной железы или под воздействием внешних факторов: интоксикации, стресса, травмы и инфекции.
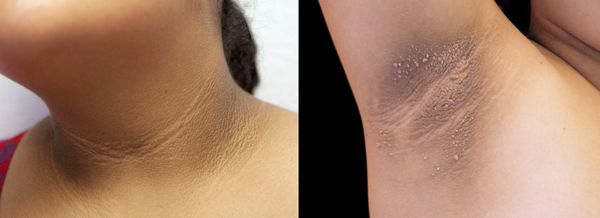
2. Стромальный текоматоз яичников (синдром Френкеля) — тяжёлая форма овариальной неопухолевой гиперандрогении. При заболевании разрастается соединительная ткань и возникает синдром HAIR-AN (высокий уровень андрогенов, инсулинорезистентности, ожирение и чёрный акантоз). Это редкая патология выявляется преимущественно в постменопаузе.
3. Андроген-продуцирующая опухоль яичников:
Надпочечниковая гиперандрогения:
Другие формы гиперадрогении
Осложнения гиперандрогении
Наиболее частые осложнения гиперандрогении: бесплодие, инсулинорезистентность и ожирение. Нарушение обмена липидов, сахарный диабет, сердечно-сосудистая патология возникают как следствие этих процессов.
Механизмы развития гиперандрогении и гиперинсулинемии до конца не изучены. Теоретически возможны три варианта взаимодействия: гиперандрогения вызывает гиперинсулинемию, гиперинсулинемия приводит к гиперандрогении и есть третий фактор, ответственный за оба феномена.
Предположение о том, что гиперандрогения вызывает гиперинсулинемию, основано на следующих фактах:
О том, что гиперинсулинемия вызывает гиперандрогению, свидетельствует следующее: инсулинорезистентность сохраняется у пациенток с удалёнными яичниками и при длительном приёме препаратов, подавляющих выработку андрогенов.
Диагностика гиперандрогении
Диагностика проводится эндокринологом или гинекологом-эндокринологом.
Этапы:
1. Опрос (сбор анамнеза). Врач беседует с пациенткой и выясняет следующие факты:
2. Осмотр. Доктор обращает внимание на следующие симптомы:
3. Лабораторные исследования:
Направление на анализы выписывает врач, так как часть из них нужно проводить в определённые дни менструального цикла.
4. Инструментальная диагностика:
Лечение гиперандрогении
Заболевание лечит врач-эндокринолог или гинеколог-эндокринолог.
Лечение поможет устранить симптомы и достичь основных целей:
Нормализация менструального цикла уменьшает риск гиперплазии эндометрия и рака тела матки, маточных кровотечений и постгеморрагической анемии.
В редких случаях выполняют операции на яичниках.
Комбинированные оральные контрацептивы (КОК) снижают уровень гонадотропинов, а значит и концентрацию андрогенов, которые производятся в яичниках. Содержащиеся в КОК эстрогены увеличивают синтез глобулина, связывающего половые гормоны и, следовательно, снижают уровень свободного тестостерона. Кроме того, прогестагены в составе КОК уменьшают синтез андрогенов в надпочечниках, подавляют фермент 5-альфа-редуктазу и блокируют связывание андрогенов с рецепторами.
Оптимальными будут КОК, содержащие прогестаген с антиандрогенным действием: ципротерон, хлормадинон, диеногест и дроспиренон. Также предпочтительны оральные контрацептивы с этинилэстрадиолом.
Наиболее известные КОК, применяемые для лечения гиперандрогении:
Прогестагены нормализуют менструальный цикл при циклическом или постоянном приёме. Однако есть гипотезы, что прогестерон сам обладает андрогеноподобным действием. Его, как правило, не назначают для лечения гиперандрогении, но применяют для нормализации второй фазы менструального цикла.
Блокаторы андрогенных рецепторов из–за выраженной тератогенности (влияния на внутриутробную закладку органов будущего ребёнка) беременным принимать запрещено.
Основные препараты из группы блокаторов андрогенных рецепторов:
Дозировку и режим приёма препаратов врач назначает индивидуально.
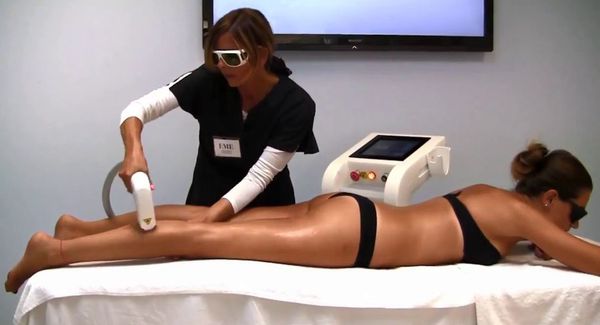
Способы удаления волос при гирсутизме
Существуют три вида электроэпиляции:
Побочные эффекты электроэпиляции: ожоги, раздражение кожи, редко — образование рубцов.
Лазерная эпиляция позволяет повредить волосяной фолликул, не разрушив окружающие его ткани. Процедуры нужно проводить многократно, но полностью избавиться от волос удаётся редко. В зависимости от источника светового излечения лазеры для удаления волос делятся на три группы:
Прогноз. Профилактика
Если своевременно обратиться к врачу и правильно подобрать лечение, то можно уменьшить неприятные симптомы и избежать серьёзных осложнений.
Результаты терапии следует оценивать через 3–6 месяцев, потому что антиандрогенные препараты действуют медленно: они постепенно накапливаются в организме и встраиваются в обмен веществ. Их приём требует адекватного дозирования, а также регулярной оценки результатов и возможных побочных действий.
Лечение позволяет избавиться от симптомов, поэтому для грамотной коррекции терапии пациентке необходимо регулярно посещать врача-эндокринолога
Профилактика:
Антиандрогенная терапия что это
На сегодняшний день рак молочной железы (РМЖ) рассматривается как системное гетерогенное заболевание, течение и прогноз которого зависят, прежде всего, от молекулярно-биологических характеристик опухоли [12]. Современные высокотехнологичные исследования подтверждают концепцию B. Fisher о возможности диссеминации даже ранних форм РМЖ, что и определяет особую роль лекарственной терапии в составе комплексного лечения данной болезни [1]. Схожие изменения локального гормонального статуса практически при всех подтипах РМЖ доказывают исключительную значимость стероидных гормонов в патогенезе данного заболевания [2]. Определение экспрессии рецепторов эстрогена (РЭ) и прогестерона (РП) – один из ключевых моментов разделения опухолей молочной железы на биологические подтипы и является крайне важным фактором для выбора оптимальной системной терапии [13]. Возможность прицельного воздействия на некоторые элементы сигнального пути канцерогенеза принято обозначать термином «таргетная терапия», в том числе и на рецепторы стероидных гормонов. Роль андрогенов в развитии РМЖ до конца не определена и достаточно противоречива, что обуславливает возрастающий интерес исследователей и клиницистов к их изучению [7]. Лечение андрогенами в практической онкологии применяется с шестидесятых годов XX века и используется при метастатическом РМЖ в качестве последней линии гормонотерапии [5]. Были попытки использовать и антиандрогены (флутамид) для лечения генерализованных форм РМЖ, однако они не увенчались успехом, и потенциал данного вида эндокринотерапии был поставлен под сомнение [11]. Несмотря на обескураживающие предшествующие исследования применения антагонистов андрогенов в лечении РМЖ, появление новых андрогенных блокаторов для терапии рака предстательной железы и детальное изучение подтипов РМЖ вновь вернули интерес к этой проблеме [6]. Антиандрогенная терапия представляется особенно перспективной там, где отсутствуют другие терапевтические мишени, например при развитии резистентности к антиэстрогенной терапии или в лечении тройного негативного РМЖ [10]. Так, в настоящее время активно изучается возможность применения бикалутамида и других андрогенных антагонистов у пациенток с тройным негативным фенотипом опухоли и наличием экспрессии рецепторов андрогенов [8; 9]. Кроме этого, определение экспрессии рецепторов андрогенов (РА) может служить дополнительным прогностическим фактором. Выраженная экспрессия РА сопряжена с низким риском рецидива при всех подтипах РМЖ, а в сочетании с экспрессией рецепторов эстрогенов является предиктором лучшей общей выживаемости [15]. Таким образом, на наш взгляд, абсолютно закономерен вопрос: имеются ли действительно в ткани опухоли предпосылки для антиандрогенной терапии?
Цель исследования: изучить локальный гормональный фон опухоли, перифокальной зоны, а также гормонального рецепторного статуса у больных различными биологическими подтипами РМЖ и репродуктивным статусом.
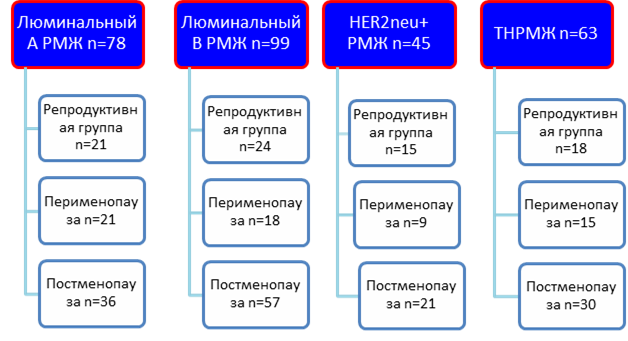
Материалы и методы. Для исследования были отобраны 285 больных различными биологическими подтипами РМЖ и репродуктивным статусом. До забора материала больные не получали специфического лечения. Все пациентки до начала обследования дали свое письменное согласие на использование их персональных данных и биологического материала для научно-исследовательских целей. Проведенное исследование одобрено локальным этическим комитетом ФГБУ «РНИОИ» Минздрава РФ. Репродуктивный период женщины определялся нами согласно менструальному статусу [3]. Возраст больных в постменопаузе был 65–70 лет, в перименопаузе составил 49–50 лет, и больных репродуктивной группы – 40 лет. В исследование вошли пациентки с различными гистологическими формами РМЖ. Распределение больных по биологическим подтипам осуществлялось на основании рекомендаций Панели экспертов St. Gallen (2013) (рисунок).
Характеристика клинического материала
Учитывая, что неоднородность люминального В РМЖ определяется не только HER2neu статусом, но и другими немаловажными параметрами, такими как, например, индекс пролиферативной активности опухоли, а критерии его оценки постоянно пересматриваются, в данной работе мы решили рассматривать данный подтип в целом, не разделяя его на HER2neu+ и HER2neu- варианты. На наш взгляд, люминальный В подтип нуждается в пристальном изучении и заслуживает отдельного исследования.
Уровень эстрадиола, эстрона и тестостерона определяли в 10%-ных цитозольных фракциях тканей молочной железы, приготовленных на 0,1 М калий-фосфатном буфере рН 7,4, содержащем 0,1% Твин-20 и 1% БСА, стандартными ИФА-методами (наборы ХЕМА, «Биохиммак», «АлкорБио» Россия; DBC Канада). Все исследования у больных репродуктивной группы проводили на 2-ю фазу менструального цикла. В качестве интактной использовали ткань молочной железы (n=16), полученную во время операций по поводу редукции молочных желез. Стандартной морфологической и иммуногистохимической (ИГХ) оценке подвергался операционный или биопсийный материал всех больных. Использованные в работе первичные антитела и их разведения представлены в табл. 1.