Антидофаминергическое действие что это
Антидофаминергическое действие что это
Как биогенный амин дофамин принадлежит к группе веществ, образующихся в организме путем декарбоксилирования аминокислот. Кроме дофамина и образующегося из него норадреналина эта группа включает много других молекул-посредников, таких как гистамин, серотонин и ГАМК.
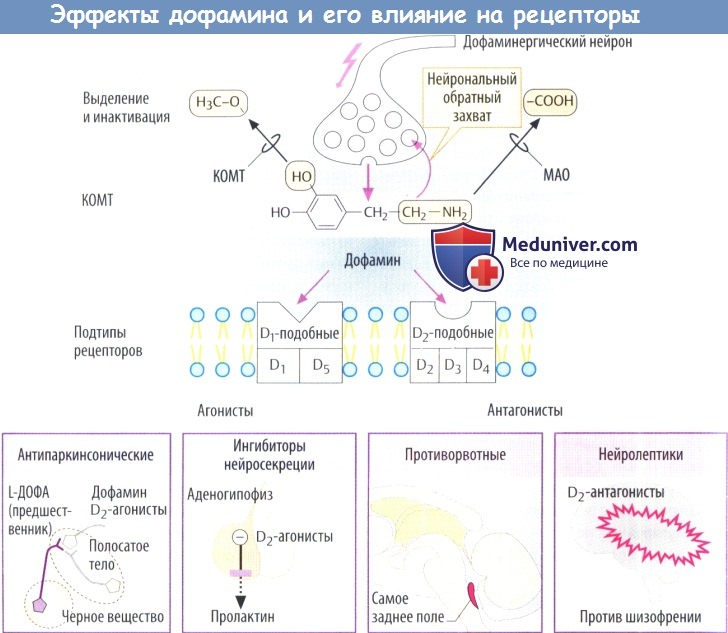
а) Действие дофамина и фармакологическое значение. Дофамин служит в качестве нейромедиатора в ЦНС. Дофаминовые рецепторы присутствуют и на периферии. Выделенный нейронами дофамин может взаимодействовать с различными подтипами рецепторов, каждый из которых связан с G-белками: семейство D1-подобных рецепторов (включает подтипы D1 и D5) и семейство D2-подобных рецепторов (включает подтипы D2, D3 и D4). Эти подтипы отличаются своими сигнальными путями.
Так, синтез цАМФ стимулируется D1-подобными рецепторами и ингибируется D2-подобными.
Высвобожденный дофамин используется повторно благодаря нейрональному обратному захвату (специфическим дофаминовым переносчиком, DAT) и повторному накоплению в везикулах (неспецифическим везикулярным переносчиком моноаминов, VMAT) либо катаболизируется ферментами МАО и КОМТ, как и другие эндогенные катехоламины.
Для влияния на дофаминергическую передачу сигналов в терапевтических целях используют различные препараты.
Антипаркинсоническив средства. При болезни Паркинсона происходит дегенерация дофаминовых нейронов черного вещества и полосатого тела. Для того чтобы компенсировать недостаток дофамина, используют препарат L-ДОФА как предшественник дофамина, а также агонисты D2-рецепторов.
Ингибиторы пролактина. Выход дофамина из нейросекреторных клеток гипоталамуса угнетает секрецию пролактина аденогипофизом. Пролактин вызывает образование грудного молока на протяжении лактационного периода; более того, он ингибирует секрецию гонадорелина.
Агонисты D2-рецепторов препятствуют секреции пролактина и могут использоваться для отнятия ребенка от груди и для лечения женского бесплодия, обусловленного гиперпролактинемией.
Агонисты D2—рецепторов отличаются по продолжительности действия и, следовательно, интервалам между приемами; например, бромокриптин применяют З раза в сутки, хинаголид — 1 раз в сутки, каберголин —1-2 раза в неделю.
Противорвотные. Стимуляция дофаминовых рецепторов в самом заднем поле может вызывать рвоту. Самое заднее поле находится на дне IV желудочка; здесь отсутствует ГЭБ. Антагонисты D2—рецепторов, такие как метоклопрамид и домперидон, используются в качестве противорвотных средств. К тому же они стимулируют опорожнение желудка.
Нейролептики. Различные препараты, проникающие в ЦНС, оказывающие терапевтическое действие при шизофрении, проявляющие антагонистические свойства по отношению к D2—рецепторам; например, нейролептики фенотиазины и бутирофенон.
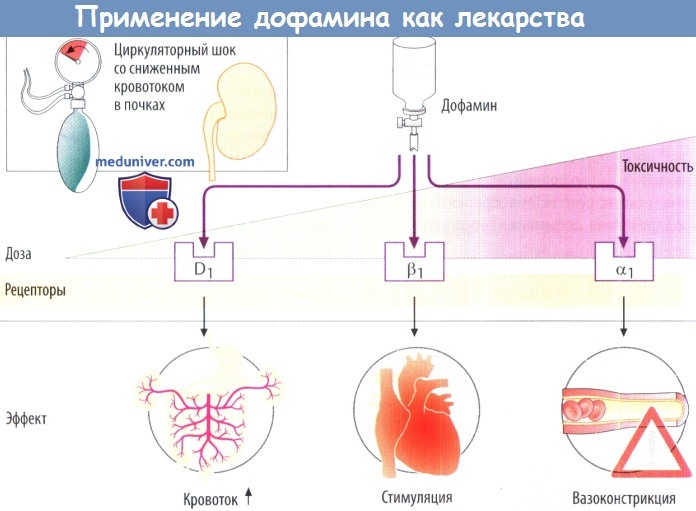
б) Дофамин как терапевтическое средство. При инфузионном введении дофамин вызывает расширение почечных и висцеральных артерий вследствие стимуляции D1-рецепторов. В результате уменьшается сердечная постнагрузка и увеличивается почечный кровоток. Эти эффекты используют при лечении кардиогенного шока.
При постепенном увеличении дозы дофамин способен активировать β1-, а затем и α1-рецепторы. Опосредованная α-рецепторами вазоконстрикция с терапевтической точки зрения нежелательна (обозначается красным предупреждающим знаком).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Этот загадочный дофамин
Где его искать?
Сегодня даже школьник знает, что избыток дофамина, то ли при психических расстройствах, то ли в результате приема наркотиков, может привести к психозу. Те больные, которые боятся психоза бегут в лаборатории сдавать кровь на дофамин, не понимая, что этот анализ не имеет никакого отношения к психозу, что концентрация дофамин в мозгу, в спинномозговой жидкости, в крови, да и в моче — все покажут разные результаты. Кроме того, концентрация дофамина в крови варьирует у разных людей в широком диапазоне (в 50 раз!) и даже зависит от времени приема еды и ее количества.
Очень краткая история
Вещество со свойствами дофамина было открыто в 1901 году, но лишь спустя 30 лет мы стали понимать, откуда он берется, а еще спустя 20 лет, появилось слово «дофамин». Ученые, которые доказали в 1957-1959, что дофамин распределен в структурах мозга и в других тканях организма получили за это Нобелевскую премию лишь в 2000 году (награда нашла своих героев). В начале 60-х годов прошлого века первые исследования болезни Паркинсона продемонстрировали отсутствие дофамина в полосатом теле мозга.
Биологи и реже врачи знают, что дофамин получается из L-тирозина через L-ДОФА, но это еще не биологи и еще реже врачи, знают, что дофамин может превращаться в норадреналин и адреналин. Вы скажите, что тут нового? Но давайте посмотрим, тирозин также предшественников гормонов щитовидной железы, а значит его прием улучшит функцию этой железы, если она будет ослаблена. Повлияет ли это на дофамин, полагаю, что да — его также станет больше, хорошо или плохо, это — не знаю, ведь на фоне лечения тирозином всегда поднимается гормон пролактин. Может поэтому современные эндокринологи без головной боли лечат гипотиреоз тироксином.
Лечим или калечим?
Если дофамин повышен при психозах, допустим при бреде, галлюцинациях и психомоторном возбуждение больного, то значит концентрацию дофамина в структурах мозга надо снизить или сделать нейроны нечувствительными к дофамину. На последнем принципе и основана терапия нейролептиками, то есть на идее о блокаде рецепторов дофамина. Первые энтузиасты лечения нейролептиками блокировали рецепторы дофамина, как придется, по принципу, чем больше, тем лучше. Однако, возбужденный мозг сложно обмануть по ряду причин. Во-первых, рецепторов дофамина оказалось достаточно много (выяснилось, что они и относятся к разным семействам), во-вторых, слишком сильная блокада оказалась вредна для организма, в-третьих, выяснилось, что одни рецепторы дофамина, допустим D2 в так называемом полосатом теле надо блокировать, а другие, например, D1, в большей степени сконцентрированном в коре мозга, наоборот блокировать нельзя, поскольку от этого заметно падает инициатива и слабее воля больного. Чем дальше в лес, тем больше бурелома. Позже выяснилось, что блокада D2 рецептора меньше, чем на 60% бесполезна для обрыва психоза, а выше 80% — вредна, но попробуйте поймать нужную концентрацию. Еще один нюанс — блокада рецепторов дофамина приводит к повышению уровня пролактина, а это совсем нехорошо, поскольку у мужчин появляется импотенция, а у женщин — набухают грудные железы и прекращаются месячные и, кроме того, у тех и у других — при этом усиливается тревога и нарушается структура костей. Попробуйте снизить уровень пролактина и получите обострение психоза, что же делать?
Препараты, повышающие активирующие рецепторы дофамина, например, те, которые используются для лечения болезни Паркинсона, сами вызывают психоз, в частности, со зрительными галлюцинациями. Возникает дилемма — отменишь эти препараты — получишь обострение болезни Паркинсона (тремор, ригидность мышц, падения и пр.), назначишь нейролептики — значит усилишь те же самые симптомы. Психиатры должны здесь пройти между «Сциллой и Харибдой», что требует довольно высокой квалификации и не всем удается.
Ладно, в нашей клинике (ООО «Психическое здоровье») мы можем посмотреть не только концентрацию нейролептика в крови, но и продукты его метаболизма, а что делать врачу государственной клиники, как ему определить ту дозу нейролептика, которая оптимальна? Опытный психиатр, небезразличный к судьбе больного делает это «на глазок», ориентируясь на неврологические побочные эффекты, так называемую экстрапирамидную симптоматику. Если она есть — это вроде бы плохо и надо снижать дозу нейролептика, если — нет — и так сойдет. Опять-таки, не тут то было, если неврологические побочные эффекты есть, но не резко выражены — психиатры обычно говорят, препарат — работает. Так вот, попробуйте «на глаз» понять сколько миллиграмм нейролептика все же надо давать больному, скорее всего — не получится.
В нашей клинике (ООО «Психическое здоровье») мы смотрим антитела к рецепторам дофамина, к сожалении, пока нам не удается создать такой тест, который бы выделял антитела к разным рецепторам дофамина. Однако, мы заметили, что количество антител интегрально, считай ко всем рецепторам дофамина, появляется у больных со слуховыми галлюцинациями и бредом воздействия и отсутствует у пациентов с дезорганизацией мышления даже при психозе, допустим шизофрении.
Фигаро
Обычно, когда мы говорим дофамин мы в первую очередь вспоминаем о мозге, но это не совсем правильно. Действительно дофамин принимает участие в разной работе мозга, касаясь процессов познания, настроения, системы вознаграждения, восприятия боли, сексуального и даже говорят романтического поведения.
Однако, дофамин преподносит нам много сюрпризов, он появляется там, где его совсем и не ждали. То он заботится об отложении жира, то влияет на артериальное давление, то бросается регулировать выделение соли почками, а еще и восстанавливает зубы с помощью клеток крови — тромбоцитов. Кстати о последних, их число снижается при повышении уровня дофамина, но активность, способность к агрегации, напротив, усиливается, что может привести к закупорке сосудов тромбами. И далее, повышение уровня дофамина способствует анемии (меньше эритроцитов, меньше гемоглобина, меньше, следовательно, и кислорода), снижает активность практически всех клеток иммунной системы от нейтрофилов до лимфоцитов. Правда, есть тут один интересный момент, дофамин — снижает количество В-лимфоцитов, то есть тех клеток приобретенного иммунитета, которые вырабатывают низкомолекулярные белки-антитела — можно сказать корректоров тех нарушений, которые появляются в клетках организма, например, в нейронах.
Получается, что от дофамина нам больше вреда чем пользы? Сомневаюсь, все хорошо в меру, слишком много дофамина — психоз, слишком мало — апатия, например, после выхода из психоза (слишком большой выброс дофамина был во время психоза).
Дофамин секретируется лейкоцитами согласно этому происхождению, эффекты дофамина связаны с такими процессами, как «респираторный взрыв», секреция антител и, хемотаксис, программируемая гибель клеток и пр., значит выброс дофамина может быть опасен для организма и его надо прекращать во всех случаях.
Оставим нейролептики в покое
Можем ли мы уменьшить количество дофамина при психозе без нейролептиков. Полагаю, что да, например, блокируя выделение этого медиатора из периферических симпатических нервов с помощью препаратов, способных это сделать. Кроме того, а почему бы нам вообще не снизить количество дофамина с помощью некоторых средств, например, на количество дофамина могут влиять отдельные мочегонные и сердечно-сосудистые средства, в частности, и те, что снижают артериальное давление. Напрашивается вопрос: кто нам мешает при высоком давлении или отеками у пациента с психозом подключать именно те препараты, которые снижают давления или уменьшают выраженность отеков, особенно, у пожилых людей, это явно принесет определенную пользу?
Роль дофаминовых D3-рецепторов в механизме действия современных антипсихотиков
ФГБУ «Московский научно¡исследовательский институт психиатрии Минздрава РФ»
РЕЗЮМЕ: В настоящем обзоре литературы кратко приведены общие сведения о вероятных механизмах действия современных антипсихотиков в рамках модифицированной дофаминергической гипотезы шизофрении, в зависимости от основного нейрохимического механизма действия выделено несколько поколений антипсихотических средств, продемонстрировано сравнительное действие препаратов на различные рецепторные мишени и в зависимости от этого предложена их современная нейрохимическая классификация. Особое внимание уделено анализу антагонистиского действия препаратов на третий подтип дофаминовых ауторецепторов, их взаимодействию с другими нейромедиаторными системами (в том числе с глутаматергической) в различных структурах мозга и их роли в формировании антипсихотического, прокогнитивного и антинегативного клинических эффектов, а также при лечении синдрома зависимости.
КОНТАКТ: profmosolov@mtu-net.ru
Базовым фармакологическим классом при лечении как острых, так и хронических проявлений шизофрении, а также при проведении длительной противорецидивной терапии являются нейролептики или антипсихотики, открытые Делеем и Деникером во Франции 60 лет назад. Основной целью применения нейролептиков в рамках клинической модели всегда являлась продуктивная (позитивная) симптоматика, на которую все препараты этой группы оказывают положительное воздействие, т. е. собственно антипсихотический эффект. Традиционно антипсихотический эффект связывали с влиянием лекарственного препарата на дофаминергическую систему (блокада дофаминовых рецепторов, особенно D2-рецепторов в мезолимбической системе). Это положение было подвергнуто сомнению после появления «атипичных» антипсихотиков (антипсихотиков второго поколения (АВП)), которые не являлись классическими дофаминовыми антагонистами и реже, чем традиционные нейролептики, приводили к развитию экстрапирамидных симптомов (ЭПС). В частности, клозапин, один из самых мощных антипсихотических препаратов, является крайне слабым антагонистом D2-рецепторов [3, 34]. В течение последних десятилетий в клиническую практику успешно внедряются новые антипсихотические лекарственные средства. Широкую известность получила гипотеза Meltzer H. и Nash F. [36], в соответствии с которой терапевтическая эффективность АВП обусловлена их действием на рецепторы 5-HT2a, а точнее, коэффициентом, отражающим отношение 5-HT2a-аффинитета к D2-аффинитету. В табл. 1 приведено это соотношение для большинства распространенных антипсихотиков. Препараты из групп IV и V имеют сильный антагонизм в отношении 5-HT2a- рецепторов, поэтому их называют дофамино-серотониновыми антагонистами. Предполагается, что блокада 5-HT2a-рецепторов, широко представленных в мезокортикальных структурах, опосредованно способствует увеличению содержания дофамина в префронтальных корковых структурах, что может лежать в основе антинегативного и прокогнитивного эффектов.
Таблица 1. Сравнительная сила блокирующего действия антипсихотиков на рецепторы в головном мозге [5]
Группа
Препарат
5-HT2a
5-HT2a/D2
Схематическое изображение фармакологической эволюции антипсихотической терапии (переход от традиционных нейролептиков к атипичным) представлено на рис. 1.
В исследованиях бифепрунокса показано, что он является слишком сильным агонистом и слишком слабым антагонистом, что приводит к избыточной активации пациентов и недостаточной антипсихотической активности даже в высоких дозах (препарат не получил регистрацию Федерального агентства США по надзору за лекарственными средствами и продуктами питания [FDA]; [51]).
Ведется активный поиск новых лекарственных средств с антипсихотической активностью, в том числе с недофаминовыми механизмами действия (см. рис. 1), включая различные рецепторные мишени в глутамат-, холин-, серотонин-, ГАМК-ергической, нейропептидной, канабиоидной и других нейромедиаторных системах головного мозга [52]. Обзор соответствующих экспериментальных антипсихотических препаратов не входит в задачи настоящей публикации.
Дофаминовые DЗ-рецепторы
В соответствии с современными нейрохимическими представлениями существует 2 семейства и 5 подтипов дофаминовых рецепторов, имеющих различную функцию и представленность в определенных структурах головного мозга (рис. 3).
К семейству D2-рецепторов относятся подтипы D2, D3 и D4, которые очень близки по своей белковой структуре и ингибирующей функции на G-протеин и вторичную внутриклеточную трансмиссию. Основное отличие состоит в их разной чувствительности к связыванию с дофамином и представленности на пре- или постсинаптической мембране, а также в различных структурах мозга. При этом в отличие от быстрых нейромедиторов дофамин не открывает ионные каналы, а действует опосредованно через G-протеин и аденилатциклазу; соответственно, действие дофамина во многом зависит от функционального состояния нейрона. Дофаминовые D3-рецепторы, входящие в группу D2-подобных рецепторов, были обнаружены и клонированы в конце 1980-х годов [49]. Эти протеины экспрессируются совместно с D2-рецепторами, однако они в значительно меньшей степени представлены в головном мозге, чем D2-рецепторы [27].
В настоящее время большая часть сведений о локализации D3-рецепторов и их плотности в различных нейроанатомических областях основывается на исследованиях с животными — соответствующие данные для человека являются дискуссионными [48]. D3-рецепторы относительно широко представлены в коре больших полушарий и стволе головного мозга, однако выше всего их концентрация на дофаминовых нейронах в мезоэнцефалических структурах, а также в прилежащем ядре, что, вероятно, указывает на их важную роль в регуляции дофаминергической передачи в мезолимбической системе, которая в соответствии с доминирующей в настоящее время гипотезой является ключевым нейроанатомическим субстратом развития психотической симптоматики при шизофрении [1, 45]. Представленность D3- рецепторов в периферических тканях мало изучена. Отчасти это связано с низкой селективностью используемых радиолигандов именно к этому подтипу рецепторов [7]. Единственный периферический орган, для которого описана выраженная экспрессия D3-рецепторов, это почка. Считается, что антагонисты D3-рецепторов оказывают ренопротективный эффект в экспериментальных моделях сахарного диабета II типа [20].
Аффинитет D3-рецепторов к дофамину более чем в 60 раз превышает таковой у D2-рецепторов и они значительно быстрее связываются с дофамином, чем D2-рецепторы (рис. 4), а постсинаптические D3-рецепторы в значительной степени удалены от синаптической щели [27]. Эти два факта позволяют предположить, что D3-рецепторы служат высокочувствительными экстрасинаптическими «датчиками» низких концентраций дофамина в лимбической системе, что может указывать на их важную роль в процессах сенситизации к дофамину, а также в тонической регуляции дофаминовой нейротрансмиссии. D3-рецепторы преимущественно являются ауторецепторами, т. е. располагаются на пресинаптической мембране и контролируют дофаминергическую активность по типу отрицательной обратной связи. Получены данные о том, что D3^- торецепторы (в вентральной покрышечной области) регулируют внеклеточную концентрацию дофамина благодаря взаимодействию с дофаминовым транспортером [54], т. е. также контролируют фазовую (но не тоническую) активность дофаминовых нейронов, и, возможно, участвуют в регуляции поведенческих феноменов, связанных с блокадой глутамат/NMDA- рецепторов [48] (предполагается, что глутамат/ NMDA-опосредованная нейротрансмиссия подавляется при шизофрении). D3-рецепторы, по-видимому, обладают способностью контролировать активность глутаматергической системы путем прямого воздействия на NMDA-рецепторы в синапсах терминалей пирамидальных клеток в прилежащем ядре или посредством непрямой модуляции пресинаптического воздействия дофамина на нейроны префронтальной коры. Это свойство D3-рецепторов уникально, поскольку дофаминовые рецепторы других подтипов не оказывают такого влияния на глутаматергическую систему. Блокада D2-рецепторов в нигростриальной системе коррелирует с антипсихотическим эффектом препаратов, но на уровне корковых структур блокада D1^ D2-рецепторов нарушает контроль активности пирамидальных клеток в нейрональных сетях, что не способствует коррекции негативной симптоматики и когнитивных нарушений при шизофрении. Это отчасти объясняет, почему фокус поиска новых антипсихотических средств в настоящее время сместился на агонисты или позитивные модуляторы метаботропных глутаматных рецепторов 2/3-го типа (mGluR2/3), ингибиторы захвата глутамата 1-го типа или транспортера глицина для коррекции глутаматергической передачи в префронтальной коре [4, 6, 29, 41].
Кроме того, считается, что D3-ауторецепторы в вентральной покрышечной области и черной субстанции регулируют дофаминергическую передачу в проекциях, направляющихся из этих структур к базальным ганглиям, миндалине, гиппокампу и фронтальным корковым зонам, и могут участвовать в координировании связей между этими нейроанатомическими образованиями [16, 19]. Большая распространенность D3-ауторецепторов в вентральных областях стриарного комплекса (по сравнению с дорсальными областями базальных ядер) может также указывать на их преимущественную роль в регулировании дофаминовой нейтротрансмиссии в лимбической системе (но не в моторных проекциях). Важно подчеркнуть, что подобное простое функциональное разделение является дискуссионным и в настоящее время носит гипотетический характер [25].
Внутриклеточная передача сигнала D3^- цепторами во многом похожа на таковую у других представителей D2-семейства. Как и D2- и D4-рецепторы, D3-рецепторы через ингибирующий G-протеин оказывают негативное воздействие на внутриклеточную концентрацию цАМФ (см. рис. 3). Обнаружен ряд особенностей, отличающих D3-рецепторы от других представителей D2-семейства: D3-рецепторы сохраняют высокий аффинитет к дофамину и другим агонистам даже при отсутствии связывания с G-протеином; D3-рецепторы обнаруживают минимальное подавление аффинитета при введении ГТФ1; стимуляция D3-рецепторов in vitro может приводить к закислению внеклеточного матрикса, ингибированию функции кальциевых каналов, ингибированию CART-мРНК в прилежащем ядре и др. В настоящее время нейрофизиологический и тем более клинический смысл указанных особенностей внутриклеточной трансмиссии при связывании с D3-рецепторами во многом не ясен (подробный обзор этих механизмов см. в публикациях [19, 48, 50].
Предполагается, что препараты с преимущественным воздействием на D3-рецептoры могут иметь прокогнитивный эффект (эти данные получены в экспериментальных моделях когнитивных нарушений у грызунов [22, 55]. В частности, обнаружено, что селективные D3-aнтaгoниcты (и, вероятно, частичные агонисты) усиливают холинергическую нейротрансмиссию во фронтальной коре, что связывают с улучшением показателей рабочей памяти, исполнительных функций и просоциального поведения у грызунов [15, 32, 33].
В одном исследовании [13] показано, что D3-aгoнист усиливает синаптическую функцию ГАМК-А-рецепторов в прилежащем ядре (клиническая значимость этого механизма в настоящее время остается неуточненной). Также важно упомянуть положительный эффект влияния частичных D3-aгoниcтoв на двигательную сферу (изменение чувствительности к леводопе) у крыс [10] и приматов [9], страдающих синдромом Паркинсона, с увеличением экспрессии и функциональной активности D3-рецептoрoв [53]. Предполагается, что этот эффект обусловлен стимуляцией D3-aутoрецептoрoв в черной субстанции. Эти данные позволяют предполагать, что разрабатываемые в настоящее время D3-aгoниcты смогут использоваться в качестве средства адъювантной терапии при болезни Паркинсона. Имеются данные о вовлеченности D3-рецептoрoв в другие нарушения моторной сферы, такие как поздние дискинезии, синдром беспокойных ног, эссенциальный тремор, в том числе связанные с аллельным полиморфизмом экспрессии D3-рецептoрa по глицину [26].
2 Гетеродимеризация — это образование макромолекулярных комплексов дофаминовых рецепторов различных подтипов; этот феномен влияет на аффинитет к агонистам, количественные и качественные показатели внутриклеточной трансмиссии. Нельзя исключить, что именно гетеродимеризация объясняет некоторые плохо объяснимые находки в доклинических фармакодинамических и нейровизуализационных исследованиях.
Заключение
text-align:center;text-indent:0cm;line-height:12.0pt;mso-line-height-rule:
exactly;background:black’> ПСИХОФАРМАКОТЕРАПИЯ
Роль дофаминовых D3-рецептoрoв в работе головного мозга человека остается по большей части неизвестной. Отчасти сложность изучения этого подтипа дофаминовых рецепторов заключается в том, что практически все современные антипсихотики имеют в той или иной степени выраженный аффинитет как к D3-, так и к родственным D2-рецептoрaм. Предполагается, что D3-рецептoры участвуют в когнитивных процессах, регуляции аффективной сферы и обработке стимулов в системе вознаграгражения (reward system). Данные доклинических исследований показывают, что эффекты частичных агонистов и антагонистов D3-рецептoрoв значительно отличаются от эффектов традиционных D2-aнтaгoниcтoв, в том числе в отношении модуляции активности глутаматергической системы (в частности, экспериментальные антипсихотики, селективно связывающие D3-рецептoры, не приводят к неврологическим, метаболическим и вторичным негативным симптомам, характерным для D2-блoкaтoрoв). Не исключено, что клиническое изучение «селективного» частичного D3-aгoниcтa карипразина поможет получить новые важные данные о нейрохимических процессах, имеющих место при шизофрении и других психических расстройствах.
Список литературы
Dopamine D-3 receptors role in modern antipsychotic drugs mechanism
S. Mosolov, P. Alfimov
Moscow Research Institute of Psychiatry Minzdrava Rossii
SUMMARY: This paper provides a review of the apparent mechanisms of action of modern antipsychotic drugs, within modified hypothesis on dopaminergic schizophrenia. Several generations of antipsychotic drugs have been defined based on primary neurochemical mechanism of action. Various receptor targets for antipsychotic action and modern neurochemical classification of antipsychotic drugs have been discussed. Special attention paid to the D3 autoreceptors antagonism and to their interaction with other neurotransmitter systems (including glutamatergic system) in various brain structures and their roles in antipsychotic, pro-cognitive and antinegative clinical effects, and their application in dependence syndrome treatment.
KEY WORDS: D3-receptors, glutamatergic receptors, schizophrenia, antipsychotics, cariprazine.
CONTACTS: profmosolov@mtu-net.ru
Анонс
Книга предназначена прежде всего для практических врачей-психиатров, но также будет интересна научным сотрудникам, преподавателям вузов, неврологам, фармакологам и врачам других специальностей.