Антилейкотриеновый препарат что это
Антилейкотриеновый препарат что это
История открытия лейкотриенов начинается в 1938 году, когда W. Feldberg и C.H. Kellaway занимались изучением влияния яда кобры на легкие морских свинок и обнаружили в перфузате легких вещество, способное вызывать медленное, стойкое сокращение гладких мышц. В 1940 г. C.H. Kellaway и E.R. Trethewie заметили, что это сокращение отличается по продолжительности от сокращения, вызываемого гистамином, и назвали новый медиатор медленно реагирующей субстанцией анафилаксии (МРС-А). В 1960 г. W. Brocklehurst заметил, что при добавлении аллергена к фрагментам легкого, взятых у больного бронхиальной астмой, в них вырабатывается МРСА. Это свидетельствует о том, что МРС-А – медиатор, отвечающий за симптоматику бронхиальной астмы, так как он вызывает более длительный бронхоспазм, чем другой бронхоконстриктор, например, гистамин. А в конце 70-х ученым удалось выяснить, что МРС-А является лейкотриенами. И после этого открытия учеными были предприняты попытки создания лекарств, являющихся ингибиторами синтеза и антагонистами лейкотриенов, которые используются при лечении бронхиальной астмы. [2]
Синтез лейкотриенов – это сложный, многоступенчатый процесс, который начинается с отщепления арахидоновой кислоты от фосфолипидов цитоплазматической мембраны с помощью фермента фосфолипаза А2. Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием циклооксигеназы она превращается в простагландины, а под влиянием липоксигеназной ферментной системы в лейкотриены. Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным ферментом является 5-липоксигеназа (5-ЛОГ). Арахидоновая кислота под воздействием комплекса 5-ЛОГ превращается в оксиэйкозатетраеновые кислоты, из которой в свою очередь образуется LТА4. Во внутриклеточной среде к LТА4 под действием LТС4- синтазы присоединяется глутатион и образуется LТС4. Далее LТС4 выходит во внеклеточную среду, где от него отщепляется остаток глутаминовой кислоты и образуется лейкотриен D4. LТЕ4 образуется при отщеплении остатка глицина от LТD4. (рис.1) Лейкотриены С4, D4 и Е4 содержат цистеин, поэтому их называют цистеиновыми лейкотриенами. Именно цистеиниловые лейкотриены были названы МРС-А. Они имеют одно действие, но лейкотриен Е4 имеет меньшую активность. Ферментные системы, необходимые для синтеза лейкотриенов, были обнаружены в альвеолярных макрофагах, тучных клетках и лейкоцитах. А именно эозинофилы и тучные клетки являются основными эффекторами в патогенезе астмы. [4]
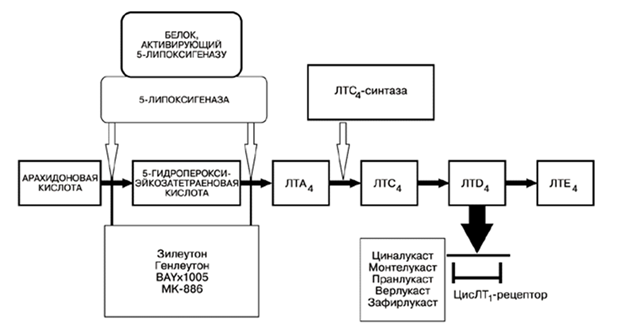
Рис. 1. Биосинтез цистеинил лейкотриенов.
Биологическое действие лейкотриенов опосредовано через рецепторы, которые относятся к группе пуриновых рецепторов, 7-кратно пронизывающих мембрану и связанных с G-белком. По специфическому связыванию с лигандами они делятся на 2 подкласса: связывающиеся с лейкотриеном B4, называемые BLT рецепторами, и цистеинил лейкотриеновые рецепторы – CysLTR. Эндогенными лигандами цистеинил лейкотриеновых рецепторов являются лейкотриены C4, D4 и E4.
Основное биологическое действие LTB4 заключается в стимуляции хемотаксиса, активации макрофагов и синтезе хемокинов и цитокинов. Считается, что он играет важную роль в формировании гнойного воспаления, ревматоидного артрита и других воспалительных заболеваниях. Однако его роль в патогенезе бронхиальной астмы не ясна, так как при использовании антагонистов рецепторов к LTB4 для лечения БА симптоматика не меняется.[5]
Выделяют две разновидности цистеинил лейкотриеновых рецепторов: CysLTR1 и CysLTR2. Эксперименты на мышах с дефицитом CysLTR2 или сверхэкспрессией CysLTR2 в легких показали, что CysLTR2 не способствуют бронхоспазму, а скорее способствуют воспалению, проницаемости сосудов и фиброзу тканей. Цистеиниловые лейкотриены повышают экспрессию таких молекул адгезии, как Р-селектин, который опосредует адгезию лейкоцитов к эндотелию сосудов в процессе острого воспаления. Модификаторы лейкотриенов могут снижать экспрессию цитокинов, блокируя их действия. Обратное явление также верно: цитокины могут модулировать экспрессию лейкотриенов. В целом цистеиниловые лейкотриены вызывают расширение периферических и сужение коронарных сосудов, увеличивают проницаемость бронхов, подавляют пролиферацию лимфоцитов и способствуют их дифференцировке. Ингаляции LTE4 увеличивают число эозинофилов в биоптате дыхательных путей, а ингаляции LTD4 повышают число эозинофилов в мокроте больных с бронхиальной астмой. Также именно этот комплекс ответственен за медленную фазу бронхоспазма при бронхиальной астме. [2,5]
Это объясняет усугубление астматических приступов у больных с непереносимостью нестероидных противовоспалительных препаратов (НПВП). У таких больных в бронхах увеличена экспрессия LTC4-синтазы, что приводит к увеличению продукции цистеиниллейкотриенов. Частичным объяснением этого явления может быть генетический полиморфизм гена LTC4-синтазы. Общий вариант промотора гена создает предрасположенность к аспириновой астме(АА) путем усиления эффекторного механизма бронхоконстрикции. Исследования с аспирином в сочетании с оценкой полиморфизма синтазы LTC 4 и экскреции LTC 4 с мочой указывают на некоторую гетерогенность среди пациентов с AA. Они тормозят образование простагландинов, высвобождая метаболический шунт арахидоновой кислоты в пользу лейкотриенов. Это проявляется в виде покраснений кожных покровов, приступов удушья и кашля, подъема температуры, конъюнктивита и отека Квинке. Степень аллергической реакции на НПВП зависит от антициклооксигеназной активности препарата и его количества. К препаратам с высокой антициклооксигеназной активностью относятся салицилаты (аспирин), полициклические кислоты (индометацин, толметин), ненасыщенные жирные кислоты (диклофенак, ибупрофен, кетопрофен, тиапрофеновая кислота), оксикамы (пироксикам, лорноксикам). [5]
Исходя из выше сказанного для лечения бронхиальной астмы, особенно у пациентов с непереносимостью НПВП, можно применять препараты, действующие на лейкотриеновую систему – антилейкотриены. С теоретической точки зрения, подавить активность лейкотриенов можно двумя путями: первый, это ингибировать их синтез, воздействуя на ферментную систему (в настоящее время удалось ингибировать только фермент 5-липоксигеназу), а второй это препятствовать связыванию лейкотриенов с их рецепторами. На рисунке 1 также показаны основные места действия различных антилейкотриенов. [4]
К первой группе этих препаратов относятся зилеутон (Zileuton) и генлеутон. Они явдяются антагонистами белка, активирующего 5-липоксигеназу. Ко второй антагонисты цистеинил лейкотриеновых рецепторов (CysLTR) – зафирлукаст (Zafirlucast), монтелукаст, циналукаст.
Зилеутон принимают перорально и он быстро всасывается. Жирная пища стимулирует его абсорбцию. При первом прохождении через печень из него образуются глюкурониды. Максимальная концентрация в крови наблюдается через 1,8-2,5 ч. Метаболиты выделяются почками. t
1-2,3 ч. Препарат рекомендован для применения взрослым. [3]
Результаты исследования A.R. Fischer et al. Показали, что прием Зилеутона не только уменьшает воспаление дыхательных путей, но и снижает их реактивность, то есть уменьшается степень и скорость сужения бронхов после контакта с бронхоконстрикторами. [7] Зилеутон помимо лечения бронхиальной астмы может использоваться и при ревматоидном артрите и язвенном колите. При применении Зилеутона возможны побочные эффекты: лихорадка, миалгия, утомляемость, головокружения, головная боль, диспепсия, повышение уровня трансаминаз и другие. [3]
Зафирлукаст избирательно и длительно блокирует рецепторы для LTE4 и LTD4 и обладает выраженным противовоспалительным действием. При бронхиальной астме это проявляется в виде уменьшения проницаемости сосудов, снижения отека слизистой, секреции густой мокроты, расширении бронхиол. Также было замечено, что зафирлукаст блокирует микросомальные ферменты, что сказывается на метаболизме и фармакокинетике других лекарств. Клинический эффект препарата развивается примерно через одни сутки, поэтому он используется для профилактики и длительного лечения бронхиальной астмы. Для купирования острых астматических приступов данный препарат не пригоден. Но он может использоваться в совокупности с быстродействующими антиастматическими лекарственными средствами. [6] Применение зафирлукаста может вызвать такие побочные действия, как головная боль, гастрит, фарингит, миалгия, артралгия и другие.
Препарат принимается перорально, хотя эффективен и при ингаляции. Максимальная концентрация определяется через 3 часа. Приимать следует натощак, так как наличие пищевых масс в кишечнике уменьшает всасывание на 40%. Через гематоэнцефалический барьер проникает плохо. Его метаболиты выделяются кишечником и почками, t
10 ч. Рекомендован для применения взрослым и детям старше 5 лет. [3]
Также к блокаторам антилейкотриеновых рецепторов относится Монтелукаст. Он является избирательным антагонистом LTD4, но в отличие от Зафирлукаста не ингибирует микросомальные ферменты, поэтому не влияет на фармакокинетику других препаратов. Известно, что при блокаде CysLTR1 Монтелукастом значительно снижается эозинофильное воспаление, что сопровождается количественным уменьшением медиаторов: нейрокинина А и вещества Р в лаважной, назальной жидкости пациентов с полиппозом носа и астмой, с непереносимостью НПВС или без нее. [8]
Монтелукаст вводится внутрь, всасывается быстро. Его абсорбция от состава пищи не зависит. Метаболиты выделяются в основном кишечником. t
2,7-5,5 ч. Область применения такая же, как и у Зафирлукаста, но препарат рекомендован для применения взрослым и детям старше 6 месяцев. [3]
Зафирлукаст и Монтелукаст, в настоящее время, активно не используются в связи с низкой эффективностью и высокой стоимостью. Однако они имеют и свои преимущества: простой режим лечения, 1-2-кратный прием и появление эффекта в течение 24 часов после приема препарата. Также на фоне приема антилейкотриенов возможно развитие синдрома Черджа-Стросса, однако этот факт требует дальнейшего изучения. И в современной медицинской практике антагонисты лейкотриенов не применяются для куппирования приступов бронхиальной астмы. [8]
Антилейкотриены могут служить альтернативой монотерапии ингаляционными кортикостероидами при лечении легкой персистирующей астмы у взрослых и детей. Но из-за плохого контроля над астмой и, как следствие, возникновения приступов, и последующего назначения кортикостероидов использование лейкотриенов для монотерапии бронхиальной астмы пока остается под вопросом. Однако применение ингибиторов синтеза лейкотриенов может снизить необходимость экстренного применения ингаляционных стероидов или системного лечения стероидами. [6]
Изучение Конкрейновской базы данных показало, что использование антилейкотриенов при астме менее эффективно, чем использование ингаляционных кортикостероидов (ИГКС). Была проведена оценка 14 эксперементов, 12 из которых были проведены у взрослых, одно у взрослых и подростков (≥ 12лет), одно у детей (
10 лет). Продолжительность вмещательства варьировала от 4 до 37 недель. Из антилейкотриеновых препаратов использовали монтелукаст, пранлукаст и зафирлукаст. У пациентов, получавших антилейкотриены больше, чем кортикостероиды, наблюдалось увеличение обострений бронхиальной астмы. Из этого следует вывод, что применение кортикостероидов более эффективно. [7]
В нашей стране антилейкотриены обозначаются как дополнительная терапия в совокупности с ингаляционными кортикостероидами и являются альтернативой длительно действующим β2-агонистам при персистирующей бронхиальной астме. Но по сравнению с β2-агонистами монтелукаст менее эффективен и к тому же более дорогой.
Современная терапия бронхиальной астмы должна отвечать поставленным целям:
1. Достижение и поддержание контроля симптомов БА в течение длительного времени;
2. Минимизация рисков будущих обострений БА.
Именно поэтому был разработан специальный ступенчатый подход к ее лечению. Каждая ступень соответствует определенной выраженности клинических проявлений БА и представляет собой варианты ее терапии. По данной схеме антилейкотриены могут применять на 2, 3 и 4 ступенях.
На 2 ступени антилейкотриены рекомендуются для терапии пациентам с БА в сочетании с аллергическим ринитом, пациетам с вирусиндуцированной БА, с астмой физического усилия. На 3 ступени – у детей младше 5 лет в качестве дополнения к терапии ИГКС; у детей старше 5 лет лечения БА в качестве дополнения к базисной терапии низкими/средними дозами ИГКС. На 4 ступени детям 5-12 лет с неконтролируемым течением БА на фоне терапии 400 мкг беклометазона дипропионата или его эквивалнента в день в комбинации с длительно действующими бэта-агонистами (ДДБА) рекомендуется увеличение дозы ИГКС до максимальной в сочетании с ДДБА или добавление антилейкотриенов. (рис. 2) [1]
Таким образом, несмотря на большое количество исследований в данной области, эффективность применения антилейкотриеновых препаратов до сих пор остается под вопросом. При их назначении необходимо учитывать соотношение польза/вред, стадию течения бронхиальной астмы, индивидуальные реакции организма на препарат. Но одно можно сказать точно, антилейкотриеновые препараты – это достаточно перспективное направление в области лечения бронхиальной астмы, которое при дальнейшем развитии может привести к разработке новых препаратов и снижении побочных эффектов уже существующих.
Рисунок 2. Ступенчатая терапия бронхиальной астмы.
Антагонисты леикотриеновых рецепторов в лечении бронхиальной астмы
Опубликовано в журнале:
Южно-Российский медицинский журнал »» N 1-2 / 2001 Пульмонология Голубев Л.А., Бабак С.Л., Григорьянц Г.А.
Московский НИИ пульмонологии
В развитии воспаления важное значение имеют генетические факторы, в частности, атопия. В то же время имеется большое количество доказательств, что факторы окружающей среды являются факторами риска и могут приводить к дебюту заболевания.
Вдыхание аллергенов домашнего клеща, пассивное курение являются особенно важными. К факторам риска также относятся воздействие выбросов автомобилей и профессиональных сенсибилизаторов. Развивающееся воспаление ведет к развитию гиперреактивности бронхов, их обструкции, что поддерживается триггерными механизмами [5].
Хроническое воспаление характерно для астмы вне зависимости от ее тяжести. Воспаление сопровождается развитием гиперреактивности бронхов и бронхиальной обструкции, являющихся двумя определяющими факторами, лежащими в основе нарушения легочной функции. Гиперреактивность дыхательных путей проявляется в чрезмерной бронхоконстрикторной реакции на различные раздражители. Бронхи являются важным компонентом в этой реакции. [5].
В патогенез бронхиальной астмы вовлечены различные медиаторы, продуцирующиеся этими клетками, которые вносят свой вклад в повышение бронхиальной реактивности и клинические проявления астмы. Такие медиаторы, как гистамин, простагландины и лейкотриены непосредственно приводят к сокращению гладкой мускулатуры дыхательных путей, повышению проницаемости сосудов, увеличению секреции слизи в просвет дыхательных путей, активируют другие воспалительные клетки, высвобождающие вторичные медиаторы воспаления.
Одним из механизмов нарушения функции дыхания является бронхиальная обструкция.
По данным P.Devillier и соавт. [17] в основе обструкции дыхательных путей лежит сокращение гладкой мускулатуры бронхов, отек слизистой, увеличение секреции слизи и инфильтрация дыхательных путей клетками воспаления (преимущественно эозинофилами).
В последние годы в патогенезе бронхиальной астмы выявлена роль посредников воспаления нового класса, получивших название лейкотриены.
История открытия лейкотриенов [15, 22] связана с исследованием медленно реагирующей субстанции анафилаксии (SAS-A), Broklekast, 1960.
В 1983 г. B.Samuelsson индентифицировал LTC4, LTD4 и LTE4. В 1993 г. L.Laltlnen и соавт. и в 1997 г. Z.Diamant и соавт. [19] описали триггерную реакцию при активизации рецепторов цистеинил-лейкотриенов в дыхательных путях и клетках воспаления, эффект бронхоконстрикции, отек тканей, секрецию слизи в дыхательных путях и стимуляцию клеток воспаления в легочной ткани. Цистеинил-лейкотриены являлись медиаторами обструкции дыхательных путей при астме.
Лейкотриены образуются из арахидоновой кислоты при участии липоксигеназы. Лейкотриены синтезируются различными клетками [31, 26] под воздействием специфических стимулов: IgE, IgJ, эндотоксинов, факторов фагоцитоза.
Роль лейкотриенов в патогенезе бронхиальной астмы заключается в усилении секреции слизи, подавлении ее клиренса, увеличении выработки катионных белков, повреждающих эпителиальные клетки. Лейкотриены усиливают приток эозинофилов, повышают проницаемость кровеносных сосудов. Они ведут к сокращению гладких мышц бронхов, способствуют миграции клеток, участвующих в развитии воспалительного процесса (активированные Т-клетки, тучные клетки, эозинофилы) [13, 35, 39]. В ряде исследований показано, что у больных бронхиальной астмой в моче обнаруживается лейкотриен Е4 [20].
LTC4 и LTD4 обладают мощным бронхоконстрикторным действием. Эффект бронхоспазма, в отличие от вызванного гистамином, развивается медленнее, но является более продолжительным. Лейкотриены усиливают проницаемость сосудов в 1000 раз эффективнее гистамина. Повышение проницаемости венул объясняется образованием щелей за счет сокращения эндотелия. LTD4 более активно влияет на процесс усиления секреции слизи слизистой оболочкой бронхов.
Установлено, что лейкотриены В4, С4, D4, Е4 играют важную роль в механизмах воспаления и вызывают изменения, характерные для бронхиальной астмы [6, 35]. Лейкотриены С4, D4 приводят к ранним изменениям и вызывают миграцию клеток в зону воспаления дыхательных путей.
Клинические эффекты лейкотриена В4 обуславливают хемотаксис лейкоцитов, адгезию нейтрофилов к эндотелию, освобождение протеаз и образование супероксида нейтрофилами. Это способствует повышению проницаемости капилляров. Лейкотриены D4, С4 и Е4 приводят к спазму гладкой мускулатуры бронхов, развитию отека, привлечению эозинофилов, повышению секреции слизи и нарушению ее транспорта.
Установлено, что лейкотриены связываются рецепторами, локализованными на плазматических мембранах клеток [7]. Выделено три основных типа рецепторов лейкотриенов.
1. Рецептор LTI к лейкотриенам LTC/D/E4. Данный рецептор опосредует бронхоконстрикторный эффект лейкотриенов.
2. Рецептор LT2 к LTC/D/E4; ему принадлежит важная роль в контроле над сосудистой проницаемостью.
3. Рецептор LTB4 опосредует хемотаксический эффект лейкотриенов.
Ингибиторы рецепторов лейкотриенов
Представления о лейкотриенах, как о медиаторах воспаления, позволили разработать концепцию создания нового класса лекарственных препаратов, получивших название «антилейкотриеновые субстанции» [7, 12].
Антилейкотриеновые субстанции включают в себя антагонисты рецепторов к цистеиновым лейкотриенам и препараты, ингибирующие синтез лейкотриенов [24].
Создание лекарственных препаратов, влияющих на синтез лейкотриенов, осуществляется в следующих направлениях. [1, 9, 21, 34, 36].
1. Создание антагонистов рецепторов лейкотриенов. К ним относятся зафирлукаст (акколат, субстанция 1С1204219) пранлукаст (субстанция ONO-1078), побилукаст (субстанция SKF 104353), монтелукаст (сингуляр, субстанция МЛ-0476).
2. Поиск ингибиторов 5-липоксигеназы. Представителем этой группы препаратов является зилеутон (субстанция Ф-64077).
Экспериментальными исследованиями показано, что антагонисты рецепторов лейкотриенов препятствовали развитию бронхоспазма, снижали количество воспалительных клеток (лимфоцитов и эозинофилов) в бронхоальвеолярной жидкости. Данные клинических исследований свидетельствуют о том, что антагонисты лейкотриеновых рецепторов предупреждают развитие симптомов бронхиальной астмы, улучшают функцию легких [40].
Показано, что in vitro антагонисты цистеинил-лейкотриенов конкурируют с лейкотриеном D4 за связь с рецепторами, которые присутствуют в мембранах клеток легких морских свинок и человека [16]. Их сходство с лейкотриеном D4 превышает естественный лиганд примерно в два раза. Антагонисты лейкотриенов (зафирлукаст, монтелукаст, побилукаст) блокируют лейкотриены D4 и Е4, вызывающие сокращение гладкой мускулатуры изолированной трахеи морской свинки, но не блокируют спазм, вызванный лейкотриеном С4. Под их влиянием уменьшается концентрация медиаторов воспаления в зоне развития воспалительного процесса, тормозится заключительная фаза антигениндуцированного бронхоспазма, обеспечивается защита при различных провокациях. [8, 10, 11, 30, 32, 33, 36]
Все ингибиторы рецепторов лейкотриенов с различной степенью активности предупреждают LTD4-индуцированную бронхоконстрикцию [30]. Они блокируют ранний и поздний ответ на воздействие антигена, эффекты на влияние холода и аспирина, увеличивают FEV при легкой и умеренной астме, снижают применение бета-агонистов, усиливают действие антигистаминных препаратов.
Антилейкотриеновые препараты хорошо переносятся больными, не приводят к развитию серьезных осложнений [38]. Важным является то обстоятельство, что они применяются в таблетированной форме один-два раза в день.
Последние исследования показывают, что антагонисты лейкотриенов могут быть использованы в качестве альтернативы кортикостероидной терапии при устойчивой астме легкого течения [21, 27]. Антагонисты лейкотриенов снижают дозу ингаляционных кортикостероидов при обострении астмы.
Лейкотриен D4, действуя на гладкую мускулатуру бронхов, не влияет на синтез ДНК, содержание РНК, коллагена, эластина, бигликана, фибронектина [29]. Некоторые антилейкотриены активировали в печени микросомальную активность и аминотрансферазы.
Антилейкотриены эффективны при индукции бронхоспазма аллергенами, холодным воздухом, физическими упражнениями, аспирином. Клинические наблюдения осуществлены, как в течение короткого, так и длительного наблюдения [23].
Антагонисты лейкотриенов позволяют снизить дозировку других препаратов, используемых для лечения бронхиальной астмы, в частности, b2-агонистов [18]. В настоящее время признано, что лучшим противовоспалительным эффектом обладают кортикостероиды. В то же время, при их длительном применении могут возникать серьезные побочные эффекты [40]. Многие пациенты испытывают трудности при пользовании устройствами для ингаляции, так как ее необходимо проводить несколько раз в день. Отмечены случаи развития локальной и системной толерантности к кортикостероидам [18, 41]. Необходимы дальнейшие исследования в целях определения их эффективности при совместном применении с ингаляционными кортикостероидами [14, 39].
Антилейкотриеновый препарат что это
Н.Г. Алиева, В.В. Омельяновский, С.А. Пронина
Сегодня лечение бронхиальной астмы является одной из серьезнейших проблем здравоохранения во всем мире. И это не случайно, так как за последние десятилетия это заболевание из относительно редко встречающихся в клинической практике превратилось в одно из наиболее распространенных. По данным ВОЗ, в мире насчитывается около 100 млн. больных бронхиальной астмой, причем основной контингент заболевших составляют лица трудоспособного возраста и дети.
В связи с тем, что в основе развития бронхиальной астмы лежит хронический воспалительный процесс в бронхиальном дереве, ингаляционные глюкокортикоиды, обладающие высокой противовоспалительной активностью, рассматриваются сегодня как препараты первого ряда в лечении данного заболевания.
Однако в последние годы все более пристальное внимание специалистов начали привлекать лекарственные препараты с антилейкотриеновым механизмом действия. После 20 лет широкого использования при бронхиальной астме ингаляционных кортикостероидов и кромонов в качестве базисных противовоспалительных средств появление антилейкотриеновых препаратов позволяет сделать новый важный шаг в лечении этого заболевания.
Исследования показали, что эти энзимы принимают участие в высвобождении арахидоновой кислоты, последующий метаболизм которой может происходить с образованием простагландинов, тромбоксана А2 и лейкотриенов, часто называемых эйкозаноидами. Циклооксигеназа (COX) опосредует один из путей метаболизма арахидоновой кислоты с образованием простагландинов и тромбоксана А2. Существует две формы этого энзима: COX-1, которая содержится во многих клетках и принимает участие в физиологических клеточных реакциях, не связанных с развитием воспаления, и COX-2, регулирующая синтез простагландинов, индуцированный различными провоспалительными стимулами. Ключевым энзимом в синтезе лейкотриенов является 5-липооксигеназа, которая в присутствии мембранного протеина, имеющего название 5-липооксигеназо-активированный протеин (FLAP), приводит к образованию 5-гидроксиперокси-эйкозатетраеновой кислоты (5-HPETE) с последующим формированием лейкотриена А4 (LTA4). LTA4, в свою очередь, может быть метаболизирован в LTB4 при участии LTA4-гидролазы или в LTC4 в результате коньюгации с глютатионом при участии LTC4-синтетазы. LTC4 активно транспортируется из клеток и в дальнейшем метаболизируется в LTD4 и LTE4.
LTE4 в неизменном виде и в виде активных метаболитов экскретируется мочой. В настоящее время метод измерения LTE4 в моче широко используется исследователями для оценки уровня синтеза лейкотриенов.
LTB4 продуцируется преимущественно нейтрофилами, и одним из его важнейших эффектов является хемотаксис нейтрофилов; в меньшей степени выражено влияние этого лейкотриена на эозинофильный хемотаксис [10]. Учитывая, что данные о роли нейтрофилов в патогенезе астмы противоречива, хотя продемонстрировано увеличение их числа в бронхоальвеолярном лаваже у пациентов с этим заболеванием, в особенности после воздействия химических агентов [9], значение LTB4 в механизмах развития астмы также пока остается неясной. Другие лейкотриены – LTC4, LTD4 и LTE4, известные как «сульфидопептидные лейкотриены» или «цистеинил-лейкотриены», продуцируются эозинофилами, тучными клетками, макрофагами, моноцитами и базофилами [24]. Их роль в патогенезе бронхиальной астмы сегодня не вызывает сомнений.
Роль цистеинил-лейкотриенов при бронхиальной астме
Бронхиальная астма – это хроническое воспалительное заболевание, в основе которого лежит бронхоспазм, формирующийся в ответ на различные неспецифические стимулы. Известно 4 наиболее важных механизма, ведущих к образованию обструкции дыхательных путей: спазм гладкой мускулатуры бронхов, отек их слизистой оболочки вследствие пропотевания протеина и воды, увеличение секреции слизи и инфильтративное эозинофильное воспаление [25].
Экспериментально установлено, что лейкотриены могут принимать участие в каждом из вышеперечисленных механизмов. Так, в исследованиях in vitro, LTC4 и LTD4 оказывали сходный по силе бронхоконстрикторного действия эффект, в 1000 раз превосходящий эффект гистамина. В отношении LTE4 данные более противоречивы. Одни считают, что по силе бронхоконстрикторного эффекта он эквипотентен LTC4 и LTD4 [23], по мнению других, он обладает значительно менее выраженным действием [38]. После бронхоспазма у больных отмечалось повышение экскреции LTE4 с мочой.
Кроме того, в исследованиях с помощью меченого альбумина и с использованием флюорисцентного метода у морских свинок была доказана роль лейкотриенов в повышении проницаемости капилляров и увеличении секреции слизи [22,36]. Также было продемонстрировано значение лейкотриенов в хемотаксисе клеток воспаления, хотя точный механизм этого феномена пока еще остается неясным [34].
Фармакологический контроль лейкотриеновых механизмов развития воспаления
Лекарственные препараты, которые селективно воздействуют на лейкотриеновые патофизиологические механизмы, принято называть антилейкотриеновыми. Существуют две основных стратегии их терапевтического применения. Первая состоит в использовании 5-липооксигеназных ингибиторов, которые в настоящее время могут быть классифицированы на препараты, непосредственно ингибирующие 5-липооксигеназу, и препараты, связывающиеся с FLAP (18 кД трансмембранный протеин, соединяющийся с 5-липооксигеназой до начала биосинтеза лейкотриенов из арахидоновой кислоты). К препаратам прямого 5-липооксигеназного ингибирования относятся зилеутон и новое пероральное средство ICI-D2318. Другие препараты этой группы – МК-886, связывающийся с FLAP, ВАУ-1005 и МК 0591 – являются сильными ингибиторами лейкотриеновых соединений и сегодня находятся в процессе изучения.
Вторая стратегия – ингибирование активности лейкотриенов путем использования антагонистов их рецепторов (зафирлукаст, монтелукаст, пранлукаст).
Ингибиторы биосинтеза лейкотриенов подавляют образование LTB4 и цистеинил-лейкотриенов (CysLT1), тогда как антагонисты CysLT1 селективно ингибируют их рецепторное взаимодействие. Среди CysLT1-антагонистов широкое применение в клинике нашли следующие препараты (таблица).
На сегодняшний день для лечения бронхиальной астмы во многих странах уже зарегистрированы антагонисты цистеинил-лейкотриенов – монтелукаст, пранлукаст и зафирлукаст. Эти препараты предназначены для использования внутрь и способны существенно изменять дозозависимый ответ при ингаляции LTD4 у здоровых лиц или пациентов с бронхиальной астмой.
Широко применяется для лечения астмы и 5-липооксигеназный ингибитор (5-ЛОИ) зилеутон. В России в настоящее время разрешены к применению зафирлукаст и монтелукаст.
Роль антилейкотриеновых препаратов в лечении бронхиальной астмы
Хотя уже зарегистрирован и разрешен к применению целый ряд антилейкотриеновых препаратов, интерес к ним, как к сравнительно новому классу противоастматических средств, остается крайне высоким, что подтверждается многочисленными научными публикациями. Следует отметить, что первоначальные исследования с 5-ЛОИ пирипростом и доцебеноном окончились неудачей: препараты не оказывали значимого эффекта у больных с вызванной аллергеном бронхоконстрикцией и не изменяли порог бронхиальной чувствительности по отношению к ацетилхолину [12]. Исследования с зилеутоном принесли более обнадеживающие результаты. При однократном использовании внутрь в дозе 800 мг препарат значительно уменьшал бронхоконстрикторный ответ больных астмой при вдыхании холодного сухого воздуха [20].
На сегодняшний день этот препарат является единственным 5-ЛОИ, доступным для клинического использования, хотя к применению у взрослых и детей не моложе 12 лет он был разрешен в США еще в 1996 г. Результаты клинических наблюдений свидетельствуют, что применение зилеутона при бронхиальной астме приводит к значительному возрастанию показателей легочной функции как при кратковременном, так и длительном использовании. При этом бронходилатационный эффект препарата проявлялся уже через 1-2 часа после однократного введения [21].
Длительное использование зилеутона у взрослых пациентов с легкими и умеренными проявлениями бронхиальной астмы ведет не только к возрастанию показателей функции внешнего дыхания, но и к снижению потребности в использовании бета-адреномиметиков, ослаблению симптомов астмы и значительному уменьшению уровня LTE4 в моче [19]. Наряду с подавлением продукции цистеинил-лейкотриенов препарат одновременно снижает и уровень LTB4. И хотя роль LTB4 в патогенезе бронхиальной астмы до конца еще не изучена, высказываются предположения, согласно которым зилеутон может оказаться особенно полезным в качестве средства дополнительной терапии у некоторых больных с «ночной» и стероидозависимой формами астмы с высоким уровнем этого лейкотриена в бронхоальвеолярном лаваже [45]. Уровень LTB4, который, как известно, стимулирует хемотаксис нейтрофилов в очаг воспаления, прямо коррелирует с количеством этих клеток и уменьшается на фоне длительного применения зилеутона. Одновременно у пациентов наблюдается ослабление симптомов астмы и возрастание показателей легочной функции в ночное время.
В настоящее время в многочисленных исследованиях продемонстрирована эффективность антилейкотриеновых препаратов при проведении провокационных тестов с аллергенами, холодным воздухом, аспирином и физической нагрузкой. В остром тесте с бронходилатацией, использование этих препаратов приводило к достоверному повышению FEV1 в среднем на 10-20%, причем отмечалась прямая взаимосвязь между величиной ответа и степенью изменения FEV1 [18]. Более того, бронходилататорный ответ к зафирлукасту и МК-571 был аддитивен по отношению к эффекту бета-адреномиметиков, что подразумевает различные пути воздействия этих препаратов на процесс расслабления гладкой мускулатуры бронхов [14].
Зафирлукаст (Аколат, AstraZeneca) стал первым антагонистом лейкотриеновых рецепторов, зарегистрированным в США (сентябрь 1997 г.) и одобренным для клинического применения у пациентов в возрасте 12 лет и старше. Клинические плацебо-контролируемые испытания продемонстрировали способность препарата не только снижать бронхоспастический ответ после ингаляции метахолина и различных аллергенов при однократном использовании, но и ослаблять ночные и дневные симптомы астмы, а также уменьшать использование бета-адреномиметиков короткого действия при 6-недельном применении [41]. Зафирлукаст в одинаковой степени противодействует сокращению гладкой мускулатуры под воздействием всех трех пептидных лейкотриенов (LTC4, LTD4, LTE4). Специфичность препарата доказана в клинических исследованиях, в которых продемонстрировано, что зафирлукаст действует только на рецепторы к лейкотриенам, но не взаимодействует с простогландиновыми, тромбоксановыми, холинергическими и гистаминовыми рецепторами. В плацебо-контролируемых исследованиях при сегментарной бронхопровокации с последующим бронхоальвеолярным дренажем в течение 2 суток зафирлукаст снижал подъем уровня базофилов, лимфоцитов и гистамина, уменьшая стимулированную продукцию супероксидов альвеолярными макрофагами. Препарат ослаблял возрастающую после провокации ингаляционными аллергенами гиперреактивность бронхов и их констрикцию, индуцированную фактором активации тромбоцитов. Помимо этого, при длительном приеме препарата в дозе 20 мг 2 раза в сутки снижалась чувствительность к метахолину. Зафирлукаст также дозозависимо купировал бронхоспазм, вызванный ингаляционным введением лейкотриена D4. Учитывая, что больные астмой в 10 раз чувствительнее к бронхоспазму, вызванному действием лейкотриена D4, прием внутрь таблетированного зафирлукаста (одной дозы) позволяет таким пациентам вдыхать в 100 раз большую дозу лейкотриена D4 и при этом сохранять защитный эффект в течение 12 и 24 часов. Уменьшение количества дневных приступов астмы, снижение потребности в приеме бета2-агонистов и улучшение показателей среднего утреннего PERF в 1,5-2 раза под влиянием зафирлукаста (Аколата) было продемонстрировано в исследовании Lockey и соавт., в котором продолжительность лечения Аколатом (n=514) в сравнении с плацебо (n=248) составляла 13 недель [30]. Spector и соавт. показали значительное уменьшение числа ночных пробуждений у пациентов, получающих Аколат в течение 6 недель [39]. В обоих исследованиях Аколат назначался в дозе 20 мг 2 раза в сутки в сочетании с симптоматическим приемом бета2-адреномиметики, в контрольной группе назначались только бета2-адреномиметики.
Зафирлукаст препятствует развитию бронхоспазма, возникающего вследствие воздействия таких провокаторов, как холодный воздух и физическая нагрузка, а также ослабляет ранние и поздние фазы воспалительных реакций, вызываемых различными аллергенами (растения, шерсть и перхоть животных, перо, амброзия, смешанные антигены). Терапевтически значимый эффект после назначения Аколата развивается в течение первых недель приема, реже – уже в первые дни. Препарат подвергается метаболизму в печени с помощью ферментной системы цитохрома Р-450 и потенциально может вступать во взаимодействия с другими препаратами, метаболизирующимися в печени аналогичным образом. Одновременное использование с варфарином приводит к увеличению протромбинового времени, и поэтому необходимо проведение мониторинга у пациентов, получающих эти препараты. Совместное использование с эритромицином и теофиллином приводит к снижению плазменной концентрации зафирлукаста без заметных изменений в их собственной концентрации. Данные о совместном назначении зафирлукаста с другими препаратами, взаимодействующими с энзимной системой цитохрома Р-450 (антагонисты кальция, цизаприд, астемизол и др.), пока не опубликованы, и этот вопрос требует дальнейшего изучения.
Как правило, при длительном применении зафирлукаста не отмечается развитие серьезных побочных эффектов. Лишь в единичных случаях лечение этим препаратом ассоциируется с проявлениями синдрома Chrug-Strauss, редко упоминаемого в отечественной литературе. Он может наблюдаться у больных со стероидо-зависимой формой бронхиальной астмы при одновременном снижении системной гормональной терапии и назначении антилейкотриеновых препаратов. Клинически синдром проявляется эозинофильным гранулематозным васкулитом верхних и нижних дыхательных путей, а также симптомами ринита, синусита и астмы. Однако, по мнению многих исследователей, развитие синдрома не связано непосредственно с использование антилейкотриенов, а обусловлено исключительно снижением дозы кортикостероидов, ассоциирующимся с их назначением [11,17,43].
Более четко идентифицированными побочными эффектами зафирлукаста являются головная боль, ринит, симптомы гастрита [41,44].
Монтелукаст (Сингуляр, MSD) является вторым антагонистом лейкотриеновых рецепторов, разрешенным к применению в России. Это единственный на сегодняшний день антилейкотриеновый препарат, одобренный для использования у детей с 6 лет. Аффинность монтелукаста по отношению к лейкотриеновым рецепторам, по данным исследований in vitro, сопоставима с таковой пранлукаста и зафирлукаста [32].
Препарат обладает широким терапевтическим диапазоном (от 5 до 250 мг) и способен ингибировать индуцированную LTD4 острую бронхоконстрикцию у больных с бронхиальной астмой. Монтелукаст имеет быстрое начало действия – уже через 15 минут после его внутривенного введения в дозе 7 мг отмечалось повышение FEV1 на 18,4, 12,9 и 7.3% в среднем в течение первого часа, а клинический эффект препарата проявляется уже после однократной принятой внутрь дозы [7].
У пациентов с умеренными и тяжелыми проявлениями бронхиальной астмы однократный прием 100 или 250 мг монтелукаста приводил к значительному повышению FEV1 (с 55% до 79% от нормального уровня) уже через 1 час после назначения, причем этот эффект сохранялся в течение 6 часов [37]. В клинически значимой дозе (10 мг/дн) монтелукаст предотвращал развитие ранней и поздней фаз аллергических реакций при использовании провоцирующих тестов с аллергеном у больных с легкой персистирующей формой астмы.
Доказано участие лейкотриеновых механизмов в развитии астмы, провоцируемой физическим напряжением [3]. При длительном применении (8-12 недель) монтелукаст оказывал значительный бронхопротективный эффект у больных с легкой персистирующей формой астмы и астмой физического напряжения после выполнения стандартного 6-минутного теста с физической нагрузкой на тредмиле. Одновременно у больных отмечалось значительное снижение потребности в бета-адреномиметиках после выполнения физических упражнений [16]. Villaran и соавт. исследовали кратковременные и длительные эффекты сальметерола и монтелукаста у больных с легкой формой астмы, провоцируемой физическим напряжением [4]. Авторы сделали вывод о преимуществе монтелукаста у данной категории больных: препарат обеспечивал лучший бронхопротективный эффект при длительном лечении (4-8 недель и более). Однако эти результаты нуждаются в дополнительном подтверждении, и на сегодняшний день антилейкотриеновые препараты все еще не рассматриваются в качестве альтернативы пролонгированным симпатомиметикам.
Открытым остается пока и вопрос о способности антагонистов лейкотриеновых рецепторов представлять собой реальную альтернативу ингаляционным кортикостероидам при лечении больных с легким течением бронхиальной астмы. Дело в том, что несмотря на высокую эффективность ингаляционных кортикостероидов, при их применении врачам приходится сталкиваться с целым рядом проблем. К ним можно отнести неумение пациентов правильно использовать ингаляционные препараты, сложности в овладении техникой ингаляции, развитие системных эффектов при использовании ингаляционных кортикостероидов в дозах, превышающих 1500 мкг, отказ больных от использования любых гормональных средств из-за «стероидофобии», невысокая комплаентность. Поэтому большие надежды возлагаются на результаты контролируемых рандомизированных исследований с антилейкотриеновыми препаратами и ингаляционными кортикостероидами.
В исследованиях Reiss и соавт. показан аддитивный эффект принятой однократно оральной дозы монтелукаста и ингаляционных глюкокортикоидов [37]. Длительное использование монтелукаста в комбинации с беклометазоном дипропионатом обеспечивало лучший контроль над симптомами астмы, что проявлялось в снижении числа приступов удушья и улучшении показателей функции внешнего дыхания [28].
В работе Haahtela и соавт. обсуждается возможность приравнивания эффектов антилейкотриеновых препаратов к эффектам низких доз ингаляционных кортикостероидов в ходе длительного лечения (4-13 недель) легкой персистирующей астмы [15]. В более поздних исследованиях оценивалось назначение монтелукаста в качестве дополнительной терапии у более тяжелой категории больных с бронхиальной астмой, которая недостаточно контролировалась с помощью традиционной терапии, включая ингаляционные кортикостероиды. Как оказалось, применение монтелукаста позволяет не только обеспечить большую стабильность состояния пациентов, но и снизить дозы ингаляционных стероидов [5]. Это позволило авторам рекомендовать антагонисты лейкотриеновых рецепторов, в частности, монтелукаст, для длительного лечения больных, требующих назначения высоких доз ингаляционных кортикостероидов. Эти данные согласуются с результатами исследований Tamaoki и соавт., которые продемонстрировали аддитивность клинических эффектов антагонистов лейкотриеновых рецепторов и ингаляционных кортикостероидов [42].
Недавно проведенные клинические испытания показали снижение общего числа циркулирующих эозинофилов во время лечения монтелукастом, что коррелировало с ослаблением симптомов астмы, улучшением легочных показателей и значительным уменьшением содержания эозинофилов в мокроте. Имеются данные, что другие антилейкотриеновые препараты (зилеутон и зафирлукаст) ингибируют миграцию эозинофилов в дыхательные пути у астматиков после провокационного теста с аллергеном, что подтверждает способность цистеинил-лейкотриенов в большей степени, чем LTB4, содействовать этому потенциально негативному процессу [27,29]. Снижение содержания эозинофилов в периферической крови и в дыхательных путях было обнаружено и при совместном использовании антагонистов лейкотриеновых рецепторов и ингаляционных кортикостероидов. Хотя механизмы этого эффекта не до конца изучены, предполагают, что кортикостероиды укорачивают время жизни эозинофилов путем усиления апоптоза, а антагонисты лейкотриеновых рецепторов замедляют созревание эозинофилов в костном мозге за счет ингибирования синергических эффектов цистеинил-лейкотриенов и пептидных факторов роста [13,46].
После орального назначения 10 мг монтелукаста здоровым добровольцам всасывается примерно 64% принятой дозы, а максимальная концентрация препарата в плазме крови достигается через 3-4 часа. На второй день после приема монтелукаста его концентрация находится на стабильном (steady state) уровне. Прием пищи не влияет на абсорбцию препарата. Степень проникновения монтелукаста через гематоэнцефалический барьер незначительна. В исследованиях у животных монтелукаст проникал через плацентарный барьер и в грудное молоко [33]. Препарат метаболизируется в печени с помощью ферментной системы цитохрома Р-450 с образованием метаболитов и элиминируется преимущественно с желчью. Фармакокинетика монтелукаста приблизительно одинакова у добровольцев в возрасте 20-45 лет и пожилых субъектов в возрасте 65 лет и старше. У детей от 5 до 14 лет при приеме препарата в оральной дозе 5 мг достигались эффекты, аналогичные таковым у взрослых при его приеме в дозе 10 мг. Монтелукаст проявляет низкую степень лекарственного взаимодействия с другими препаратами, также метаболизируемыми в печени: при его применении в клинически значимой дозе (10 мг) не было отмечено значимых взаимодействий с такими лекарственными средствами, как варфарин, дигоксин, терфенадин, оральные контрацептивы, теофиллин, преднизон или преднизолон. Фенобарбитал повышает скорость метаболизма монтелукаста, однако в клинических исследованиях коррекция дозы препарата в этой связи не проводилась.
Рекомендуемая доза монтелукаста для взрослых и подростков старше 15 лет – 10 мг в сутки, для детей в возрасте от 6 до 14 лет – 5 мг в сутки. Производитель препарата рекомендует осуществлять его прием в вечернее время, что обеспечивает более высокие плазменные концентрации монтелукаста в ранние утренние часы, когда наблюдается наиболее высокое сопротивление дыхательных путей [31]. Во время лечения монтелукастом следует избегать резкого снижения дозы ингаляционных кортикостероидов. При включении в терапию монтелукаста пристальное наблюдение необходимо за стероидозависимыми больными, получающими оральные глюкокортикоиды, особенно при снижении дозы последних.
В США монтелукаст разрешен для профилактики и длительного лечения астмы у взрослых и детей в возрасте 6 лет и старше. В Великобритании, согласно рекомендациям Королевского врачебного колледжа, препарат используется как дополнительное средство у больных с легкими и умеренными проявлениями бронхиальной астмы, которые недостаточно контролируются ингаляционными кортикостероидами и бета-адреномиметиками короткого действия. Поэтому препарат не является средством монотерапии и не может служить альтернативой ни ингаляционным кортикостероидам, ни пролонгированным бета-адреномиметикам [2]. Хотя монтелукаст является эффективным средством профилактики бронхоспазма, вызванного физическими нагрузками, в США и Великобритании он рекомендуется в качестве монотерапии при этом состоянии. Вопрос о безопасности использования монтелукаста у беременных женщин и кормящих матерей требует дальнейшего изучения, однако в исследованиях на животных тератогенный эффект препарата отмечен не был.
Антилейкотриеновые препараты и «аспириновая астма»
Неоспоримо значение антилейкотриеновых препаратов при лечении так называемой «аспириновой астмы» или «аспириновой идиосинкразии». Данный синдром проявляется развитием приступов бронхоспазма и/или ринита при приеме аспирина и других нестероидных противовоспалительных средств. Патогенез развития «аспириновой астмы» связан с чрезмерной продукцией лейкотриенов, образующихся в результате метаболизма арахидоновой кислоты преимущественно 5-липооксигеназным путем, вследствие блокады препаратами данного класса циклооксигеназного способа метаболизма. Установлено, что использование антилейкотриеновых препаратов у данной категории больных приводит к достоверному улучшению показателей функции внешнего дыхания (FVC, FEV1), ослаблению симптомов астмы и снижению повышенного уровня LTE4 в моче [21].
Результаты контролируемых исследований антилейкотриеновых препаратов свидетельствуют, что их наиболее часто наблюдаемыми побочными эффектами являются диспептические расстройства, диарея, головная боль и повышение уровня печеночных энзимов (АСТ или АЛТ) [33,40]. По имеющимся данным, монтелукаст обладает достаточно широким терапевтическим диапазоном: в клинических исследованиях у взрослых он не вызывал нежелательных побочных явлений при использовании сверхвысоких доз, в 20-90 раз превышавших рекомендуемые (10 мг/дн), что позволяет говорить о высоком индексе безопасности препарата [33]. Однако есть сообщения о риске развития синдрома Churg-Strauss при применении зафирлукаста, монтелукаста и пранлукаста (см. выше).
В заключение следует подчеркнуть, что из-за высокой стоимости антилейкотриеновых препаратов на сегодняшний день представляется достаточно сложным обосновать их широкое применение при бронхиальной астме с точки зрения соотношения клинической и экономической эффективности. В этой связи фармакоэкономические аспекты использования антилейкотриеновых препаратов требуют тщательного изучения.

