Антитела к прогестерону что это
Иммуногистохимическое исследование рецепторной чувствительности к эстрогенам и прогестерону в эндометрии (2 антитела ER+PR)
Описание
Иммуногистохимическое исследование рецепторной чувствительности к эстрогенам и прогестерону в эндометрии (2 антитела ER+PR) — исследование биоптата ткани, меченой антителами, под микроскопом. Анализ выполняется для выяснения причин бесплодия, а также для оценки злокачественности процессов в тканях матки.
ИГХ-исследования проводят после выполнения гистологического исследования.
Иммуногистохимическое исследование
Вид морфологического исследования тканей, полученных в ходе биопсии, и меченых специфическими антителами. В основе метода лежит принцип взаимодействия «антиген-антитело». Ткань, в которой происходит патологический процесс, экспрессирует антигены. При нанесении на образец ткани антител, образуется комплекс «антиген-антитело». Благодаря меткам, он становится доступным для визуализации. Врач-патоморфолог изучает количество клеток, окрашенных маркёром. Он определяет в исследуемой ткани локализацию клеток, гормонов и их рецепторов.
Иммуногистохимическое исследование полученного материала включает:
Рецепторы присутствуют в различных тканях, в том числе в молочных железах и матке.
Рецепторы к эстрогену (ER) и прогестерону (PR) являются веществами белковой природы, которые локализованы на поверхности опухолевой клетки. Под влиянием женских половых гормонов, рецепторы формируют комплекс, который стимулирует появление новых опухолевых клеток. Разрушение этого механизма лежит в основе гормонотерапии.
Иммуногистохимическое определение ER и PR способно повести дифференциальную диагностику характера опухоли, выявить чувствительность опухоли к гормонам. Анализ позволяет скорректировать и уточнить лечение, а также оценить эффективность.
Опухоли с высоким содержанием рецепторов к эстрогенам и прогестерону являются высокодифференцированными. Они обладают низкой пролиферативной активностью и характеризуются не агрессивным течением. Опухоли с такими показателями хорошо отвечают на гормональную терапию и имеют хороший прогноз. Эффективность гормональной терапии составляет около 50% при опухолях, экспрессирующих рецепторы к эстрогенам, и 75% при опухолях, экспрессирующих рецепторы к обоим гормонам.
Если опухолевые клетки имеют низкое число рецепторов к эстрогенам, гормональная терапия обычно неэффективна. Исключение составляют случаи, когда опухолевые клетки экспрессируют рецепторы только к прогестерону. При таком варианте гормональная терапия эффективна у 10% таких больных.
При проведении гистологического исследования в сторонней лаборатории необходимо обязательно предоставить протокол гистологического исследования.
Интерпретация результатов
Ответ выдается в виде описания микропрепарата, применяемых красителей и заключения. В заключении указано в процентном соотношении число клеток, где определяется экспрессия антител к эстрогену и прогестерону. Заключение может интерпретировать только врач, направивший на проведение исследования.
Лабораторная диагностика нарушений репродуктивной системы (часть 2)
Нечаев В.Н., к.б.н.
Определение уровня пролактина
Первым этапом лабораторного обследования лиц обоего пола, страдающих нарушениями репродуктивной функции, по рекомендации ВОЗ является измерение концентрации пролактина (молочного гормона) в сыворотке (плазме) крови. Пролактин не оказывает непосредственного влияния на функциональную активность половых желез, в то же время уровень пролактина в крови четко коррелирует с состоянием гипоталамуса и аденогипофиза. Пролактин регулирует секрецию молока во время лактации. Пролактин является гормоном-антагонистом ФСГ и ЛГ, и при повышении выработки пролактина нарушается гормональная функция яичников и возникает гиперпролактинемическая форма бесплодия. Физиологическая гиперпролактинемия наблюдается у женщин, кормящих грудью. У некормящих женщин повышенный уровень пролактина может быть связан с приемом некоторых лекарственных препаратов, опухолью гипофиза или нарушением его работы. Одним из проявлений гиперпролактинемии является выделение молозива или молока из молочных желез, особенно у нерожавших женщин. Патологические изменения в организме, при повышенных или пониженных уровнях пролактина представлены в таблице 1.
Таблица 1. Патологические изменения в организме при повышенных или пониженных уровнях пролактина
Увеличение концентрации
Неврогенные и психиатрические нарушения, нарушения менструального цикла
Показания к определению:
Женщины детородного периода:
Пролактин имеет довольно выраженный циркадный ритм с максимальным выбросом гормона во время ночного сна. Забор крови рекомендуется проводить утром (8-10 ч), в раннюю фолликулиновую фазу цикла (у женщин с регулярным циклом) и в спокойной обстановке. Для исключения случайного повышения уровня пролактина в ответ на стресс (взятие крови) желательно 2-3-кратное исследование.
Современные ИФА тест-системы на определение ФСГ и ЛГ основаны на использовании монклональных антител, которые не имеют перекрестной реакции с близкородственными гормонами ТТГ и ХГЧ.
В таблице 11 приведены концентрации ХГч в сыворотке крови женщины в динамике физиологической беременности.
Обзор по иммунологии репродукции

а. Два выкидыша или две неудачные попытки ЭКО
б. Недостаточный ответ яичников на стимуляцию овуляции (менее 6 яйцеклеток).
г. Бесплодие неясного генеза
д. Диагностированные иммунологические проблемы (антиядерные антитела, ревматоидный артрит и/или системная красная волчанка)
е. Осложненный акушерский анамнез – задержка развития плода во время предыдущих беременностей.
ж. Один живой ребенок и повторные выкидыши при попытке вынашивания следующих беременностей
2. Иммунологические анализы.
HLA-типирование на примере II класса HLA DQA1.
Этот анализ позволяет определить, насколько совпадают последовательности ДНК в супружеской паре. При нормальной беременности отцовские гены эмбриона, чужие для материнского организма, заставляют его вырабатывать защитную реакцию в отношении эмбриона. Если ДНК отца очень сильно совпадает с материнской, эмбрион может оказаться генетически почти одинаковым с материнским, и тогда материнский организм не распознает его как ребенка, и произойдет реакция отторжения.
DQA1*20:1
В 2% случаев мужчина, имеющий DQ альфа 201, имеет и DQ бета 201. При оплодотворении яйцеклетки сперматозоидом с таким генотипом происходит гибель зиготы в 50%. Если только один DQ антиген (альфа или бета) является 201, вероятность образования такой зиготы в два раза меньше. Ни у одного мужчины, даже если имеется два DQ альфа 2-гена, не могут все сперматозоиды нести DQ бета 201 ген.
Когда гены DQ альфа 201 и бета 201 к эмбриону попадают от матери, эмбрион развивается нормально. Однако если эти гены (оба) приходят от отца, зигота гибнет. Поэтому на Земле не существует человека, имеющего оба DQ альфа 201 и бета 201 гена.
DQА1* 40: 1
У 89% людей с антителами к фосфолипидам либо имеется DQ А 4, либо близко совпадают значения DQ А у партнеров. Совпадение матери и ребенка по DQ альфа наблюдается при невынашивании беременности (наступившей или как неудачи ЭКО). При благополучном завершении беременности чаще наблюдается несоответствие по DQ между матерью и ребенком. Если у обоих родителей имеется DQ 4, у ребенка получается генотип DQ 4, 4. Некоторые из этих беременностей не ухудшают вероятность вынашивания второго ребенка, если только HLA G-молекулы у супругов не очень близки. Первый ребенок рождается после нормально протекавшей беременности, и единственная его проблема может заключаться в том, что он сам может быть родителем DQ 4, 4-ребенка и иметь проблемы с вынашиванием второго ребенка. К сожалению, первая DQ 4, 4 – беременность активирует киллерные клетки материнского организма и снижает уровень блокирующих антител. В результате вынашивание второй и последующих беременностей становится невозможным без применения лимфоцитоиммунотерапии для повышения уровня защитных антител и внутривенного введения гамма-глобулина для снижения уровня киллерных клеток.
При совпадении показателей DQ во время беременности назначают гепарин в качестве превентивной меры, даже если тест на антифосфолипидные антитела был отрицательным до беременности. Было показано, что при совпадении генов DQ у родителей, во время беременности может возникнуть резкий всплеск уровня антифосфолипидных антител. Если после 10 недель беременности уровень антител так и остается низким, гепаринотерапию отменяют.
Определение лейкоцитарных антител
С помощью этого анализа изучают выраженность иммунологической цепной реакции, вызванной совпадением DQ-антигенов. Низкие результаты этого анализа говорят доктору о необходимости назначить иммуноцитотерапию лимфоцитами мужа. Некоторые доктора назначают внутривенное введение гамма-глобулина. Другие предлагают просто подсаживать большее число эмбрионов, чтобы снизить вероятность сохранения именно того эмбриона, у которого произойдет полное совпадение DQ-антигенов. Обычно используют лимфоциты мужа. Однако если антигены DQ альфа у супругов очень близки, то используют лимфоциты донора. Эта терапия дает положительный результат, если уровень антител у женщины к Т- и В- лимфоцитам ее мужа превышает 30%, и положителен тест микроцитотоксичности.
Репродуктивный иммунофенотип (иммунограмма).
Этот анализ проводят для определения уровня естественных киллеров. В большинстве случаев наличие естественных киллерных клеток – хороший признак, поскольку они защищают организм от раковых опухолей. Однако бывают ситуации, когда их количество резко возрастает и убивает эмбрион или нарушает работу эндокринной системы, делая невозможным вынашивание беременности. При высоких уровнях естественных киллеров назначается внутривенное введение иммуноглобулина. Наоборот, при низких уровнях естественных киллеров доктора назначают стероидные гормоны, в частности, преднизолон.
При этом анализе определяют следующие типы клеток:
У 12% женщин с привычным невынашиванием беременности и у 25% с тремя и более неудачами ЭКО отмечен повышенный уровень натуральных киллеров высокая их цитотоксичность относительно клеток плаценты in vitro.
Антинуклеарные антитела
Эти антитела играют роль в патогенезе таких заболеваний, как ревматоидный артрит и системная красная волчанка а также могут приводить к невынашиванию беременности и бесплодию. Чаcто при этом обнаруживается титр антител 1:40 и выше при неоднородном паттерне. Такой паттерн нехарактерен для СКВ и РА.
Антитела к ДНК и гистонам
Если у женщины обнаруживаются антитела к гистонам, имеющие неоднородный паттерн, значит ее организм отторгает эмбрион.
Антитела к фосфолипидам
При положительных результатах этого анализа нарушается свертываемость крови у матери, образуются микротромбы, которые нарушают снабжение кровью ребенка. Также эти антитела являются причиной плохого прикрепления эмбрина в матке. Лечение – аспирин и гепарин. Эти препараты назначают еще до беременности, в течение цикла зачатия. Это лечение хорошо известно и широко применяется врачами, иногда ои его назначают без проведения необходимых исследваний, и выкидыш все равно происходит, поскольку причиной невынашивания могли быть другие иммунологические нарушения, требующие проведения иммуноцитотерапии лимфоцитами мужа, внутривенного введения иммуноглобулина или назначения преднизолона.
Другие исследования
К ним относится определение волчаночного аникоагулянта, антител к гормонам, антител к щитовидной железе. Перед введением иммуноглобулина нужно проведение аллергического теста на иммуноглобулины
Антитела к прогестерону что это
Исследование проводится в целях диагностики патологии репродуктивной функции, а также для оценки тяжести гиперпластического процесса. Определение уровня рецепторов эстрогена и рецепторов прогестерона в среднюю стадию фазы секреции позволяет оценить степень эндометриальной дисфункции. Ki-67 – индекс пролиферативной активности – белок, который синтезируется в ядрах клеток, находящихся в процессе деления. Является одним из специфических маркеров хронического эндометрита. Исследование экспрессии Ki-67 маркера позволяет подтвердить наличие диспластических процессов, выявить поражения шейки матки с высоким риском дальнейшей прогрессии.
Метод исследования
Жидкостная цитология + иммуноцитохимическое исследование.
Какой биоматериал можно использовать для исследования?
Аспират из полости матки.
Общая информация об исследовании
Стандартное морфологическое исследование эндометрия включает определение клеточного состава, соотношения клеток, фазы менструального цикла, патологических изменений – признаков атипии, инфильтрации воспалительными клетками при световой микроскопии. Материалом для исследования является эндометрий, полученный методом аспирационной биопсии эндометрия или при гистероскопии с биопсией эндометрия, после выскабливания (кюретаж полости матки).
Иммуноцитохимия – это метод исследования клеток, основанный на обнаружении специфических антигенов с помощью присоединения к ним антител, меченных флюорохромом или ферментом. Антигены – молекулы белков или углеводов, имеющие уникальную трёхмерную структуру, способные индуцировать образование антител. Антитела – иммуноглобулины, распознающие антигены и присоединяющиеся к ним во время реакции «антиген-антитело». Антигены и антитела неразличимы при исследовании методом световой и электронной микроскопии. Для обнаружения специфических антигенов к образцу клеток добавляют реагент, содержащий меченные флюорохромом или ферментом антитела, в результате чего образуется иммунный комплекс «антиген-антитело». Комплексы формируют специфическое окрашивание клеток и их внутренних структур, обеспечивая детекцию патологических изменений на молекулярном уровне. Иммуноцитохимическое исследование позволяет верифицировать онкологические заболевания, метастатические поражения, определить их гистологическую принадлежность, оценить экспрессию маркеров, влияющих на прогноз заболевания и подбор схемы эффективной химиотерапии.
Иммуноцитохимическое исследование образца, содержащего клетки эндометрия, позволяет определить выраженность экспрессии рецепторов к эстрогену и прогестерону и определить их соотношение. В нормальном эндометрии происходит циклическое изменение баланса рецепторов женских половых гормонов в зависимости от фазы менструального цикла.
В стадию ранней пролиферации после пятого дня цикла начинается прогрессивное увеличение рецепторов к эстрогену (ER) в строме и эпителии желёз, продолжающееся в позднюю пролиферативную фазу с максимальным пиком экспрессии в предовуляторном периоде и во время овуляции. После овуляции отмечается постепенное снижение уровня рецепторов к эстрогену, обусловленное действием прогестерона.
Увеличение рецепторов к прогестерону начинается в позднюю пролифертивную фазу, достигая максимальной экспрессии в предовуляторном период, во время овуляции. В секреторную фазу железистый эпителий постепенно уменьшает экспрессию рецепторов к прогестерону, в то время как экспрессия рецепторов на стромальных клетках продолжает увеличиваться.
Максимальное количество клеток эндометрия, экспрессирующих рецепторы к женским половым гормонам, отмечается в конце поздней пролиферативной фазы и предовуляторный период, со смещением соотношения в сторону рецепторов к эстрогену (референтный интервал ER/PR составляет от 2-4:1). В секреторную фазу соотношение ER/PR смещается в сторону рецепторов к прогестерону и составляет 1:2, в стромальных клетках до 1:3 к концу менструального цикла.
К концу менструального цикла количество рецепторов к женским половым гормонам снижается до минимальных значений.
Одной из причин бесплодия может быть повышение экспрессии эстрогеновых рецепторов с одновременным снижением экспрессии прогестиновых рецепторов в клетках эндометрия в раннюю секреторную фазу, что нарушает способность эндометрия к имплантации оплодотворенной яйцеклетки.
При хроническом эндометрите отмечается смещение максимального пика экспрессии рецепторов эстрогена и прогестерона в сторону пролиферативной фазы, уменьшение количества клеток, экспрессирующих рецепторы, более раннее истощение рецепторного аппарата с резким снижением эстрогеновых рецепторов в раннюю секреторную фазу. Аналогичные изменения характерны и для рецепторов к прогестерону в клетках эпителия желез.
Для неопластической трансформации эндометрия характерно снижение рецепторов к эстрогену и прогестерону. До 80% опухолей эндометрия экспрессируют рецепторы к эстрогену. Высокая экспрессия рецепторов женских половых гормонов с сохранением соотношения ER/PR свидетельствует о высокой дифференцировке клеток опухоли, что связано с более благоприятным прогнозом в отношении выживаемости. Низкое содержание рецепторов прогестерона позволяет прогнозировать лучший ответ на химиотерапию гормональными препаратами (прогестинами).
Определение экспрессии Ki-67 проводится методом иммуноцитохимии. К образцу, содержащему клетки эндометрия, добавляют меченый антиген к белку Ki-67. В результате реакции «антиген-антитело» формируется специфическое окрашивание ядер клеток. Для анализа выполняется подсчет позитивно меченных клеток, оценка интенсивности окрашивания ядра.
Экспрессия Ki-67 значительно повышается при атипической гиперплазии, раке эндометрия.
При всех типах гиперплазии эндометрия отмечается снижение экспрессии ER, PR и Ki-67 по сравнению с нормальным эндометрием в фазу пролиферации. При сравнении результата иммуноцитохимии с нормальным эндометрием в секреторную фазу наблюдается обратная картина: экспрессия ER, PR и Ki-67 значительно выше при гиперплазии эндометрия.
При раке эндометрия экспрессия ER и PR снижается с одновременным увеличением Ki-67. Чем выше экспрессия Ki-67, тем более низкая дифференцировка клеток опухоли, что свидетельствует о менее благоприятном прогнозе для жизни.
Когда назначается исследование?
Что означают результаты?
Соотношение рецепторов эстрогена к рецепторам прогестерона (ЕR/PR) в строме составляет 4:1.
При хроническом эндометрите отмечается смещение пика уровня экспрессии рецепторов эстрогенов и прогестерона в сторону средней и поздней стадий фазы пролиферации, в то время как в нормальном эндометрии пик экспрессии приходится на овуляцию.
Нарушение экспрессии рецепторов половых гормонов связано с формированием гиперплазии эндометрия и определяет форму и тяжесть гиперпластического процесса.
При простой железистой гиперплазии без атипии наблюдается повышение рецепторов ER и PR в эпителии желез и стромальных элементах с одновременно высокими показателями экспрессии маркера пролиферации Ki-67.
При неопластической трансформации клетки эндометрия частично или полностью утрачивают рецепторы к эстрогенам и прогестерону. Соотношение рецепторов ER/PR в клетках различных аденокарцином различается и связано со степенью морфологической дифференцировки опухоли.
Степень экспрессии белка Ki-67 увеличивается по мере нарастания неопластических изменений эпителия шейки матки и достигает максимума при цервикальной плоскоклеточной карциноме. Его величина прямо коррелирует со степенью гистологической злокачественности.
Степень экспрессии Ki-67 выражается в процентах.
83 Диагностика хронического эндометрита: CD20+, CD56+, CD138+, HLA-DR
52 Гистологическое исследование биопсийного материала
36 Антиген плоскоклеточной карциномы (SCCA)
Кто назначает исследование?
Гинеколог, эмбриолог, онколог, эндокринолог, цитолог.
1) Techniques of immunohistochemistry: principles, pitfalls, and standardization. Richard W. Cartun, Clive R. Taylor and David J. Dabbs. Diagnostic Immunohistochemistry, Chapter 1, 1-46.
2) Benign Endometrium. David W Kindelberger and Marisa R Nucci. Gynecologic Pathology: A Volume in the Series: Foundations in Diagnostic Pathology, Chapter 6, 197-232.
3) The Female Genital Tract. Lora Hedrick Ellenson and Edyta C. PirogRobbins and Cotran Pathologic Basis of Disease, Chapter 22, 991-1042.
Антитела к прогестерону что это
Химические канцерогены окружающей среды, в частности бензо[a]пирен (БП), являются значимыми факторами возникновения рака легкого (РЛ) у человека [8]. В свою очередь эндогенные стероидные гормоны принимают участие в патогенезе злокачественных опухолей. Имеются основания полагать, что эстрогены стимулируют, а прогестерон (ПГ) ингибирует пролиферацию клеток РЛ [12, 13].
В сыворотке крови здоровых мужчин и больных раком легкого ранее обнаружены антитела (АТ) к БП [2, 3, 6, 14], а также эстрадиолу (ЭС) и ПГ [4, 5]. Предполагается, что АТ к химическим канцерогенам окружающей среды и к эндогенным стероидам, модулируя их биологические свойства, способны влиять на процессы инициации и промоции злокачественной трансформации клеток [1, 10, 11]. Для дальнейшего выяснения роли АТ к низкомолекулярным ксено- и эндобиотикам в канцерогенезе целесообразно исследовать их у женщин с онкологическими заболеваниями.
Цель настоящей работы – сравнить образование АТ к БП, ПГ и ЭС у мужчин и женщин, больных РЛ.
Материалы и методы исследования
В обследовании приняли участие 316 человек. Из них – 201 мужчина и 115 женщин с диагнозом РЛ, которые поступили на лечение в Областной клинический онкологический диспансер г. Кемерово. Диагноз РЛ в каждом случае был подтвержден морфологически, рентгенологически и эндоскопически. Средний возраст мужчин, больных РЛ, составил 59,4 ± 6,9 лет, средний возраст женщин, больных РЛ – 58,2 ± 8,2 лет.
Забор периферической крови осуществлялся согласно этическим стандартам в соответствии с Хельсинской декларацией 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003 г. Все лица, участвовавшие в исследовании, дали информированное письменное согласие на участие в нем.
Исследование АТ к БП, ЭС и ПГ проводили с помощью модифицированного нами неконкурентного иммуноферментного анализа [3, 4]. Уровни АТ к гаптенам выражали в относительных единицах и вычисляли по формуле
где Х = БП, ЭС, ПГ; ODХ-БСА – связывание АТ с конъюгатом гаптен-БСА; ODБСА – связывание с БСА.
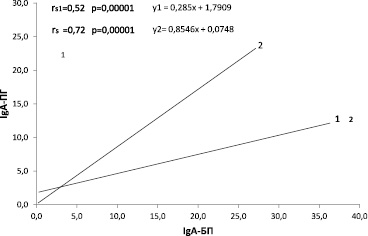
Статистическую обработку результатов проводили с использованием ППП STATISTICA 6.0 (StatSoft, Inc., USA). Ненормальный характер распределения показателей определили с помощью критерия Шапиро ‒ Уилка и в дальнейшем статистически значимые различия между группами выявляли с помощью непараметрического критерия χ2 с поправкой Йетса на непрерывность вариации и U-критерия Манна – Уитни при уровне значимости p Примечание. rs – коэффициент корреляции по Спирмену.
Видно, что коэффициенты а в уравнениях линейной регрессии для каждой исследуемой взаимосвязи у женщин больше, чем у мужчин. Это означает, что при возрастании уровня АТ-БП (х) уровни АТ-ПГ и АТ-ЭС (у) у женщин увеличиваются больше, чем у мужчин.
Корреляция между уровнями АТ к БП (IgA-БП) и АТ-ПГ (IgA-ПГ) у мужчин (1) и женщин (2), больных РЛ
В качестве наглядного примера на рисунке приведено графическое изображение корреляций IgA-БП(х) и IgA-ПГ(у) в сравниваемых группах.
Заключение
Ранее предположили, что гаптен-специфические иммунные реакции на химические канцерогены окружающей среды и низкомолекулярные эндобиотики – это взаимосвязанные процессы, влияющие на механизмы инициации и промоции канцерогенеза [9]. В настоящей работе получено подтверждение этой гипотезы не только для РЛ у мужчин [4, 5], но и у женщин. Обнаруженные различия между сравниваемыми группами свидетельствуют о половых особенностях образования АТ к низкомолекулярным ксено- и эндобиотикам. Вероятно, они обусловлены различиями в уровнях половых гормонов и их реакционных метаболитов, образующих аддукты с макромолекулами организма, за счет чего и происходит индукция синтеза гаптен-специфических АТ.
Роль АТ к химическим канцерогенам и стероидным гормонам остается неясной. Возможные физиологические (адаптационные) или патологические (стимуляция канцерогенеза) функции указанных АТ в возникновении злокачественных опухолей подробно рассматриваются в предыдущих статьях [1, 9–11].
Работа выполнена в рамках проекта № 59.1.1. Программы фундаментальных научных исследований СО РАН.
Благодарность. Авторы благодарят академика Л.Н. Иванову за содействие в развитии выбранного направления исследований; сотрудников лаборатории иммунохимии ИЭЧ СО РАН Аносову Т.П., Аносова М.П., Красильникову К.С., Гурова Е.А. за техническую поддержку настоящей работы.
Рецензенты:
Лавряшина М.Б., д.б.н., профессор кафедры генетики биологического факультета, ФГБОУ ВПО «Кемеровский государственный университет», г. Кемерово;
Неверова О.А., д.б.н., профессор, заведующая лабораторией экологического биомониторинга, ФГБУН «Институт экологии человека Сибирского отделения РАН», г. Кемерово.