Апикальный лимфоузел в кишке что это
Апикальный лимфоузел в кишке что это
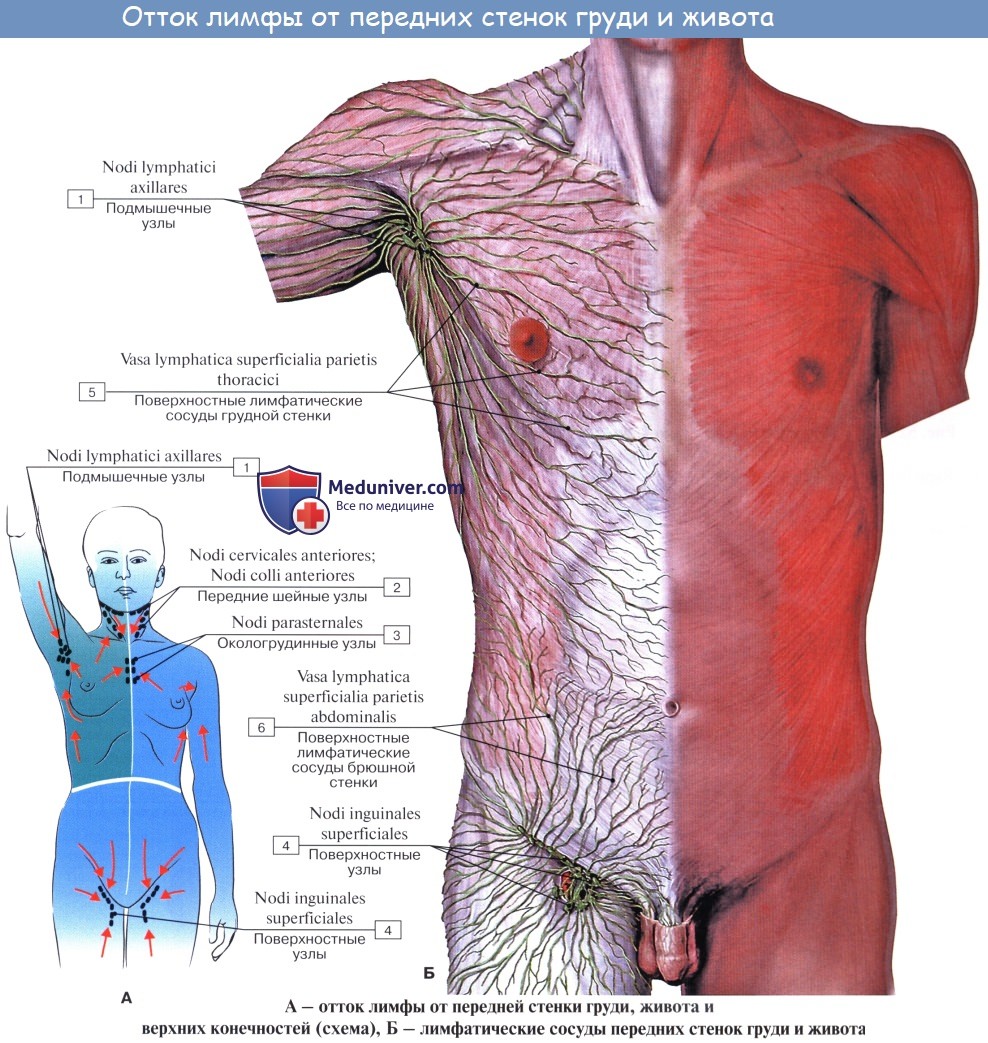
Лимфатические сосуды верхней половины стенки живота направляются вверх и латерально к nodi lymphatici axillares; сосуды нижней половины стенки живота, напротив, спускаются к nodi lymphatici inguinales.
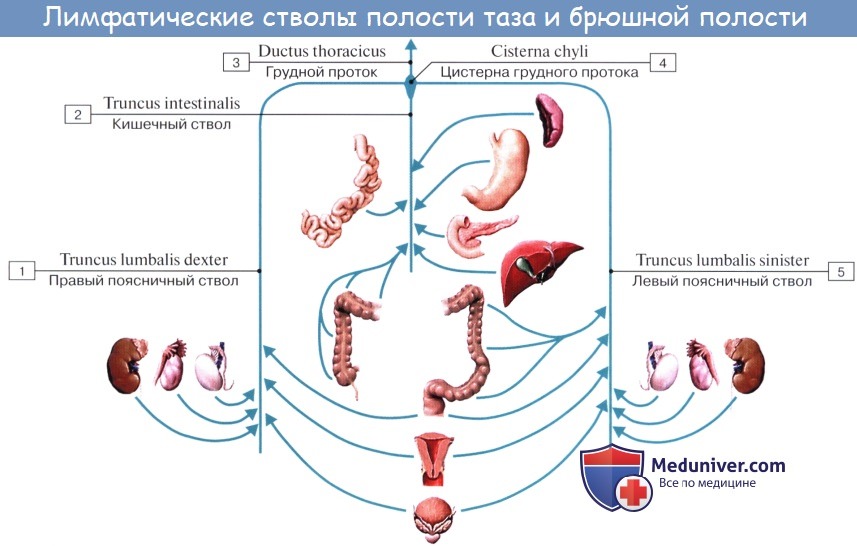
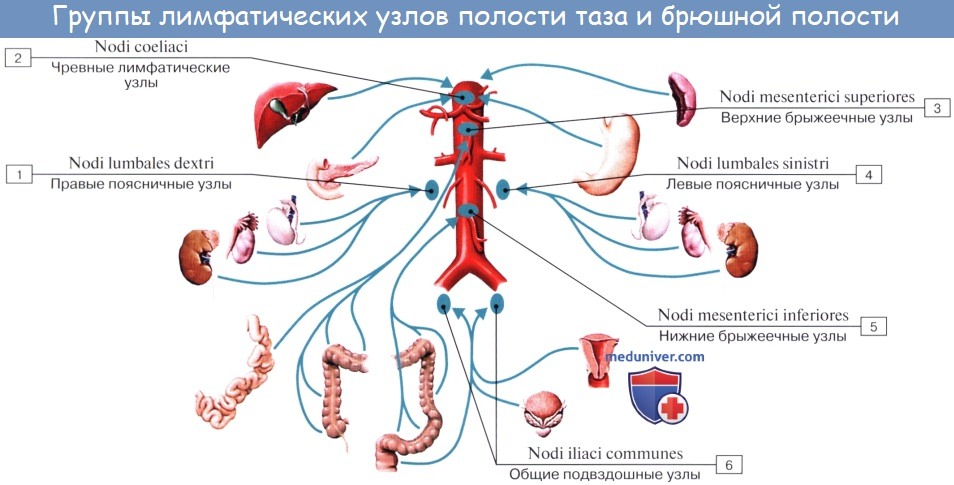
В брюшной полости различают: 1) париетальные узлы, залегающие вокруг аорты и нижней полой вены, и 2) висцеральные, которые распределяются вдоль стволов и ветвей чревного ствола, верхней и нижней брыжеечных артерий. Количество париетальных узлов достигает 30 — 50. Общее название этих узлов «поясничные», nodi lymphatici lumbales.
Висцеральные узлы брюшной полости распадаются на две большие группы: 1) по ходу ветвей чревного ствола, 2) по ходу ветвей брыжеечных артерий, nodi lymphatici mesenterici superkkes et inferiores.
Лимфатические узлы первой группы получают название по отношению к артериям и органам: nodi lymphatici coeliaci, gastrici sinistri et dextri, hepatici, pancreaticoduodenales, pylorici.
Вторая группа висцеральных узлов, расположенных вдоль брыжеечных артерий, отличается своей многочисленностью (около 300). Она заложена в толще брыжейки тонкой и толстой кишки и была описана вместе с их лимфатическими сосудами. Впадающие в перечисленные лимфатические узлы лимфатические сосуды органов брюшной полости описаны при изложении анатомии каждого органа (см. «Спланхнология»).

Тонкая кишка имеет особую систему лимфатических сосудов — систему млечных сосудов. Кишка содержит сплетение лимфатических сосудов во всех слоях, составляющих ее стенку: в слизистой, подслизистой, мышечной и серозной.
При этом различают две группы лимфатических сосудов:
1. Лимфатические сосуды серозной оболочки.
2. Хилусные, или млечные сосуды (chylus — млечный сок) имеют своими корнями центральные лимфатические сосуды, начинающиеся слепо под эпителием, на вершине ворсинки. Они залегают в слизистой оболочке и подслизистой основе кишки, продолжаясь затем в брыжейку, и транспортируют всасывающийся жир, придающий лимфе вид молочной эмульсии (хилуса), откуда и происходит название этих сосудов (рис. 258). Остальные питательные вещества всасываются венозной системой и уносятся к печени через воротную вену.
Отводящие лимфатические сосуды двенадцатиперстной кишки идут к панкреатодуоденальным лимфатическим узлам. Отводящие лимфатические сосуды тощей и подвздошной кишки идут в толще брыжейки к брыжеечным узлам.
В брыжейке тонкой кишки следует выделять три группы лимфатических сосудов: 1) левая группа — от начального отрезка тошей кишки (40 — 70 см), 2) средняя группа — от остальной части тощей кишки и 3) правая группа — от подвздошной кишки.
Проходя в брыжейке, млечные сосуды прерываются брыжеечными лимфатическими узлами, расположенными в четыре ряда. Узлы первого ряда расположены вдоль брыжеечного края кишки, узлы второго — несколько отступя от края, узлы третьего — около корня брыжейки и узлы четвертого — в корне брыжейки. Из брыжеечных узлов лимфа течет к поясничным узлам, а оттуда в truncus lumbalis sinister и далее в грудной проток.
Из толстой кишки лимфоотток происходит в nodi lymphatici ileocolici, colici dextri, colici medii, mesenterici inferiores, colici sinistri, расположенные по ходу одноименных сосудов.
Колоректальный рак: оценка лимфатических узлов и уровень выживаемости после его удаления
Вовлечение лимфатических узлов является важным прогностическим фактором при неметастатических случаях колоректального рака.
Метастазы в лимфатические узлы — это параметр, который влияет на выживаемость и частоту рецидивов [1,2]. Точные данные о состоянии лимфатических узлов, в том числе о количестве собранных для анализа лимфатических узлов (ЛУ) и количество метастатических узлов, играют важную роль в принятии решения о применении адъювантной химиотерапии или лучевой терапии, а также в предоставлении информации о прогнозе. Тем не менее, сохраняются споры о том, сколько лимфатических узлов необходимо оценивать, чтобы точно определить стадию колоректального рака. Рекомендуемое число лимфатических узлов при анализе литературы составляет от 6 до 18, в то время как Американский объединённый онкологический комитет (AJCC) предложил оценивать 12 или более лимфатических узлов, а в недавних исследованиях рекомендуется исследовать по меньшей мере 9-12 лимфатических узлов для обеспечения точной постановки диагноза 4. Кроме того, некоторые исследователи сообщили, что расширенная лимфаденэктомия дает терапевтическое преимущество, в то время как другие заявили, что эта процедура просто обеспечивает лучшую точность с точки зрения постановки стадии колоректального рака [7]. Однако неадекватная оценка лимфатических узлов остается проблемой, которая может приводить к неточной диагностике стадии колоректального рака у большинства пациентов, чьи лимфатические узлы изучаются в ограниченном количестве [8]. Недавние исследования продемонстрировали, что отношение лимфатических узлов (ОЛУ), определяемое как отношение положительных (лимфоузлы с патологическим процессом) лимфатических узлов к общему количеству исследованных лимфатических узлов, может обеспечить значительную прогностическую роль в диагностике колоректального рака 11.
Мы ретроспективно проанализировали данные пациентов, которым была проведена радикальная операция на толстой кишке с удалением брыжеечно-ободочных лимфатических узлов для оценки возможной корреляции между параметрами лимфатических узлов, включая количество удаленных лимфатических узлов, ОЛУ, стадией онкологического процесса (N) и выживаемостью.
Материалы и методы
В этом ретроспективном обсервационном исследовании мы провели ретроспективный обзор диаграммы пациентов в возрасте от 18 лет и старше, которые подверглись хирургическому вмешательству в связи с колоректальным раком в отделении общей хирургии в Турции в период с сентября 2005 года по июль 2015 года. Исследование проводилось в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации — этическими принципами медицинских исследований, в которых участвуют люди.
Всем пациентам, включенным в исследование, была проведена хирургическая операция двумя хирургами. Хирургические образцы всех испытуемых оценивали 2 патолога. Образцы оценивали после фиксации в 10% формалине и заливки в парафин. Пациентам была установлена стадия заболевания согласно 7-ому изданию AJCC по классификации TNM [3].
Пациенты регулярно и часто наблюдались в послеоперационном периоде. Они проверялись один раз в три месяца в течение первых 2 лет, один раз в шесть месяцев до 5 лет и один раз в год через 5 лет после хирургической операции. Во время наблюдения были взяты полный анализ крови, биохимические анализы, уровни карциноэмбрионального антигена, были выполнены ультразвук печени и рентгенография грудной клетки.
После хирургической операции колоноскопия проводилась один раз в год или один раз в два года.
Из исследования были исключены пациенты, у которых были отдаленные метастазы, рецидивирующий колоректальный рак и множественный первичный рак или те, кто получал неоадъювантную химиотерапию, и те, кто умер в первые 3 месяца после операции. Хирургические операции, патологические данные, включая стадию по классификации TNM, количество удаленных лимфатических узлов, положительный лимфатический узел(ы), результаты операции и летальные случаи во время наблюдения, а также гематологические, биохимические и рентгенографические данные пациентов, были зарегистрированы в компьютерной базе данных. Что касается общего количества удаленных лимфатических узлов, то пациенты были разделены на три группы: те, у кого были извлечены 18 узлов. ОЛУ определяли как отношение положительных узлов к общему количеству удаленных лимфатических узлов, и по данным ОЛУпациенты были разделены на четыре группы по квартилю: ОЛУ1 (
Апикальный лимфоузел в кишке что это
ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России, Москва, Россия
ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России, Москва, Россия; кафедра колопроктологии Российской медицинской академии непрерывного профессионального образования Минздрава России, Москва, Россия
ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России, Москва, Россия
ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России, Москва, Россия
ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России, Москва, Россия
Факторы риска поражения регионарных лимфатических узлов при раке прямой кишки рТ1
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2018;(8): 4-9
Чернышов С. В., Шелыгин Ю. А., Кашников В. Н., Майновская О. А., Рыбаков Е. Г. Факторы риска поражения регионарных лимфатических узлов при раке прямой кишки рТ1. Хирургия. Журнал им. Н.И. Пирогова. 2018;(8):4-9.
Chernyshov S V, Shelygin Yu A, Kashnikov V N, Mainovskaya O A, Rybakov E G. Risk factors of regional lymph node metastases in pT1 colorectal cancer. Khirurgiya. 2018;(8):4-9.
https://doi.org/10.17116/hirurgia20180824
ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России, Москва, Россия
Резекция прямой кишки с тотальной мезоректумэктомией (ТМЭ) является стандартом лечения рака прямой кишки. Однако при опухолях, ограниченных инвазией подслизистого слоя, привлекательной альтернативой может быть местное иссечение — трансанальная эндомикрохирургия (ТЭМ). Цель исследования — поиск независимых факторов риска метастазирования в мезоректальные лимфатические узлы при раке прямой кишки с инвазией, ограниченной подслизистой основой (рТ1). Материал и методы. В период с 1 января 2012 г. по 1 марта 2018 г. 43 пациентам выполнены трансабдоминальные резекции по поводу локализованного рака прямой кишки (рТ1), средний возраст ± σ составил 62,3±11,3 года, женщин было 34 (64%), мужчин 19 (36%). Результаты. При микроскопическом исследовании операционных препаратов SM1-2 выявлена в 22/43 (51%), SM3 — в 21/43 (49%). Исследование лимфатических узлов параректальной клетчатки показало, что у 11/43 (25,5%) пациентов с pT1 выявлены метастазы аденокарциномы: в препаратах с SM3 — 8/21 (38,1%), в препаратах с SM1-2 — 3/22 (13,6%), p=0,08. С помощью логистической регрессии выявлено, что слизистая и/или низкодифференцированная аденокарцинома (p=0,014) и лимфоваскулярная инвазия (p=0,005) являются независимыми факторами риска развития метастазов в параректальных лимфатических узлах. Заключение. Наличие факторов риска регионарного метастазирования раннего рака прямой кишки: лимфоваскулярной инвазии, слизистой и/или низкодифференцированной аденокарциномы является показанием к трансабдоминальной резекции.
ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России, Москва, Россия
ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России, Москва, Россия; кафедра колопроктологии Российской медицинской академии непрерывного профессионального образования Минздрава России, Москва, Россия
ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России, Москва, Россия
ФГБУ «Государственный научный центр колопроктологии им. А.Н. Рыжих» Минздрава России, Москва, Россия
ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России, Москва, Россия
Стандартом хирургического вмешательства при локализованных формах рака прямой кишки без вовлечения анального сфинктера является тотальная мезоректумэктомия (ТМЕ), обеспечивающая локальный контроль опухоли в 90—95% наблюдений. Вместе с тем ТМЕ связана с высоким риском развития послеоперационных осложнений и формирования постоянной стомы, мочеполовой дисфункции, а низко расположенный колоректальный анастомоз может привести к функциональным нарушениям, в значительной степени снижающим качество жизни больных [2].
Локальное удаление опухолей прямой кишки без признаков поражения регионарных лимфатических узлов: трансанальное иссечение или трансанальная эндомикрохирургия (ТЕМ) выглядит привлекательной альтернативой резекциям прямой кишки [3], однако возможности данного метода ограничены в связи с несовершенством предоперационных методов стадирования опухоли, в частности, в отношении вовлечения в опухолевый процесс регионарных лимфатических узлов, частота поражения которых при новообразованиях с инвазией в подслизистую основу стенки кишки может достигать 24% [1, 2], а частота местных рецидивов после ТЕМ, по данным метаанализа M. Sajid, превышает таковую после ТМЕ в 4 раза [13]. В этом контексте актуальным представляется выявление факторов риска метастазов рака прямой кишки, оценка которых позволила бы с бóльшей степенью надежности высказаться в пользу ТЕМ или ТМЕ. Одним из наиболее изученных факторов является глубина инвазии подслизистой основы (sm1, 2, 3) в соответствии с классификацией предложенной R. Kikuchi, согласно которой частота метастазов в параректальных лимфатических узлах возрастает с 3% при sm1 до 24% при sm3 [7].
Помимо глубины инвазии [9], с риском метастазирования связывают ряд других факторов: локализация опухоли и ее размер [10], ширина зоны инвазии [19], наличие лимфоваскулярной инвазии, венозной инвазии [5, 8, 15, 18], опухолевый budding [14, 17].
В данной статье предпринята попытка поиска независимых факторов риска метастазирования в мезоректальные лимфатические узлы при раке прямой кишки с инвазией, ограниченной подслизистой основой (рТ1).
Материал и методы
По данным архива ФГБУ «ГНЦ Колопроктологии им А.Н. Рыжих» Минздрава России, за период с 1 января 2012 г. по 1 марта 2018 г. в центре выполнено 1655 трансабдоминальных операций по поводу локализованного рака прямой кишки. При патоморфологическом исследовании удаленных препаратов в 43/1655 (2,6%) наблюдениях выявлены опухоли с инвазией, соответствующей рТ1. Эта группа больных (средний возраст±σ 62,3±11,3 года, женщин 34 (64%), мужчин 19 (36%)) включена в дальнейший анализ результатов.
По данным предоперационного обследования (КТ грудной клетки и брюшной полости) и интраоперационной ревизии, отдаленных метастазов не выявлено. Все больные оперированы в объеме ТМЕ 26 (60,4%) или частичной мезоректумэктомии 19 (39,6%).
Патоморфологическое исследование
При морфологическом исследовании удаленных препаратов проводили макроскопическую оценку качества мезоректумэктомии с использованием критериев, предложенных P. Quirke [20]. В соответствии с принятой методикой, маркировали циркулярный край резекции и фиксировали препарат в 10% растворе формалина в течение 48 ч. Фиксированный препарат изучали на серийных поперечных срезах для оценки распространенности опухоли, определения величины хирургического клиренса, метастазов опухоли в лимфатические узлы. Гистологически исследовали все обнаруженные лимфатические узлы в мезоректуме и в клетчатке по ходу нижней брыжеечной артерии. Гистологические препараты изготавливали с использованием стандартных протоколов и окрашивали гематоксилином и эозином.
Для стадирования опухолей применяли классификацию TNM в 7 редакции [4], для оценки глубины инвазии в подслизистый слой использовали классификацию R. Kikuchi [7].
Статистика
Статистический анализ проводили с помощью программы GraphPad 7 for Mac. При гауссовом распределении непрерывные величины описывали среднеквадратичным отклонением и амплитудой, при не-гауссовом — медианой и квартилями. Соответственно сравнение средних и медиан — с помощью непарного t-теста и теста Манна—Уитни. Дискретные величины сравнивали с помощью точного теста Фишера. Для оценки факторов риска рассчитывали отношение шансов (Оdds Ratio, OR), сравнение проводили методом log-rank, вычисляли отношение рисков (Hazard Ratio, HR).
Результаты
Медиана длительности оперативных вмешательств составила 125 (90—240) мин. Интраоперационных осложнений не отмечено ни в одном наблюдении, также не было изменения запланированного объема оперативного вмешательства. Средняя кровопотеря±σ составила 178,8±131,5 мл и была клинически незначимой.
Летальности не было. Послеоперационные осложнения в сроки до 30 дней развились у 7/43 (16,2%) больных.
По данным морфологического исследования удаленных препаратов, все оперативные вмешательства были выполнены в R0-объеме (табл. 1).

При микроскопическом исследовании операционных препаратов, согласно субклассификации R. Kikuchi [7], среди pT1 (табл. 2)

Лимфоваскулярная инвазия встречалась в операционных препаратах у каждого третьего пациента с инфильтрацией всей толщи подслизистого слоя (sm3) в отличие от инвазии sm1−2: 7/21 (33%) и 2/22 (9%) соответственно; p=0,06. Также в операционных препаратах с sm3 в 5 раз чаще встречались низкодифференцированные и слизистые аденокарциномы в сравнении с sm1−2: 5/21 (23,8%) и 1/22 (4,5%) соответственно; p=0,09.
Исследование лимфатических узлов параректальной клетчатки показало, что у 11/43 (25,5%) пациентов с pT1 выявлены метастазы аденокарциномы. Таким образом, частота поражения лимфоузлов при инвазивном раннем раке прямой кишки составила 25,5%.
Наиболее часто метастазы в параректальные лимфоузлы определялись в препаратах больных с sm3 — 8/21 (38,1%), в то время как при поверхностной инвазии sm1−2 только у трех больных выявлены метастазы опухоли 3/22 (13,6%); p=0,08.
Лимфоваскулярная инвазия была выявлена в пяти случаях с N+ в сочетании с sm3. В одном наблюдении с sm3 и метастазами в лимфоузлы выявлено сочетание венозной и лимфоваскулярной инвазии. cреди больных с N+ слизистая и низкодифференцированная аденокарцинома выявлена в трех наблюдениях с sm3 и в одном случае с sm1−2. Данные патоморфологического исследования опухолей с N+ иллюстрируют их агрессивный характер, тем не менее, статистически значимых различий между новообразованиями в зависимости от степени инвазии подслизистого слоя не получено.
Для выявления факторов, влияющих на частоту развития метастазов в параректальных лимфатических узлах у больных инвазивным ранним раком прямой кишки, был проведен унивариантный анализ (см. рисунок).

Оказалось, что наличие низкодифференцированной аденокарциномы и/или слизистой аденокарциномы (p=0,005, OR=16,67, 95%CI 1,56—177,5), а также лимфоваскулярной инвазии в опухоли (р=0,005, OR=27,0, 95%CI 2,38—306,6) являются статистически значимыми факторами риска развития метастазов в регионарных лимфоузлах вне зависимости от глубины инвазии опухоли в подслизистый слой. Мультивариантный анализ с помощью биноминальной логистической регрессии подтвердил, что слизистая и/или низкодифференцированная аденокарцинома (p=0,014) и лимфоваскулярная инвазия (p=0,005) являются независимыми факторами риска развития метастазов в параректальных лимфатических узлах (табл. 3).

Важно подчеркнуть, что, согласно проведенному анализу, инфильтрация опухолью всей толщи подслизистого слоя (pT1sm3) не является статистически значимым фактором риска метастазирования в регионарные лимфоузлы.
Таким образом, у 11/43 (25,5%) больных ранним раком прямой кишки на основании патоморфологического исследования операционного препарата выявлено метастатическое поражение параректальных лимфоузлов, т. е. III стадия заболевания. Среди них двое больных имели стадию pT1sm1N1aМ0, один пациент — pT1sm1N1bМ0, четверо больных — pT1sm3N1aM0, и четверо — pT1sm3N1bМ0. Всем пациентам была назначена адъювантная системная полихимиотерапия (ПХТ) в режиме XELOX, 6/11 больных закончили системное лечение в объеме 6 курсов, остальные 5/11 получают ПХТ. Ни в одном случае токсических реакций отмечено не было.
Прослежено 38 из 43 (88,4%) больных в сроки от 2 до 52 мес, медиана наблюдения — 24 мес. У одного больного через 14 мес после брюшно-анальной резекции прямой кишки с формированием одноствольной забрюшинной сигмостомы по поводу pT1sm1N0М0 развился локорегионарный рецидив в области культи анального канала. Таким образом, частота местных рецидивов раннего рака прямой кишки после резекций составила 1/38 (2,6%).
Отдаленные метастазы рака прямой кишки в печень возникли у 1/38 (2,6%) пациентки и были диагностированы через 14 мес после низкой передней резекции прямой кишки. При патоморфологическом исследовании операционного препарата была выявлена слизистая аденокарцинома, стадия pT1sm3N1b (2/10)M0. Больной была назначена системная полихимиотерапия, однако через 8 мес она погибла от прогрессирования заболевания.
До настоящего времени остается открытым вопрос о возможности органосохраняющего лечения больных ранним раком прямой кишки. Локальное иссечение — ТЭМ может являться основным методом лечения у представленной категории пациентов, так как возможность прецизионного и полностенного удаления опухоли создает условия для достижения локального контроля заболевания с частотой местных рецидивов, не превышающей 4% [1, 2]. Тем не менее результаты представленного исследования иллюстрируют, что у каждого четвертого больного инвазивным ранним раком прямой кишки (25,5%) выявляется метастатическое поражение параректальных лимфатических узлов, особенно при опухолях, с инвазией всей толщи подслизистой основы (sm3). В этих ситуациях местное иссечение опухоли заведомо неадекватно, так как не может быть достигнут контроль заболевания. В этом контексте актуальным является исследование факторов риска регионарного метастазирования раннего рака прямой кишки, наличие или отсутствие которых может повлиять на решение о выполнении местного иссечения опухоли или резекции прямой кишки.
В соответствии с рекомендациями NCCN (National Comprehensive Cancer Network, NCCN Guidelines Version 3.2017, Rectal Cancer) [12], рекомендациями европейской ассоциации клинических онкологов (ESMO Clinical Practice Guidelines) [6] — локальное удаление рака прямой кишки как самостоятельный радикальный метод лечения — возможен только у больных с инвазией опухоли соответствующей сТ1Nх. Вместе с тем при выявлении в операционном препарате раннего рака прямой кишки с высоким риском метастазирования — лимфоваскулярной инвазии, G3 опухоли с глубиной инвазии pT1sm3 — местное иссечение является нерадикальным методом лечения, что требует выполнения резекции прямой кишки с тотальной мезоректумэктомией.
В подтверждение этому R. Naschimbeni и соавт. [10], анализируя патоморфологические результаты радикальных резекций, выявили ранний колоректальный рак (рТ1) в 8,6% наблюдений, из которых в 13% обнаружено поражение регионарных лимфоузлов (pT1N+). Авторы отмечают, что только совокупность нескольких факторов: инвазия опухолью всей толщи подслизистой основы (sm3), лимфоваскулярная инвазия, локализация новообразования в нижнеампулярном отделе прямой кишки и G3 дифференцировка опухоли увеличивает частоту поражения параректальных лимфатических узлов до 34%.
Y. Tateishi и соавт. [17] исследовали 322 операционных препарата после вмешательств по поводу колоректального рака с инвазией сТ1 и обнаружили метастазы в регионарных лимфоузлах в 14,3% случаев. Проведенный статистический анализ выявил несколько независимых факторов риска метастатического поражения лимфоузлов: лимфоваскулярная инвазия (OR=3,19; p=0,01), G3 опухоли (OR=3,02; p=0,01) и наличие Tumor budding (OR=2,59; p=0,01). Напротив, Т1sm3 — инвазия всей толщи подслизистой основы — не оказывала влияния на частоту регионарного метастазирования по результатам данного исследования.
Несколько японских авторов [8, 18] выявили в качестве основного независимого фактора регионарного метастазирования наличие лимфоваскулярной инвазии в опухоли, в то время как К. Sugimoto и соавт. [15] и Y. Egashira и соавт. [5] высказывались, что не последнюю роль в появлении метастазов в регионарных лимфоузлах играет венозная инвазия. Таким образом, результаты существующих исследований разнородны и зачастую не представляется возможным однозначно принять решение о том, является ли инвазия всей толщи подслизистого слоя (sm3) показанием для тотальной мезоректумэктомии.
В нашем исследовании частота регионарного метастазирования достаточно высока и превышает представленные данные практически в два раза. Возможно, это является следствием недостаточного количества клинического материала. Тем не менее среднее количество исследованных лимфоузлов параректальной клетчатки составляет 14,3±7,2 (7—46). При этом в большей части анализированных работ [5, 8, 10, 11, 16, 18, 21] среднее количество исследованных лимфоузлов не достигает 12 — количества, рекомендуемого AJCC «Anatomic Stages/Prognostic Groups» [4] для установления стадии N. Так, в исследовании из Нидерландов [10] среднее число исследованных лимфузлов составило всего лишь 7,3; в работе S. Okabe и соавт. [11] фигурируют данные о среднем количестве лимфоузлов, равном 10, в то время как K. Kitajima и соавт. [8], Y. Egashira и соавт. [5] и H. Wang и соавт. [21] вообще не упоминают о числе изученных лимфатических узлов. Лишь в работах K. Tominaga и соавт. [18] и H. Sung и соавт. [16] в удаленных препаратах после радикальных резекций среднее число найденных и исследованных лимфоузлов составляло 14,1 и 12 соответственно.
На основании проведенного унивариантного и мультивариантного анализа методом логистической регрессии мы выявили только два независимых фактора риска регионарного метастазирования раннего рака прямой кишки: слизистая и/или низкодифференцированная аденокарцинома (OR 24,5; 95%CI 1,92—312,4; p=0,014) и лимфоваскулярная инвазия (OR 74,3; 95%CI 3,73—1478,4; p=0,005). При этом инвазия всей толщи подслизистого слоя, как и в исследовании Y. Tateishi и соавт. [17], не оказывала статистически значимого влияния на частоту метастазирования в регионарные лимфоузлы (OR 0,24; 95%CI 0,04—1,43; p=0,22).
Таким образом, решение о возможности применения органосохраняющего лечения раннего рака прямой кишки должно приниматься мультидисциплинарной командой специалистов. Однако с нашей точки зрения адекватный выбор возможен лишь при наличии в клинике хорошо оснащенной лаборатории патоморфологии и мотивированных врачей-патоморфологов, способных предоставить исчерпывающую информацию об удаленной опухоли. При выявлении в ней факторов риска поражения регионарных лимфоузлов необходимо выполнить мезоректумэктомию.
Заключение
Наличие факторов риска регионарного метастазирования раннего рака прямой кишки: лимфоваскулярной инвазии, слизистой и/или низкодифференцированной аденокарциномы является показанием к трансабдоминальной резекции.
Авторы заявляют об отсутствии конфликта интересов.