Апоптоз что это коротко
Апоптоз что это коротко
Стремление решить сложную задачу по поиску новых лекарственных средств для пациентов вылилось в работу длительностью 31 год и большому вкладу в исследования онкологических заболеваний.
вызывая-гибель-опухолевых-клеток»>
Вызывая гибель опухолевых клеток
Как почти два десятилетия исследований дали понимание и надежду на восстановление способности опухолевой клетки к гибели.
Ссылки
[1] Cory S, Huang DCS, Adams JM. The Bcl-2 family: roles in cell survival and oncogenesis. Oncogene. 2003;22:8590-8607.
[2] Anders CK, Winer EP, Ford JM, et al. PARP inhibition: “targeted” therapy for triple negative breast cancer. Clin Cancer Res. 2010;16(19):4702-4710.
Ученые компании AbbVie объединяют глубокие знания в области биологии и передовые исследовательские технологии для совершенствования методов лечения рака.
Узнайте больше об иммуноонкологии
Copyright © 2021 AbbVie, Северный Чикаго, Иллинойс, США
Если не указано иное, все названия продуктов, появляющиеся на этом интернет-сайте, являются товарными знаками, принадлежащими и лицензированными компанией AbbVie Inc., ее дочерними компаниями или филиалами. Любое использование торговой марки, фирменного наименования или фирменного стиля AbbVie, указанного на данном сайте, не допускается без предварительного письменного разрешения AbbVie Inc., за исключением идентификации продукта или услуг компании.
Вы собираетесь покинуть сайт AbbVie.
Веб-сайт для конкретного продукта, который вы запросили, предназначен для жителей определенной страны или стран, как указано на этом сайте. В результате сайт может содержать информацию о фармацевтических препаратах, которые не одобрены в других странах или регионах. Если вы являетесь резидентом страны, отличной от той, в которую направлен сайт, пожалуйста, вернитесь на сайт AbbVie.com или обратитесь к местному партнеру AbbVie, чтобы получить соответствующую информацию о продукте для вашей страны проживания. Запрошенный вами интернет-сайт может быть не оптимизирован под ваш размер экрана. Хотите ли бы вы продолжить работу на этом сайте, посвященном конкретному продукту?
Принять по умолчанию
Отклонить по умолчанию
Вы собираетесь перейти на сторонний веб-сайт.
Приведенная ниже ссылка выведет вас из семейства веб-сайтов AbbVie. Ссылки, которые выводят вас с веб-сайтов AbbVie, не находятся под контролем AbbVie, и AbbVie не несет ответственности за содержание любого такого сайта или любых других ссылок с такого сайта. AbbVie предоставляет вам эти ссылки только для удобства, и переход по любой ссылке не означает одобрения связанного сайта компанией AbbVie. Запрошенный вами интернет-сайт может быть не оптимизирован под ваш размер экрана. Вы хотите покинуть этот сайт?
Апоптоз что это коротко
Клеточный гомеостаз в организме здорового человека определяется балансом между гибелью и пролиферацией клеток. Дефекты, возникающие в процессах дефференцировки и новообразования клеток, ведут к самоуничтожению этих структур [2]. Может показаться парадоксальным, что стимуляция клеточной гибели может способствовать выживанию организма.
Механизм, отвечающий за инициирование и выполнение запрограммированной гибели клеток, называется апоптозом. Он осуществляется под действием внеклеточных или внутриклеточных факторов. Под воздействием этого процесса, ДНК распадается на фрагменты, клетка сжимается, клеточные мембраны разрушаются, происходит элиминация и она поглощается соседней клеткой или специфичной клеткой имунной системы. Особенностью этого процесса является то, что мембрана клетки не разрушается до полного завершения этапов самопроизвольной гибели. Что дает возможность избежать риска возникновения воспалительных процессов. Обычно от начала запуска апоптоза до окончательной клеточной фрагментации требуется несколько часов. Однако этот период зависит от типа клетки, стимула и апоптотического пути [1,2].
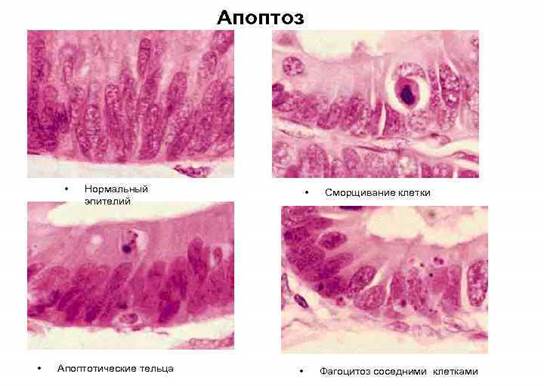
Апоптозные клетки выглядят как округлые либо овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина [1]. (Рис. 1.).
Рис. 1. Стадии апоптоза эпителиальной клетки
Основными регуляторами запрограммированной гибели клеток являются белки, принадлежащие к семейству Bcl-2. Эти белки могут, как активировать апоптоз, то есть быть проапоптотическими, так и ингибировать его, обладая антиапоптотическими свойствами. Антиапоптотические белки в здоровой клетке связывают и инактивируют проапоптотические. Это происходит тогда, когда она не нуждается в гибели [4,5].
Существует два основных пути апоптоза: внутренний и внешний. Внешний путь обеспечивает связывание «лиганд смерти» с «рецептором смерти». Внутренний путь контролируется митохондриями и выделением цитохрома С. Регуляторы апоптоза взаимодействуют со специфическими рецепторами на мембране клетки, называющимися «рецепторы смерти», которые связываются с молекулами, сигнализирующими гибель, как часть внешнего апоптотического пути. Это связывание вызывает эффект апоптоза [7].
Контроль такой элиминации производится в митохондриях, которые обеспечивают внутреннюю часть апоптического пути. В этих органеллах содержатся сигнальные молекулы, связаные с митохондриальной мембраной и известные как цитохром C. В ответ на проапоптотические сигналы из проапоптотических белков, высокую концентрацию Ca 2+ в цитозоле или гипоксию цитохром C высвобождается в клетку митохондриями и связывается с белком. Это приводит к образованию апоптосомы. После образования апоптосома активирует группу белков под названием каспазы, которые денатурируют другие белки в клетках [8]. Так как активные каспазы могут разрушающе воздействовать внутри здоровой клетки, они производятся в неактивной форме – прокаспазы. В фазе апоптоза семейство каспаз представляет собой основные эффекторные молекулы самого процесса элиминации, которые вносят вклад в конечные стадии апоптотической гибели клеток путем компонентов цитоскелетного аппарата и ядерной ДНК [4,9]. Все каспазы подразделяются на инициаторы, эффекторы и стимуляторы. Инициаторы расщепляют и активируют каспазы эффекторы, амплифицируя сигнал. Эффекторы расщепляют различные белки, что приводит к процессу апоптоза. Активация каспаз ведет к запуску протеолитического каскада реакций, провоцирующих гибель клетки [9].
Помимо каспаз, чрезвычайно важным является белок P53, обеспечивая обнаружение повреждения ДНК, аномалий хромосом и остановку клеточного цикла. Если повреждения необратимые, то апоптоз актимируется. P53 активирует процесс путем увеличения продуцирования проапоптотического белка, который активирует каспазный каскад, что в конечном итоге приводит к самоуничтожению клетки [10].
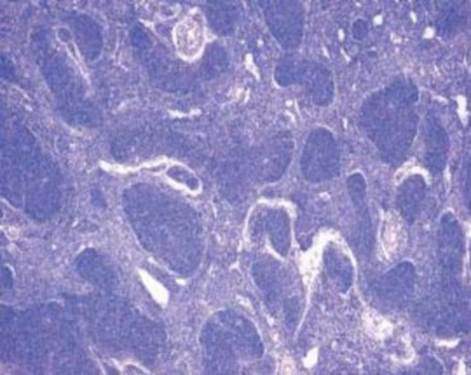
Так, в основе возникновения В-клеточной лимфомы лежит механизм, подавляющий синтез проапоптического белка семейства Bcl-2, что приводит к торможению апоптоза клеток фолликулярной лимфомы и их пролиферацию [3]. (Рис. 2.).
Рис. 2. Гистопрепарат ткани лимфатического узла. Фолликулярная лимфома.
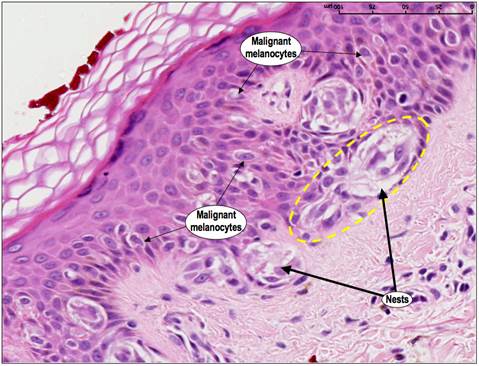
Новообразования можно рассматривать как результат последовательности генетических изменений, в течение которых нормальная клетка превращается в злокачественную. И именно несостоявшийся апоптоз таких клеток является одним из существенных критериев, которые вызывают злокачественную трансформацию [3]. Злокачественные клетки подвергаются серии генетических изменений. Если это способствует их преимущественному росту над нормальными клетками, то риск развития и роста новообразований значительно возрастает. Например, когда в клетках кожи возникают повреждения под воздействием ультрафиолетового излучения (например, солнцем, соляриями), обычно срабатывает апоптоз. Это помогает устранить патологические элементы. Если апоптоз не происходит, такие клетки могут выживать и пролифирировать, превращаясь в злокачественные. (Рис.3.).
Выводы. Таким образом, канцерогенез можно рассматривать как сложный клеточный процесс, который связан с неограниченным репликативным потенциалом, независимостью от сигналов роста и параллельным сопротивлением ингибирующему рост сигналу, уклонение от активации клеточной смерти, устойчивый ангиогенез, а также способность тканевой инвазии и метастазирования. Злокачественные опухоли являются инвазивными и могут метастазировать в отдаленные места через систему кровообращения. Следовательно, метастатическое распространение, а не первичная опухолевая нагрузка, является основной причиной смертей от рака [6,4,7].
АПОПТОЗ. МОРФОЛОГИЯ, БИОХИМИЯ
Морфологическое проявление апоптоза…………………………………4
Участие апоптоза в физиологических и патологических процессах…..7
Список используемой литературы……………………………………….18
Введение.
Запрограммированная клеточная гибель это биохимически специфический тип гибели клетки, который характеризуется активацией нелизосомных эндогенных эндонуклеаз, которые расщепляют ядерную ДНК на маленькие фрагменты. Морфологически апоптоз проявляется гибелью единичных, беспорядочно расположенных клеток, что сопровождается формированием округлых, окруженных мембраной телец (“апоптотические тельца”), которые тут же фагоцитируются окружающими клетками.
Апоптоз – энергозависимый процесс, посредством которого удаляются нежелательные и дефектные клетки организма. Он играет большую роль в морфогенезе и является механизмом постоянного контроля размеров органов. При снижении апоптоза происходит накопление клеток, пример – опухолевый рост. При увеличении апоптоза наблюдается прогрессивное уменьшение количества клеток в ткани, пример – атрофия.
Морфологические проявления апоптоза.
Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки выглядят как округлые или овальные скопления интенсивно эозинофильной цитоплазмы с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах он обнаруживается в случаях его значительной выраженности. К тому же апоптоз – в отличие от некроза – никогда не сопровождается воспалительной реакцией, что также затрудняет его гистологическое выявление.
Наиболее четко морфологические признаки выявляются при электронной микроскопии. Для клетки, подвергающейся апоптозу характерно:
Сжатие клетки. Клетка уменьшается в размерах; цитоплазма уплотняется; органеллы, которые выглядят относительно нормальными, располагаются более компактно. Предполагается, что нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы. Этот фермент вызывает прогрессивное образование перекрестных связей в цитоплазматических белках, что приводит к формированию своеобразной оболочки под клеточной мембраной, подобно ороговевающим клеткам эпителия.
Конденсация хроматина. Это наиболее характерное проявление апоптоза. Хроматин конденсируется по периферии, под мембраной ядра, при этом образуются четко очерченные плотные массы различной формы и размеров. Ядро же может разрываться на два или несколько фрагментов. Механизм конденсации хроматина изучен достаточно хорошо. Он обусловлен расщеплением ядерной ДНК в местах, связывающих отдельные нуклеосомы, что приводит к развитию большого количества фрагментов, в которых число пар оснований делится на 180-200. При электрофорезе фрагменты дают характерную картину лестницы. Эта картина отличается от таковой при некрозе клеток, где длина фрагментов ДНК варьирует.
Формирование в цитоплазме полостей и апоптотических телец. В апоптотической клетке первоначально формируются глубокие впячивания поверхности с образованием полостей, что приводит к фрагментации клетки и формированию окруженных мембраной апоптотических телец, состоящих из цитоплазмы и плотно расположенных органелл, с или без фрагментов ядра.
Фагоцитоз апоптотических телец. Фагоцитоз апоптотических клеток или телец осуществляется окружающими здоровыми клетками, или паренхиматозными, или макрофагами. Апоптотические тельца быстро разрушаются в лизосомах, а окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство. Фагоцитоз апоптотических телец макрофагами или другими клетками активируется рецепторами на этих клетках: они захватывают и поглощают апоптотические клетки. Один из таких рецепторов на макрофагах – рецептор витронектина, который является β3-интегрином и активирует фагоцитоз апоптотических нейтрофилов.
Участие апоптоза в физиологических и патологических процессах
Запрограммированном разрушении клеток во время эмбриогенеза (включая имплантацию, органогенез). Несмотря на то, что при эмбриогенезе апоптоз не всегда является отражением “запрограммированной смерти клетки”, это определение апоптоза широко используют различные исследователи.
Гормон-зависимой инволюции органов у взрослых, например, отторжение эндометрия во время менструального цикла, атрезии фолликулов в яичниках в менопаузе и регрессия молочной железы после прекращения лактации.
Удалении некоторых клеток при пролиферации клеточной популяции.
Гибели отдельных клеток в опухолях, в основном при ее регрессии, но также и в активно растущей опухоли.
Патологической атрофии гормон-зависимых органов, например, атрофии предстательной железы после кастрации и истощении лимфоцитов в тимусе при терапии глюкокортикоидами.
Патологической атрофии паренхиматозных органов после обтурации выводных протоков, что наблюдается в поджелудочной и слюнных железах, почках.
Гибели клеток, вызванных действием цитотоксических Т-клеток, например, при отторжении трансплантата и болезни “трансплантат против хозяина”.
Повреждении клеток при некоторых вирусных заболеваниях, например, при вирусном гепатите, когда фрагменты апоптотических клеток обнаруживаются в печени, как тельца Каунсильмана.
Гибели клеток при действии различных повреждающих факторов, которые способны вызвать некроз, но действующих в небольших дозах, например, при действии высокой температуры, ионизирующего излучения, противоопухолевых препаратов.
Биохимия апоптоза.
Активация цистеиновых (и некоторых других) протеаз — наиболее универсальная черта программируемой клеточной гибели независимо от организма, в котором она происходит. Основные участники программируемой клеточной гибели, каспазы («caspase» от «cysteine aspase») — это семейство эволюционно консервативных цистеиновых протеаз, которые специфически расщепляют белки по остаткам аспарагиновой кислоты. В настоящее время идентифицировано 10 каспаз. При апоптозе помимо активации цистеиновых протеаз, у растений выявлено возрастание активности сериновой и аспарагиновой протеаз.
Кроме того, в апоптозе принимают участие и другие протеазы, прежде всего, кальпаины, или Са2+-зависимые протеазы и убиквитин (протеаза, ковалентно связывающаяся с белком-мишенью). Эти протеазы — обязательный компонент каскада протеолитических ферментов. Так, ингибиторы кальпаина блокируют апоптоз. Убиквитин-протеосомный путь деградации белков активируется при апоптозе.
Роль каспаз в апоптозе разнообразна. Результатом активности протеаз являются характерные изменения в морфологии клеток при апоптозе.1. Гидролиз белков ламинов, армирующих ядерную мембрану. Это ведет к распаду ядерной оболочки и конденсации хроматина. Мишенями протеаз при апоптозе являются также белки ядрышек, гистоны и негистоновые белки и топоизомераза. Топоизомераза — связующее звено между ДНК хроматина и белковыми структурами ядра, с помощью которого хроматин прикрепляется к ядерному матриксу. Расщепление топоизомеразы — это этап образования высокомолекулярных фрагментов ДНК.
Множество ветвей сигнальной трансдукции перепроверяет правильность выбранного алгоритма событий на пути к апоптозу, уберегая клетку от бессмысленной гибели. Выявлено несколько механизмов, ограждающих клетку от случайного самоуничтожения с участием протеаз.
Во-первых, протеазы синтезируются в клетке в неактивной форме, а процессинг неактивных форм протеаз происходит путем автолиза или путем протеолиза другими протеазами. Например, каспазы синтезируются в клетке в виде прокаспазы — неактивного мономера с молекулярной массой 30-50 кДа. Активные формы — тетрамеры, содержащие по две субъединицы: (р 10 — р20)2 (рис. 9.7). Прокаспазы обладают незначительной протеолитической активностью, составляющей 1-2% активности зрелой каспазы. Механизм протеолитического само- или перекрестного расщепления (ауто- или транс-процессинга), а затем пространственного сближения ведет к образованию активных каспаз. От прокаспазы отделяется регуляторный N-концевой домен (продомен), а оставшаяся часть молекулы разделяется на большую (около 20 кДа) и малую (около 10 кДа) субъединицы. Затем происходит ассоциация большой и малой субъединиц. Два гетеродимера образуют тетрамер с двумя каталитическими центрами, работающими независимо. Первоначально концентрация каспаз в клетке ничтожна. Благодаря свойству автокатализа, концентрация активных каспаз может возрастать лавинообразно.Во-вторых, протеазы обратимо взаимодействуют с эндогенными белковыми ингибиторами, образуя неактивные комплексы (латентные комплексы описаны для цистеиновых, Са2+-зависимых и некоторых других протеаз). При действии различных индукторов апоптоза происходит диссоциация неактивных комплексов протеаза-ингибитор. Обратимое взаимодействие Са2+-зависимых протеаз с эндогенными ингибиторами регулируется кальцием. Цистеиновая протеаза связывается ковалентно с ингибитором через дисульфидную связь. Высвобождение и активация каспазы происходит в результате тиол-дисульфидного обмена и сопряжена с окислительно-восстановительным состоянием клетки и метаболизмом глюкозы.В-третьих, протеазы могут быть компонентами специальных рецептор-зависимых систем. Так, [рецептор + лиганд + адаптер + прокаспаза] формируют специфический агрегат, в котором происходит активация каспаз. Такой агрегат называют апоптосомой или апоптозным шапероном. Самое интересное, что выявлены консервативные области гомологии (в том числе NB-область) белка адаптера у животных и продуктов генов резистентности у растений, включая томат, арабидопсис и табак. Более того, белки похожи структурно. Предполагается, что продукты гена резистентности могут играть роль адаптеров в апоптосоме. Таким образом, при узнавании продукта авирулентности, по всей видимости, происходит диссоциация апоптосомы и развертывание программы апоптоза.
Продукты генов резистентности, по-видимому, ответственны за эффективность гибели клеток при заражении — узнавание факторов и запуск машины самоуничтожения, за первые (самые важные) шаги на пути к стремительной гибели клетки.Существует несколько путей реализации программы ПКГ. Путь передачи сигнала: индукторы — рецепторы — адаптеры — каспазы первого эшелона — регуляторы — каспазы второго эшелона. Рецептор взаимодействует с лигандом. Насколько обратима гибель клетки? На этапе активации каспаз первого эшелона жизнь клетки еще можно сохранить. Существуют регуляторы, которые блокируют или, напротив, усиливают разрушительное действие каспаз первого эшелона. После активации каспазами первого эшелона каспаз второго эшелона путем протеолиза из прокаспаз процесс, запушенный программой смерти, становится необратим. Эти каспазы способны в дальнейшем к самоактивации (автокатализу или автопроцессингу) и активируют фактор фрагментации ДНК на нуклеосомные фрагменты. Вернемся к митохондриям. Апоптотическое изменение митохондрии может индуцироваться окислительным стрессом, повышением концентрации Ca2+. При апоптозе из межмембранного пространства митохондрий высвобождаются белки — апоптогенные факторы:
AIF (Apoptosis Inducing Factor) — флавопротеин с молекулярной массой 57 кДа. Будучи добавлен к изолированным ядрам, он вызывает конденсацию хроматина и фрагментацию ДНК, а при добавлении к изолированным митохондриям — высвобождение цитохрома С и каспазы 9. Высвобождаемый цитохром С вместе с цитоплазматическим фактором APAF-1 (apoptosis protease activating factor-1) образует комплекс с прокаспазой. APAF-I играет роль арматуры, на которой происходит аугокаталитический процессинг каспазы 9 (мультимерная арматура APAF1-цитохром-С-комплексов напоминает пропеллер). Обнаружены ингибиторы высвобождения цитохрома С, блокирующие апоптоз, например, белок Bel.
Список используемой литературы:
Гордеева А.В., Лабас Ю.А., Звягильская Р.А.Апоптоз одноклеточных организмов: механизмы и эволюция Биохимия, 2004, том 69, вып. 10, с. 1301—1313
Голубев А.М., Москалева Е. Ю., Северин С.Е., Веснянко Т.П., Кузовлев А.Н., Алкадарский А.С., Порошенко Г.Г. Апоптоз при критических состояниях
Апоптоз в сосудистой патологии: настоящее и будущее
Полный текст
Аннотация
Ключевые слова
Полный текст
В течение длительного периода времени исследователи были заинтригованы наблюдением гибели клеток сосудистой стенки при отсутствии их явного некроза [1]. В 1972 г. J.F. Кеrr и его коллеги описали новую форму гибели клеток отличную от некроза, которую назвали апоптозом (в переводе с древнегреческого «опадение» или «листопад») [2]. Он представляет собой запрограммированную клеточную гибель, которая находится под контролем генетических механизмов и необходима для нормального существования организма. Основная его роль – поддержание постоянства клеточного состава и уничтожение дефектных клеток [3]. Нарушения механизмов смерти клеток лежат в основе многих заболеваний, включая ишемические повреждения, аутоиммунные расстройства, злокачественные новообразования.
Молекулярные механизмы апоптоза
Апоптоз, с одной стороны, может быть активирован через систему внутренних сигналов. Клетки запускают внутреннюю программу самоуничтожения в ответ на изменения гемодинамических параметров или потерю контакта с соседними клетками. С другой стороны, он может быть инициирован через внешние стимулы, такие как цитокины, гормоны, окисленные липиды, ионизирующие или вирусные агенты, протекая при этом более остро и массивно. Некоторые пути гибели клеток предрасположены к повсеместному распространению (например, те, которые связаны с радиационным повреждением ДНК), тогда как другие присутствуют только в определенных клетках, что обеспечивает их эффективное удаление. Соотношение проапоптотических и антиапоптотических молекул определяет судьбу клетки в конкретный момент времени [4].
В запрограммированном каскаде гибели клетки выделяют несколько основных функциональных этапов.
В фазе инициации, или сигнализации, клетки получают индуцирующие сигналы. Это достигается путем присоединения определенных молекул (таких как фактор некроза опухоли α (ФНО-α), Fas-лиганд) к рецепторам гибели (TNFR1, Fas) на поверхности клетки с последующим набором белков домена смерти (например, FADD), необходимых для активизации каспазы-8 [5].
В контрольной, или эффекторной, фазе происходит активация каспаз с потерей митохондриального мембранного потенциала. Каспазы представляют собой семейство цистеиновых протеаз, которые участвуют в трансдукции и выполнении апоптотической программы. Они находятся в виде неактивных проферментов, которые активируются протеолитическим расщеплением. В центральных переходах на пути апоптоза расположены каспаза 3, 8 и 9.
Фаза выполнения находится под контролем семейства белков Bcl-2, которые ингибируют высвобождение цитохрома С или фактора индуцирующего апоптоз из митохондрий. Семейство белков Bcl-2 содержит как ингибиторы (Bcl-2, Bcl-xL и др.), так и индукторы (Bcl-xS, Bax, Bid, Bad, Bak и др.) смерти [6]. Соотношение между антиапоптотическими и проапоптотическими белками определяет, подвергнется клетка гибели или нет. После получения соответствующего сигнала Bax или Bak подвергаются конфирмационным изменениям и перемещаются в митохондриальную мембрану, где они вызывают выделение цитохрома С в цитозоль [7].
Фаза деградации геномной ДНК приводит к необратимой потере жизнеспособности клетки.
В фазе распознавания погибшие клетки удаляются из ткани в результате фагоцитоза соседними клетками с помощью различных механизмов (например, через фосфатидилсерин (ФС) или рецептор витронектина) [8].
Апоптоз эндотелиальных клеток
Фактор роста фибробластов (FGF-2) является еще одним внутрисосудистым фактором сохранения эндотелиальных клеток. Проведенное А. Karsan, et al. (1997) исследование показало, что FGF-2 специфически индуцирует Bcl-2, но не другие белки семейства Bcl. Однако другие Bcl-2-независимые механизмы, такие как фосфорилирование тирозина, могут также ингибировать гибель эндотелия с помощью FGF-2 [10].
Инкубация клеток эндотелия с ФНО-α заметно усиливает апоптоз через активацию каспазы-3. Данный процесс может быть полностью отменен ингибиторами каспаз [15]. С другой стороны, ФНО-α способен индуцировать белки семейства Bcl-2, а также активировать путь NF-κB. Следовательно, ФНО-α, может инициировать как проапоптотический, так и антиапоптотический пути [16]. Белки Bcl-2 и Bcl-XL способны подавлять активацию эндотелиальных клеток посредством специфического ингибирования NF-κB пути. Это доказывает, что данные белки обладают цитопротективными эффектами противодействия провоспалительным стимулам. Интересно, что интерлейкин-10 (IL-10) обладает антиапоптотическим действием, поэтому баланс между выживанием и гибелью клеток может зависеть от баланса между про- и противовоспалительными цитокинами.
Апоптоз гладкомышечных клеток
После проведения многочисленных исследований рост гладкомышечных клеток (ГМК) рассматривается как результат противоположных эффектов клеточной пролиферации и апоптоза. Как известно, многие факторы роста ГМК действуют как митогены, частично предотвращая апоптоз, поддерживая секрецию белков Bcl-2. Например, IGF-I стимулирует повышенную экспрессию неактивной фосфорилированной формы Bad посредством PI3-киназозависимого пути. Факторы роста и соответствующие им рецепторы синтезируются при многих сосудистых заболеваниях и могут предотвращать апоптоз ГМК в пределах артериальной стенки [17].
Механические факторы. M.J. Pollman, et al. (1999) показали, что чрескожная транслюминальная баллонная ангиопластика (ЧТБА) вызывает быструю гибель ГМК в пределах нормальной артериальной стенки [18]. Апоптоз ГМК связан с активацией стресс-активируемой протеинкиназы, а введение антиоксидантов ингибирует ее. Этот сигнальный путь не может быть активирован в неоинтимальных ГМК из-за активизации в них Bcl-xl [19]. Окисленные липопротеины низкой плотности (ЛПНП) способствуют апоптозу ГМК, частично за счет подавления Bcl-2 и активации каспазы-3.
Вазоактивные вещества
Локальная продукция высоких уровней NO в стенке артерии ингибирует рост клеток и образование неоинтимы после ЧТБА [19]. В свою очередь, ангиотензин II (АТ II) в стенке сосуда способствует росту ГМК и утолщению стенки [20]. NO-индуцированный апоптоз предотвращается ингибированием cGMP-зависимой протеинкиназы Iα, а также добавлением АТ II. Следует отметить, что проапоптотическое действие NO проявляется на супрафизиологическом (патологическом или воспалительном) уровне, тогда как его антиапоптотическое действие, наблюдается при физиологических (эндотелиальных) концентрациях [21]. Аналогично, AТ II предотвращает гибель ГМК посредством стимуляции рецептора AT1, но способствует апоптозу посредством стимуляции рецептора AT2 [22].
Онкогены и гены-супрессоры опухолей. Онкоген c-myc экспрессируется в ГМК атеросклеротических бляшек (АТБ) и эти клетки демонстрируют более низкую скорость роста в сравнении с ГМК, полученных из стенки нормальных артерий. В своей работе T. Jacob, et al. (2012) показали, что ГМК АТБ гиперчувствительны к апоптозу, опосредованному р53. Активация p53 временно увеличивает поверхностную экспрессию Fas и сенсибилизирует клетку к гибели [23].
Апоптоз при атеросклерозе
Во время развития АТБ происходит как гибель, так и пролиферация клеток. В настоящее время получены доказательства наличия апоптоза во всех клетках АТБ: ГМК, макрофагах, лимфоцитах и эндотелиальных клетках. Наиболее часто встречается в макрофагах, что позволяет предположить, участие этих клеток в его индукции. Запрограммированная гибель клеток почти не определяется в нормальных артериях, едва детектируется в жировых полосках и более распространенна в распространенных атеросклеротических поражениях [24]. ГМК погибают в АТБ, несмотря на присутствие факторов роста. Это связано с экспрессией онкогена c-myc в отсутствии белков Bcl-2 и повышенной чувствительностью к p53 [25]. Последние данные показали повышенную активность проапоптотического белка Bax в жировых полосах человека и распространенных АТБ. Bax не обнаруживался в нормальных артериях, где преобладала экспрессия белка Bcl-xl. Баланс между про- и антиапоптотическими белками при атеросклерозе благоприятствует первому, и подразумевает, что ГМК запрограммированы на гибель при наличии дополнительных проапоптотических стимулов [26].
Одна из главных ролей апоптоза при атеросклерозе связана с его прокоагулянтным потенциалом. Воздействие ФС на клеточную поверхность значительно усиливает активность тканевого фактора, который определяет тромбогенность АТБ и способствует возникновению острых ише-мических событий [27].
Терапевтическая модуляция апоптоза при атеросклерозе
M.J. Pollman, et al. (1998) сообщили о регрессии бляшки у кроликов, после ингибирования экспрессии Bcl-xl с помощью антисмыслового олигонуклеотида с последующей индукцией апоптоза неоинтимы [28].
NO является мощной антиапоптотической молекулой для эндотелиальных клеток. B.Y. Wang, et al. (1999) также наблюдали регрессию атероматозных поражений у кроликов после введения L-аргинина для индукции апоптоза макрофагов через cинтез NO [29]. С другой стороны, может быть опасно индуцировать массовую гибель клеток атеросклеротических поражений без антикоагулянтной терапии, учитывая их протромбогенный потенциал. Погибающие эндотелиальные клетки преимущественно расположены в постстенотической зоне с низким напряжением сдвига. Следовательно, доставка NO, с добавлением L-аргинина или доставка эндотелиальных факторов роста может ограничить гибель, тромбоз клеток и изменить прогрессирование атеросклероза [30].
В свою очередь, антагонисты рецепторов АТ II, блокаторы кальциевых каналов являются сильными индукторами апоптоза. Антиоксиданты, такие как триметазидин, пробукол, витамины С и Е ингибируют апоптоз ГМК после хирургического вмешательства [31, 32]. Применение препаратов данных групп недостаточно исследовано в литературе, а полученные результаты противоречивы.
Наконец, возникновение смерти клеток в АТБ сильно зависит от воспалительного баланса. Введение IL-10 может быть разумной стратегией для уменьшения воспалительной реакции, апоптотической гибели клеток и, следовательно, стабилизации бляшки.
Апоптоз и рестеноз
В различных атеросклеротических и рестенотических поражениях апоптозу подвергаются от 2 до 50% клеток. На моделях с использованием различных животных по формированию неоинтимы после ЧТБА, было показано, что апоптоз происходит в разные моменты времени и на разных уровнях в процессе восстановления.
J.M. Isner, et al. (1995) показали более высокую частоту апоптоза в рестенотических поражениях в сравнении с первичным атеросклерозом коронарных артерий [34]. Однако, этот вывод был оспорен G. Bauri-edel, et al. (1998), которые наблюдали снижение уровня апоптоза в зоне рестеноза. Высокая плотность клеток является ключевой находкой при позднем развитии рестеноза области хирургического вмешательства и соответствуют парадигме, что более низкие показатели апоптоза приводят к гиперплазии. Это согласуется с обнаружением сниженной активности р53 в рестенотическом материале коронарных артерий [35].
В своей работе P. Krishnan, et al. (2019) изучил рестенотические поражения после применения баллона с лекарственным покрытием во время ЧТБА. В них было значительно снижены количество клеток неоинтимы, ГМК, плотность фибробластов, увеличена активность каспазы 3 и определялись отложения коллагена типа III в сравнении поражениями при применении баллонов без покрытия [37].
Заключение
Дальнейшее изучение процессов гибели и пролиферации клеток необходимо для разработки вмешательств с целью предотвращения развития различных заболеваний.
Дополнительная информация [Additional Info]
Источник финансирования. Бюджет ФГБОУ ВО Рязанский государственный медицинский университет им. акад. И.П. Павлова Минздрава России.
[Financing of stady. Budget of Ryazan State Medical University.]
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, о которых необходимо сообщить, в связи с публикацией данной статьи.
[Сonflict of interests. The authors declare no actual and potential conflict of interests which should be stated in connection with publication of the article.]
Участие авторов. Калинин Р.Е. – концепция литературного обзора, редактирование, Сучков И.А., Егоров А.А., Поваров В.О. – редактирование, Климентова Э.А., – сбор, перевод и анализ материала, написание текста.