Апоптоз что это простыми словами
Апоптоз
Апоптоз – это гибель клеток организма, запрограммированная генетически. При апоптозе клетки «аккуратно» разбираются и удаляются, впоследствии не развивается воспалительный процесс (в отличие от некроза клеток). Каждый день около 5% клеток организма подвергаются апоптозу, и вместо них образуются новые клетки. Весь процесс гибели клетки в результате апоптоза занимает около 20-120 минут, после истечения этого времени от клетки не остается и следа.
Благодаря этому процессу удаляются дефектные и нежелательные клетки организма, если апоптоз будет снижен, то велик риск развития и роста опухолей.
Некроз – это тоже форма клеточной гибели, но имеет существенные отличия от апоптоза:
Примеры апоптоза:
Внешнее влияние на процесс апоптоза
Внешние факторы действительно могут воздействовать на апоптоз, если они повреждают ДНК. Активируют апоптоз также повреждения клетки, нарушения регуляции клеточного роста, вирусные инфекции. Апоптоз, словно защитный щит, включается при потенциальной угрозе для организма, удаляя поврежденные клетки, которые могут причинить вред.
При этом независимо от причины апоптоза, его конечный путь регулируется только генами, внешние факторы и различные состояние организма могут только влиять на ускорение или замедление начальных стадий апоптоза.
Если в организме наблюдается усиленный апоптоз, то это может провоцировать раннее старение и развитие болезни Альцгеймера. Также доказано, что усиленный апоптоз наблюдается при нейротрофических заболеваниях, СПИДе, некоторых болезнях крови.
Если же апоптоз снижен (из-за избытка белка, ингибирующего апоптоз, или при недостатке гена, который следит за целостностью генома при митозе), то возрастает риск роста клеток злокачественных образований, эти клетки накапливаются, то есть растут и развиваются опухоли.
Апоптоз что это простыми словами
Апоптозом называется запрограммированная клеточная гибель. Этот процесс играет важную роль в росте и развитии организма, т. к. по мере созревания тканей некоторые клетки должны погибнуть, чтобы уступить место более дифференцированным и специализированным.
Если клетка не умирает и становится бессмертной, может развиться злокачественная опухоль. Впервые апоптоз был описан в 1970-е годы, но только в последнее время исследователи осознали его важную роль для развития организма, дифференцировки тканей и малигнизации.
Интерес к апоптозу возрос, когда выяснилось, что этот процесс находится под контролем генов, вовлеченных в злокачественную трансформацию, т. е. онкогенов, протоонкогенов и генов-супрессоров. Очевидно, что многие из этих генов активны во время развития организма.
Полагают, что изучение апоптоза и путей его регуляции позволит понять механизмы развития организма и старения. Утрата клеточного контроля над программированной клеточной гибелью ведет к развитию опухолей.
Апоптоз — особый вид клеточной гибели, ответственный за устранение клеток в нормальных тканях. Тем не менее этот процесс наблюдается и при патологических процессах. Гистологически проявляется уменьшением клетки, буллезным разрушением клеточной мембраны и конденсацией клеточного ядра.
В итоге образуются апоптотические тельца, содержащие неповрежденные органеллы; окружающие клетки фагоцитируют эти тельца. Апоптоз не сопровождается воспалением, что отличает его от некроза. Последний сопровождается набуханием клетки, разрушением всех ее структур и развитием воспалительного ответа.
На молекулярном уровне при апоптозе происходит саморазрушение генома на мельчайшие фрагменты, осуществляемое ферментами самой клетки; в итоге при электрофорезе образующихся клеточных компонентов в полиакриламидном геле выявляется характерная «лестница» из фрагментов ДНК.
Апоптоз играет важную роль в нормальном росте организма, а также в развитии и прогрессировании злокачественных опухолей. Спонтанный апоптоз встречается в злокачественных клетках и даже замедляет их рост.
Интенсивность этого процесса возрастает при облучении опухоли, проведении гормоно- и химиотерапии, при нагревании опухоли. В злокачественных опухолях апоптоз представляет механизм уничтожения клеток, в которых произошли канцерогенные изменения ДНК.
Однако если он заблокирован или подавлен мутациями контролирующих его генов, например BCL2 или ТР53, то эти клетки получают возможность свободно делиться и неограниченно накапливать мутации. Такая генетическая нестабильность — ранний этап развития злокачественных опухолей.
Многие из современных методов лечения, например лучевая и химиотерапия, направлены на уничтожение клеток за счет повреждения их ДНК. Мутации гена BCL2 или ТР53 ухудшают эффективность лечения, т. к. подавляют клеточную гибель.
Более глубокое понимание процессов запрограммированной клеточной гибели может привести к разработке новых, более эффективных методов лечения. Ингибиторы апоптоза (например, протоонкоген BCL2) могут быть ответственны за развитие резистентности к противоопухолевым препаратам, позволяя выживать клеткам с патологической ДНК.
Вероятно, в дальнейшем будут выявлены и другие механизмы подавления апоптоза. Не следует думать, что этот процесс отражает нечто иллюзорное в биологической литературе, а термин принят только для описания отличной от некроза клеточной гибели. Апоптоз — фундаментальный процесс, контролируемый на молекулярном уровне, и можно надеяться, что его удастся расшифровать и использовать для медицинских нужд. Возможные механизмы апоптоза представлены на рисунке.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Онкология»
Апоптоз
Из Википедии — свободной энциклопедии
Апопто́з (др.-греч. ἀπόπτωσις «опадание», от ἀπό- + πτῶσις «падение») — регулируемый процесс программируемой клеточной гибели, в результате которого клетка распадается на отдельные апоптотические тельца, ограниченные плазматической мембраной. Фрагменты погибшей клетки обычно очень быстро (в среднем за 90 минут [1] ) фагоцитируются макрофагами либо соседними клетками, минуя развитие воспалительной реакции. Морфологически регистрируемый процесс апоптоза продолжается 1—3 часа. [2] Одной из основных функций апоптоза является уничтожение дефектных (повреждённых, мутантных, инфицированных) клеток. В многоклеточных организмах апоптоз к тому же задействован в процессах дифференциации и морфогенеза, в поддержании клеточного гомеостаза, в обеспечении важных аспектов развития и функционирования иммунной системы. Апоптоз наблюдается у всех эукариотов, начиная от одноклеточных простейших и вплоть до высших организмов. В программируемой смерти прокариотов участвуют функциональные аналоги эукариотических белков апоптоза. [3]
Исследования программируемой клеточной смерти ведутся с конца 1960-х годов. Термин «апоптоз» был впервые употреблён в 1972 году в работе британских учёных — Дж. Керра, Э. Уайли и А. Керри. Одними из первых к изучению генетики и молекулярных механизмов апоптоза приступили С. Бреннер, Дж. Салстон и Р. Хорвиц, все трое в 2002 году были удостоены Нобелевской премии по физиологии или медицине за открытия в области генетической регуляции развития органов и за достижения в исследованиях программируемой клеточной смерти. В настоящее время установлены основные механизмы реализации апоптоза в эукариотических клетках, активно ведутся исследования регуляторов и активаторов апоптоза. Интерес учёных связан с возможностью применения знаний о программируемой клеточной смерти в медицине при лечении онкологических, аутоиммунных и нейродегенеративных заболеваний. [4]
В организме среднестатистического взрослого человека в результате апоптоза погибает ежедневно порядка 50—70 миллиардов клеток. Для среднестатистического ребёнка в возрасте от 8 до 14 лет число клеток, погибших путём апоптоза, составляет порядка 20—30 миллиардов в день. Суммарная масса клеток, которые на протяжении 1 года жизни подвергаются разрушению, эквивалентна массе тела человека. При этом восполнение утраченных клеток обеспечивается за счёт пролиферации — увеличения клеточной популяции путём деления. [5]
Апоптоз
«Апоптоз» в переводе с греческого означает «опадение листьев» — в современное клеточной теории это понятие означает вид «клеточной смерти», генетически строго контролируемый процесс, зависящий как от внутренних, так и от внешних факторов.
В последнее десятилетие были открыты многие белки и молекулы, лежащие в основе механизма апоптоза, выяснена природа клеточных процессов и сигнальных каскадов, регулирующих процесс апоптоза. Ранее биологи предпочитали говорить о «программированной клеточной смерти» (синоним апоптоза), поскольку этот термин подчеркивал значимость клеточной программы в форме генов и белков, активированных во время фазы регулирования и исполнения данного вида «смерти (гибели) клеток».
Апоптоз — активный процесс, и часто ведет к активации каспазы. В отличие от некроза, при котором «смерть клетки» наступает после механического или патологического повреждения мембран и клеточных органелл и процесс которого сопровождается воспалительной реакцией с последующим выделением, участвующих в реакциях цитокинов, при апоптозе последние выделяются лишь в незначительном количестве.
С морфологической точки зрения параметры апоптоза включают в себя конденсацию хроматина и разложение ДНК на 180bp интернуклеосомальные фрагменты из-за эндонуклеазы, активированной каспазами. Во время апоптоза в клетке присутствуют фрагменты ДНК с большой молекулярной массой (50-300 kbp), отражающие активацию факторов, разрушающих ДНК, например, фактора, индуцирующего апоптоз.
С точки зрения психиатрии и неврологии представляет интерес тот факт, что некоторые субпопуляции нейронов могут иметь признаки апоптоза после различных повреждений (некроз после инсульта). Одновременное сочетание признаков некроза и апоптоза (разрушенные мембраны, фрагментированные ДНК) могут быть обнаружены в одном и том же нейроне. Более того, одни и те же химические вещества, например, каиновая кислота, стимулирующая глутаматные рецепторы нейронов и вызывающая эксайтотоксичность, могут привести как к апоптозу, так и к некрозу клетки. Вариант исхода в данном случае зависит от времени воздействия, концентрации активно действующего вещества, возраста организма и самого нейрона. Вообще нейронам свойственно подвергаться апоптозу, когда в наличие имеется достаточное количество энергии. Однако этот процесс может быть прекращен вследствие воздействия различных факторов, таких, как АТФ и функционирование митохондрий.
Уровень свободных радикалов (активных форм кислорода — АФК) играет большую роль в регуляции апоптоза с помощью вовлечения клеточных органелл, включая митохондрии. Образование АФК и оксидантный стресс участвуют в развитии нейродегенеративных заболеваний (болезнь Альцгеймера). При травме головного мозга описана парадоксальная реакция ингибирования выработки АФК одновременно с увеличением числа клеток, подвергнувшихся апоптозу.
Апоптоз происходит в нормальных пределах среди различных популяций развивающихся нейронов, однако, морфология гибнущих клеток отличается от морфологии классического апоптоза, при этом замедляется и кинетика «смерти клеток». Возможно, что нейроны могут подвергаться и апоптозу и аутофагической дегенерации во время одного и того же патологического процесса. Одновременная активация протеаз и сигнальных путей, согласованно действующих в клетке, является общим мотивом при многих заболеваниях головного мозга, сопровождающихся дисфункцией и гибелью нейронов. Некоторые авторы предлагают заменить термин «апоптоз» понятием «активная клеточная смерть» (активация клеточных процессов), а «некроз» — «пассивная клеточная смерть».
Медицинские интернет-конференции
Языки
Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
Булудова М.В., Полутов В.Э.
Резюме
В работе представлены современные данные литературы, относительно механизмов развития апоптоза, его принципиальных отличий от некроза, значение в поддержании клеточного гомеостаза в лимфоидной и других пролиферирующих тканях.
Ключевые слова
Статья
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
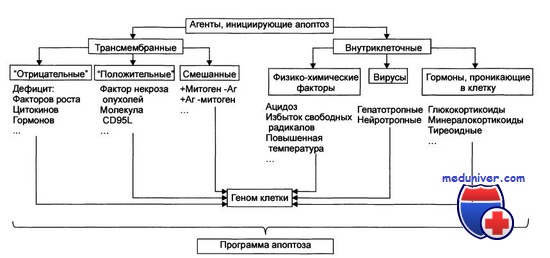
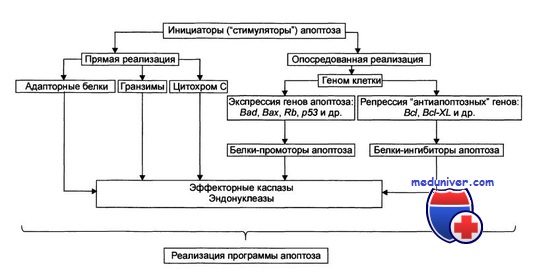
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные. Отрицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
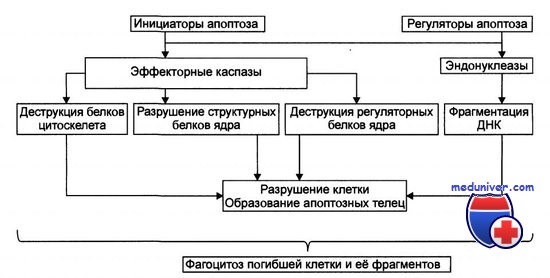
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов. Повышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).