Аппарат для получения тромбоцитарной фракции крови что это
Памятка для доноров
АППАРАТНЫЙ ТРОМБОЦИТАФЕРЕЗ
Достижение последних лет в службе крови позволило осуществлять в лечение больных принцип компонентой терапии, т.е. использование компонентов донорской крови. Это в свою очередь послужило толчком для заготовки не цельной крови, а компонентов донорской крови.
Обращаясь в пункт сдачи крови, желая стать донором, человек выражает проявление гуманизма и патриотизма. Донорство-акт доброй воли, но вид донорства определяет врач в соответствии с заявками лечебно-профилактических учреждений, и это компонентное донорство.
Донором аппаратного тромбоцитафереза может быть любой человек, достигший 18 лет, добровольно согласившейся на эту процедуру и прошедший медицинское освидетельствование и предварительное лабораторное обследование. Процедура будет выполняться только после получения результатов исследований.
Донорам, получившим направление на данную процедуру за 48 часов до ее проведения нельзя принимать препараты способствующие разжижению крови: ацетилсалициловую кислоту (аспирин), трентал, курантил. Это может спровоцировать кровотечение или образование гематом.
До и после процедуры донор должен выпить стакан теплого сладкого чая, что является обязательным условием для благополучного проведения процедуры.
В процессе проведения процедуры необходимо выполнять все рекомендации медицинского персонала, после проведения выполнять рекомендации врача по режиму труда и отдыха, а также соблюдения интервала между последующими процедурами.
Аппарат для получения тромбоцитарной фракции крови что это
Принципы действия PRP
Описание процедуры PRP

1 этап: Выполняется забор крови из локтевой вены пациента (около 15-20 мл) в специальный комбинированный шприц-шаттл;


Что нужно знать перед применением процедуры PRP?
Перед применением данной процедуры пациенту необходима консультация специалиста для точной диагностики проблемы, построения правильной схемы лечения и возможного выявления противопоказаний:
• наличия у пациентов воспалительных заболеваний (ОРЗ, ОРВИ и т.д.);
• отсутствия таких заболеваний, как Гепатит B, Гепатит C, ВИЧ и т.д;
После выполнения процедуры необходимо воздержаться от чрезмерных физических нагрузок (1-2 дня).
Специалисты Клиники травматологии и ортопедии ММЦ «СОГАЗ» обладают необходимым опытом для проведения терапии обогащенной тромбоцитарной массы (PRP) на современном оборудовании Клиники.
*О возможных противопоказаниях проконсультируйтесь со специалистом.
Савицкий Дмитрий Святославович, заведующий отделением травматологии и ортопедии, врач травматолог-ортопед.
Устройство для получения тромбоцитарных фракций плазмы крови
Владельцы патента RU 2736004:
Изобретение относится к области медицины, в частности к устройствам, предназначенным для получения тромбоцитарных фракций плазмы крови. Устройство для получения тромбоцитарных фракций плазмы крови в закрытом цикле включает в себя два шприца с цилиндрическими корпусами разного диаметра. При этом шприцы выполнены из прозрачного материала. Первый шприц имеет поршень, шток которого соединен с ним резьбовым соединением. Ручка поршня имеет широкое устойчивое основание, выполненное с возможностью устойчивого размещения шприца на поверхности после забора цельной крови и после центрифугирования перед присоединением второго шприца. На внешнюю поверхность корпуса первого шприца нанесена круговая метка, которая соответствует верхнему краю поршня после забора крови, при этом круговая метка расположена таким образом, что поршень выполнен с возможностью дальнейшего смещения до упора в основание корпуса шприца. Дистальные концы первого и второго шприцев имеют внешние резьбовые соединения, соответствующие внутренним резьбовым соединениям цилиндрического прозрачного переходника между ними, катетеров и колпачков. На внешнюю поверхность корпуса переходника нанесена круговая метка, соответствующая верхнему уровню крови в первом шприце после перемещения необогащенной и обогащенной тромбоцитами фракции во второй шприц. 1 ил.
Изобретение относится к области медицины, в частности к устройствам, предназначенным для получения тромбоцитарных фракций плазмы крови.
Известно устройство для получения обогащенной тромбоцитами плазмы торговой марки PlasmoliftingTM [1], представляющее собой пробирку содержащую антикоагулянт и прозрачный разделительный гель-фильтр, отделяющий тромбоцитарную взвесь от компонентов крови. Пробирка изготовлена из высококачественного медицинского боросиликатного стекла. Пробка, укупоривающая пробирку, выполнена из бромбутилкаучука, обладающего геморепеллентным свойством (свойством отталкивать кровь). Она обеспечивает герметичность пробирки, стерильность и неизменность химического состава плазмы, а также создание вакуума, позволяющего значительно ускорить и упростить процедуру забора крови.
Недостатком данного устройства является отсутствие в его составе элементов для забора крови и получения плазмы. Это не дает получить истинно обогащенную тромбоцитарную плазму за счет многократного контакта забранной крови и полученной плазмы с другими поверхностями, что ведет к агрегации тромбоцитов и снижению качества полученной плазмы. Плотность разделительного геля реально ниже плотности тромбоцитов, поэтому они с легкостью проходят через его барьер. Гель, являясь полимерным соединением, влияет на химический состав забранной крови и полученной плазмы. Устройство невозможно использовать в стерильных условиях.
Известно устройство для получения обогащенной тромбоцитами плазмы Arthrex АСР Double Syringe System торговой марки Arthrex, состоящее из двух шприцев [2, 3]. Внешний шприц предназначен для забора крови, имеет объем 15 мл и накручивающийся на канюлю плоский колпачок для возможности вертикальной установки шприца. Внутренний шприц предназначен для забора плазмы из внешнего шприца после центрифугирования. Внутренний шприц извлекают из внешнего для последующего использования. Шприцы изготовлены из прозрачного пластика, устройство предназначено для одноразового использования.
С помощью данного устройства реально возможно получение только бедной тромбоцитами плазмы, тогда как содержание в 1 мкл фракции около или более 1 млн. тромбоцитов, присущее истинной ОТП, устройство не дает. Первый шприц с поршнем ориентирован на ложемент центрифуги этой же фирмы Arthrex и не подходит для устойчивого расположения и фиксации в ложементах центрифуг большинства других производителей. Кроме того, для расположения шприца в центрифуге его необходимо перевернуть, что повышает травматизацию биоматериала и обеспечивает получение бедной тромбоцитами плазмы. На шприцах отсутствуют маркеры движения поршня при заборе цельной крови и перемещения их содержимого, что также обеспечивает возможность излишнего движения материала внутри корпуса шприца и его травматизации. Это устройство взято нами за прототип.
Целью изобретения является создание устройства для получения тромбоцитарных фракций плазмы крови.
Эта цель достигается тем, что первый шприц имеет поршень, шток которого соединен с ним резьбовым соединением; ручка поршня имеет широкое основание; на внешнюю поверхность корпуса первого шприца нанесена круговая метка, которая соответствует верхнему краю основания поршня после забора крови; дистальные концы первого и второго шприцев имеют внешние резьбовые соединения, соответствующие внутренним резьбовым соединениям цилиндрического прозрачного переходника между ними, катетеров и колпачков; на внешнюю поверхность корпуса переходника нанесена круговая метка, соответствующая верхнему уровню цельной крови в первом шприце после перемещения необогащенной и обогащенной тромбоцитами фракции во второй шприц.
Резьбовые соединения между элементами дают возможность герметично объединять оба шприца через переходник и надежно закрывать их колпачками для предупреждения контаминации материала и защиты от него медицинских работников. Круговые метки на корпусе первого шприца и переходника позволяют контролировать уровни движения поршня при заборе цельной крови и перемещении полученных необогащенной и обогащенной тромбоцитами фракций во второй шприц. Это облегчает и стандартизирует работу врача, уменьшает излишние перемещения биоматериала внутри корпуса первого шприца и между ними, снижая его травматизацию и повышая качество, получаемых фракций, в частности ОТП.
Широкое основание штока поршня первого шприца позволяет при необходимости устойчиво размещать его на поверхности после забора цельной крови и после центрифугирования перед присоединением второго шприца. Устройство позволяет получать фракции в закрытом цикле, что дает возможность применять его как в амбулаторных, так и в стерильных условиях операционной.
Устройство для получения тромбоцитарных фракций плазмы крови, включающее в себя два шприца с цилиндрическими корпусами разного диаметра, отличающееся тем, что шприцы выполнены из прозрачного материала; первый шприц имеет поршень, шток которого соединен с ним резьбовым соединением; ручка поршня имеет широкое основание; на внешнюю поверхность корпуса первого шприца нанесена круговая метка, которая соответствует верхнему краю основания поршня после забора крови; дистальные концы первого и второго шприцев имеют внешние резьбовые соединения, соответствующие внутренним резьбовым соединениям цилиндрического прозрачного переходника между ними, катетеров и колпачков; на внешнюю поверхность корпуса переходника нанесена круговая метка, соответствующая верхнему уровню цельной крови в первом шприце после перемещения необогащенной и обогащенной тромбоцитами фракции во второй шприц.
Изобретение поясняется графическим материалом. На Фигуре 1 показана схема устройства. Первый шприц 1 и второй шприц 2 содержат поршни со штоками 3, имеющими основания 4. При этом шток 3 поршня первого шприца 1 соединен с ним резьбовым соединением 5. На корпус первого шприца 1 нанесена круговая метка 6. Дистальные концы шприцев 1 и 2 имеют внешние резьбовые соединения 7, соответствующие внутренним резьбовым соединениям цилиндрического прозрачного переходника 8 между ними. На внешнюю поверхность переходника 8 нанесена круговая метка 9. Внешние резьбовые соединения 7 дистальных концов шприцев 1 и 2 также соответствуют внутренним резьбовым соединениям их колпачков 10.
Устройство используют следующим образом. В условиях перевязочного кабинета или операционной проводят забор крови пациента через катетер, предварительно соединив его резьбовым соединением с дистальным концом первого шприца, до тех пор пока верхняя граница его поршня не дойдет до метки внешней поверхности корпуса. Отсоединяют от первого шприца катетер. Максимально смещают поршень первого шприца до упора в основание его корпуса. Закрывают дистальный конец первого шприца колпачком. Отсоединяют от основания поршня первого шприца шток. Размещают первый шприц в ложементе центрифуги вертикально. Осуществляют центрифугирование. Извлекают первый шприц из центрифуги. Вновь присоединяют к поршню первого шприца шток. Размещают первый шприц вертикально на устойчивом широком основании штока его поршня. Откручивают крышку с конца первого шприца и соединяют его через переходник со вторым шприцем.
Перемещают поршень первого шприца так, чтобы верхний уровень цельной крови достиг круговой метки переходника. Разъединяют шприцы и закрывают их колпачками. Первый шприц утилизируют. Содержимое второго шприца используют для лечебных целей.
Использование устройства иллюстрируется клиническими примерами.
Пример 2. Пациент Л, 36 лет поступил в Клиники с диагнозом ложный сустав средней трети левой плечевой кости. Интраоперационно после резекции ложного сустава, забора костного аутотрансплантата и остеосинтеза для стимуляции регенераторных процессов на контактирующие поверхности отломков была нанесена ОТП, содержащая 1,5 млн. тромбоцитов в 1 мкл, а в рядом расположенный мышечный футляр осуществлены инъекций обедненной тромбоцитами фракции плазмы. Обе фракции были получены с помощью разработанного устройства. Никаких проблем с получением фракций не было. Центрифугирование крови проходило параллельно с другими этапами операции и никак не отразилось на ее общей продолжительности.
Таким образом, изобретение целесообразно применять в любых медицинских, в том числе и ветеринарных учреждениях, где для целей регенеративной медицины пациенту необходимо применение тромбоцитарных фракций плазмы крови.
2. www.kneeandhipsurgerv.com>pdf>ACP Arthrex АСР Double Syringe System, 2009.
3. https://www.arthrex.com, Arthrex АСР Double Syringe System, 2019.
Устройство для получения тромбоцитарных фракций плазмы крови в закрытом цикле, включающее в себя два шприца с цилиндрическими корпусами разного диаметра, отличающееся тем, что шприцы выполнены из прозрачного материала; первый шприц имеет поршень, шток которого соединен с ним резьбовым соединением; ручка поршня имеет широкое устойчивое основание, выполненное с возможностью устойчивого размещения шприца на поверхности после забора цельной крови и после центрифугирования перед присоединением второго шприца; на внешнюю поверхность корпуса первого шприца нанесена круговая метка, которая соответствует верхнему краю поршня после забора крови, при этом круговая метка расположена таким образом, что поршень выполнен с возможностью дальнейшего смещения до упора в основание корпуса шприца; дистальные концы первого и второго шприцев имеют внешние резьбовые соединения, соответствующие внутренним резьбовым соединениям цилиндрического прозрачного переходника между ними, катетеров и колпачков; на внешнюю поверхность корпуса переходника нанесена круговая метка, соответствующая верхнему уровню крови в первом шприце после перемещения необогащенной и обогащенной тромбоцитами фракции во второй шприц.
 Служба крови
Служба крови
Получение пулированного тромбоконцентрата из лейкотромбослоя
Введение
Пулирование отдельных доз лейкотромбослоя (Buffy coat), выделенного из консервированной крови, является широко распространенным в Европе способом получения тромбоцитов. Такой компонент содержит терапевтическую дозу тромбоцитов с минимальной примесью других клеток и по лечебному эффекту не отличается от концентрата, заготовленного методом автоматического афереза.
Щадящие условия центрифугирования на «биологической подложке» из эритроцитов и лейкоцитов обеспечивают низкую активацию тромбоцитов, и, как следствие, способность длительной циркуляции в сосудистом русле пациента.
Данный метод позволяет гарантированно обеспечивать лечебные учреждения высококачественным тромбоцитным концентратом (ТК), не требуя дополнительного времени и средств для проведения аппаратного тромбоцитафереза.
Технология рассчитана на максимальную реализацию донорского потенциала, а именно на получение трех компонентов из дозы цельной крови:
Использование систем контейнеров с консервантом CPD/SAGM и специальных систем для пулирования с интегрированным лейкофильтром позволяет получать терапевтическую дозу ТК очень высокого качества с содержанием тромбоцитов более 3,0 х 1011 и количеством остаточных лейкоцитов менее 0,2 х 106.
Воздухопроницаемые контейнеры позволяют хранить пулированный ТК до 5 дней при условии постоянного перемешивания.
Длительность циркуляции тромбоцитов в кровотоке пациента после трансфузии составляет 5-7 суток.
Существует возможность забора образца для определения бактериальной контаминации полученного ТК (eBBS, Pall).
Данный метод позволяет проводить последующую инактивацию патогенов в полученном ТК аппаратным методом (INTERSEPT, Cerus). Таким образом, сводится к минимуму риск инфицирования пациента.
Этапы получения пулированного тромбоконцентрата
Сбор цельной крови осуществляется в систему полимерных контейнеров с консервантом CPD/SAGM.
Консервированная кровь подвергается первичному «жёсткому» центрифугированию на рефрижераторной центрифуге.
Для фракционирования крови с дальнейшим получением эритроцитной взвеси, плазмы и стандартной дозы ЛТС (45-55 мл) рекомендуется использование автоматического фракционатора.
4-6 ЛТС объединяются по групповой совместимости в один мешок с дальнейшим разбавлением раствором PAS.
Для отделения ТК от других клеточных элементов пула используется «мягкий» режим центрифугирования. Отделение и лейкофильтрация богатой тромбоцитами надосадочной жидкости осуществляются на автоматическом фракционаторе.
ТК хранится при температуре 22 ± 2°С и постоянном помешивании. Срок хранения не должен превышать 5 дней после сбора.
Принцип получения пулированного тромбоконцентрата
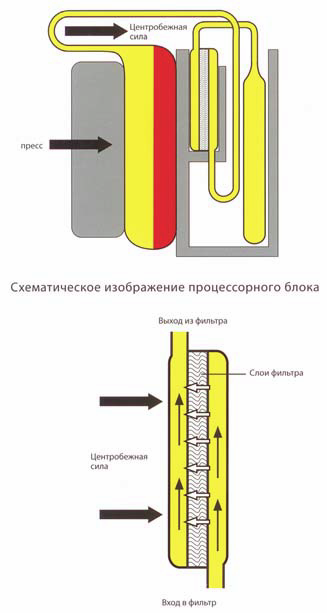
В фазе седиментации центробежная сила и фиксированное положение вкладышей с мешками приводят к вертикальной седиментации компонентов крови по направлению к стенкам вкладышей. В ходе фазы сепарации пулированный тромбоконцентрат проходит через встроенный фильтр, предназначенный для удаления лейкоцитов, и попадает в мешок для хранения. Центробежная сила в фазе сепарации стабилизирует слои и улучшает качество сепарации. Два оптических датчика обеспечивают четкое распознавание остаточного ЛТС, что дает максимальный выход тромбоцитов.
Фирма Terumo разработала новый фильтр IMUGARD® для тромбоцитов, используя полиуретановый материал с высокой биосовместимостью для получения в процессе лейкоредукции пулированного тромбоконцентрата. Расположение фильтра обеспечивает поступление суспензии тромбоцитов в фильтр со стороны днища и прохождение через пластины фильтра в направлении, противоположном действующей центробежной силе. Поступающие в фильтр эритроциты будут изначально накапливаться в его входной части.
Полиуретан как фильтрующий материал
Полиуретан – это полимер, в котором исходные молекулы соединены уретановыми связями путем реакции диизоцианатов и полиолов. Путем правильного выбора вариантов компонентов и их соотношений достигаются оптимальные физические, химические характеристики и характеристики биосовместимости.
Для создания лейкоцитарных фильтров в системах IMUGARD® III и IMUFLEX® фирма Terumo выбрала полиуретан с высочайшей биосовместимостью.
Исследование механизмов удаления лейкоцитов с применением полиурета на показывает, что большая часть лейкоцитов застревает механически в небольших порах или ямках материала.
Очень ограниченное взаимодействие клеток с материалом и отсутствие клеточной и протеиновой активации позволяют получать компоненты крови превосходного качества.
Заключение
Внедрение технологии получения тромбоцитов из ЛТС является перспективным направлением развития службы крови РФ.
Несмотря на распространение аферезного метода, приготовление тромбоцитов из ЛТС имеет ряд преимуществ. Высокое качество тромбоконцентрата. Технология обеспечивает хороший выход и низкую активацию тромбоцитов, их морфологическую гомогенность, незначительную примесь лейкоцитов и эритроцитов, длительность циркуляции в кровотоке до 5-7 суток (при отсутствии повышенного потребления). Оперативность и простота приготовления. Получив заявку, СПК имеет возможность приготовить лечебную дозу тромбоцитного концентрата из ЛТС, обследованных накануне, без затрат дополнительного времени и средств на вызов и обследование донора тромбоцитов.
Возможность заблаговременной заготовки тромбоцитов. Продление сроков хранения ТК до 5 суток позволяет СПК и ОПК поддерживать необходимый запас терапевтических доз ТК.
Доступность технологии для любой СПК. При фракционировании цельной крови на эритроциты и плазму достаточно выделять ЛТС, используя соответствующие режимы центрифугирования. Обязательной составляющей методики является расходный комплект для пулирования и устройство для стерильного соединения полимерных магистралей.
Возможность определения бактериальной контаминации и патогенной инактивации продукта.
Автоматизация процесса. По мере освоения технологии возможен переход к полной автоматизации (использование автоматических фракционаторов крови, расходных комплектов и аппарата TACSI компании Terumo).
Применение тромбоцитарного геля в стоматологии
В многочисленных исследованиях показан лечебный эффект аутологичной богатой тромбоцитами плазмы при заживлении костной и мягкой ткани после восстановительной и реконструктивной хирургии в стоматологии. Высокая лечебная эффективность процедуры сочетается с простотой получения концентрата тромбоцитов путем дифференциального центрифугирования цельной крови.
Компания Стормовъ поставляет на российский рынок пригодные для этой цели автоматизированные системы центрифугирования крови, а также более простые лабораторные центрифуги.
Одним из последних достижений в стоматологии является использование тромбоцитарного геля (ТГ) для улучшения заживления мягких и твердых тканей после хирургического вмешательства. ТГ ускоряет процессы заживления и выздоровления при рефрактерном генерализованном агрессивном периодонтите, реконструктивной ротовой и челюстно-лицевой хирургии (напр., синус-лифтинг), хирургическом восстановлении альвеолярных расщелин, орально-антральных и орально-назальных фистул и установке костно-интегрированных имплантатов. Показана эффективность ТГ для ускорения заживления мягких тканей и эпителизации при пересадке свободного соединительнотканного трансплантата, манипуляциях со слизисто-надкостничным лоскутом и наращивании мягких тканей при косметических вмешательствах в ротовой полости.
Конечный препарат ТГ содержит в 3-5 раз больше тромбоцитов, чем в нормальной крови (до 1 млн тромбоцитов в 1 мкл плазмы крови), что увеличивает концентрацию продуцируемых тромбоцитами естественных факторов роста, стимулирует местный ангиогенез, привлекает недифференцированные стволовые клетки в область повреждений и запускает процесс деления клеток, участвующих в процессе регенерации ткани. В обогащенной тромбоцитами плазме содержатся тромбоцитарный фактор роста (PDGF), трансформирующий фактор роста (TGF), фактор роста эндотелия сосудов (VEGF), фактор роста эпителия (EGF) и адгезивные молекулы (фибрин, фибронектин, витронектин). Фибриновый компонент ТГ обеспечивает связывание частиц костного материала и способствует остеокондукции посредством образования сети, выполняющей роль скелета, поддерживающего рост новой кости. Комбинация данных факторов позволяет сократить сроки роста и созревания костной ткани.
Преимуществами использования ТГ является безопасность (отсутствие риска инфекционных заболеваний или возникновения иммуногенных реакций) и неинвазивность самой процедуры, доставка факторов роста и цитокинов непосредственно в область раны, быстрота и несложность приготовления препарата ТГ.
Для получения ТГ у пациента непосредственно перед проведением операции забирают 45-60 мл крови в шприц, содержащий антикоагулянт на основе цитрата с декстрозой. Кровь фракционируют путем двухкратного центрифугирования. В результате первого цикла центрифугирования при невысокой скорости эритроциты отделяются от лейкоцитов, тромбоцитов и бедной тромбоцитами плазмы. На этом этапе получается препарат плазмы с низкой концентрацией тромбоцитов. Для получения тромбоцитарного концентрата требуется повторное центрифугирование фракции плазмы. Обогащенная тромбоцитами плазма сохраняется стерильной в жидком состоянии в течение 8 часов, поэтому ее можно использовать при продолжительных хирургических вмешательствах.
Активация тромбоцитов происходит путем смешивания 7 мл концентрата тромбоцитов с 1 мл смеси, содержащей 5000ЕД топического коровьего тромбина и 10% раствора хлорида кальция, а также 1 мл воздуха, который необходим для формирования пузырьков, участвующих в смешивании. После встряхивания в течение 10 секунд материал приобретает консистенцию вязкого геля, который вводится в рану, разрез или наносится на костный материал. В течение первых 10 минут тромбоциты секретируют около 70% содержащихся в них факторов роста с полным их высвобождением в течение часа. Тромбоцитарный гель сохраняет активность в течение приблизительно 8 дней, после чего тромбоциты погибают. Применение ТГ ускоряет заживление мягких тканей и способствует быстрой минерализации новой формирующейся кости.
Рисунок 1. Лабораторная центрифуга
Не всякая центрифуга пригодна для получения ТГ. Идеальной для этой цели является автоматизированная установка двойного центрифугирования SmartPReP, в которой контейнер с кровью подвергается двухкратному центрифугированию в стерильных условиях без открывания контейнера до стадии забора обогащенной тромбоцитами плазмы. Более дешевой, но менее эффективной альтернативой является использование лабораторных центрифуг, которые также различаются по своим возможностям с точки зрения эффективности дифференциального центрифугирования цельной крови.



 Служба крови
Служба крови