Авелокс или таваник что лучше
Современные методы терапии воспаления легких
Антимикробные препараты для лечения пневмонии:
β-лактамные антибиотики
• Незащищенные амоксициллины (Амоксициллин, Амоксикар, Флемоксин солютаб)
• Защищенные амоксициллины (Амоксиклав, Аугментин, Амоклав)
• Цефуроксим аксетил (Зиннат, Зинацеф, Аксеф, Цефоктам)
Макролиды
• Кларитромицин (Фромилид, Клацид, Клабакс)
• Рокситромицин (Рулицин, Рулид, Ромик)
• Азитромицин (Азибиот, Сумамед, Азимицин)
Фторхинолоны (при легочной патологии)
• Левофлоксацин (Таваник, Лебел, Левоксимед)
• Моксифлоксацин (Моксифур, Авелокс, Симофлокс)
• Гемифлоксацин (Фактив)
В структуре возбудителей внебольничной пневмонии лидирует пневмококк. Лечение подразумевает назначение защищенных β-лактамов, например, Аугментина, Амоксиклава, Уназина, Сулациллина. Спектр их активности включает стафило- и стрептококки, кишечную группу бактерий, гемофильную палочку, анаэробы.
При отсутствии устойчивости применяют цефалоспорины 3 поколения (цефотаксим, цефтриаксон, цефиксим, цефтибутен). Применяют и альтернативные вспомогательные препараты: макролиды (кларитромицин, азитромицин), фторхинолоны для лечения легочной патологии (левофлоксацин, моксифлоксацин, гемифлоксацин). В тяжелых случаях назначают резервные АПМ: ванкомицин, линезолид.
Важно! Применение нереспираторных фторхинолонов (пефлоксацин, ципрофлоксацин, норфлоксацин и др.) считается нерациональным.
Схожие принципы лечения и у внебольничной пневмонии, вызванной гемофильной палочкой или кишечной группой бактерий.
В случаях, когда возбудителем выступает золотистый стафилококк, особое внимание уделяют такому фактору, как MRSA/MSSA (метициллинрезистентный/чувствительный стафилококк). При чувствительной к метициллину разновидности MSSA применяют стандартную терапию, и выбирают один из следующих препаратов:
амоксициллин/клавуланат (Аугментин, Амоксиклав),
амоксициллин/сульбактам (Уназин, Сулациллин), цефалоспорины 3 поколения (цефотаксим, цефтриаксон, цефиксим, цефтибутен), линкозамиды (линкомицин, клиндамицин).
Если же форма пневмонии тяжёлая и обнаружен MRSA, то используют препараты резерва: линезолид, ванкомицин. Атипичные формы пневмонии лечат медикаментами из группы макролидов или тетрациклинов (доксициклин), или респираторных фторхинолонов.
Патогенетическая
Специфическая патогенетическая терапия актуальна при выявлении тяжелых и затяжных форм внебольничной пневмонии у взрослых. Патогенетическая терапия подразумевает:
• иммунозаместительную терапию;
• дезинтоксикационную терапию;
• лечение сосудистой недостаточности;
• лечение гипоксии или эффективная респираторная поддержка;
• коррекция перфузионных нарушений;
• лечение бронхиальной обструкции;
• противовоспалительная терапия.
В тяжелых случаях течения внебольничной пневмонии целесообразно усиление защитных сил. С данной целью ее можно вылечить применяя препараты иммуномодулирующего назначения (интерфероны, Левамизол, Зимозан, Диуцифон, Т-активин, Тималин, Полиоксидоний, Изопринозин).
Иммунозаместительная и иммуномодулирующая терапия назначается только по рекомендации врача, так как при сильном ослаблении организма пациента данный вид препаратов может ухудшить состояние.
При ассоциации бактерии и вируса в организме пациента целесообразно назначить антигриппозный у-глобулин, противовирусные средства (Рибавирин, интерфероны). Вирусную гриппозную пневмонию лечат препаратом Тамифлю.
В случае тяжелого стафилококкового воспаления проводят пассивную иммунизацию сывороткой (гипериммунная антистафилококковая) или стафилококковым антитоксином.
Из других способов патогенетической терапии важным является коррекция бронхиальной обструкции.
Возбудители пневмонии способствуют тому, что проходимость бронхов значительно уменьшается за счет сужения их просвета, особенно при атипичных формах воспаления.
Назначают Беродуал, Пульмикорт, Беротек, Сальбутамол, Атровент. Средства с бронхолитическим действием, т.е. направленные на расширение бронхов, лучше вводить ингаляционно. Так повышается их эффективность. Из таблетированных препаратов эффективны Теопэк и Теотард.
Используют средства, разжижающие мокроту: амброксол, АЦЦ, бромгексин Средство сочетанного действия Джосет позволяет расширить бронхи и облегчить выведение мокроты. Благоприятно воздействует и теплое щелочное питьё: молоко, минеральная вода.
К средствам неспецифической терапии относятся витамины А, С, Е, группы В. Также благоприятно влияют на восстановление организма адаптогены: элеутерококк, настойки лимонника и женьшеня.
Дезинтоксикационная
Данный вид терапии проводится с целью устранения токсического влияния на организм продуктов распада бактерий. Специфические процедуры, такие как внутривенные капельные вливания физиологического раствора, глюкозы проводятся при тяжелом состоянии. В большинстве случаев эффективным является обильное питьё.
Немедикаментозная
Наряду с лечением антибактериальными препаратами актуальна немедикаментозная поддержка организма. В первую очередь больным рекомендуют обильное щелочное питьё. Можно использовать теплое молоко или минеральную воду.
Эффективны дыхательные упражнения. Они улучшают дыхательную подвижность грудной стенки, укрепляют дыхательные мышцы. ЛФК проводят с помощью различных специальных приборов или непосредственно гимнастикой. Упражнения, так же как и другие вспомогательные мероприятия, начинают проводить не раньше 3 дня после нормализации температуры.
Возможно применение массажа (вибрационного или вакуумного). Данные процедуры проводятся также после стабильного улучшение состояния. Вибрационный массаж выполняется с помощью специальных вибромассажёров с заданной амплитудой. Для вакуумного массажа используют банки, которые благодаря созданию отрицательного давления улучшают местное кровообращение и вызывают рефлекторное раздражение, расширение сосудов. Такие процедуры облегчают дренирование лёгких, и уменьшают воспалительный процесс в альвеолярной ткани.
Физиотерапия
В качестве мероприятий, целью которых считается восстановление дренажной способности бронхов, улучшение отхождения мокроты и нормализация резистентности организма, используют физиотерапию.
Данное вспомогательное лечение назначается только после достижения показателей температуры 37°С. Среди процедур наиболее эффективными считаются:
• ингаляции бронхолитиков через небулайзер или ультразвуковой ингалятор;
• местная УВЧ терапия;
• местное УФО;
• электрофорез антимикробного препарата.
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
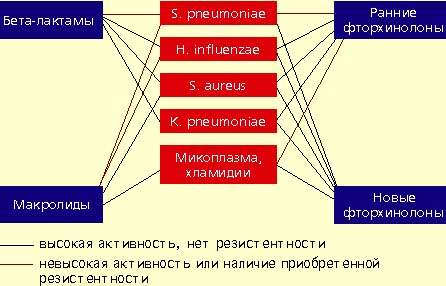 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Что лучше: Таваник или Авелокс
Таваник
Авелокс
Исходя из данных исследований, Авелокс лучше, чем Таваник. Поэтому мы советуем выбрать его.
Но не забывайте, что у данных препаратов в составе разные активные вещества. Поэтому обязательно проконсультируйтесь с врачом. Возможно, какой-то из них может не подойти для вашей терапии.
Сравнение эффективности Таваника и Авелокса
Эффективность у Таваника достотаточно схожа с Авелоксом – это означает, что способность лекарственного вещества оказывать максимально возможное действие схоже.
Например, если терапевтический эффект у Таваника более выраженный, то при применении Авелокса даже в больших дозах не получится добиться данного эффекта.
Также скорость терапии – показатель быстроты терапевтического действия у Таваника и Авелокса примерно одинаковы. А биодоступность, то есть количество лекарственного вещества, доходящее до места его действия в организме, схожа. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Таваника и Авелокса
Безопасность препарата включает множество факторов.
При этом у Таваника она достаточно схожа с Авелоксом. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Таваника, также как и у Авелокса мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Таваника нет никаих рисков при применении, также как и у Авелокса.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Таваника и Авелокса.
Сравнение противопоказаний Таваника и Авелокса
Исходя из инструкции. Количество противопоказаний у Авелокса в пределах нормы, но оно больше чем у Таваником. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Авелокса или Таваника может быть нежелательным или недопустимым.
Сравнение привыкания у Таваника и Авелокса
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значениий таких параметров, как «cиндром отмены» и «развитие резистентности», у Таваника меньше, чем аналогичные значения у Авелокса. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной.
Сравнение побочек Таваника и Авелокса
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Таваника больше нежелательных явлений, чем у Авелокса. Это подразумевает, что частота их проявления у Таваника низкая, а у Авелокса низкая. Частота проявления – это показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано. Нежелательное влияние на организм, сила влияния и токсическое действие у препаратов разное: как быстро организм восстановиться после приема и восстановиться ли вообще. При применении Таваника возможность у организма восстановится быстрее выше, чем у Авелокса.
Сравнение удобства применения Таваника и Авелокса
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Таваника примерно одинаковое с Авелоксом. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-04 13:48:27
Современные подходы к терапии хронического бактериального простатита
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу
Хронический простатит (ХП) принадлежит к числу самых распространенных урологических заболеваний. По данным Н. А. Лопаткина (1998), в России на долю ХП приходится до 35% всех обращений к врачу по поводу урологических проблем среди мужчин в возрасте от 20 до 50 лет. Для получения данных о частоте встречаемости симптомов простатита с оценкой распространенности дизурии, дискомфорта в промежности и в области полового члена было проведено международное (Англия, Франция, Голландия, Корея) эпидемиологическое исследование Urepik. Анализ, проводившийся на основании шкалы симптомов Nickel и Sorensen (1996), дал возможность выявить признаки простатита у 4800 мужчин в возрасте от 40 до 79 лет. У 35% мужчин за последний год наблюдался как минимум один из симптомов простатита, и для 8% мужчин это представляло, по меньшей мере, неудобство [1].
На долю хронического бактериального простатита (ХБП) приходится 5–15% случаев заболевания [6]. Наиболее распространенными, по мнению большинства исследователей, этиологическими агентами ХБП являются такие грамотрицательные бактерии семейства Enterobacteriaceae, как Escherichia coli, которые обнаруживаются в 65–80% случаев инфекций. Различные виды Serratia, Klebsiella, Enterobacter, Acinetobacter выявляются у 10–15% больных. Большинство исследователей полагают, что на долю таких грамположительных бактерий, как Enterococcus faecalis, приходится от 5 до 10% случаев подтвержденных инфекций простаты [5].
В настоящее время обсуждается роль грамположительных бактерий — коагулазо-негативных стафилококков и стрептококков в развитии ХБП [5, 6, 7]. По нашим данным (Е. Б. Мазо и соавт., 2003, 2004) [1], основанным на результатах микробиологического исследования, которое проводилось в виде четырехстаканного теста Meares–Stamey у 70 больных с ХБП с 2002 г., именно коагулазо-негативные стафилококки играют ведущую роль (66%), если говорить об этиологии ХБП. Между тем на долю грамотрицательных патогенов приходится 19% случаев ХБП, а 15% составляют больные с Enterococcus faecalis. Аналогичными данными располагают М. Ф. Трапезникова и соавторы (2004), суммировавшие результаты идентификации 662 штаммов микроорганизмов у 264 больных ХБП, за которыми велось наблюдение в течение последних 13 лет. При этом выявлена ведущая роль грамположительных кокков в этиологии ХБП: за последние 3 года частота распространения коагулазо-негативных стафилококков составила 87,5% [3]. В то же время удельный вес грамотрицательных палочек — «общепризнанных» возбудителей ХБП — за предыдущие 7 лет неуклонно снижался (с 13,3 до 4,2%). С. Н. Калинина, В. П. Александров, О. Л. Тиктинский (2003) при обследовании 174 больных ХБП также выявили преобладание (82%) грамположительной флоры. Инфекция простаты может быть следствием бактериальной колонизации мочеиспускательного канала. Нормальная флора мочеиспускательного канала у мужчин состоит главным образом из дифтероидов и грамположительных кокков. Сексуальная активность может способствовать колонизации мочеиспускательного канала потенциальными уропатогенами. Blacklock (1974) и Stamey (1980) отметили, что секрет простаты у некоторых мужчин с ХБП содержал те же уропатогены, которые присутствовали в вагинальной флоре их сексуальных партнерш. Бактериальная колонизация может также вызвать персистенцию бактерий в простате. Отличительной чертой этого состояния является персистенция бактерий внутри простаты, несмотря на лечение антибиотиками, что связано с хроническим воспалением и склонностью к обострению инфекции мочевыводящего тракта тем же самым патогеном.
К предрасполагающим факторам развития ХБП относятся: уретропростатический рефлюкс; фимоз; анально-генитальные сношения без предохранения; инфекции мочевых путей; острый эпидидимит; постоянные уретральные катетеры и проведение трансуретральных операций у мужчин с инфицированной мочой без предшествующей антимикробной терапии [1]. У пациентов с ХП может быть выявлено нарушение секреторной функции простаты, характеризующееся изменением состава секрета, т. е. снижением уровней фруктозы, лимонной кислоты, кислой фосфатазы, катионов цинка, магния и кальция; цинксодержащего антибактериального фактора простаты. При этом увеличиваются такие показатели, как рН, отношения изоферментов лактатдегидрогеназы-5 к лактатдегидрогеназе-1, белков воспаления — церулоплазмина и компонента комплемента С3. Эти изменения в секреторной функции простаты также обусловливают неблагоприятное воздействие на антибактериальную природу секрета простаты. Уменьшение действия антибактериального фактора простаты способно снижать врожденную противобактериальную активность секрета, тогда как щелочной показатель рН может препятствовать диффузии в ткань и в секрет простаты основных антимикробных препаратов.
Симптомами ХП являются боли в тазовой области, расстройства мочеиспускания и эякуляции (см. табл. 1).
| Таблица 1 Симптомы хронического простатита | ||
| Локализация боли в тазовой области | Расстройство мочеиспускания | Расстройство эякуляции |
| В промежности В половом члене В яичках В паховой области Над лоном В прямой кишке В крестце | Учащенное мочеиспускание Неполное опорожнение мочевого пузыря Слабая или прерывистая струя мочи Боль или ее усиление во время мочеиспускания | Боли во время или после эякуляции Гемоспермия |
Ведущее место в лабораторной диагностике ХБП принадлежит микробиологическому исследованию — четырехстаканному локализационному тесту, предложенному в 1968 г. Meares и Stamey [8]. Он состоит в получении, после тщательного туалета наружных половых органов (во избежание контаминации поверхностными бактериями), первой (10 мл) и второй (средней) порций мочи для бактериологического исследования, массажа предстательной железы (ПЖ) со взятием секрета для микроскопии и посева, а также третьей порции мочи (после взятия секрета) для посева (рис. 1). Количественные посевы первой и второй порций мочи выявляют бактерии в уретре и мочевом пузыре, в то время как при посевах секрета простаты и порции мочи после взятия секрета (третьей порции мочи) выявляют флору простаты. ХБП характеризуется воспалительной реакцией в секрете (при микроскопии определяется более 10 лейкоцитов в поле зрения при большом увеличении). После инкубации посевов подсчитывают количество колониеобразующих единиц (КОЕ).
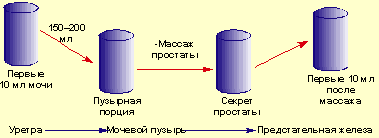 |
| Рисунок 1. Четырехстаканный локализационный тест Meares–Stamey |
Бактериологическое подтверждение ХБП мы проводим на основании, по крайней мере, одного из следующих критериев, предложенных K. G. Naber (2003):
Характерное для ХБП содержание патогенов в образцах примерно следующее:
первая порция мочи 3 КОЕ/мл;
вторая порция мочи 3 КОЕ/мл;
секрет простаты ≥ 10 4 КОЕ/мл;
третья порция мочи ≥ 10 3 КОЕ/мл.
Четкое соблюдение правил микробиологической диагностики и вышеуказанных критериев интерпретации результатов локализационного теста Meares — Stamey на большом количестве наблюдений позволят более точно определить частоту встречаемости истинных патогенов ХБП.
Антимикробная терапия. После идентификации этиологического агента и определения антибиотикорезистентности возникает необходимость назначения больному с ХБП антимикробной терапии. К факторам, оказывающим влияние на выбор антимикробного препарата для лечения ХБП, относятся: чувствительность идентифицированного микроорганизма к антибиотику, его способность в достаточной концентрации проникать через гематопростатический барьер и накапливаться в ткани и секрете простаты, сперме, а также способность препарата преодолевать экстрацеллюлярную полисахаридную оболочку, формируемую микроколониями бактерий, и хорошая переносимость при длительном пероральном приеме. Идеальный антибактериальный препарат для лечения ХБП должен быть жирорастворимым, слабощелочным, с коэффициентом диссоциации, способствующим максимальной концентрации препарата в простате [2]. Антимикробные средства из группы фторхинолонов на сегодняшний день отвечают вышеперечисленным требованиям и являются препаратами выбора для лечения ХБП. Особенностью антибактериального действия фторхинолонов является наличие двух мишеней действия в бактериальной клетке, каковыми являются ферменты (топоизомеразы II типа), ответственные за изменения пространственной конфигурации бактериальной ДНК: ДНК-гираза и топоизомераза IV. ДНК-гираза осуществляет суперспирализацию бактериальной ДНК, а топоизомераза IV — разделение дочерних хромосом в процессе репликации. Ключевым моментом в действии фторхинолонов является образование трехкомпонентного комплекса (бактериальная ДНК–фермент–фторхинолон). Указанный комплекс предотвращает репликацию бактериальной ДНК. Благодаря тому, что топоизомеразы обладают расщепляющей активностью, происходит разрушение молекулы ДНК (С. В. Сидоренко, 2002).
 |
| Рисунок 2. Классификация фторхинолонов (по K.G. Naber,1998) |
В настоящее время в практическое здравоохранение внедрены новые антимикробные препараты из группы фторхинолонов III и IV поколений, которые проявляют активность в отношении как грамотрицательных и грамположительных бактерий, так и атипичных внутриклеточных микроорганизмов, а также обладают способностью воздействовать на бактерии в биологических пленках (см. рис. 2). Антимикробная активность in vitro фторхинолонов III поколения — спарфлоксацина и левофлоксацина, а также фторхинолона IV поколения — моксифлоксацина наглядно представлена в таблице 2.
| Таблица 2 Антимикробная активность in vitro спарфлоксацина, левофлоксацина и моксифлоксацина (МПК90, мкг/мл) [4] | |||
| Микроорганизмы | Спарфлоксацин | Левофлоксацин | Моксифлоксацин |
| Acinetobacter spp. | 0,25 | 16 | 0,5 |
| Citrobacter freundii | 0,25 | 0,5 | 0,5 |
| Enterobacter cloacae | 0,5 | 0,5 | 0,5 |
| Escherichia coli | 0,12 | 0,12 | 0,5 |
| Klebsiella pneumoniae | 0,25 | 0,25 | 0,5 |
| Proteus mirabilis | 0,5 | 0,25 | 0,12 |
| Pseudomonas aeruginosa | 8 | 4 | 16 |
| Staphylococcus epidermidis | 1 | 1 | 2 |
| Staphylococcus saprophyticus | 0,25 | — | 0,5 |
| Enterococcus faecalis | 2 | 16 | 4 |
В 2004 г. мы сравнили чувствительность 25 различных штаммов коагулазо-негативных стафилококков — наиболее распространенных, по нашим данным (Е. Б. Мазо и соавт., 2003, 2004), этиологических агентов ХБП — к левофлоксацину, спарфлоксацину и моксифлоксацину. Бактериологическое исследование проводили классическим методом: выполняли посев мочи и секрета простаты на питательные среды с выделением чистой культуры и идентификацией выделенных штаммов при помощи полуавтоматического микробиологического анализатора Sceptor (Becton Dickinson, USA). Чувствительность выделенных микроорганизмов к левофлоксацину, спарфлоксацину и моксифлоксацину определяли дискодиффузионным методом на среде Мюллера–Хинтона. Результаты оценивали по значениям диаметров зон задержки роста. Всего было изучено 25 штаммов коагулазо-негативных стафилококков (21 — Staphylococcus haemolyticus, 3 — Staphylococcus epidermidis, 1 — Staphylococcus warnerii), выделенных в диагностическом титре из секрета простаты и мочи у больных ХБП при четырехстаканном тесте Meares–Stamey. Проведенный нами анализ чувствительности коагулазо-негативных стафилококков к фторхинолонам III и IV поколений показал наиболее высокую чувствительность этих бактерий к моксифлоксацину — у 24 (96%) штаммов. К левофлоксацину оказались чувствительны 21 (84%), а к спарфлоксацину 20 (80%) штаммов коагулазо-негативных стафилококков. Пять резистентных к спарфлоксацину штаммов были выделены нами у больных после длительной антимикробной терапии этим препаратом. Был выделен также штамм гемолитического стафилококка, резистентный ко всем фторхинолонам III и IV поколений у больного, ранее принимавшего в течение 6 нед моксифлоксацин. Проведенное исследование продемонстрировало высокую чувствительность коагулазо-негативных стафилококков, выделенных от больных ХБП, к фторхинолонам III и IV поколений. Чувствительность исследованных бактерий к моксифлоксацину оказалась наиболее высокой, в то время как к левофлоксацину и спарфлоксацину была практически одинаково ниже. Таким образом, длительная антимикробная терапия моксифлоксацином может привести к селекции устойчивых штаммов и развитию перекрестной резистентности к фторхинолонам III и IV поколений.
На сегодняшний день проведено ограниченное количество клинических исследований применения фторхинолонов в лечении ХБП. Результаты таких исследований, с периодом наблюдения не менее 6 мес, представлены в таблице 3.
Как видно из данных, приведенных в таблице 3, несмотря на существенные различия в количестве больных, принимавших участие в исследованиях, бактериальная эрадикация при различной длительности терапии фторхинолонами, наблюдалась более чем у 60% пациентов. Проведение подобных исследований в будущем, с соблюдением стандартов микробиологической диагностики, позволит выработать единый подход к рациональной антимикробной терапии ХБП.
Согласно актуальным на сегодняшний день рекомендациям Европейской ассоциации урологов по лечению инфекций мочевыводящих путей и инфекций репродуктивной системы у мужчин, принятым в 2001 г., длительность антимикробной терапии ХБП фторхинолонами или триметопримом должна составлять 2 нед (после установления предварительного диагноза). После повторного обследования больного антимикробную терапию рекомендуют продолжать суммарно в течение 4–6 нед только при положительном результате микробиологического исследования секрета простаты, взятого до начала лечения, или в случае, если у больного улучшилось состояние после приема антимикробных препаратов [2].
Антимикробные препараты, используемые для лечения ХБП, а также способы их применения приведены в таблице 4.
| Таблица 4 Способы применения антимикробных препаратов для лечения хронического бактериального простатита | ||
| Группа препаратов | Препараты | Способ применения |
| Фторхинолоны | Ципрофлоксацин (сифлокс, ципролет, цифран) | По 500 мг 2 раза в сутки |
| Офлоксацин (джеофлокс, заноцин, офлоксин 200) | По 400 мг 2 раза в сутки | |
| Ломефлоксацин (ксенаквин, ломфлокс, максаквин) | По 400 мг 1 раз в сутки | |
| Левофлоксацин (таваник) | По 500 мг 1 раз в сутки | |
| Спарфлоксацин (спарфло) | Первый прием 400 мг, затем по 200 мг 1 раз в сутки | |
| Моксифлоксацин (авелокс) | По 400 мг 1 раз в сутки | |
| Триметоприм/ сульфаметоксазол | Ко-тримоксазол (бикотрим, бисептол) | По 960 мг 2 раза в сутки |
Следует отметить, что больные с ХБП должны принимать антибиотик фторхинолонового ряда в течение длительного периода (от 4 до 6 нед) для предотвращения рецидива инфекции нижних мочевых путей. Продолжительная терапия антибиотиками в низких профилактических дозах или супрессивная антимикробная терапия могут применяться в случаях рецидивирующего или невосприимчивого к лечению простатита.
Литература
С. В. Попов
А. К. Чепуров, доктор медицинских наук, профессор
В. И. Карабак, кандидат медицинских наук
РГМУ, Москва