Авиремия гепатит с что это такое
Что такое гепатит С? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
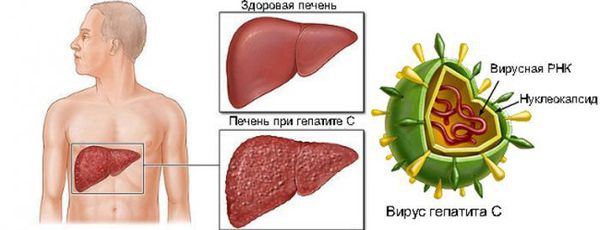
Вирусный гепатит С — острое или хроническое инфекционное заболевание, вызываемое различными типами вируса гепатита С, которые поражают в основном гепатоциты (клетки печени) и вызывают развитие воспалительного процесса в печени. При сочетании ряда факторов, образа жизни и отсутствии адекватного лечения вирусы гепатита С приводят к цирротической перестройке ткани и раку печени (гепатоцеллюлярной карциноме).
Краткое содержание статьи — в видео:
Этиологический агент — вирус гепатита С (ВГС). Вирус был впервые выделен американскими учёными в 1989 году.
Таксономическая структура:
Этиологические и морфологические свойства вируса
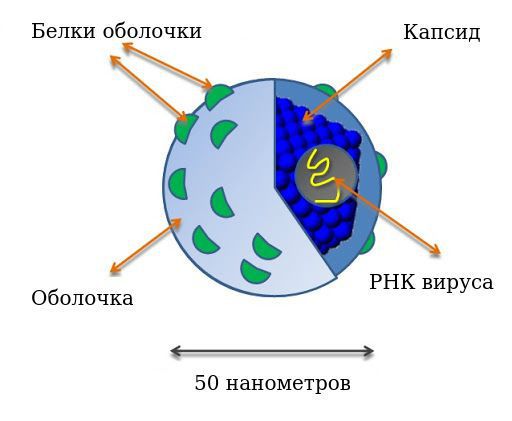
Диаметр вириона (вирусной частицы) — 50 нанометров. Имеет внешнюю белково-липидную оболочку. Оболочка вирусной частицы образуется в том числе за счёт взаимодействия вируса с липопротеидами низкой плотности хозяина, что позволяет ему ускользать из под иммунной атаки и проникать в клетки.
Генетическая структура представляет собой линейную однонитевую молекулу рибонуклеиновой кислоты (РНК), её размер примерно 9400 нуклеотидов. В ней выделяют следующие зоны: шифрующие структурные (Е1 и Е2 белки) и неструктурные (функциональные) белки — NS2, NS3, NS4A, NS4B, NS5A, NS5B, отвечающие за различные функции в жизни вируса. Структурные белки определяют прямой цитопатический эффект (повреждение клеток), полиморфизм (многообразие) вируса, участвуют в эффекте проникновения и выхода из клетки. Неструктурные белки участвуют в процессе развития и размножения вируса, определяют развитие резистентности (устойчивости) к интерферонам (NS5A). Встраивания вирусной РНК в геном клеток человека не замечено.
Передача вируса гепатита С
Передача вируса осуществляется только через кровь. Инфицирующая доза в несколько десятков раз больше, чем при гепатите В, т. е. для заражения нужны видимые следы крови. А вот пути заражения бывают различны:
При поцелуях, рукопожатиях, через посуду, сухие пятна крови на одежде, через воду, при кашле, чихании, потении, сидении рядом, по воздуху и т. д. гепатит С не передаётся. Заразиться через грудное молоко также нельзя, но заражение возможно при попадании крови матери на повреждённые губы ребёнка. Есть незначительный риск при попадании инфицированной крови в глаза, однако это единичные случаи. Заразиться при переливании крови практически невозможно, т. к. кров ь на гепатит С тестируют методом ПЦР (полимеразной цепной реакции) с высокой чувствительностью.
Нет никаких научных оснований ограничивать выбор профессии, работы и круг общения людей с гепатитом С — передача осуществляется только через кровь, поэтому ограничений в работе (например учителем, врачом, няней), контактах с родственниками и т. п. быть не должно.
Территориальное распределение
В настоящее время вирусный гепатит С распространяется в общей популяции, т. е. заболеванию подвержены люди всех возрастов и социальных слоёв, однако наибольший риск имеют следующие категории:
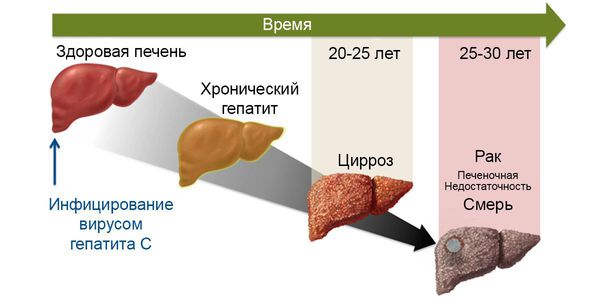
После перенесённого острого вирусного гепатита С примерно 30 % людей самоизлечиваются, т. е. полностью избавляются от вируса, в остальных случаях формируется хронический гепатит. Предикторы (прогностические параметры) самоизлечения — желтуха, высокий уровень АЛТ, молодой возраст, женский пол, 1 генотип вируса, наличие гепатита В с HbsAg (антигеном вируса гепатита В). У каждого 5-25 человека из 100 в течение 10-20 лет от момента инфицирования при хронизации развивается цирроз печени и у них имеется 1-4 % годовой вероятности развития рака печени.
Провоцирующие факторы развития цирроза печени:
Гепатитом С можно заразиться после выздоровления от предыдущего случая (даже тем же генотипом), можно заразиться другим генотипом, даже если человек уже имеет гепатит С какого-либо генотипа (суперинфекция). В этом случае наблюдается борьба между генотипами за доминирование. Побеждает, как правило, какой-то один, а другой может сохраняться на минимальных степенях репликации. При этом существует риск ошибки при определении генотипа.
Симптомы гепатита С
Скрытый (инкубационный) период гепатита С может составлять от 2 недель до 6 месяцев. В это время может не быть никаких признаков заражения и развивающегося заболевания. Однако коварство гепатита С в том, что даже по прошествии этого времени может не возникнуть никаких явных симптомов и проявлений (большинство больных вообще не имеет симптомов или их нельзя связать с гепатитом). Даже если симптомы и возникают, то зачастую они настолько незначительны, что человек абсолютно не придаёт им значения и не обращается за медицинской помощью до развития осложнений. Чаще всего информация о болезни появляется после прохождения рутинных исследований для операции или донорства крови.
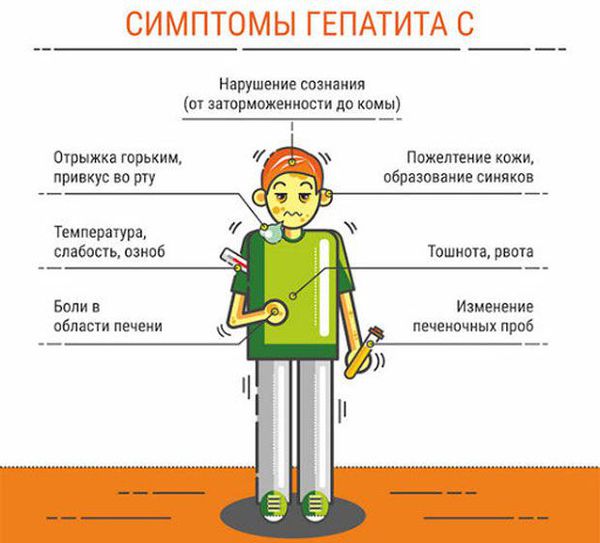
Симптомы вирусного гепатита С в остром и хроническом периоде:
Повышение температуры отмечается редко. Возможен различный характер течения хронического заболевания, в большинстве случаев на протяжении десятков лет больной испытывает незначительную усталость, периодический дискомфорт в правом подреберье, иногда связанный с погрешностями в диете. Примечательно, что чёткого продолжительного периода ухудшения самочувствия обычно нет. Лишь на завершающей стадии заболевания (через несколько десятков лет) человек испытывает резкое ухудшение самочувствия, нарастание отёков, в том числе у него наблюдается накопление жидкости в брюшной полости (асцит), повышенная кровоточивость, похудание, желтуха. Зачастую толчком к этому служит принятие алкоголя на праздники в значительных дозах. В этом коварство вирусного гепатита С — мнимый период благополучия даже при высокоактивном инфекционном процессе («ласковый убийца», как длительное время его называли).
Гепатит С у беременных
Каких-либо значимых различий в течении вирусного гепатита С при беременности нет, как правило, происходит даже минимизация клинических и лабораторных изменений. Риск заражения ребёнка имеется лишь в родах, причём чем выше количество вируса в мл крови (вирусная нагрузка), тем выше риск. Выбор способа родоразрешения может влиять на риск передачи вируса при высокой вирусной нагрузке (свыше 8 х 10^5 МЕ/мл): при естественных родах риск до 8 %, при плановом кесаревом сечении — до 1 % (некоторые исследователи не подтверждают это). При коинфекции ВИЧ у матери риск передачи значительно возрастает — до 15 %.
Гепатит С у детей
Патогенез гепатита С
Проникая в организм, вирус гепатита С не оставляет никаких следов в месте внедрения. С током крови он быстро попадает в клетки печени, где оказывает неярко выраженное прямое разрушающее действие на клетки-мишени и в большей степени вызывает иммуноопосредованное поражение клеток на фоне репликации вируса. При использовании одного из исследований — ультрачувствительного ПЦР (полимеразной цепной реакции) — РНК вируса в крови может обнаруживаться уже через 2 недели от момента заражения. Значений, которые выявляются всеми тест-системами, как правило, вирусная нагрузка достигает через 1,5 месяца после заражения.
Нарушается баланс продукции цитокинов (белков, которые оказывают комплексное регулирующее влияние на воспаление и иммунитет):
Возможность нахождения и размножения вируса в клетках иммунной и нервной систем делает его недоступным для иммунного контроля. Главенствующая частота перехода вирусного гепатита С в хроническую форму (около 70 %) обусловлена не только различными особенностями самого вируса, но и обязательным участием (или вернее неадекватным участием) иммунной системы:
После заражения и малосимптомного протекания острой фазы заболевания при отсутствии самоизлечения (около 30 %) наступает хронизация инфекции — длительный латентный период (до 10-30 лет, иногда более длительно). В течение этого периода человек ведёт обычный образ жизни, не испытывает никаких явных признаков заболевания, а появляющееся чувство усталости вполне логично списывает на интенсивный современный ритм жизни.
Классификация и стадии развития гепатита С
Острый вирусный гепатит С
Периоды:
По (МКБ-10): B17.1 Острый гепатит С.
По клинической форме:
По степени тяжести:
По длительности течения:
Осложнения гепатита С
В остром периоде гепатита С возможно развитие «печёночной комы» — резкого выраженного угнетения функции печени вследствие массивной гибели печёночных клеток и накопления в организме токсичных продуктов обмена различных веществ. Это состояние характеризуется заторможенностью, потерей сознания, нарушением витальных (жизненно важных) функций. Однако встречаемость данного осложнения крайне низкая.
В хронической фазе болезни (или, по мнению части исследователей, конечной фазе заболевания) наиболее частым осложнением является развитие цирроза печени — замещения функционального долькового строения печёночной ткани грубым соединительнотканным образованием, что приводит к неадекватному функционированию органа. Определённое время печень способна выполнять функцию даже на стадии цирроза, но со временем при воздействии вируса наступает декомпенсация работы. Это состояние характеризуется нарушением кровотока в печени, повышением давления в системе воротной вены, расширением вен пищевода и желудка, увеличением селезёночной вены. Прогрессивно снижается уровень выработки белков, факторов свёртывания крови, фильтрационная способность. Появляются отёки, асцит (скопление жидкости в брюшной полости), кровотечения различной интенсивности, ухудшается общее состояние, интеллектуально-мнестические характеристики. В конечном итоге возможен летальный исход из-за массивного кровотечения и полиорганной недостаточности.
Не менее значимое осложнение хронической фазы гепатита С — развитие гепатоцеллюлярной карциномы (опухолевое перерождение). Согласно основной гипотезе, злокачественное перерождение возникает в результате повышенного распада клеток печени и последующего их восстановления, что приводит к повышенному числу мутаций. На ранних стадиях принципиальных отличий от течения хронического гепатита нет, в запущенных случаях возникает стремительное ухудшение состояния, нарастание асцита, желтухи, неспецифических желудочно-кишечных симптомов, потери веса, анорексии.
У 10-15 % больных с хроническим вирусным гепатитом С возможно развитие аутоиммунных заболеваний, наиболее частыми из которых являются аутоиммунный гепатит (АИГ) и криоглобулинемия. АИГ — это иммуноопосредованное поражение печени. Внешне оно мало отличается от проявлений гепатитов другой этиологии, но зачастую имеет более агрессивное течение и поддаётся терапии только длительными курсами иммуносупрессивных препаратов. Криоглобулинемия — накопление в малых и средних кровеносных сосудах специфических белков, которые вызывают затруднение в них тока крови и приводят к специфическим проявлениям.
Диагностика гепатита С
Вариантов первичного выявления вируса и заболевания множество, однако чаще всего гепатит С выявляется в ходе планового обследования при сопутствующем заболевании (операции или госпитализации). Как правило, обнаруживают повышенный уровень АЛТ или антитела к гепатиту С (HCVAb). Это служит поводом для направления такого пациента к врачу-инфекционисту для углублённого обследования.
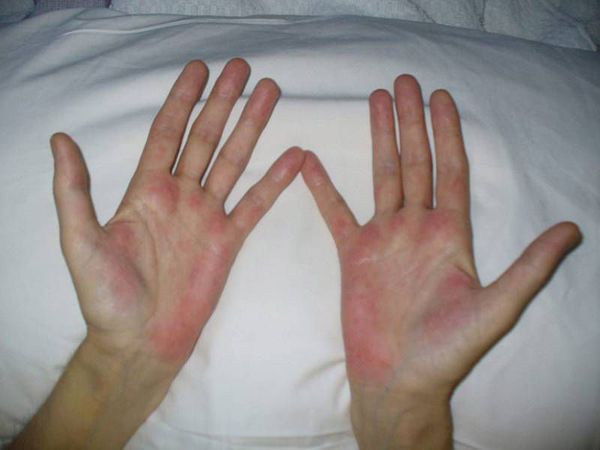
На приёме врач-инфекционист (гепатолог) осматривает пациента, в части случаев (в различных сочетаниях) выявляет характерное изменение цвета ладоней (печёночные ладони), увеличение размеров печени. В продвинутых случаях заболевания врач отмечает расширение вен области передней брюшной стенки («голова медузы»), отёчность (в том числе асцит как причина увеличения размеров живота), сосудистые звездочки и др.
Прохождение тестирования на гепатит С
При лабораторном обследовании в первую очередь должно быть назначено исследование на АЛТ, РНК вируса методом ПЦР качественно с чувствительностью 15-60 МЕ и антитела к вирусу гепатита С суммарные. При отрицательном результате ПЦР и положительном анализе на антитела диагноз гепатита С не подтверждается. Согласно действующему в РФ законодательству, такой человек должен быть поставлен на учёт к инфекционисту на срок 2 года с обязательным обследованием методом ПЦР раз в 6 месяцев. При отрицательном результате наблюдение прекращается с диагнозом паст-инфекция гепатита С (выздоровление). При положительном результате ПЦР происходит подтверждение диагноза — острый или хронический вирусный гепатит С — и назначается дополнительное обследование в целях уточнения текущего состояния. Необходимо помнить, что выявление суммарных антител в иммуноферментном анализе (ИФА) говорит лишь о прошлой встрече с инфекцией и не даёт практически никакой информации о наличии заболевания в текущий момент. Антитела могут сохраняться пожизненно.
Обязательно должны быть назначены следующие исследования:
Дифференциальная диагностика
Надо ли проверяться на гепатит С здоровому человеку
Регулярное обследование на гепатит С при отсутствии симптомов следует проводить медработникам, пациентам отделений гемодиализа, частым посетителям стоматолога, больным хроническими заболеваниями с частыми парентеральными вмешательствами (внутривенно, подкожно и внутримышечно) и лицам, часто меняющим половых партнёров.
Лечение гепатита С
Основу любого лечебного воздействия составляет правильно подобранная диета. В отношении вируса гепатита С этот метод как никогда актуален, однако он зачастую игнорируется как пациентами, так и самими врачами.
Диета при гепатите С
Самое главное условие — полный отказ от алкоголя. Ничто так не вредит печени, как алкоголь. Именно он может стать тем фактором, который запускает цепь патологических реакций и переводит гепатит из вялотекущего процесса в высокоактивный, ускоряя наступление цирротической стадии гепатита. В отношении других продуктов питания и напитков следует соблюдать золотую середину: питание должно быть разнообразным, всего должно быть в меру, без злоупотреблений «тяжёлой» пищей (ограничение жирного, жареного, солёного, копчёного) с учётом отсутствия или наличия сопутствующих заболеваний.
Большое значение имеет поддержание разумной физической активности и контроль веса (индекс массы тела не должен превышать 25 кг/м 2 ).
Какие врачи лечат гепатит С
Лечением гепатита С занимаются врачи-инфекционисты.
Медикаментозная терапия Гепатита С
Медикаментозное лечение гепатита С зависит от фазы развития заболевания, индивидуальных особенностей и возможностей организма. В остром периоде широко применяется инфузионная терапия (введение растворов) с привлечением различных дезинтоксикационных (очищение организма от вредных веществ) и питательных лечебных растворов.
Роль специфической противовирусной терапии гепатита С окончательно не решена и возможна лишь в индивидуальном порядке, например при угрозе хронизации или при фульминантном течении болезни (тяжёлом варианте воспалительно-некротического поражения печени). При невозможности радикального лечения гепатита С в хронической фазе вполне приемлема поддерживающая терапия так называемой группой гепатопротекторов (фосфолипиды, аминокислоты, антиоксиданты и др.). Данные средства не имеют чётко доказанной эффективности, однако широко применяются на практике и в некоторых случаях способны несколько задержать прогрессирование заболевания. Хороший эффект даёт нормализация функции ЖКТ и улучшение микрофлоры кишечника.
Попытки воздействия на вирус предпринимались с момента его открытия. Вначале это было изолированное применение препаратов интерферона короткого действия, затем комбинации интерферона короткого действия и рибавирина (препарата общевирусного действия). Их сменила комбинация интерферона пролонгированного действия и рибавирина.
К концу интерфероновой эпохи были достигнуты значительные успехи в процессе лечения и избавления человеческого организма от вируса гепатита С. Однако терапия была длительной, процент излечения достигал не более 70 % в среднем по генотипам, и курс лечения имел серьёзные побочные эффекты, иногда приводя к последствиям намного серьёзнее, чем сам гепатит С. Это обстоятельство дало толчок к разработке принципиально новых лекарственных средств, характеризующихся прямым противовирусным действием, сочетающих высокую эффективность (до 99 %), высокий профиль безопасности (минимальные побочные эффекты), простоту и удобство дозирования и небольшую длительность (2-3 месяца). В основу механизма действия легло подавление ключевых этапов размножения вируса, в первую очередь протеазы и полимеразы вируса гепатита С. Проведённые испытания препаратов показали высокие результаты, и, начиная с 2013 года, данная группа последних эффективных разработок с успехом применяется во всём мире. В некоторых странах одобрено лечение детей современными препаратами начиная с 3 лет (в зависимости от генотипа) с соответствующими взрослым показателями успеха.
Можно ли вылечить гепатит С полностью
В 2016 году Всемирная организация здравоохранения (ВОЗ) объявила гепатит С полностью излечимым заболеванием.
На 2020 год в мире доступны следующие виды и комбинации лекарственных препаратов прямого противовирусного действия для лечения гепатита С:
Как лечить гепатит С в домашних условиях
Схемы лечения гепатита С в России
В России на сегодняшний день для лечения гепатита С используется преимущественно устаревшее лечение интерферонами (чаще бесплатно или со скидкой), в редких случаях — препаратами прямого противовирусного действия (чаще платно со скидкой).
Прогноз. Профилактика
Если лечение гепатита начать до того, как разовьётся цирроз печени, то прогноз будет благоприятным: как правило, наступает полное излечение. При запущенных стадиях (цирроз и рак печени) прогноз зависит от множества факторов, обычно при начальном циррозе больные при должном лечении могут жить дальше без каких-либо серьёзных проблем со здоровьем, при декомпенсированном процессе прогноз неблагоприятный.
Прогноз при отсутствии лечения гепатита С
В среднем без лечения при отсутствии пагубных привычек и здоровом образе жизни в течение 20 лет примерно у 10-20 % больных разовьются цирроз и рак печени, при регулярном злоупотреблении алкоголем, наркотиками и токсинами (в том числе лекарствами) доля таких тяжёлых осложнений составит до 30-40%.
Из-за повышенной мутационной способности вируса существует ряд технических сложностей в создании вакцины — на данный момент её не существует (ведутся разработки). Поэтому меры профилактики распространения вируса гепатита С направлены на разрывы механизмов и путей передачи вируса, санитарное информирование и обучение населения.
Первичная профилактика
Вторичная профилактика
Что делать, если член семьи болен гепатитом С
Самое важное, что следует сделать, чтобы предотвратить заражение вирусом — это избегать контакта с кровью инфицированного человека. Кровь может быть заразной, даже если она сухая. Надевайте перчатки, если вам нужно прикасаться к использованным бинтам. После контакта с кровью тщательно вымойте руки, даже если вы были в перчатках.
Некоторые предметы личной гигиены могут иногда содержать небольшое количество крови. Не следует совместно использовать зубную щётку, бритву или маникюрные ножницы.
Деятельность ВОЗ
Реактивация вируса гепатита в у больных гематологическими заболеваниями, получающих иммуносупрессивную или цитотоксическую терапию
Т.Н. Лопаткина, Д.Т. Абдурахманов, Е.В. Волчкова
ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздравсоцразвития России
Данные, приведенные в статье, были получены в исследовании оригинального препарата энтекавира (Бараклюд ® ). Применение несертифицированных противовирусных средств может угрожать вашему здоровью, привести к возникновению мутантных штаммов вируса гепатита В и неэффективности дальнейшей терапии.
Заражение вирусом гепатита В (HBV) может быть причиной серьезной реактивации и даже смерти у пациентов с онко-гематологическими заболеваниями, а также у больных после трансплантации костного мозга. Представлены 3 клинических наблюдения реактивации HBV-инфекции у больных В-клеточной лимфомой с развитием печеночно-клеточной недостаточности, которые удалось купировать с помощью нуклеозидных аналогов. Обсуждаются способы профилактики и лечения реактивации HBV-инфекции у больных с лимфомами, получающих химиотерапию.
Ключевые слова: HBV-инфекция, реактивация, В-клеточная лимфома, химиотерапия, иммуносупрессивная терапия, нуклеозидные аналоги, ламивудин, энтекавир.
Для корреспонденции:
Лопаткина Татьяна Николаевна, канд. мед. наук, доц. каф. терапии и профзаболеваний ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Минздравсоцразвития России
Адрес: 119992, Москва, ул. Россолимо, д. 11
Заражение вирусом гепатита В (HBV) нередко является причиной серьезных осложнений и даже смерти у больных с опухолевыми заболеваниями, особенно с гематологическими опухолями, получающих химиотерапию или перенесших трансплантацию костного мозга. Известно, что частота реактивации HBV-инфекции у больных, получающих химиотерапию, достигает 36,8 %, у 13 % больных может развиться острая печеночная недостаточность, а 5,5 % погибают от заболеваний печени. Особенно высока вероятность реактивации HBV-инфекции при длительной иммуносупрессии и использовании при иммуносупрессии или химиотерапии глюкокортикостероидов и ритуксимаба [1–3].
Признаки реактивации HBV-инфекции
Реактивация HBV-инфекции оценивается по ряду признаков. Это, во-первых, развитие гепатита с повышением уровня HBV ДНК в сыворотке крови более чем на 1 log10 копий/мл от исходного уровня, во-вторых, абсолютное увеличение вирусной нагрузки свыше 6 log10 копий/мл или конверсия HBV ДНК в сыворотке крови из отрицательной в положительную.
Реактивация HBV-инфекции в результате химиотерапии проходит 3 стадии. Первоначально вследствие иммунной супрессии, обусловленной химиотерапией, повышается репликация вируса. Степень ее нарастания можно оценить при количественном определении HBV ДНК в сыворотке крови. Повышение количества вируса в крови предшествует росту содержания АЛТ в сыворотке крови за 3–4 нед. На 1-й стадии реактивации у неактивных носителей HBsAg может появиться HBeAg, у больных с латентной формой инфекции, имеющих в сыворотке крови «изолированные» HBcAb, – выявиться HBsAg или снизиться титр HBsAb.
На 2-й стадии реактивации происходит восстановление иммунной системы после отмены химиотерапии и наступает разрушение гепатоцитов, инфицированных HBV. Нарастает уровень АЛТ в сыворотке крови, в ткани печени у большинства больных развиваются массивные некрозы, которые сопровождаются выраженной желтухой и признаками декомпенсации заболевания печени. Реактивация HBV-инфекции протекает в виде острого вирусного или даже фульминантного гепатита с классическими признаками, включающими слабость, анорексию, желтуху, асцит и коагулопатию. Могут появиться признаки печеночной энцефалопатии, печеночно-клеточной недостаточности, не исключен летальный исход. У некоторых больных на короткий период времени может снизиться уровень HBV ДНК в сыворотке крови. У отдельных больных клиническая картина реактивации HBV-инфекции проявляется рецидивом активности хронического гепатита В с повышением активности АЛТ не менее чем в 3 раза от исходного уровня, что фиксируется при повторном исследовании с интервалом в 5 дней. У части больных реактивация HBV-инфекции может протекать бессимптомно с повышением уровня HBV ДНК в сыворотке крови, но при отсутствии клиники острого гепатита.
На 3-й стадии реактивации наступает реконвалесценция, отмечается клиническое разрешение гепатита и возврат к исходным маркерам HBV. У больных с тяжелым течением 2-й стадии реактивации HBV-инфекции реконвалесценция может не наступить, у них проявляются клиника хронического гепатита В и нарушение печеночно-клеточной функции [4].
Для верификации реактивации HBV-инфекции необходимо исключить другие причины гепатита, в том числе суперинфекцию другими вирусами (например, острого гепатита А, гепатита дельта, цитомегаловируса, вирусов простого герпеса, опоясывающего герпеса, Эпштейна-Барр или аденовируса), лекарственное поражение печени, синдром обструкции синусоидов, обусловленный применением ряда химиотерапевтических препаратов, реакцию отторжения трансплантата и наличие прямого опухолевого поражения печени. Прерывание противоопухолевой химиотерапии вследствие реактивации HBV-инфекции снижает общую выживаемость больных [4, 5].
Следует отметить, что реактивация HBV-инфекции отмечается у больных хроническим HBeAg-положительным или HBeAg-отрицательным гепатитом В, а также на стадии неактивного носительства HBsAg – самой частой формы хронической HBV-инфекции (обнаруживается у 60–70 % лиц с HBsAg в крови). Для нее характерны:
– стойко нормальный уровень трансаминаз в сыворотке крови;
– отсутствие HBeAg и наличие HBeAb в сыворотке крови;
– низкая репликативная активность вируса с уровнем HBV ДНК в сыворотке крови менее 2000 МЕ/мл (менее 10 000 копий/мл);
– минимальные признаки активности печеночного процесса по данным морфологического исследования (индекс гистологической активности менее 6 баллов по шкале Knodell или Ishak).
Данная категория больных имеет относительно благоприятный прогноз (очень низкий риск прогрессирования заболевания, развития цирроза печени, гепатоцеллюлярной карциномы и печеночной летальности) и не нуждается в противовирусной терапии. Стойко нормальный уровень АЛТ в течение длительного периода и низкая вирусная нагрузка снижают настороженность врача в отношении данных больных, однако под влиянием экзогенной иммуносупрессии, химиотерапии, лечения стероидами и биологическими препаратами, злоупотребления алкоголем возможна реактивация вируса и развитие острого гепатита тяжелого течения с осложнениями.
В последние годы появились данные о возможности реактивации латентной HBV-инфекции, при которой в отсутствии HBsAg в сыворотке крови единственными маркерами вирусной инфекции являются антитела к антигенам вируса, прежде всего «изолированные» HBcAb в сыворотке крови при наличии HBV только в ткани печени. Состояние супрессии вирусной репликации и экспрессии генов – типичный статус латентной HBV-инфекции. Он может быть нарушен с развитием типичного острого гепатита В (нередко фульминантного течения) у больных, получающих иммуносупрессивную терапию [6]. Частота реактивации латентной HBV-инфекции точно не установлена. Многочисленные исследования свидетельствуют о низком (менее 2 %) риске реактивации в этой группе больных [6–8]. Однако в отдельных исследованиях показано, что у больных, получающих ритуксимаб, он составляет от 2,7 до 45 %. По данным одного исследования [9], независимыми факторами риска развития реактивации HBV-инфекции у 46 больных с лимфомой при наличием HBcAb в сыворотке крови являются мужской пол, отсутствие HBsAb в сыворотке и применение ритуксимаба. В группе больных, получавших ритуксимаб и преднизолон, реактивация HBV-инфекции отмечена в 25 % наблюдений, в том числе с летальным исходом. В группе больных с лимфомой, получавших преднизолон, реактивация не наблюдалась. Реактивация HBV-инфекции у больных с латентной инфекцией, имеющих наряду с суммарными HBcAb в сыворотке крови также HBsAb, протекает по варианту обратной сероконверсии. Из 14 больных с латентной HBV-инфекцией при наличии HBsAb и HBcAb в сыворотке крови (данное сочетание маркеров оценивается как критерий элиминации HBV из организма), которым проведена пересадка костного мозга, у 7 отмечена сероконверсия HBsAb в HBsAg и только у 1 развился гепатит В, потребовавший стационарного лечения [10]. Частота обратной сероконверсии достигает 40 % после 2 лет и 70 % – после 5 лет наблюдения за больными с пересаженным костным мозгом [10].
Вирусологическая и клиническая реактивация латентной HBV-инфекции отмечена при ряде клинических состояний (злокачественные гематологические заболевания, ВИЧ-инфекция, трансплантация костного мозга и органов и др.). Появление новых лекарственных препаратов иммуносупрессивного действия, таких как моноклональные антитела к CD20 (ритуксимаб), CD52 (алемтузумаб), ФНО-альфа (инфликсимаб), широко применяемых при различных заболеваниях, также несет повышенный риск реактивации скрытой HBV-инфекции с развитием острого гепатита [11–13].
Факторы риска реактивации HBV-инфекции
Факторы риска реактивации HBV-инфекции определяются вариантом злокачественного заболевания и, особенно, проводимой иммуносупрессивной терапией. Наиболее высокому риску подвержены больные с лимфомой, однако имеются данные о возрастающем риске реактивации среди больных с солидными опухолями. Так, реактивация HBV-инфекции в период химиотерапии отмечена у 41–56 % больных раком легкого с маркерами HBV [14, 15], а также у 36 % больных с гепатоцеллюлярной карциномой, получающих системную химиотерапию. Противоречивы данные о реактивации инфекции после химиоэмболизации гепатоцеллюлярной карциномы [16, 17]. Ряд факторов, в первую очередь уровень вирусной нагрузки, также определяет серьезный риск реактивации. Среди 137 больных реактивация HBV-инфекции чаще отмечалась среди HBsAg-положительных пациентов с определяемой HBV ДНК в сыворотке крови до трансплантации костного мозга по сравнению с больными с неопределяемой HBV ДНК. Показано также, что вирусная нагрузка с уровнем HBV ДНК более 10 5 копий/мл является важным фактором риска реактивации [18]. Среди других факторов риска выделяют мужской пол, возраст (от 20 до 64 лет), наличие HBeAg в сыворотке крови, использование кортикостероидов и ряда химиотерапевтических препаратов (антрациклины, циклофосфан), моноклональных антител (ритуксимаб, алемтузумаб) в монотерапии или в комбинации с другими иммунодепрессантами. По данным литературы, 39 % наблюдений реактивации HBV-инфекции были отмечены у больных, леченных ритуксимабом, летальность вследствие печеночной недостаточности составила 52 % [19]. Более того, отмечена реактивация латентной HBV-инфекции (HBsAg-отрицательные, HBcAb-положительные больные) при лечении ритуксимабом [20].
Мы наблюдали больного 54 лет, у которого в 1990 г. выявлено неактивное носительство HBsAg. С декабря 2000 г. отмечает боли в правом локтевом суставе, с июля 2001 г. присоединилось ограничение движения в суставе. В феврале 2002 г. при рентгенологическом исследовании сустава появилось подозрение на онкологическое заболевание. При обследовании в Российском онкологическом научном центре им. Н.Н. Блохина РАМН (РОНЦ) выявлена диффузная В-клеточная лимфома с поражением подмышечных лимфоузлов справа, мягкотканым образованием в области правого локтевого сустава. Результаты анализов: уровень АСТ, АЛТ, билирубина в норме, HBsAg «+», HBV ДНК «–». В октябре проведены 2 курса химиотерапии винкристином, доксирубицином, циклофосфаном и преднизолоном. Через 10 дней после окончания 2-го курса отмечено повышение уровня АСТ до 2 норм и АЛТ до 4,5 норм. После 3-го курса химиотерапии уровень АСТ – 6 норм, АЛТ – 16 норм. Через месяц, в декабре 2001 г., уровень АСТ – 45 норм, АЛТ – 60 норм, впервые отмечено повышение ГГТП до 4 норм, непрямая гипербилирубинемия и гипоальбуминемия – 29 г/л. При обследовании в клинике им. Е.М. Тареева выявлены HBV ДНК более 10 9 копий/мл, HBsAg, HBeAb, HBcAb IgM и IgG; HBeAg и HBsAb «–». Исключены гепатиты А, С и дельта. Диагностирована реактивация хронической HBV-инфекции, обусловленная химиотерапией, с развитием гепатита В по типу фульминантного гепатита с признаками печеночно-клеточной недостаточности. С 3 декабря 2002 г. начато лечение ламивудином (100 мг/сутки). Через 6 нед отмечено снижение уровня АСТ до 11 норм, АЛТ – до 20 норм, альбумина – до 39 г/л, уровень виремии снизился в 100 раз (HBV ДНК – 10 7 копий/мл). Через 16 нед лечения АЛТ – 2 нормы, HBV ДНК – 10 5 копий/мл. Нормализация АЛТ и клиренс HBV ДНК наступили через 32 нед лечения ламивудином. Терапия нуклеозидным аналогом продолжена до 2 лет.
Таким образом, отсутствие превентивного противовирусного лечения у больного с неактивным носительством HBsAg при достижении значительной вирусной нагрузки (более 10 9 копий/мл) в результате химиотерапии с использованием кортикостероидов и циклофосфана обусловили развитие тяжелого поражения печени с признаками острого вирусного гепатита и печеночно-клеточной недостаточности. Медленная динамика уровня трансаминаз и виремии при противовирусной терапии явилась показанием к длительной (2 года) терапии нуклеозидными аналогами, которые обеспечили подавление репликации вируса и восстановление синтетической функции печени.
Частота реактивации HBV-инфекции у неактивных носителей HBsAg при проведении химиотерапии составляет, по данным разных исследователей, от 14 до 72 %. Смертность в этой группе больных может достигать 5–52 %. Возможным объяснением широкой вариабельности показателей могут служить различия в популяции больных, вариантах опухолевых заболеваний, режимах химиотерапии и определении статуса реактивации [4].
Поражение печени, развивающееся в ходе иммуносупрессивной терапии у инфицированных HBV больных, обусловлено прямым цитопатическим действием вируса: усиленный синтез вирусных антигенов, прежде всего HBsAg, приводит к их избыточному накоплению в цитоплазме клеток печени с последующей дистрофией, некрозом гепатоцитов и развитием в отдельных случаях тяжелого холестатического поражения печени – фиброзирующего холестатического гепатита В. Впервые данный вариант поражения печени был описан у больных после трансплантации печени, длительно получавших глюкокортикостероиды. Тяжелое поражение печени, но с преобладанием синдрома цитолиза, наблюдается и при резкой отмене иммуносупрессивной терапии, когда в ответ на повышенную экспрессию вирусных антигенов на поверхности гепатоцитов происходит иммунный лизис гепатоцитов цитотоксическими лимфоцитами – синдром «рикошета» [21].
Таким образом, у больного с неактивным носительством HBsAg через 6 мес после окончания химиотерапии В-клеточной лимфомы выявлен синдром «рикошета» с выраженным цитолизом по типу острого вирусного гепатита и умеренной виремией более 10 5 копий/мл. Лечение ламивудином быстро купировало реактивацию HBV-инфекции, авиремия сохраняется в течение длительного периода.
Более тяжелое течение реактивации HBV-инфекции при иммуносупрессии В-клеточной лимфомы отмечается у больных хроническим гепатитом В с определяемой HBV ДНК в сыворотке крови до химиотерапии.
Мы наблюдали больную 19 лет, у которой в 2006 г. во время беременности впервые выявлены HВsAg, низкий уровень HBV ДНК в сыворотке крови и нормальный уровень трансаминаз. После родов в связи с обострением хронического гепатита В в течении 6 мес больная получала зеффикс (ламивудин) в дозе 100 мг ежедневно. Через 6 мес достигнута авиремия, HВsAg в сыворотке крови сохранялся. В поликлинике по месту жительства предпринята попытка лечения иммуномодуляторами (циклофероном и неовиром) курсами в течение 6 мес без вирусологического контроля. В феврале 2008 г. отмечено резкое ухудшение состояния: выраженная слабость, стойкая лихорадка 39–40 °С, увеличение подмышечных лимфоузлов, затем появились узловатые образования в мягких тканях по ходу костей скелета. При обследовании в РОНЦ была диагностирована В-клеточная лимфома. С мая по август 2008 г. больной проводили химиотерапию, затем с сентября по октябрь 2008 г. – курс лучевой терапии с положительным эффектом. Впервые проконсультирована в клинике им. Е.М. Тареева в июне 2008 г. Было рекомендовано весь период химио- и лучевой терапии и в течение 6 мес после их окончания принимать зеффикс в дозе 100 мг ежедневно для профилактики реактивации HBV-инфекции у больной с неактивным хроническим HBeAg-отрицательным гепатитом В. После окончания курса лучевой терапии в октябре 2008 г. по совету онколога пациентка прекратила приём зеффикса. В декабре появились слабость, недомогание. В анализах от 29 декабря уровень АЛТ и билирубина в норме, однако отмечена высокая репликация вируса: HBV ДНК 8,0х10 7 МЕ/мл. При повторном биохимическом анализе 15 января 2009 г. отмечено нарастание уровня трансаминаз и билирубина, сопровождающиеся сонливостью, анорексией. Повторно проконсультирована в клинике им. Е.М. Тареева 27 января: отмечены выраженная желтуха, слабость, явления печеночной энцефалопатии, асцит. По «скорой» госпитализирована в КИБ № 2 в тяжелом состоянии. При поступлении жалобы на сильную слабость, тошноту, рвоту, отвращение к пище. Больная вялая, заторможенная, на вопросы отвечала односложно. Отмечен выраженный тремор кистей рук, резкая желтушность кожных покровов, склер, единичные геморрагии на коже груди, передней брюшной стенке, асцит. АД – 110/70 мм рт. ст., ЧСС – 96 в мин. Уровень АЛТ – 1701 ЕД/л (норма – до 55 ЕД/л), АСТ – 745 ЕД/л (норма – до 34 ЕД/л), общего билирубина – 336 мкмоль/л (норма – до 20,5 мкмоль/л), прямого билирубина – 164 мкмоль/л (норма – до 8,6 мкмоль/л), снижение протромбинового индекса до 29 %, содержание общего белка – 48 г/л. Больной срочно, при поступлении, был назначен эпивир (ламивудин) в дозе 150 мг/сут, свежезамороженная плазма – 800 мл (в дальнейшем по 250 мл ежедневно до стабилизации лабораторных показателей), дезинтоксикационная терапия под контролем кислотно-щелочного состояния и диуреза, верошпирон – 150 мг/сут, лактулоза – до 100 мл/сут в 4 приёма, гепа-мерц – 30 г 2 раза в день внутривенно. Состояние больной на протяжении 3 дней оставалось тяжёлым, но уже к 3-м суткам противовирусной и симптоматической терапии отмечено повышение протромбинового индекса до 48 %. Одновременно уровень АЛТ снизился до 449 ЕД/л, АСТ – до 150 ЕД/л. Сохранялась желтуха (общий билирубин – 394 мкмоль/л, прямой билирубин – 190 мкмоль/л), слабость. Состояние больной улучшилось к 5-му дню лечения: появился аппетит, исчезли тошнота, рвота, тремор, геморрагии на коже, протромбиновый индекс повысился до 61 %. Асцит купирован на 16-й день лечения. К дню выписки (2 марта 2009 г.) показатели нормализовались: АЛТ – 24 ЕД/л, АСТ – 43 ЕД/л, общий билирубин снизился до 66 мкмоль/л, прямой до 33 мкмоль/л, протромбиновый индекс – 92%. HBV ДНК «–». Больная в удовлетворительном состоянии выписана из стационара с рекомендацией длительно принимать ламивудин в дозе 100 мг/сут в связи с тяжестью поражения печени и наличием хронического гепатита В до начала химиотерапии. В сентябре 2009 г., через 7 мес от возобновления приема ламивудина, появилась виремия, что расценено в рамках развития резистентности к препарату, переведена на приём энтекавира в дозе 1 мг/сут. Приём препарата продолжает до настоящего времени, наблюдение за больной также продолжается.
Профилактика и лечение реактивации HBV-инфекции
Противовирусные препараты в лечении реактивации HBV
Профилактика реактивации у HBsAg-положительных больных должна начинаться как можно раньше до начала иммуносупрессии опухоли. При высокой (HBV – ДНК сыворотки более 2000 МЕ/мл) вирусной нагрузке и повышении уровня АЛТ терапию необходимо начинать незамедлительно! Среди применяемых в лечении ХГВ нуклеоз(т)идных аналогов (ламивудин, телбивудин, адефовир, энтекавир, тенофовир) ламивудин имеет наибольшую длительность (с 2000 года) и опыт применения. Ламивудин – нуклеозидный аналог (2′,3′-дидезокси-3′-тиацитидина), блокирует полимеразу HBV, характеризуется хорошим профилем эффективности, отсутствием нежелательных явлений и имеет хорошие результаты лечения как при гематологических, так и при солидных опухолях. В исследовании G.K. Lau и соавт. [23] 30 больных с лимфомой и HBsAg в сыворотке крови были рандомизированы в 2 группы: в 1-й пациенты получали ламивудин в дозе 100 мг/сутки за 1 нед до начала химиотерапии, во 2-й прием нуклеозидного аналога назначали при наличии серологических признаков развившейся реактивации HBV. В 1-й группе виремия не появилась ни у одного больного, в то время как во 2-й группе реактивация HBV-инфекции наступила у 53 % пациентов (р=0,002). В другом рандомизированном исследовании [24], включавшем 43 больных с неходжкинской лимфомой, положительных по HBsAg, выявлен значительно более низкий риск реактивации HBV у пациентов, принимавших ламивудин профилактически перед или в 1-й день химиотерапии по сравнению с теми, кому препарат назначали при нарастании уровня АЛТ в сыворотке крови (11,5 и 56 % соответственно; р=0,001)). Результаты мета-анализа 14 клинических исследований, который включал 214 больных, принимавших ламивудин, и 399 пациентов группы контроля, показали, что предварительное лечение ламивудином HBsAg-положительных больных, получающих химиотерапию, способно в значительной степени снизить риск реактивации HBV-инфекции и фатального прогноза у ряда больных (см. таблицу). Сделано заключение, что профилактическое назначение ламивудина позволяет предотвратить 1 летальный исход на каждые 15 больных, получающих иммуносупрессивную терапию [25, 26].
Таблица. Частота реактивации HBV-инфекции (в %) на фоне иммуносупрессивной терапии HBsAg-положительных больных, получавших и не получавших ламивудин
Осложнения химиотерапии
Больные, получающие ламивудин (n=214)
Контрольная группа ((n=399)