Аводарт или финастерид что лучше при аденоме простаты
Излечима ли аденома простаты?
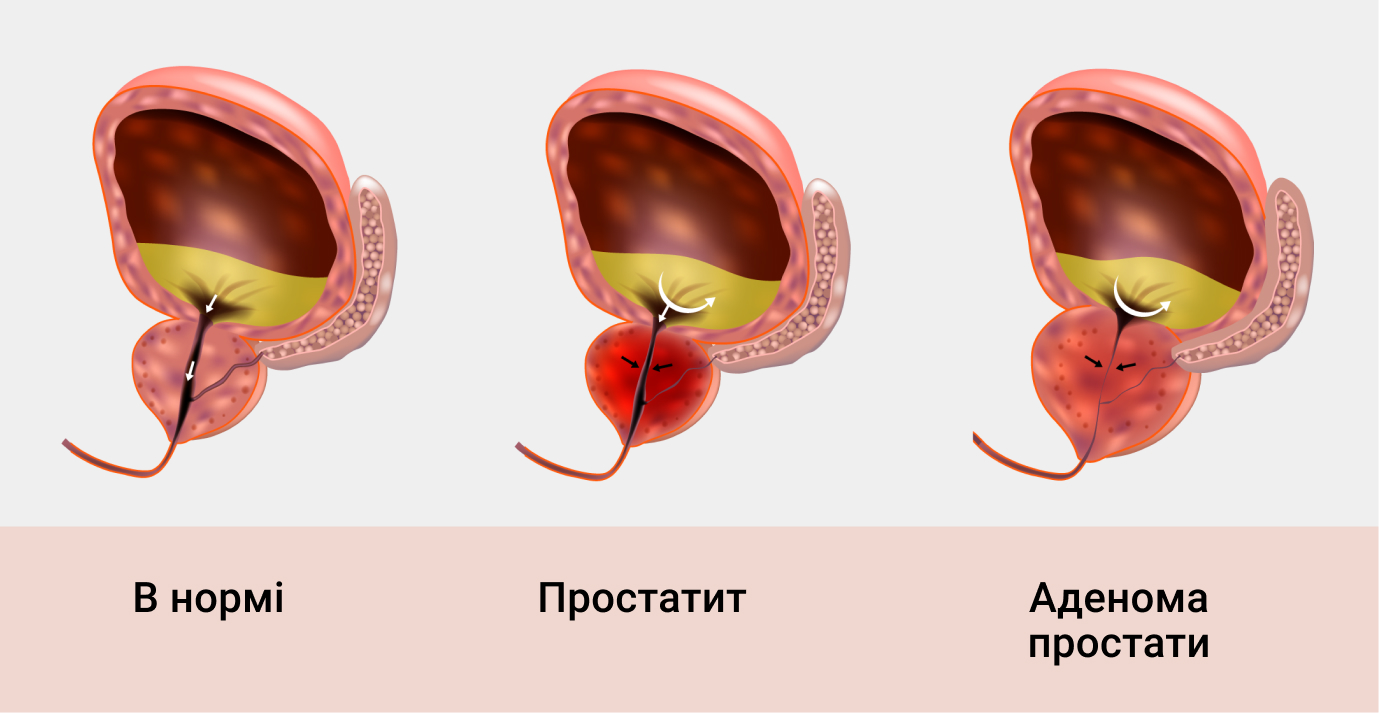
Доброкачественная гиперплазия предстательной железы (ДГПЖ), аденома предстательной железы, аденома простаты — это медицинская проблема, для которой характерно увеличение размеров простаты и наличие симптомов болезней мочевого пузыря и мочеиспускательного канала. Аденома простаты является одной из распространенных доброкачественных патологий среди мужчин старшего возраста.
Стадии болезни
Современная классификация аденомы простаты основана на стадиях клинического течения патологического процесса.
Стадии аденомы предстательной железы:
I стадия компенсации:
расстройства мочеиспускания наблюдаются при полном опорожнении мочевого пузыря, отсутствует остаточная моча (или ее объем не превышает 50 мл);
II стадия субкомпенсации:
функции мочевого пузыря значительно нарушены, объем остаточной мочи составляет более 50 мл;
III стадия декомпенсации:
тотальное нарушение функционирования мочевого пузыря.
Причины возникновения заболевания
Аденома простаты является полиэтиологическим заболеванием. При этом прослеживается четкая корреляция между развитием болезни и возрастом мужчины.
Основные причины аденомы простаты:
Отдельные исследования показали, что к косвенным факторам возникновения аденомы могут быть отнесены: неправильное питание, прием алкоголя, никотиновая зависимость, активность половой жизни, наследственность, сидячий образ жизни, патологии печени, сахарный диабет, высокое АД.
Возникновение, течение и исход болезни
Предстательная железа — орган, который находится под контролем гормонов гипоталамо-гипофизарной системы. Рост, развитие и функционирование простаты напрямую зависит от уровня тестостерона в крови. Морфологическая дифференциация эпителиальной и соединительной ткани простаты тоже зависят от обмена тестостерона.
При нарушении гормональной регуляции простаты наблюдается избыточное образование факторов роста на фоне уменьшения выраженности подавляющих факторов, снижения чувствительности к этим факторам клеток железы. Это ведет к значительному увеличению предстательной железы, развитию и дальнейшему прогрессированию гиперплазии.
Макроскопически гиперплазия простаты представляет собой отграниченный, четко очерченный капсульный узел, который расположен в толще органа. Микроскопически он состоит из соединительнотканной стромы и эпителиальной паренхимы. Кистозный эпителий продуцирует секрет, в результате чего образуются кистозные полости. Наблюдается разрастание железистой ткани, мышечных волокон, фиброзное разрастание.
Симптоматика заболевания
Основные признаки аденомы простаты — симптомы патологий нижних мочевых путей или расстройства мочеиспускания.
Выраженность клинических проявлений прямо пропорциональна стадии медицинской проблемы.
Симптомы аденомы простаты:
Осложнения
Для осложненной формы аденомы простаты характерны задержка мочи, гематурия, рецидивирующие инфекции мочевых путей, почечная недостаточность.
Последствия аденомы простаты:
Диагностические мероприятия
Диагностика аденомы простаты базируется на сборе анамнеза и изучении истории болезни (продолжительность и возможные причины симптомов болезней мочевого пузыря и мочеиспускательного канала, проводимое ранее лечение, действенность проводимой терапии), оценке клинических проявлений аденомы, а также наиболее объективных факторах — результаты лабораторных анализов и инструментальных методов, физикальное обследование.
Оценка симптомов аденомы простаты проводиться по широко распространенной среди урологов шкале IPSS.
Эта шкала позволяет оценить выраженность симптомов у пациентов с нарушением мочеиспускания. На основании суммарного балла симптомов пациент может быть отнесен к одной из 3 групп:
Для получения объективной информации о частоте и объеме мочеиспускания пациента просят вести дневник мочеиспускания, где он делает в течение суток соответствующие записи.
Лабораторные виды диагностики:
Физическое обследование включает пальпацию предстательной железы, которая позволяет определить размер простаты и выявить поражения железы.
Инструментальная диагностика аденомы простаты:
Трансректальное УЗИ простаты назначается для выбора хирургического метода лечения аденомы: трансуретральное удаление простаты (ТУРП) или открытая простатэктомия (удаление предстательной железы).
Дополнительно по усмотрению врача-уролога могут быть проведены исследования “давление-поток” (позволяет отличить синдром инфравезикальной обструкции от сниженной сократимости детрузора), уретроцистоскопия (помогает исключить стриктуры уретры, рак мочевого пузыря и др.).
Дифференциальная диагностика аденомы предстательной железы проводится с простатитом, стриктурой мочеиспускательного канала, гиперактивностью мочевого пузыря, расстройствами мочеиспускания нейрогенной природы, раком простаты.
Лечение
Правильное лечение аденомы простаты направлено, прежде всего, на облегчение симптомов нижних мочевых путей, улучшение качества жизни пациента и предотвращение развития осложнений, связанных с гиперплазией простаты.
Лечение аденомы предстательной железы проводится в урологическом стационаре или амбулаторно.
Если клинические проявления выражены незначительно, за пациентом устанавливается динамическое наблюдение, которое включает рекомендации по изменению образа жизни (регуляция режима мочеиспускания, уменьшение потребления перед сном жидкости, коррекция сопутствующей медикаментозной терапии и др.). Одновременно проводятся контрольные анализы мочи и анализ крови, ПСА, УЗ-диагностика и урофлоуметрия каждые 6-12 месяцев.
В медикаментозное лечение при аденоме простаты входят:
Выбор метода хирургии зависит от стадии гиперплазии и объема простаты.
Виды операций, которые могут применять:
Операции показаны пациентам, которым не помогла лекарственная терапия. Особенно важно, провести своевременное оперативное вмешательство при наличии таких серьезных осложнений как: рефлекторная задержка мочи, МКБ, почечная недостаточность и др. Необходимость в применении хирургии повышается с возрастом и зависит от начальной клинической картины.
Малоинвазивные методы лечения аденомы:
Стентирование суженных областей рекомендовано в качестве альтернативы катетеризации у пациентов группы высокого риска с рецидивирующей задержкой мочи и лицам, которым не подходят другие методы хирургии.
Контроль излеченности
Последующее наблюдение у уролога необходимо всем пациентам, проходящим лечение доброкачественной гиперплазии простаты. В зависимости от тяжести заболевания, через 1.5, 3 и 6 месяцев могут быть показаны физикальное обследование, определение ПСА, креатинина, количества остаточной мочи, а также ОАМ и урофлоуметрия.
Оценка клинической картины производится по шкале IPSS.
Профилактика
Специфическая профилактика аденомы простаты отсутствует. По той причине, что наиболее реальными факторами возникновения этой медицинской проблемы считаются: возраст и морфофункциональное состояние яичек.
Общие меры профилактики ДГПЖ:
Пациентам с легкой гиперплазией предстательной железы рекомендовано соблюдать все меры профилактики заболевания, осуществлять периодический контроль и придерживаться здорового образа жизни.
Уже сегодня вы можете получить ответы на возникшие вопросы, пройти комплексное диагностическое обследование и лечение аденомы простаты (г. Киев). Клиники МЕДИКОМ (Оболонь, Печерск) предлагают широкий спектр современных и малоинвазивных методов лечения и профилактики ДГПЖ.
Вопрос-Ответ
Как уменьшить размер простаты?
Влияет ли аденома простаты на потенцию?
Может ли аденома простаты перейти в рак?
Можно ли греть аденому простаты?
Несмотря на то, что самым известным народным методом лечения ДГПЖ является прогревание, самостоятельно греть аденому простаты нельзя. Любой перегрев половых органов несет мужчине больше вреда, чем пользы. А вот под медицинским контролем, в комплексе с другим лечением, действительно назначаются процедуры, основанные на влиянии тепла на органы. Кроме того, только врач может определить возможность применения прогреваний при аденоме простаты. Поскольку, в некоторых случаях ее категорически нельзя греть, даже под медицинским наблюдением. Это может спровоцировать развитие онкологического процесса на фоне доброкачественной гиперплазии.
Что полезно есть при аденоме простаты?
Статья носит информационно-ознакомительный характер. Пожалуйста, помните: самолечение может вредить вашему здоровью.
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
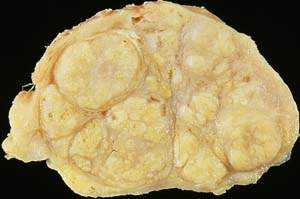 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Длительное лечение больных с аденомой предстательной железы дутастеридом (препаратом Аводарт)
Высокая распространенность аденомы предстательной железы (АПЖ) у мужчин определяет актуальность проблем лечения этого заболевания. В связи с увеличением продолжительности жизни число мужчин, страдающих АПЖ, с каждым годом растет [1]. По данным отечественных и зарубежных исследователей [2, 3], клинические проявления АПЖ имеют место у 25–35% мужчин в возрасте 40–50 лет, их частота увеличивается с возрастом и достигает 75–80% у мужчин старше 70 лет.
Многочисленные клинические симптомы АПЖ крайне разнообразны, но многие из них существенно снижают качество жизни больных. При прогрессировании заболевания могут возникнуть серьезные осложнения (острая задержка мочи, хроническая почечная недостаточность, камни мочевого пузыря и др.), которые потребуют выполнения оперативного вмешательства. В настоящее время около 30% мужчин, страдающих АПЖ, подвергаются хирургическому лечению, однако, по данным ряда авторов, у 25–35% прооперированных больных выявляют различные интраоперационные и послеоперационные осложнения [2, 3].
В последние годы предложены десятки препаратов для лечения больных аденомой предстательной железы. Однако установлено, что из многих препаратов, применяемых для лечения пациентов с АПЖ, только ингибиторы 5-альфа-редуктазы способны оказывать патогенетически направленное действие и предупреждать прогрессирование заболевания [1–3]. С учетом ведущей роли фермента 5-альфа-редуктазы в патогенезе АПЖ, с 1992 г. для лечения этой болезни стали применять ингибитор 5-альфа-редуктазы II типа финастерид. В 2005 г. в России был зарегистрирован и разрешен для лечения пациентов с АПЖ новый препарат этого класса – дутастерид под коммерческим названием Аводарт (производство компании GlaxoSmithKline, Великобритания), который обладает способностью ингибировать 5-альфа-редуктазу не только II, но и I типа.
За последнее десятилетие были опубликованы работы, доказывающие высокую эффективность дутастерида у больных АПЖ [4–6]. Так, по данным метаанализа 2004 г., проведенного F. Debuyne и соавт., через 24 месяца приема этого препарата объем предстательной железы в среднем снизился на 26%, симптоматика болезни по Международной шкале оценки простатических симптомов (International Prostate Symptom Score, IPSS) уменьшилась на 4,4 балла, уровень дигидротестостерона в сыворотке крови снизился на 93,7%, уровень простатспецифического антигена (ПСА) – на 57,2%, а максимальная скорость потока мочи выросла на 2,2 мл/с [5]. В последние годы появились работы, в которых изучалась целесообразность применения дутастерида у больных с АПЖ перед трансуретральной резекцией простаты для уменьшения размера железы и профилактики геморрагических осложнений [7, 8].
Однако одним из спорных вопросов терапии больных АПЖ дутастеридом является определение оптимальной длительности лечения. Некоторые авторы [9] отмечают положительный эффект (уменьшение объема простаты и снижение симптоматики) от приема дутастерида уже через 3 месяца лечения, тогда как другие для достижения эффекта рекомендуют принимать этот препарат в течение как минимум 6 месяцев, далее продолжая терапию в течение 12 месяцев [10] или даже 48 месяцев [5]. В связи с этим целью проведенного нами исследования была оценка эффективности длительного лечения больных с АПЖ дутастеридом.
Материалы и методы
Под нашим наблюдением находились 188 больных с АПЖ, которые получали дутастерид по 0,5 мг 1 раз в сутки. В зависимости от длительности приема дутастерида больные были разделены на 3 группы. У 28 (14,9%) больных (первая группа) курс лечения продолжался в течение 6 месяцев, у 63 (33,5%) больных (вторая группа) – в течение 12 месяцев, а у 97 (51,6%) больных (третья группа) – в течение 24 месяцев непрерывно. Других препаратов для лечения АПЖ пациенты всех трех групп в процессе терапии дутастеридом не получали.
Все больные были обследованы перед назначением дутастерида, в процессе приема препарата и сразу же после завершения курса лечения. Кроме того, 28 пациентов первой группы, 53 из 63 пациентов второй группы и 89 из 97 пациентов третьей группы были обследованы спустя 12–36 месяцев после окончания приема дутастерида для изучения отдаленных результатов проведенной терапии.
Средний возраст пациентов перед назначением дутастерида составил 63,5 ± 4,4 года (от 52 до 80 лет). В исследование не включались больные с увеличением средней доли предстательной железы, склерозом шейки мочевого пузыря, камнями и дивертикулами мочевого пузыря, стриктурами уретры, после оперативных вмешательств на органах малого таза, с выраженными кардиологическими и цереброваскулярными нарушениями, почечной и печеночной недостаточностью.
Исходные показатели симптоматики болезни у наблюдаемых нами пациентов были следующими:
Результаты и обсуждение
К концу лечения показатели клинического течения заболевания улучшились у всех больных АПЖ первой, второй и третьей групп (табл. 1), однако более существенно – у больных третьей группы, получавших дутастерид в течение 24 месяцев непрерывно. Так, у больных первой группы, которые получали дутастерид в течение 6 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 3,3 балла (с 14,1 ± 2,9 до 10,8 ± 3,0), качество жизни (QoL) улучшилось на 1,7 балла (с 4,2 ± 0,6 до 2,5 ± 0,8 баллов), объем предстательной железы уменьшился на 6,2 см3, или на 11% (с 56,5 ± 10,3 до 50,3 ± 8,8 см3), максимальная скорость потока мочи (Qmax) возросла на 2,1 мл/с (с 8,9 ± 0,8 до 11,0 ± 0,9 мл/с).
У больных второй группы, которые получали дутастерид в течение 12 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 6,9 баллов (с 14,1 ± 2,9 до 7,2 ± 2,5), качество жизни (QoL) улучшилось на 2,2 балла (с 4,2 ± 0,6 до 2,0 ± 0,7 баллов), объем предстательной железы уменьшился на 10,3 см3, или на 18,2% (с 56,5 ± 10,3 до 46,2 ± 9,1 см3), максимальная скорость потока мочи (Qmax) возросла на 4,3 мл/с (с 8,9 ± 0,8 до 13,2 ± 0,5 мл/с).
У больных третьей группы, которые получали дутастерид в течение 24 месяцев, суммарный балл симптоматики по шкале IPSS к концу лечения снизился на 9,2 балла (с 14,1 ± 2,9 до 4,9 ± 1,2), качество жизни (QoL) улучшилось на 2,6 балла (с 4,2 ± 0,6 до 1,6 ± 0,8 баллов), объем предстательной железы уменьшился на 14,6 см3, или на 25,9% (с 56,5 ± 10,3 до 41,9 ± 7,1 см3).
Одним из важных объективных показателей эффективности проводимого медикаментозного лечения больных АПЖ является уменьшение объема предстательной железы к концу терапии. Согласно нашим наблюдениям, оказалось, что через 6 месяцев лечения дутастеридом объем предстательной железы уменьшился в среднем на 11%, тогда как через 12 месяцев – уже на 18,2% (p