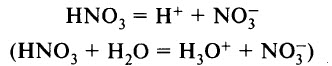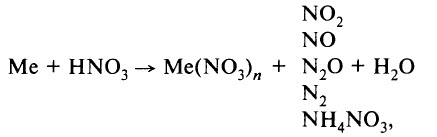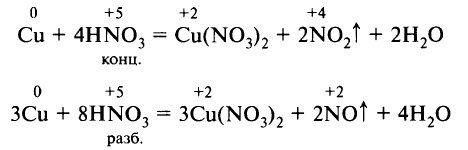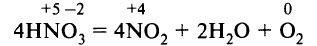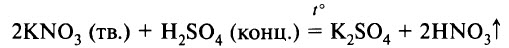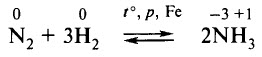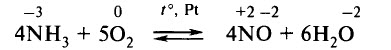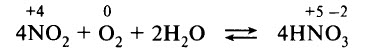Азотная кислота чем нейтрализуется
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
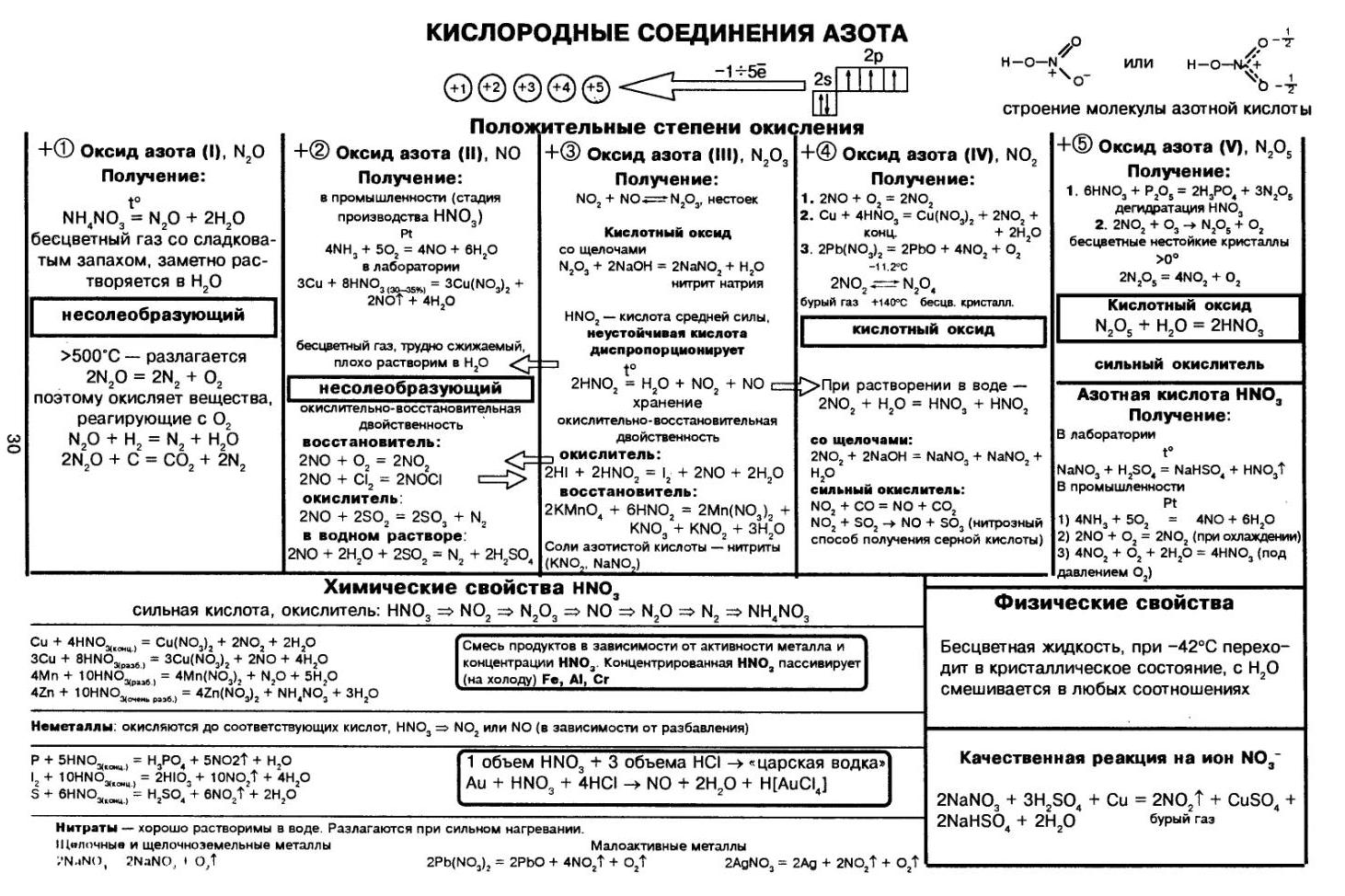
Нейтрализация азотной кислоты газообразным аммиаком
Нейтрализация азотной кислоты газообразным аммиаком является простой реакцией:
Образование аммиачной селитры протекает обратимо и сопровождается выделением тепла. Количество тепла, выделяющегося при реакции нейтрализации, зависит от концентрации применяемой азотной кислоты и ее температуры, а также от температуры газообразного аммиака. Чем выше концентрация азотной кислоты, тем больше выделяется тепла. При этом происходит испарение воды, что позволяет получать более концентрированные растворы аммиачной селитры. Для получения растворов аммиачной селитры применяют 42-58% азотную кислоту.
На рис.4.1 показан тепловой эффект реакции нейтрализации азотной кислоты газообразным аммиаком. Из приведенных данных видно, что
при использовании для нейтрализации аммиака 45% азотной кислоты выделяется значительное количества тепла-свыше 353 ккал/кг NH4NO3.
Применение азотной кислоты концентрацией выше 58% для получения растворов аммиачной селитры не целесообразно, так как в этом случае в аппаратах — нейтрализаторах развивается температура, значительно превышающая температуру кипения азотной кислоты, что может привести к ее разложению с выделением оксидов азота.
Зависимость между концентрацией применяемой азотной кислоты, выходом сокового пара и концентрацией получаемых растворов аммиачной селитры видна из табл. 4.1.
| Концентрация, % | Выход сокового пара на 1 т селитры, кг | Концентрация, % | Выход сокового пара на 1 т селитры, кг | ||
| HNO3 ‘ | NH4NO3 | HNO3 | NH4NO3 | ||
| 43 | 58,3 | 328 | 50 | 71,1 | 381 |
| 44 | 60,0 | 337 | 52 | 75,3 | 397 |
| 45 | 61,9 | 346 | 54 | 79,6 | 414 |
| 46 | 63,5 | 353 | 55 | 81,8 | 422 |
| 47 | 65,4 | 360 | 56 | 84,0 | 427 |
| 48 | 67,1 | 367 | 57 | 86,1 | 432 |
| 49 | 69,1 | 374 | 58 | 88,3 | 437 |
При получении растворов аммиачной селитры максимально возможной концентрации требуется относительно небольшие теплообменные поверхности выпарных аппаратов, и на дальнейшее упаривание растворов расходуется малое количество свежего пара. В связи с этим вместе с исходным сырьем стремятся подводить в нейтрализатор дополнительное количества тепла, для чего подогревают соковым паром аммиак до 70 0 С и азотную кислоту до 60 0 С (при более высокой температуре азотной кислоты происходит значительное ее разложение, и трубы подогревателя подвергаются сильной коррозии).
Потери аммиака и азотной кислоты с соковым паром сильно зависят от интенсивности циркуляции растворов селитры в нейтрализаторах. Нейтрализацию в большинстве случаев проводят под абсолютным давлением 1,2 ат. Такое давление позволяет использовать соковые пары в качестве греющего пара для производственных нужд.
Растворы аммиачной селитры получают в слабокислой среде. Практика показывает, что при нейтрализации в слабокислой среде потери аммиака, азотной кислоты и селитры с соковым паром меньше, чем в слабощелочной среде. Объясняется это тем, что при избытке азотной кислоты давление паров азотной кислоты над растворами селитры меньше давления паров аммиака.
Применяемая в производстве аммиачной селитры азотная кислота должна содержать не более 0,20 % растворенных оксидов азота.
В соковом паре содержатся примеси аммиака, азотной кислоты и аммиачной селитры. Количество этих примесей сильно зависит от стабильности давлений, при которых должны подаваться в нейтрализатор аммиак и азотная кислота. Для поддержания заданного давления азотную кислоту подают из напорного бака, снабженного переливной трубой, а газообразный аммиак – с помощью регулятора давления.
Получаемые в нейтрализаторах растворы аммиачной селитры накапливаются в промежуточных емкостях с мешалками, донейтрализуются аммиаком или азотной кислотой, после чего направляются на упаривание.
Форум химиков
как избавиться от азотной кислоты?
как избавиться от азотной кислоты?
Сообщение StYV » Пн ноя 07, 2005 6:22 pm
Re: как избавиться от азотной кислоты?
Сообщение Bolverk » Пн ноя 07, 2005 7:11 pm
Сообщение StYV » Пн ноя 07, 2005 7:47 pm
Сообщение Bolverk » Пн ноя 07, 2005 8:01 pm
Сообщение StYV » Пн ноя 07, 2005 8:26 pm
Re: как избавиться от азотной кислоты?
Сообщение avor » Пн ноя 07, 2005 9:05 pm
1. Странно, но никогда не слышал, чтобы азотка мешала опредению металлов, да и фосфора тоже вроде не сильно мешает.
2. Обычно азотку просто удаляют прокаливанием образцов.
3. Если вам не подходит прокаливание можно ее восстановить, например сульфиды восстанавливают азотку при нагревании, сами в основном превращаясь в серу, которая легко отделяется от раствора в виде осадка. Так же можно использовать легкоокисляемые органические вещества, например тот же формалин.
До аммиака вы загнули это нужен бешенный востановитель, чтобы из азотки получить аммиак, обычно дальше азота дело не заходит, а чаще всего образуются различные окислы наиболее стойкие закись и двуокись.
—А может на ионообменной колонке прогнать?
—-Это очень сложно для аналитики.
За чтоже вы так аналитику. Аналитика абсолютно не брезгает хроматографией вообще и ионообменной в частности.
А процедура то выглядит элементарно: На фильтре вроде Шотта промываете смолу АВ-17-8(любой анионообменник подойдет) промываете ее 1М солянкой потом водой потом 1М щелочью потом водой потом загружаете ее анионом вам нужным(например хлоридом или ацетатом сооответственно повар. солью или ацетатом натрия) и потом пропускаете сквозь смолу ваш образец и промываете смолу несколькими обьемами воды, обьединяя с образцом промывки. Все! Дело сделано большинство анионов в вашем растворе заменилось на тот, что вы заказали.
Это что безумно сложная операция?
Приготавление стандарт титра из перманганата калия с последующей его оттитровкой на мой взгляд сложнее.
Сообщение StYV » Вт ноя 08, 2005 8:25 am
Сообщение Nord » Вт ноя 08, 2005 9:12 am
Сообщение StYV » Вт ноя 08, 2005 9:23 am
Сообщение Nord » Вт ноя 08, 2005 12:22 pm
Ну, я помню, что нитрит-ионы, и кажется, нитраты при кипячении в растворе с мочевиной реагируют до азота и углекислоты.
Я не готовое решение предлагаю, а лишь путь.
Сообщение avor » Вт ноя 08, 2005 1:04 pm
Вот видите теперь более или менее становится ясным вопрос.
1) Не знаю аналитики бора. Но возможно ему нитраты и мешают. Помню только прелестную реакцию со спиртом в пламени замечательный зеленинький цвет. Кстати, может вам вместо удаления нитрата, испарить бор в виде борорганики.
2)Образцы тысячами не значит, что методика должна быть простой. Это всего лиш вопрос автоматизации. Например методика секвенирования ДНК не может быть названа простой, однако для программы «Геном человека» она была автоматизирована так, что стали возможны сотни тысячь анализов. При чем каждый последующий геном обходится дешевле первого и делается быстрее.
3) Опишите эксперимент.
4) Замена иона в ионообменнике не сравнима по простоте и возможности автоматизации с ВЭЖХ. Например, я себе представляю недорогую установку в которой легко можно обрабатывать до 400 образцов одновременно.
6) нет у меня ссылки, сам на уроке делал(давно это было), да в любом кач. анализе, что-то подобное должно быть описано.
Есть еще предложения.
а) Пркаливание с силикатами улетучивает нитраты. Потом можно выщелачивать из королька бор щелочью.
Аммиачная силитра разлагается с выделением закиси азота. Намек поняли. Нечто подобное предлагал Норд.
И поймите меня правильно, для меня поставленная вами задача также нова, как и для вас. И я думаю для любого из тех кто читает здесь наши опусы. Поэтому высказанное есть только идеи, а не решение проблемы.
А проверять вам и решать стоит проверять или нет тоже вам.
А все пространные рассуждения с самого начала были вызваны расплывчатостью заданного вопроса.
Азотная кислота чем нейтрализуется
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
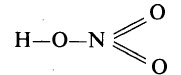
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты:
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
При обычных условиях азотная кислота – бесцветная жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе, смешивается с водой в любых соотношениях. Часто концентрированный раствор азотной кислоты окрашен в жёлтый цвет, который придаёт раствору оксид азота (IV) NO2, выделяющийся вследствие частичного разложения HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота является сильной одноосновной кислотой, в водном растворе диссоциирует на ионы:
Ион Н3O + можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
КОН + HNO3 = KNO3 + H2O
OH – + Н + = H2O
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н + = Mg 2+ + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н + = Zn 2+ + 2H2O
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н + = Cu 2+ + H2O
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО3 2– + 2Н + = CO2↑ + H2O
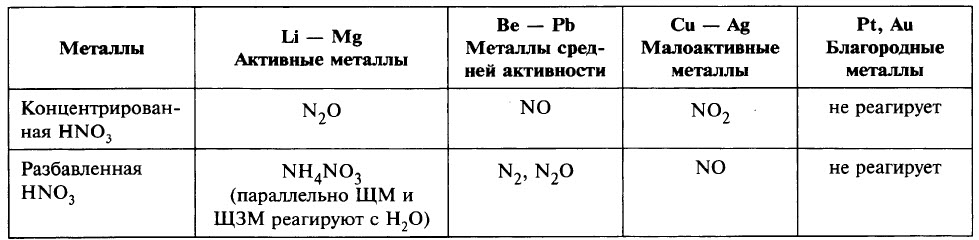
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
где Me – металл.
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
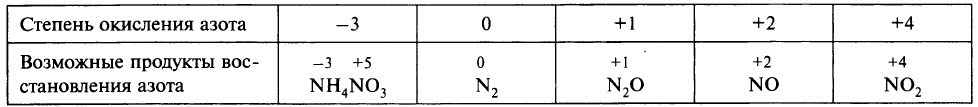
Глубина восстановления азота зависит:
С азотной кислотой не реагируют:
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
Классическими примерами взаимодействия азотной кислоты с металлами является растворение меди в азотной кислоте:
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
Сырьём является азот, получаемый разделением жидкого воздуха на фракции. Сначала осуществляется синтез аммиака:
Аммиак окисляют кислородом на платиновом катализаторе:
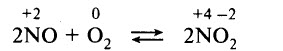
Оксид азота (II) легко окисляется кислородом воздуха:
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
Всё про азотную кислоту кратко в одной таблице
Всё про азотную кислоту кратко в одной таблице
Конспект урока «Азотная кислота: строение, свойства, получение, применение».
Азотная кислота
Азотная кислота – важный, но опасный химический реактив
Современная химия насчитывает огромное количество химических реактивов: щелочи, кислоты, реагенты, соли и другие. Среди них кислоты – самая распространенная группа. Кислоты – это сложные водородосодержащие соединения, атомы которых могут замещаться атомами металла. Сфера их применения обширна. Она охватывает многие отрасли производства: химическую, машиностроительную, нефтеперерабатывающую, пищевую, а также медицину, фармакологию, косметологию; широко используется в быту.
Азотная кислота и ее определение

Форма выпуска азотной кислоты зависит от ее концентрации:
— обычная – 65 %, 68 %;
— дымная – 86 % и более. Цвет «дыма» может быть белым, если концентрация составляет от 86 % до 95 %, или красным – свыше 95 %.
В настоящее время производство сильно- или слабоконцентрированной азотной кислоты проходит следующие этапы:
1. процесс каталитического окисления синтетического аммиака;
2. как результат – получение смеси нитрозных газов;
3. впитывания воды;
4. процесс концентрирования азотной кислоты.
Хранение и транспортировка
— каждая тара помечается надписью «Опасно».
Где применяется химический реактив?
Сфера применения азотной кислоты в настоящее время огромна. Она охватывает многие отрасли промышленности, такие как:
— химическую (изготовление взрывчатых веществ, органических красителей, пластмасс, натрия, калия, пластмасс, некоторых видов кислот, искусственного волокна);
— сельскохозяйственную (производство азотных минеральных удобрений или селитры);
— металлургическую (растворение и травление металлов);
— фармакологическую (входит в состав препаратов по удалению кожных образований);
— ювелирное производство (определение чистоты драгоценных металлов и сплавов);
— военную (входит в состав взрывчатых веществ как нитрующий реагент);
— ракетно-космическую (одна из составляющих ракетного топлива);
— медицину (для прижигания бородавок и других кожных образований).