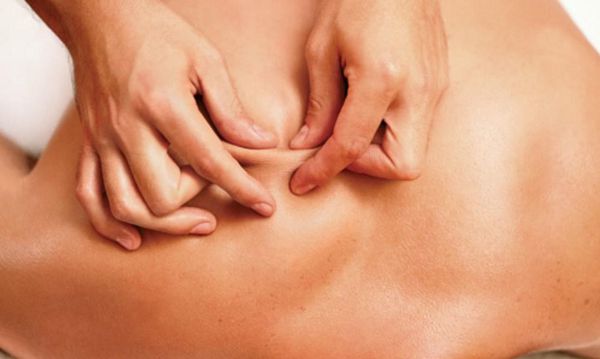
фасцикуляции мышц при каких заболеваниях
Боковой (латеральный) амиотрофический склероз (и синдром БАС)
Боковой (латеральный) амиотрофический склероз (БАС) (также известен как болезнь моторных нейронов, Мотонейронная болезнь, болезнь Шарко, в англоязычных странах — болезнь Лу Герига) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепно-мозговых нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Болезнь известна не так давно. Впервые описана Жан-Мартеном Шарко в 1869г. По статистике выявляется у 2-5 человек на 100 000 населения в год, что говорит о том, что данная патология относительно редко встречается. Всего в мире насчитывается около 70 тысяч больных боковым амиотрофическим склерозом. Обычно заболевание заявляет о себе у людей старше 50 лет.
Совсем недавно было высказано мнение, что случаи бокового амиотрофического склероза чаще регистрируются у высокоинтеллектуальных людей, профессионалов в своем деле, а также у спортсменов-атлетов, которые на протяжении всей жизни отличались крепким здоровьем.
Точная этиология БАС неизвестна.
Сущность болезни заключается в дегенерации двигательных нейронов, т.е. под воздействием ряда причин запускается процесс разрушения нервных клеток, ответственных за сокращения мышц. Этот процесс затрагивает нейроны коры больших полушарий, ядер головного мозга и нейроны передних рогов спинного мозга. Двигательные нейроны погибают, а их функции никто больше не выполняет. Нервные импульсы к мышечным клеткам больше не поступают. И мышцы слабеют, развиваются парезы и параличи, атрофия мышечной ткани.
Если в основе бокового амиотрофического склероза лежит мутация в гене супероксиддисмутазы-1, то процесс выглядит примерно следующим образом. Мутантная супероксиддисмутаза-1 накапливается в митохондриях двигательных нейронов (в энергетических станциях клетки). Это «мешает» нормальному внутриклеточному транспорту белковых образований. Белки соединятся друг с другом, как бы слипаются, и это запускает процесс дегенерации клетки.
Если причиной становится избыток глутамата, то механизм запуска разрушения двигательных нейронов выглядит так: глутамат открывает каналы в мембране нейронов для кальция. Кальций устремляется внутрь клеток. Избыток кальция, в свою очередь, активирует внутриклеточные ферменты. Ферменты как бы «переваривают» структуры нервных клеток, при этом образуется большое количество свободных радикалов. И эти свободные радикалы повреждают нейроны, постепенно приводя к их полному разрушению.
Предполагается, что роль других факторов в развитии БАС также заключается в запуске свободнорадикального окисления.
Классификация БАС, формы:
Общими симптомами, характерными для любой из форм бокового амиотрофического склероза, являются:
Начальные проявления заболевания:
•слабость в дистальных отделах рук, неловкость при выполнении тонких движений пальцами, похудание в кистях и фасцикуляции (мышечные подергивания)
•реже заболевание дебютирует слабостью в проксимальных отделах рук и плечевом поясе, атрофиями в мышцах ног в сочетании с нижним спастическим парапарезом
•возможно также начало заболевания с бульбарных расстройств – дизартрии и дисфагии (25% случаев)
•крампи (болезненные сокращения, спазмы мышц), нередко генерализованные, встречаются практически у всех больных БАС, и нередко являются первым признаком заболевания
Для БАС в большинстве случаев характерна асимметричность симптоматики.
При этой форме заболевания возможно два варианта:
Также может дебютировать двумя способами:
В руках по мере прогрессирования болезни формируется парез с атрофическими изменениями, повышением рефлексов, повышением тонуса и патологическими стопными признаками. Аналогичные изменения возникают и в ногах, но несколько позже.
Это разновидность бокового амиотрофического склероза, когда заболевание протекает с преимущественным поражением центрального мотонейрона. При этом во всех мышцах туловища и конечностей формируются парезы с повышением мышечного тонуса, патологическими симптомами.
Бульбарная и высокая формы БАС являются прогностически неблагоприятными. Больные с таким началом заболевания имеют меньшую продолжительность жизни по сравнению с шейно-грудной и пояснично-крестцовой формами. Какими бы ни были первые проявления заболевания, оно неуклонно прогрессируют.
Парезы в различных конечностях приводят к нарушению способности самостоятельно передвигаться, обслуживать себя. Вовлечение в процесс дыхательной мускулатуры приводит вначале к появлению одышки при физической нагрузке, затем одышка беспокоит уже в покое, появляются эпизоды острой нехватки воздуха. В терминальных стадиях самостоятельное дыхание просто невозможно, больным требуется постоянная искусственная вентиляция легких.
Продолжительность жизни больного БАС составляет по разным данным от 2 до 12 лет, однако более 90% больных умирают в течение 5 лет от момента постановки диагноза. В терминальную стадию болезни больные полностью прикованы к постели, дыхание поддерживается с помощью аппарата искусственной вентиляции легких. Причиной гибели таких больных может стать остановка дыхания, присоединение осложнений в виде пневмонии, тромбоэмболии, инфицирования пролежней с генерализацией инфекции.
Среди параклинических исследований наиболее существенное диагностическое значение имеет электромиография. Выявляется распространенное поражение клеток передних рогов (даже в клинически сохранных мышцах) с фибрилляциями, фасцикуляциями, позитивными волнами, изменениями потенциалов двигательных единиц (увеличивается их амплитуда и длительность) при нормальной скорости проведения возбуждения по волокнам чувствительных нервов. Содержание КФК в плазме может быть незначительно повышено
Боковой амиотрофический склероз нужно заподозрить:
•при развитии слабости и атрофий, а возможно и фасцикуляций (мышечных подергиваний) в мышцах кисти
•при похудания мышц тенара одной из кистей с развитием слабости аддукции (приведения) и оппозиции большого пальца (обычно асимметрично)
•при этом наблюдается затруднение при схватывании большим и указательным пальцами, затруднения при подбирании мелких предметов, при застегивании пуговиц, при письме
•при развитии слабости в проксимальных отделах рук и плечевом поясе, атрофий в мышцах ног в сочетании с нижним спастическим парапарезом
•при развитии у пациента дизартрии (нарушений речи) и дисфагии (нарушений глотания)
•при появлении у пациента крампи (болезненных мышечных сокращений)
Диагностические критерии БАС:
Критерии подтверждения БАС:
Диагноз БАС подьверждается:
Дифференциальный диагноз БАС (синдромы похожие на БАС):
•Спондилогенная шейная миелопатия.
•Опухоли краниовертебральной области и спинного мозга.
•Краниовертебральные аномалии.
•Сирингомиелия.
•Подострая комбинированная дегенерация спинного мозга при недостаточности витамина В12.
•Семейный спастический парапарез Штрюмпеля.
•Прогрессирующие спинальные амиотрофии.
•Постполиомиелитический синдром.
•Интоксикации свинцом, ртутью, марганцем.
•Недостаточность гексозаминидазы типа А у взрослых при ганглиозидозе GM2.
•Диабетическая амиотрофия.
•Мультифокальная моторная невропатия с блоками проведения.
•Болезнь Крейцтфельдта-Якоба.
•Паранеопластический синдром, в частности при лимфогранулематозе и злокачественной лимфоме.
•Синдром БАС при парапротеинемии.
•Аксональная нейропатия при болезни Лайма (Лайм-боррелиозе).
•Синдром Гийена-Барре.
•Миастения.
•Рассеянный склероз
•Эндокринопатии (тиреотоксикоз, гиперпаратиреоз, диабетическая амиотрофия).
•Доброкачественные фасцикуляции, т.е. фасцикуляции, продолжающиеся годами без признаков поражения двигательной системы.
•Нейроинфекции (полиомиелит, бруцеллез, эпидемический энцефалит, клещевой энцефалит, нейросифилис, болезнь Лайма).
•Первичный боковой склероз.
Диагностические исследования при синдроме БАС.
Для уточнения диагноза и проведения дифференциального диагноза при синдроме БАС рекомендутся следующее обследование больного:
Анализ крови (СОЭ, гематологические и биохимические исследования)
Рентгенография органов грудной клетки
Исследование функций щитовидной железы
Определение содержания витамина В12 и фолиевой кислоты в крови
Креатинкиназа в сыворотке
МРТ головного мозга и при необходимости, спинного мозга
Эффективного лечения заболевания не существует. Единственный препарат, ингибитор высвобождения глутамата рилузол (Рилутек), отодвигает летальный исход на 2 – 4 месяца. Его назначают по 50 мг два раза в день.
Основу лечения составляет симптоматическая терапия:
•Физическая активность. Пациент должен по мере своих возможностей поддерживать физическую активность По мере прогрессирования заболевания возникает необходимость в кресле-каталке и других специальных приспособлениях.
•Диета. Дисфагия создаёт опасность попадания пищи в дыхательные пути • Иногда возникает необходимость в питании через зонд или в гастростомии.
•Применение ортопедических приспособлений: шейного воротника, различных шин, устройств для захвата предметов.
•При крампи (болезненным мышечных спазмах): карбамазепин (Финлепсин, Тегретол) и/или витамин Е, а также препараты магния, верапамил (Изоптин).
•При спастичности: баклофен (Баклосан), Сирдалуд, а также клоназепам.
•При слюнотечении атропин, или гиосцин (Бускопан).
•При невозможности приема пищи вследствие нарушения глотания накладывают гастростому или вводят назогастральный зонд. Раннее проведение чрезкожной эндоскопической гастростомии продлевает жизнь пациентов в среднем на 6 месяцев.
•Церебролизин в высоких дозах (10-30 мл в/в капельно 10 дней повторными курсами). Существует ряд небольших исследований, показывающих нейропротективную эффективность церебролизина при БАС.
•Антидепрессанты: Серталин или Паксил или Амитриптилин (часть больных БАС предпочитает именно его как раз из-за побочных действий – он вызывает сухость во рту, соответственно уменьшает гиперсаливацию (слюнотечение), часто мучающую больных БАС).
•При появлении дыхательных нарушений: искусственная вентиляция легких в условиях стационаров, как правило, не проводится, но некоторые больные приобретают портативные приборы ИВЛ и проводят ИВЛ в домашних условиях.
•Ведутся разработки к применению гормона роста, нейротрофических факторов при БАС.
•Последнее время активно ведутся разработки лечения стволовыми клетками. Этот метод обещает быть перспективным, но все же пока находится на стадии научных экспериментов.
•Боковой амиотрофический склероз является фатальным заболеванием. Средняя продолжительность жизни больных БАС 3 – 5 лет, тем не менее, 30% больных живут 5 лет, а около 10 – 20% живут более 10 лет от начала заболевания.
•Неблагоприятные прогностические признаки – пожилой возраст и бульбарные нарушения (после появления последних больные живут не более 1 – 3 лет).
Что такое миофасциальный синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Коршуновой Юлии Витальевны, невролога со стажем в 31 год.
Определение болезни. Причины заболевания
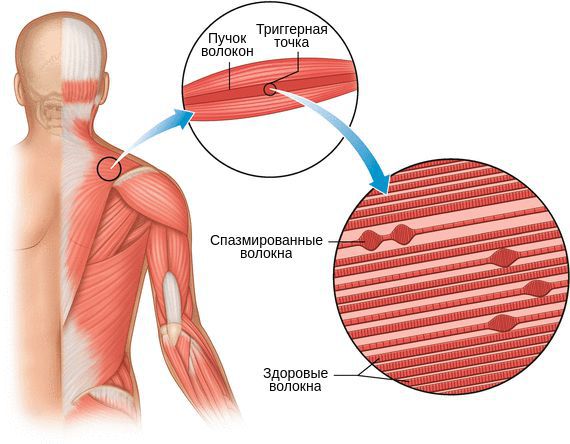
Миофасциальный синдром — это болезненное состояние, для которого характерна боль в любой части тела и болезненные мышечные напряжения с локальными уплотнениями — триггерными точками. Источником такой боли становятся мышцы и фасции — соединительная ткань, покрывающая мышцы.
Миофасциальная боль — одно из проявлений миофасциального синдрома. Она развивается при хронической скелетно-мышечной боли и может возникать в любых скелетных мышцах.
Триггерные точки, как и миофасциальная боль, могут располагаться в любой мышце. Их появление не зависит от расы и пола, однако с возрастом риск образования увеличивается.
Развитию миофасциальной боли способствуют многие факторы:
Боль в поражённых внутренних органах и суставах приводит к защитному напряжению мышц. Это позволяет разгрузить сустав и создать мышечный корсет вокруг внутреннего органа. Например, при некоторых болезнях желудка тонус сгибателей шеи снижается, а тонус разгибателей повышается. Это приводит к боли в области затылка.
Эмоциональный стресс также сопровождается мышечным напряжением, чем может активировать триггерные точки. При этом мышцы могут оставаться в спазмированном состоянии даже после прекращения стресса.
Другими причинами миофасциального синдрома могут стать длительное статическое напряжение мышц и стереотипные движения, особенно в условиях низкой температуры. К таким факторам относят частые повороты и наклоны туловища, однообразный тяжёлый физический труд, длительную сидячую работу в офисе или долгие поездки за рулём.
Спровоцировать появление триггерных точек может сдавление мышц ремнями, лямками рюкзака, узкими бретельками, тугими джинсами или тяжёлой шубой.
Ещё одна причина — длительная неподвижность мышцы, например сон в одной и той же позе или ношение гипса после перелома.
Свой вклад в формирование миофасциального синдрома также вносят:
Симптомы миофасциального синдрома
Классическими признаками миофасциальной боли являются:
Пациенты с миофасциальной болью обычно жалуются на местные ноющие и плохо локализуемые боли в мышцах и суставах, которые часто не дают им уснуть. Боль может быть очень сильной и отдавать в конечность. Такое состояние пациенты часто трактуют, как ущемление нерва.
Миофасциальная боль может вызывать напряжение, мышечную слабость, треск и щелчки в суставах, а также вегетативные явления, например потливость, ощущение «ползания мурашек» и изменения температуры кожи.
Спазмированная мышца, сдавившая проходящий рядом кровеносный/лимфатический сосуд или нерв, может вызвать дополнительные симптомы, такие как онемение и отёк части тела. При спазмировании мышц шеи может возникнуть головокружение, заложенность и шум в ухе.
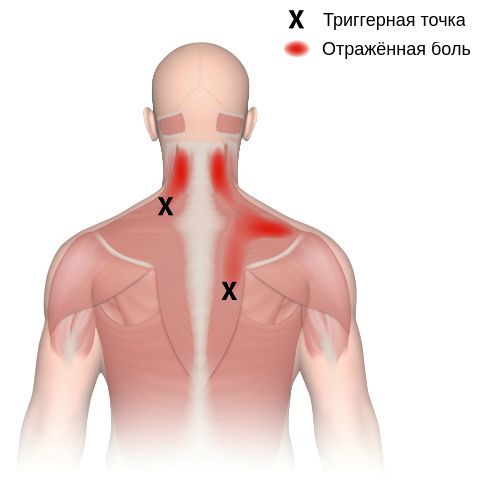
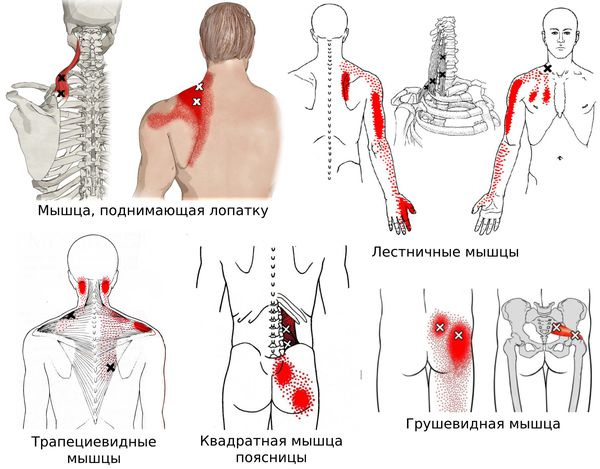
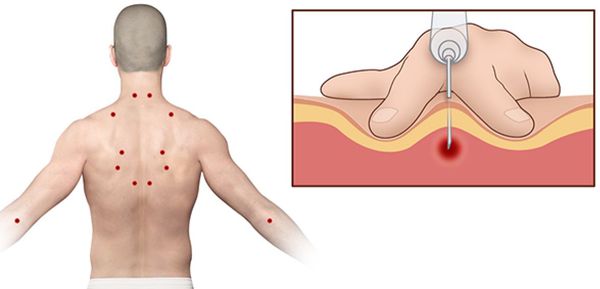
Согласно наблюдениям, чаще спазм возникает в мышце, поднимающей лопатку, грушевидной, трапециевидной, лестничной мышцах и квадратной мышце поясницы.
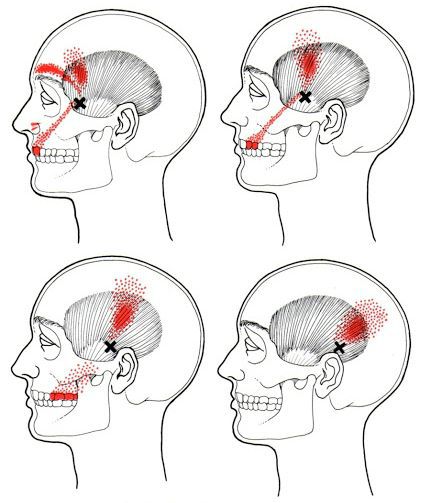
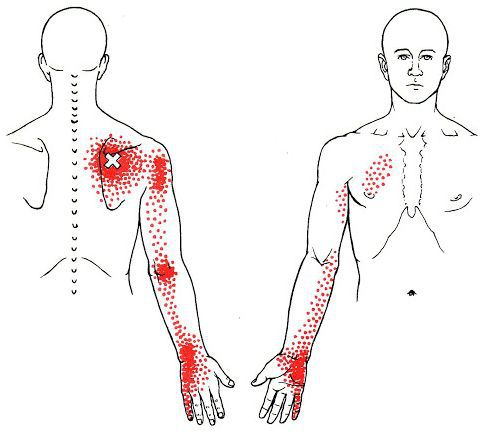
Каждой точке характерны свои зоны иррадиации. Например:
Активные триггерные точки являются непосредственным источником боли. После их стимуляции боль распространяется в отдалённые, но строго определённые зоны, как на картинках выше.
Уплотнение участка мышцы может предшествовать формированию триггерной точки, поэтому его появление не всегда сопровождается болью.
Патогенез миофасциального синдрома
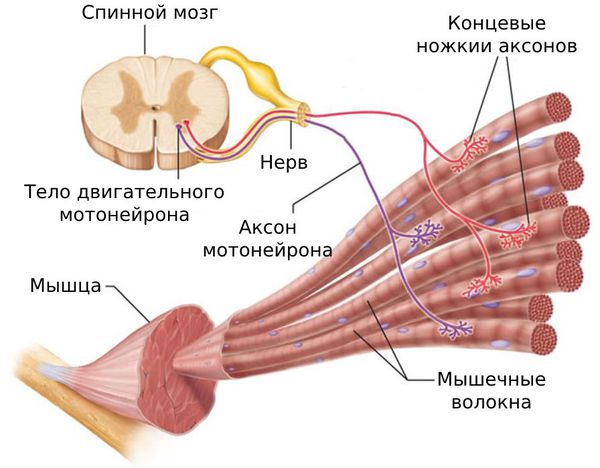
Патофизиология миофасциальной боли не совсем понятна. Считается, что в основе этой патологии лежит нарушение сократимости мышц и уменьшение их способности к расслаблению.
Длительный спазм приводит к рубцеванию мышцы и формированию триггерных точек. Мышца становиться менее растяжимой, что ведёт к ограничению движений.
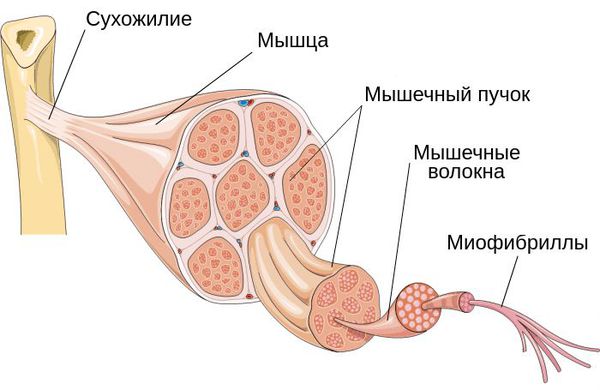
Поражение может локализоваться как в пределах нескольких миофибрилл — микроструктурной части мышцы, так и в мышечных группах.
Один из показателей изменения тонуса мышц — наличие локальных уплотнений. Они могут образоваться в вялой (гипотоничной) мышце в виде малоактивных образований или как триггерный феномен в виде уплотнённого участка мышцы с выраженной местной и отражённой болью и локальным судорожным ответом.
Классификация и стадии развития миофасциального синдрома
В Международной классификации болезней (МКБ-10) нет отдельного кода для миофасциального синдрома. Он относится сразу к нескольким рубрикам:
Первичный синдром связан с первоначальной дисфункцией мышцы, например перерастяжением, повторной микротравмой, переохлаждением мышцы и работой за компьютером в неправильной позе.
Течение миофасциальной боли разделяют на три фазы:
Осложнения миофасциального синдрома
Лечение триггерных точек временно облегчает боль, иррадиирующую из внутренних органов. Б ез лечения миофасциальный синдром может усугубить симптомы остеохондроза, сколиоза или другого основного заболевания, тем самым формируя порочный круг.
В качестве осложнений также можно отметить сдавление сосудов и нервов спазмированной мышцей. Это состояние приводит к радикулиту и вазомоторным нарушениям: приливам, повышенной потливости и побледнению кожи.
Диагностика миофасциального синдрома
Чтобы поставить диагноз «миофасциальный синдром», необходимо выявить у пациента пять больших критериев и один из трёх малых.
Физикальное обследование
Поиск триггерных точек — наиболее важная часть осмотра при подозрении на миофасциальный синдром. Как правило, они находятся в определённых участках мышц. При давлении на такие точки пациент подпрыгивает или вздрагивает от боли и дискомфорта. Причём боль возникает в характерной для каждой мышцы области.
Пальпируя мышцу перпендикулярно мышечным волокнам, можно обнаружить узел или тугой тяж — веревкообразное утолщение. Это и есть триггерная точка. Пальпация данной зоны очень болезненна.
В области активных и латентных триггерных точек пальпируемой мышцы могут отмечаться подёргивания, местные вегетативные реакции и сенсорные нарушения, такие как парестезии и дизестезии.
Парестезии — это ощущения, которые возникают без каких-либо раздражителей, например ползание мурашек.
Дизестезии — это ощущения, которые не соответствуют силе раздражителя. В таких случаях лёгкое прикосновение к коже может вызывать неприятные ощущения или даже сильную боль.
Часто сенсорные нарушения соответствуют зоне распространения боли.
Лабораторные исследования
Лабораторных тестов, выявляющих миофасциальный синдром, не существует. Однако они полезны в поиске предрасполагающих факторов, таких как гипотиреоз, гипогликемия и дефицит витаминов.
Перечень анализов включает общий анализ крови, скорость оседания эритроцитов (СОЭ), биохимический профиль и определение уровня витаминов C, B1, B6, B12 и фолиевой кислоты. На причину миофасциальной боли могут указать любые отклонения в результатах данных тестов.
Анализ на тиреотропин, или тиреотропный гормон (ТТГ), может быть полезным при наличии клинических признаков заболевания щитовидной железы. Допустимые значения тиреотропина для взрослых составляют 0,3-4,2 мкме/мл.
Дополнительные методы исследования
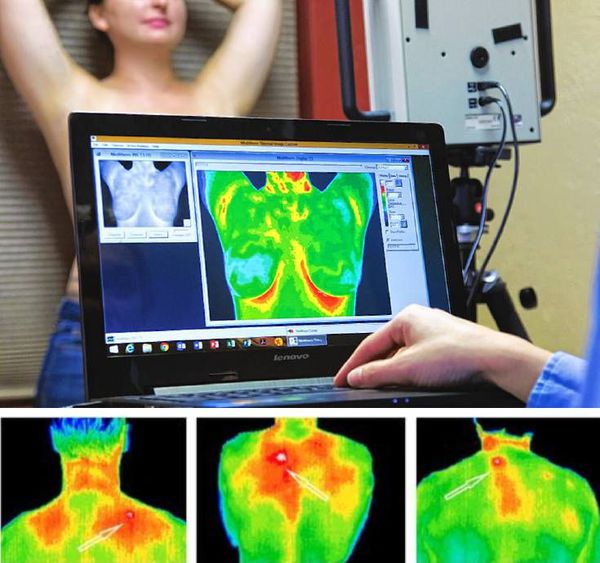
Инфракрасная или жидкокристаллическая термография позволяют визуализировать усиление кровотока, которое иногда отмечается в триггерных точках. Но данные методики применяются редко, так как они не являются стандартизированными.
Дифференциальная диагностика
В ходе обследования важно исключить другие причины боли: фибромиалгию, радикулопатию, дискогенную боль, спондилогенную боль, заболевания суставов (артрозы, артриты ) и болезни внутренних органов.
Лечение миофасциального синдрома
В лечении миофасциальной боли применяют комплексный подход. Он предполагает устранение патологического мышечного напряжения и триггерных точек.
При первичном синдроме проводится местное воздействие на поражённые структуры:
При вторичном синдроме на первый план выходит лечение основного заболевания.
К медикаментозным методам лечения миофасциальной боли относят:
НПВП снимают боль, воспаление и понижают температуру тела. Механизм их действия основан на подавлении активности веществ, которые участвуют в каскаде воспалительных реакций.
При выраженном болевом синдроме назначают низкие дозы трициклических антидепрессантов. Они уменьшают мышечную боль и обладают седативным эффектом.
Ишемическая компрессия триггерных точек направлена на прекращение или значительное снижение мышечного напряжения и уменьшение боли. Триггерная точка сдавливается кончиками пальцев и удерживается 60-90 секунд с постепенным увеличением силы давления.
Одновременно со сдавливанием триггерной точки производится растяжение поражённой мышцы. Это позволяет сократить время процедуры: чем больше мышца растягивается, тем сильнее она расслабляется, снимается гипертонус, быстрее происходит обезболивание.
Пациенты, принимавшие участие в эксперименте, были разделены на три группы по 20 человек: первую группу лечили в течение 4-х дней с помощью лидокаинового пластыря, приклеенного на триггерную точку; второй группе назначался пластырь с плацебо; а третья группа получала инъекции 0,5 % гидрохлорида бупивакаина.
Исследователи обнаружили, что в первой и третьей группах значительно уменьшились субъективные симптомы и увеличился порог болевой чувствительности. Причём эффективность терапии оказалась выше у пациентов третьей группы, которая получала инъекции анестетика, но они испытывали больший дискомфорт от проводимого лечения, чем пациенты из первой группы.
Пластырь используют только один раз в сутки. Его приклеивают на сухую неповреждённую кожу в области боли не больше чем на полдня, после чего делают перерыв не менее 12 часов. Перед приклеиванием пластыря волосы на коже нужно состричь ножницами, не сбривать.
Одновременно можно использовать не больше трёх пластырей. Если потребуется, пластырь можно разрезать на части, но только перед удалением защитной плёнки. Повторно использовать снятый пластырь не следует.
Важно регулярно оценивать эффективность такой местной терапии. Это позволит определить оптимальное количество пластырей, которые можно использовать одновременно, чтобы покрыть область боли или увеличить время между аппликациями.
Через 2-4 недели от начала лечения эффективность аппликаций нужно оценить повторно. Если за это время ответ на терапию был недостаточным или терапевтический эффект определяется только защитными свойствами пластыря, лечение следует прекратить.
В лечебный комплекс должны быть включены упражнения по перестройке неоптимального двигательного стереотипа. Они корректируют позы и движения, выполняемые в быту и во время работы.
В университете штата Мичиган проводилось изучение различных методик массажа и мануальной терапии, в результате которого был разработан специальный метод воздействия на миофасциальные структуры — » миофасциальный релиз «. Данная техника предполагает самостоятельное выполнение упражнений, без помощи врача или массажиста, что даёт возможность регулировать степень нажатия на мышцы и их растяжение, руководствуясь своими ощущениями.
Миофасциальный релиз можно выполнять с помощью различных инструментов: пенопластовых и ручных роликов, латексных шариков или других вспомогательных устройств. Они позволяют снять излишнее напряжение в триггерных точках, расслабить мышцы и связочный аппарат путём воздействия на фасцию. В результате наступает полное расслабление одной или группы мышц.
Механизмы, лежащие в основе миофасциального релиза, изучены недостаточно. Исследования, пытающиеся проиллюстрировать эффективность данной техники, часто плохо спланированы и не дают ответа на вопросы о том, как долго должна проводиться эта процедура, какой должна быть сила давления на поражённую мышцу и какое приспособление лучше подходит для упражнений.
Программа реабилитации предполагает использование ортезов: корсетов, бандажей, специальной обуви, стелек и пр. Ортопедические стельки, специальная ортопедическая обувь и подпяточники, к примеру, могут быть полезны для коррекции длины ног.
Прогноз. Профилактика
Миофасциальный синдром — не опасное для жизни состояние, но оно может значительно снизить качество жизни и стать основной при чиной временной нетрудоспособности.
Всем людям, старше 18 лет, Всемирная организация здравоохранения рекомендует:
Если мышцы будут крепкими, упругими, эластичными, с хорошим кровоснабжением, то в условиях перегрузок они либо не пострадают, либо пострадают минимально и быстро восстановятся.
Помимо ведения активного образа жизни важно избегать провоцирующих факторов и не заниматься самолечением при появлении боли, независимо от её локализации.