фенилкетонурия это какая мутация
Фенилкетонурия это какая мутация
Аномалии, приводящие к увеличению уровня фенилаланина крови, чаще всего недостаточность фенилаланингидроксилаза (ФАГ) или фенилкетонурия (ФКУ), иллюстрируют почти все принципы биохимической генетики, относящиеся к дефектам ферментов. Все генетические аномалии метаболизма фенилаланина — следствие мутаций со снижением функции в гене, кодирующем ФАГ, или в генах, необходимых для синтеза или восстановления ее кофактора, ВН4.
Классическую фенилкетонурию (ФКУ) по праву считают образцовым представителем врожденных ошибок метаболизма. Это аутосомно-рецессивное заболевание распада фенилаланина, вызванное мутациями в гене, кодирующем ФАГ, фермент, преобразующий фенилаланин в тирозин. Открытие фенилкетонурии (ФКУ) Фелингом в 1934 г. впервые продемонстрировало генетический дефект как причину умственной отсталости.
Из-за неспособности к утилизации фенилаланина пациенты с фенилкетонурией (ФКУ) накапливают эту аминокислоту в жидкостях тела. Гиперфенилаланинемия повреждает формирующуюся в раннем детстве ЦНС и создает помехи функционированию зрелого мозга. Небольшая часть фенилаланина метаболизируется по альтернативным путям, производя повышенные количества фенилпировиноградной кислоты (кетокислота, по которой названа болезнь) и других метаболитов, выделяющихся с мочой.
Любопытно, что хотя ферментный дефект известен уже десятилетия, точный патогенетический механизм, каким образом увеличение фенилаланина повреждает мозг, все еще неизвестен. Важно, что развитие неврологического ущерба, вызванного метаболическим блоком при классической ФКУ, может в основном предупреждаться изменениями диеты, предохраняющими от накопления фенилаланина. Лечение фенилкетонурии (ФКУ) стало образцом для лечения многих метаболических болезней, исходы которых могут улучшаться за счет предотвращения накопления субстрата фермента и его производных.
Скрининг новорожденных на фенилкетонурию (ФКУ)
Широко используется популяционный скрининг новорожденных на фенилкетонурию (ФКУ). Фенилкетонурия (ФКУ) — образец генетических болезней, для которых оправдан массовый неонатальный скрининг; заболевание сравнительно часто встречается в ряде популяций (до 1 на 2900 живых новорожденных). Лечение, начатое в начале жизни, весьма эффективно; без лечения неизбежно развивается тяжелая умственная отсталость. Скрининг-тесты выполняют через несколько дней после рождения.
Капельку крови, полученную при проколе пятки, наносят на бумажный фильтр, высушивают и отправляют в централизованную лабораторию для оценки уровня фенилаланина в крови и соотношения фенилаланин/ тирозин. В прошлом образцы собирали перед выпиской ребенка из роддома. Тенденция к ранней выписке матери и новорожденного после родов изменила эту практику. Тест предпочтительно не делать до возраста 24 ч, поскольку уровень фенилаланина при фенилкетонурии (ФКУ) повышается только после рождения. Положительные результаты теста должны быть быстро подтверждены, поскольку задержка начала лечения более 4 нед после родов не позволяет избежать влияния на интеллектуальное состояние пациентов с фенилкетонурией (ФКУ).
Различные формы фенилкетонурии и гиперфенилаланинемия
Поскольку фенилкетонурия (ФКУ) связана с выраженной недостаточностью активности фенилаланингидроксилазы (ФАГ) (менее 1% по сравнению с контролем), мутантная ФАГ, имеющая остаточную активность, вызывает менее тяжелые фенотипические проявления, так называемую гиперфенилаланинемию и атипичную фенилкетонурию (ФКУ).
Гиперфенилаланинемию, отличную от фенилкетонурии (ФКУ), диагностируют, если концентрация фенилаланина в плазме ниже 1 ммоль/л на фоне нормальной диеты. Эта степень гиперфенилаланинемии только в 10 раз выше нормы и значительно ниже, чем концентрации, обнаруживаемые при классической фенилкетонурии (ФКУ) (>1 ммоль/л). Умеренное увеличение фенилаланина при гиперфенилаланинемии не способно повреждать функции мозга и может даже быть благоприятным, если увеличение небольшое (
Сначала казалось, что знание генотипа фенилаланингидроксилазы (ФАГ) надежно предсказывает детали фенотипа; это ожидание оправдалось не полностью, хотя обнаружена определенная корреляция между генотипом ФАГ и биохимическим фенотипом.
В общих чертах мутации, которые полностью подавляют или резко снижают активность фенилаланингидроксилазы (ФАГ), вызывают классическую фенилкетонурию (ФКУ), тогда как мутации, приводящие к достаточно большой остаточной активности фермента, связаны с легкими фенотипами.
Тем не менее некоторые мутации фенилаланингидроксилазы (ФАГ) у гомозиготных пациентов определяют весь спектр фенотипов, от классической фенилкетонурии (ФКУ) до доброкачественной гиперфенилаланинемии.
Таким образом, стало очевидно, что в формировании фенотипа, наблюдаемого при специфическом генотипе, участвуют другие неопознанные биологические факторы, несомненно, включая гены-модификаторы. Это наблюдение, признанное в настоящее время общей характеристикой множества моногенных болезней, указывает на то, что даже моногенные болезни, подобные фенилкетонурии (ФКУ), — генетически не простые заболевания.
Дефекты в метаболизме тетрагидробиоптерина при фенилкетонурии (ФКУ)
Первоначально считали, что все дети с наследственной гиперфенилаланинемией имеют первичную недостаточность фенилаланингидроксилазы (ФАГ). Сейчас ясно, что примерно у 1-3% пациентов ген ФАГ нормален, а их гиперфенилаланинемия — результат генетического дефекта в одном из нескольких других генов, задействованных в синтезе или регенерации кофактора ФАГ, ВН4. Ассоциация одного фенотипа, например гиперфенилаланинемии, с мутациями в разных генах — пример локусной гетерогенности.
Как показывают мутации в генах, кодирующих белок фенилаланингидроксилазы (ФАГ) и метаболизм его кофактора биоптерина, белки, закодированные генами, демонстрирующими локусную гетерогенность, обычно входят в одну цепочку биохимических реакций. Пациенты с недостаточностью ВН4 сначала были выявлены из-за того, что, несмотря на успешное поддержание в диете низкой концентрации фенилаланина, у них рано развивались глубокие неврологические проблемы.
Плохие результаты частично объясняются необходимостью кофактора ВН4 для активности двух других ферментов, тирозингидроксилазы и триптофангидроксилазы. Обе этих гидроксилазы критичны для синтеза моноаминовых нейротрансмиттеров, таких как дегидроксифенилаланин, норэпинефрин, эпинефрин и серотонин. Пациенты с недостаточностью ВН4 имеют нарушение или в его биосинтезе из ГТФ, или в регенерации ВН4. Подобно классической фенилкетонурии (ФКУ), нарушение наследуется по аутосомно-рецессивному типу.
Очень важно отличать пациентов с дефектами в метаболизме ВН4 от больных с мутациями в фенилаланингидроксилазы (ФАГ), поскольку их лечение заметно разнится. Во-первых, так как белковая структура фенилаланингидроксилазы (ФАГ) у больных с нарушениями ВН4 нормальная, ее активность может восстанавливаться, если этим пациентам давать большие дозы ВН4, что приводит к снижению уровня фенилаланина плазмы. Следовательно, степень ограничения фенилаланина в диете пациентов с дефектами в метаболизме ВН4 может быть значительно уменьшена, а некоторые пациенты могут перейти на нормальную диету (т.е. без ограничения фенилаланина).
Во-вторых, необходимо также постараться нормализовать уровень нейротрансмиттеров в мозге этих пациентов, назначая продукты тирозингидроксилазы и триптофангидроксилазы: L-dopa и 5-гидрокситриптофан соответственно. По этим соображениям всем новорожденным с гиперфенилаланинемией показано обследование для определения аномалий в метаболизме ВН4.
Реакция на тетрагидробиоптерин при мутациях в гене ФАГ при фенилкетонурии (ФКУ)
У большинства пациентов с мутациями в гене фенилаланингидроксилазы (ФАГ), а не в метаболизме ВН4, отмечено отчетливое уменьшение уровня фенилаланина крови на фоне перорального приема больших доз кофактора фенилаланингидроксилазы (ФАГ) ВН4. Лучше отвечают на такое лечение пациенты со значимой остаточной активностью фенилаланингидроксилазы (ФАГ) (т.е. пациенты с атипичной фенилкетонурией (ФКУ) и гиперфенилаланинемией), но также поддается лечению небольшое число пациентов даже с классической фенилкетонурией (ФКУ). В то же время наличие остаточной активности ФАГ не дает гарантии влияния на уровень фенилаланина плазмы при назначении ВН4.
Наиболее вероятно, что степень ответной реакции на ВН4 зависит от специфических свойств каждого мутантного белка фенилаланингидроксилазы (ФАГ), отражающих лежащую в основе мутаций ФАГ аллельную гетерогенность. Показано, что введение в диету ВН4 оказывает лечебный эффект через несколько механизмов, вызванных повышением количества нормального кофактора, входящего в контакт с мутантным.
Эти механизмы включают стабилизацию мутантного фермента, защиту фермента от разложения клеткой, увеличение поступления кофактора к ферменту, имеющего низкое сродство с ВН4, и другие полезные эффекты в кинетических и каталитических свойствах фермента. Обеспечение повышенного количества кофактора — общая стратегия, применяемая в лечении многих врожденных ошибок метаболизма.
Материнская фенилкетонурия
Обычно успешное лечение фенилкетонурии (ФКУ) позволяет больным гомозиготам вести полноценную жизнь и иметь практически нормальные перспективы деторождения. В прошлом диету с низким содержанием фенилаланина прекращали у большинства пациентов с ФКУ в среднем детстве, основываясь на предположении (ошибочном, как установлено в настоящее время), что функционирование зрелой нервной системы не нарушается при возврате гиперфенилаланине-мии. Впоследствии было обнаружено, что почти все потомство женщин с фенилкетонурией (ФКУ), не получавших лечения, аномально; большинство этих детей с задержкой умственного развития, многие имеют микроцефалию, задержку роста и пороки развития, особенно сердца.
Как предсказывают принципы менделирующего наследования, все эти дети — гетерозиготы. Таким образом, задержка их развития вызвана не собственной генетической конституцией, а высокотератогенным эффектом высоких уровней фенилаланина в материнской крови. Соответственно необходимо, чтобы женщины с фенилкетонурией (ФКУ), планирующие беременность, начинали соблюдать диету с низким содержанием фенилаланина еще до зачатия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Фенилкетонурия
Это наследственное заболевание также называют болезнью Феллинга и относят к группе ферментопатий, обусловленных нарушением метаболизма аминокислот, преимущественно фенилаланина. В случае несоблюдения низкобелковой диеты больные фенилкетонурией могут страдать от тяжелых поражений ЦНС вследствие накопления в организме фенилаланина и его токсических метаболитов.
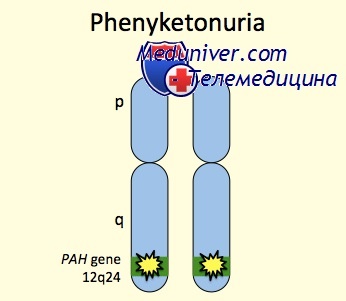
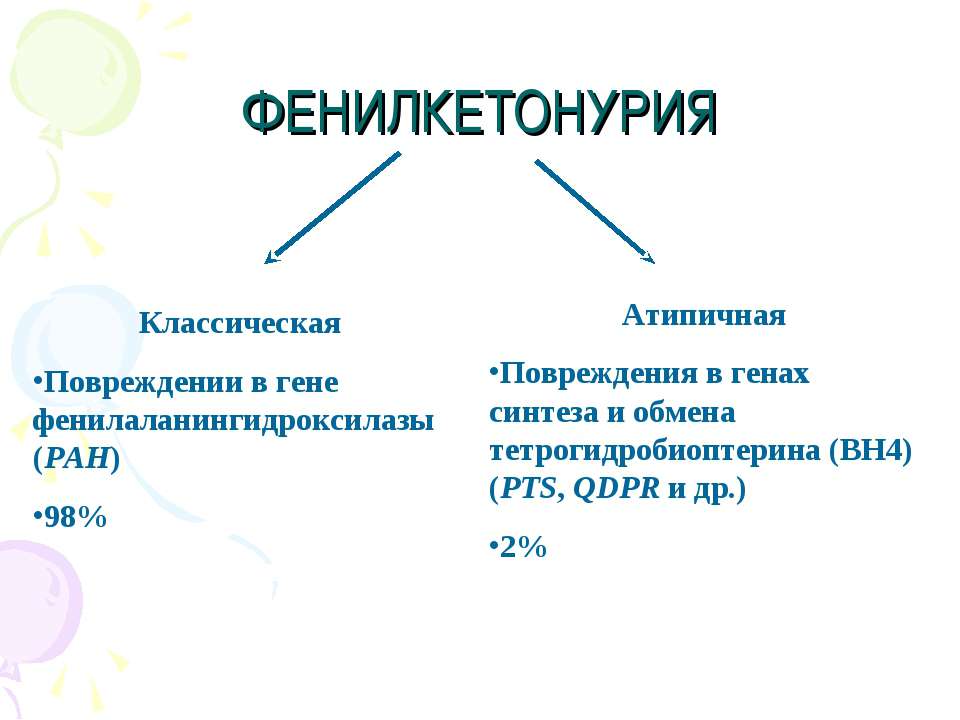
Фенилкетонурия — генетическая патология с аутосомно-рецессивным характером наследования. Чаще всего болезнь Феллинга возникает при мутации гена, который кодирует фермент фенилаланин-4-гидроксилазу и расположен на длинном плече хромосомы 12 (локус12q22-q24). Эта мутация является причиной фенилкетонурии I типа, которая встречается в 98 % всех случаев.
Существуют также атипичные формы заболевания. Это фенилкетонурия II и III типов. При схожей симптоматике они не поддаются коррекции посредством диетотерапии.
Патогенез фенилкетонурии
Дефицит фермента фенилалаиин-4-гидроксилазы лежит в основе классической формы заболевания, он приводит к нарушению окисления поступающего с пищей фенилаланина. Его концентрация в крови и спинномозговой жидкости значительно возрастает, а уровень тирозина падает. Это приводит к нарушению миелинизации нервных волокон, снижению образования нейромедиаторов и запускает патогенетические механизмы задержки умственного развития и вызывает прогредиентное слабоумие.
Манифестация болезни Феллинга происходит в возрасте 2–6 мес. Развиваются первые неспецифические симптомы: вялость, беспокойство и гипервозбудимость, мышечная дистония, срыгивание, судорожный синдром. Патогномоничным симптомом фенилкетонурии считается упорная рвота.
После 6 мес. наблюдается отставание ребенка в психомоторном развитии. Это проявляется как снижение активности, безучастность к окружающему, ребенок перестает узнавать родных, не делает попыток сесть или встать на ноги. Могут появляться шелушение кожи, экзема, дерматит, склеродермия.
Дети с фенилкетонурией, не получающие лечения, страдают от микроцефалии, прогнатии, позднего прорезывания зубов, гипоплазии эмали. Для них характерна задержка речевого развития, к трем–четырем годам развивается олигофрения с практически полным отсутствием речи.
Больные имеют диспластическое телосложение, отличаются светлой кожей, волосами и глазами. Верхние и нижние конечности согнуты в суставах (так называемая «поза портного»), походка шаткая, семенящая, может быть тремор рук, гиперкинезы.
Диагностика фенилкетонурии
Исследование на наличие болезни Феллинга входит в программу неонатального скрининга, который обязателен для всех новорожденных. Тест проводят на 3–5 днях жизни ребенка. При обнаружении гиперфенилаланинемии дают направление на генетическое исследование.
Для подтверждения наличия фенилкетонурии проводят:
Генетический дефект может быть обнаружен еще до рождения в рамках неинвазивного пренатального ДНК-теста Panorama или неинвазивного пренатального ДНК-скрининга, которые можно пройти в медико-генетическом центре «Геномед». После рождения ребенка можно провести поиск мутаций в гене РАН (в том числе расширенный), сделать «Скрининг на наследственные заболевания», панель «Наследственные нарушения обмена веществ».
Лечение, прогноз и профилактика фенилкетонурии
Основа терапии — соблюдение диеты с низким содержанием белков. Комплексное лечение может включать в себя прием витаминно-минеральных комплексов, ноотропных средств, антиконвульсантов, а также ЛФК, массаж, иглорефлексотерапию.
При раннем обнаружении фенилкетонурии и назначении элиминационной диеты прогноз благоприятный. Поздно начатая терапия имеет неблагоприятный прогноз по отношению к умственному развитию.
Профилактика фенилкетонурии включает в себя пренатальное генетическое исследование. Женщины с болезнью Феллинга должны тщательно соблюдать диету до начала и во время беременности.
Фенилкетонурия у детей и ее лечение
Фенилкетонурия (ФКУ) — генетическое заболевание, характеризующееся нарушениями обмена фенилаланина. Встречается с частотой 1 на 8000–15 000 новорожденных. Выделяют четыре формы ФКУ; существует свыше 400 различных мутаций и несколько метаболических фенотип
.jpg)
Определение, патогенез, классификация
Фенилкетонурия — наследственная аминоацидопатия, связанная с нарушением метаболизма фенилаланина, в результате мутационной блокады ферментов приводящая к стойкой хронической интоксикации и поражению ЦНС c выраженным снижением интеллекта и неврологическим дефицитом [1, 2].
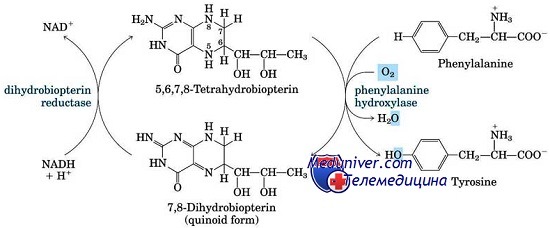
Основное значение в патогенезе классической ФКУ имеет неспособность фенилаланингидроксилазы перерабатывать фенилаланин до тирозина. В результате в организме накапливается фенилаланин и продукты его аномального обмена (фенилпировиноградная, фенилуксусная, фенилмолочная кислоты) [1–3].
В числе других патогенетических факторов рассматриваются нарушения аминокислотного транспорта через гематоэнцефалический барьер, нарушения церебрального пула аминокислот с последующим нарушением синтеза протеолипидных белков, нарушения миелинизации, низкие уровни нейротрансмиттеров (серотонин и др.) [1–4].
Фенилкетонурия I (классическая или тяжелая) — аутосомно-рецессивное заболевание, вызванное мутацией гена фенилаланингидроксилазы (длинное плечо хромосомы 12); выявлены 12 различных гаплотипов, из которых около 90% ФКУ ассоциировано с четырьмя гаплотипами. Наиболее частые мутации в гене фенилаланингидроксилазы: R408W, R261Q, IVS10 nt 546, Y414C. В основе болезни — дефицит фенилаланин-4-гидроксилазы, обеспечивающей конверсию фенилаланина в тирозин, что приводит к накоплению в тканях и физиологических жидкостях фенилаланина и его метаболитов [1–4].
Особую группу составляют атипичные варианты ФКУ, при которых клиническая картина напоминает классическую форму болезни, но по показателям развития, несмотря на проведение диетотерапии, не отмечается положительной динамики. Эти варианты ФКУ связаны с дефицитом тетрагидроптерина, дегидроптеринредуктазы, 6-пирувоилтетрагидроптеринсинтазы, гуанозин-5-трифосфатциклогидролазы и т. д. [1–4].
Фенилкетонурия II (атипичная) — аутосомно-рецессивное заболевание, при котором генный дефект локализуется в коротком плече хромосомы 4 (участок 4р15.3), характеризующееся недостаточностью дегидроптеринредуктазы, приводящей к нарушению восстановления активной формы тетрагидробиоптерина (кофактор в гидроксилировании фенилаланина, тирозина и триптофана) в сочетании со снижением в сыворотке крови и спинномозговой жидкости фолатов. Результатом являются метаболические блоки в механизмах превращения фенилаланина в тирозин, а также предшественников нейромедиаторов катехоламинового и серотонинового рядов (L-дофа, 5-окситриптофан). Болезнь описана в 1974 г. [1–4].
Фенилкетонурия III (атипичная) — аутосомно-рецессивное заболевание, связанное с недостаточностью 6-пирувоилтетрагидроптеринсинтазы, участвующей в процессе синтеза тетрагидробиоптерина из дигидронеоптеринтрифосфата (описано в 1978 г.). Дефицит тетрагидробиоптерина приводит к расстройствам, сходным с нарушениями при ФКУ II [1–4].
Примаптеринурия — атипичная ФКУ у детей с легкой гиперфенилаланинемией, у которых в моче в больших количествах присутствует примаптерин и некоторые его производные при наличии нормальной концентрации в спинномозговой жидкости нейромедиаторных метаболитов (гомованилиновой и 5-оксииндолуксусной кислот). Энзиматический дефект пока не выявлен [1–4].
Материнская ФКУ — заболевание, сопровождающееся снижением уровня интеллекта (до умственной отсталости) среди потомства женщин, страдающих ФКУ и не получающих специализированную диету в совершеннолетнем возрасте. Патогенез материнской ФКУ детально не изучен, но предполагается ведущая роль хронической интоксикации плода фенилаланином и продуктами его аномального метаболизма [1–4].
R. Koch и соавт. (2008) при аутопсии головного мозга младенца, у матери которого отмечалась ФКУ (без адекватного контроля за уровнем фенилаланина в крови), обнаружили ряд патологических изменений: низкий вес мозга, вентикуломегалию, гипоплазию белого вещества и задержку миелинизации (без признаков астроцитоза); хронических изменений в сером веществе головного мозга не было обнаружено. Предполагается, что нарушения в развитии белого вещества мозга ответственны за формирование неврологического дефицита при материнской ФКУ [5].
В практических целях в медико-генетических центрах РФ используется условная классификация ФКУ, основанная на уровнях содержания фенилаланина в сыворотке крови: классическая (тяжелая или типичная) — уровень фенилаланина выше 20 мг% (1200 мкмоль/л); средняя — 10,1–20 мг% (600–1200 мкмоль/л), а также уровень фенилаланина 8,1–10 мг%, если он устойчив на фоне физиологической нормы потребления белка в рационе питания; легкая (гиперфенилаланинемия, не требующая лечения) — уровень фенилаланина до 8 мг% (480 мкмоль/л) [2].
Клинические проявления и диагностика
При рождении дети с ФКУ I выглядят здоровыми, хотя чаще имеется специфический хабитус (светлые волосы, голубые глаза, суховатая кожа). При отсутствии своевременного выявления и лечения болезни в течение первых двух месяцев жизни у них появляется частая и интенсивная рвота и повышенная раздражительность. Между 4 и 9 месяцами становится очевидным выраженное отставание в психомоторном развитии [1–4].
Пациентов отличает специфический («мышиный») запах кожных покровов. Выраженные неврологические нарушения у них редки, но характерны черты гиперактивности и расстройств аутистического спектра. При отсутствии своевременного лечения уровень IQ составляет
В. М. Студеникин, доктор медицинских наук, профессор
Т. Э. Боровик, доктор медицинских наук, профессор
Т. В. Бушуева, кандидат медицинских наук
НЦЗД РАМН, Москва
Диагностика фенилкетонурии
Фенилкетонурия (ФКУ) ― наследственное нарушение метаболизма аминокислот, в первую очередь фенилаланина (ФА), входящего в состав белков. Вещество участвует в укладке белка и стабилизации белковых структур.
Первые симптомы: частое срыгивание, рвота, экземы, судороги, исходящий от мочи и кожи запах плесени. Ребенок может был вялым либо, наоборот, гиперактивным. Отстает в психомоторном развитии, наблюдаются признаки олигофрении. Диагноз может быть поставлен в родильном доме. Все дети с фенилкетонурией безусловно получают статус «ребенок-инвалид».
Лечение заболевания заключено в соблюдении специальной низкобелковой диете, не содержащей продукты с ФА.
Определение заболевания
Фенилкетонурия ― это врожденная, генетическая патология, подразумевающая нарушения гидроксилирования фенилаланина. Характеризуется накоплением в организме аминокислоты и продуктов ее метаболизма, что ведет к тяжелым поражениям центральной нервной системы. Впервые заболевание было описано норвежским врачом И. А. Феллингом в 1934 году.
Изучая болезнь специалисты установили, что за наличие болезни отвечает единственный ген фенилаланингидроксилазы. Первое успешное лечение было разработано и проведено в 1950 году в Англии.
В неонатальном периоде клиника отсутствует. Патология проявляется в первые полгода жизни ребенка. В дальнейшем накопление вещества приводит к тяжелым нарушениям развития. Поэтому крайне важно сразу после рождения выявить дефект и не допустить употребление продуктов, содержащих фенилаланин. Более позднее соблюдение диеты не устранит полученные нарушения, но не допустит развития новых.
Патология одинаково часто встречается среди лиц обоих полов. Расовых особенностей не выявлено. Большое количество больных в таких странах как Китай, Турция, Ирландия. В среднем по России с фенилкетонурией рождается каждый 7-ми тысячный ребенок.
Причины фенилкетонурии
Существует три типа генетического отклонения, первый считается классическим, поскольку диагностируется в более чем 90% случаев. Второй и третий ― более редкая форма патологии. Симптоматика схожа во всех типах, заболевание приводит к умственной отсталости. При классической форме фенилкетонурии избежать этого можно диетотерапией, но атипичные варианты, к сожалению, коррекции не подлежат.
Классическая фенилкетонурия (I тип) ― это низкая выработка фенилаланингидроксилазы (ФАГ), что приводит к собиранию в естественных жидкостях организма фенилаланина и продуктов его расщепления. Патология вызвана мутированным геном РАН.
Фенилкетонурия II типа ― недостаток дигидроптеридинредуктазы, что препятствует преобразованию фенилаланина в тирозин. Патология из-за мутации гена QDPR.
Фенилкетонурия III типа ― недостаток 6-пирувоилтетрагидроптеринсинтазы, нужной для синтеза тетрагидробиоптерина. Патология вызвана мутированным PTS-геном.
Все формы заболевания наследуются по аутосомно-рецессивной форме. Это означает, что генетический дефект может быть унаследован у одного из родителей. Половая принадлежность родителя и ребенка не играет роли.
Классификация
Фенилкетонурия в настоящее время не имеет общепризнанной мировой классификации. Над этим вопросом ведутся дебаты, наравне с изучением заболевания. Чуть ранее, до расшифровки генов, считалось, что степень поражения интеллектуальных способностей зависит от степени активности фермента. Поэтому текущая квалификация признана устаревшей. Не учитывает она и другие симптоматические факторы.
При диагностировании ставят:
I тип (дефицит ФАГ) ― концентрация ФА больше 20 мг/дл.
Средняя форма ФКУ ― ФА от 8,1 до 20 мг/дл.
Легкая форма ГФА-уровень ― ФА от 2,1 до 8,0 мг/дл.
При уровне до 8,0 мг/дл фенилкетонурию считают доброкачественной. Она не требует специального лечения, но необходимо наблюдение первый год жизни ребенка. Контролирует состояние врач-педиатр, невролог, генетик.
Выделяют также еще одну форму фенилкетонурии, не требующую коррекции. Это транзиторная форма ГФА в период новорожденности. Возникает, как правило, при недоношенности, что обусловлено функциональной незрелостью организма. Транзиторная фенилкетонурия ― это временное повышение ФА-уровня, способное подняться до критических значений. При этом клиника отсутствует либо проявления весьма незначительны. Через несколько месяцев биохимические показатели приходя в норму.
Патогенез
Механизм зарождения и развития фенилкетонурии связан с нарушением обмена органического соединения ― аминокислоты фенилаланина. Метаболический блок препятствует преобразованию фенилаланина в тирозин. Аминокислота не только не преобразуется, а накапливается в виде токсичных метаболитов:
фенилэтиламин и прочее.
Скопление фенил-веществ оказывает токсическое действие на ЦНС. В настоящий момент механизм еще до конца не изучен, врачам не известен патогенез дисфункции головного мозга.
Существуют предположения, что поражение нервной системы является результатом ряда факторов. Среди них как прямое токсического воздействие фенилаланина, так и нарушение обмена белков, липопротеидов и гликопротеидов, сбой гомонального метаболизмеа и мембранного транспорта аминокислот. Все это в комплексе имеет важное значение для созревания и правильного функционирования ЦНС.
Симптомы
I тип. Первые признаки у ребенка проявляются в возрасте от 2 месяцев до полугода.
Апатичность либо, наоборот, повышенная раздражительность.
Отсутствие интереса к окружению, людям, предметам, обстановке.
Нарушение мышечного тонуса.
Иногда развивается микроцефалия (малый размер черепа относительно других частей тела) и гидроцефалия (избыточная жидкость, омывающая головной мозг).
К характерным симптомам относятся гипопигментация кожи, волос, радужной оболочки глаз. Моча имеет специфический запах плесени или его еще называют «мышиным» запахом. Эпилептические припадки наблюдаются у половины больных, часто является первым выраженным клиническим симптомом. Приступ характеризуется «салаамовыми» судорогами, напоминающими кивки. Они случаются часто, плохо поддаются антиконвульсантному лечению.
Если не корректировать концентрацию ФА, болезнь прогрессирует. Как правило, уровень IQ у таких детей не превышает 20, при норме от 85. Умственная отсталость настолько сильная, что отсутствуют эмоциональные реакции, наблюдаются психопатии и шизофреноподобные расстройства.
II тип. Первая симптоматика проявляется на первом году жизни.
Сниженное артериальное давление.
Частое повышение температуры тела.
Сухожильная гиперрефлексия (повышение рефлексов) или спастический тетрапарез (обессиливание всех четырех конечностей).
Миоклоническая эпилепсия (генерализованные приступы, преимущественно возникающие после пробуждения).
III тип. Симптомы дефицита пирувоилтетрагидроптеринсинтетазы схож с проявлениями болезни Паркинсона:
Постуральная нестабильность и трудности походки. Сложно либо невозможно поддерживать определенное положение всего тела или конечностей.
Гипокинезия (низкая двигательная активность, ограниченный темп и объем движений).
Гиперсаливация (повышенное слюноотделение).
Окулогирные кризы (симметричное отклонение обоих глаз, обычно направленное вверх).
В 80% случаев этот тип заболевания сопровождается снижением количества биогенных аминов в ликворе. Лечение затруднено тем, что раннее снижение концентрации ФА может вызвать серьезные патологические изменения. Несоблюдение диетотерапии приведет к замедлению развития речи, низкому интеллекту, проблемам с памятью.
Диагностика
Выявить фенилкетонурию можно в первые дни после рождения до появления какой-либо симптоматики. Для определение концентрации фениламина в крови проводят:
Во всех случаях биологическим материалом выступают сухие пятна капиллярной крови младенца.
Если скрининг-тест показал высокие результаты уровня ФА, дополнительно может быть назначено:
Фенилаланин-нагрузочная диагностика для выявления нозологической формы заболевания.
Молекулярно-генетический анализ для установления формы: классическая, II или III тип.
Секвенирование гена РАН, если молекулярно-генетическая диагностика дала отрицательный результат по гену ФАГ.
Анализ на птерины в урине для исключения птерин-зависимых форм.
Дифференциальное диагностирование фенилкетонурии проводят с такими патологиями, как нарушение функции печени, галактоземия и с другими заболеваниями.
Лечение
Симптоматическая терапия при любой формой фенилкетонурии неэффективна. Существует только один способ предотвратить негативные последствия заболевания ― диетотерапия. Из рациона исключают высокобелковые и содержащие фенилаланин продукты. Недостающее количество белка восполняют специализированным лечебным питанием, с максимально низким содержанием аминокислоты ФА или полностью ее лишенным. Следует учитывать, что эффективность терапии напрямую зависит от времени начала коррекции и уже произошедших патологических изменений.
Цель лечебного питания при классической форме заболевания ― это предотвращение развития нарушений ЦНС, физического и умственного развития. Легкая форма ГФА допускает расширение диеты под строгим наблюдением врача за состоянием ребенка и биохимическими показателями. Под запретом: мясо, рыба, орехи, шоколад и бобовые, все виды яиц, творог и сыры. Также следует исключить продукты, содержащие искусственный подсластитель аспартам.
Критерий эффективности лечения ― уровень ФА в крови.
Прогноз и профилактика
Проведения массового скрининга в родильных домах позволяет своевременно выявить генетическое отклонение. Вовремя начать соблюдение диетотерапии и, как следствие, предотвратить тяжелые последствия. В противном случае прогноз в отношении умственного развития неблагоприятный.
Классическая ФКУ имеет благоприятный прогноз если диагностирована в первые недели жизни ребенка и соблюдаются все требования врачей. Такие дети ходят в обычные школы, способны получить высшее образовании и вести нормальный образ жизни.
Во время подготовки к беременности пара должна пройти предварительное генетическое тестирование на наличие мутаций в гене РАН. Если у одного из родителей есть дефектный ген, шанс родить ребенка с ФКУ 1:4 и 100% если оба родителя больны.
Женщины с установленной фенилкетонурией при беременности и грудном вскармливании должны соблюдать строгую диету. Высокая концентрация аминокислоты в крови и околоплодных водах оказывает серьезное тератогенное воздействие на плод.
Преимущества АО «СЗЦДМ»
Сдать анализ на уровень ФА можно в подразделениях АО «СЗЦДМ» Здесь вас ждет:
квалифицированных и доброжелательный персонал;
новейшее оборудование, отправка результатов исследований по эл. почте;
несколько вариантов получения данных анализов;
удобное расположение терминалов;
отсутствие очередей, условия конфиденциальности.
Лаборатории находятся в Санкт-Петербурге и других города Ленинградской области, а также в Великом Новгороде, Новгородской обл., Пскове, Калининграде.
Лаборатория АО «СЗЦДМ» предлагает услуги, обеспечивающие комплексное и преемственное лабораторное обследование пациента
Диагностика В медицинских центрах АО «СЗЦДМ» проводят качественные диагностические исследования всего организма
Лечение Наши медицинские центры ориентированы на обслуживание пациентов в амбулаторном режиме и объединены единым подходом к обследованию и лечению пациентов.