фенол какие свойства проявляет кислотные или основные
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
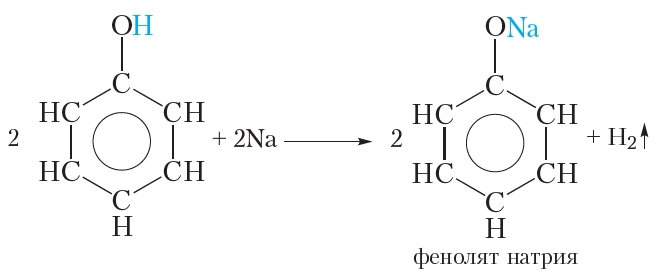
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
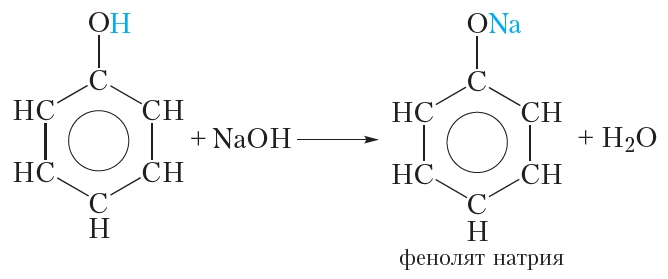
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
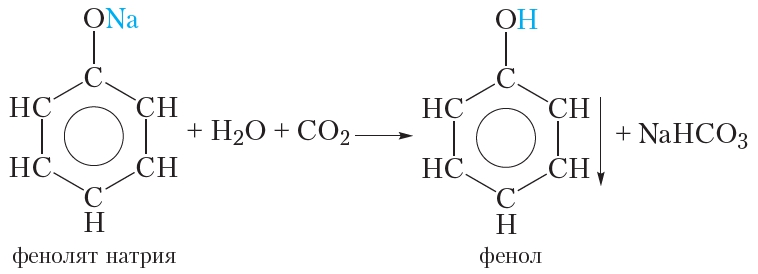
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
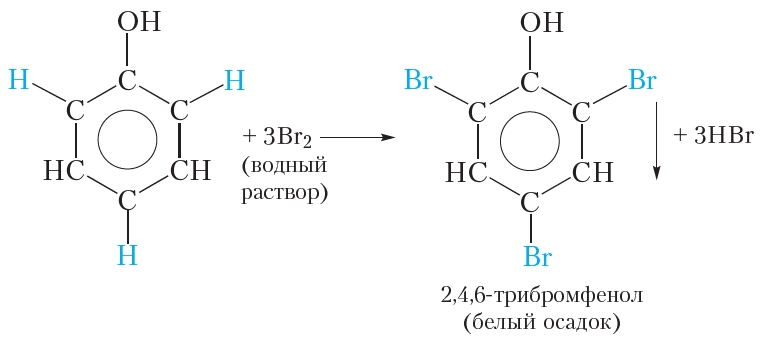
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
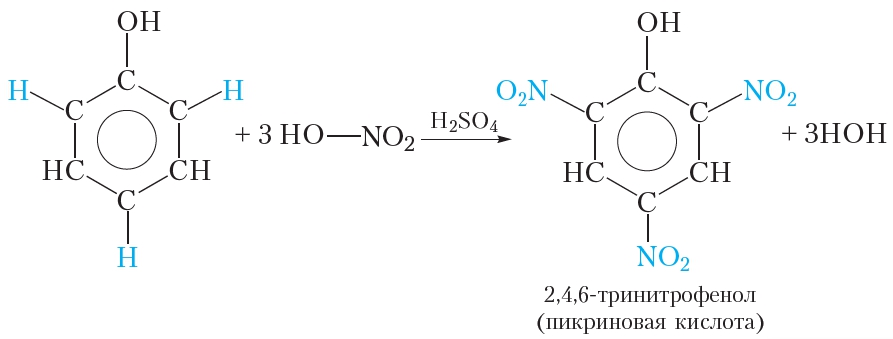
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Фенолы — номенклатура, получение, химические свойства
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Химия. 10 класс
§ 28. Химические свойства, получение и применение фенола
Химические свойства фенола
В молекуле фенола имеется гидроксильная группа, следовательно, можно ожидать, что фенол будет проявлять химические свойства, присущие спиртам. В то же время из-за влияния бензольного кольца на гидроксильную группу некоторые свойства фенола отличаются от химических свойств спиртов.
1. Взаимодействие со щелочными металлами
Подобно спиртам, фенол реагирует со щелочными металлами. Если в расплавленный фенол пометить кусочек металлического натрия, наблюдается выделение водорода (температура плавления фенола невысока и составляет всего 41 °С). В ходе реакции атом водорода гидроксильной группы замещается на атом натрия:
В результате образуется фенолят натрия. Феноляты, подобно алкоголятам, представляют собой твёрдые солеподобные вещества.
Реакция фенола со щелочными металлами свидетельствует о том, что фенол, как и спирты, проявляет слабые кислотные свойства.
2. Взаимодействие со щелочами (отличие фенола от спиртов)
Кислотные свойства фенола выражены сильнее, чем у спиртов. Это проявляется в том, что, в отличие от спиртов, фенол взаимодействует со щелочами:
Образующийся фенолят натрия хорошо растворяется в воде. Таким образом фенол умеренно растворим в воде, но хорошо растворяется в растворе гидроксида натрия, так как при этом образуется растворимый фенолят натрия. Усиление кислотных свойств фенола по сравнению со спиртами обусловлено влиянием бензольного кольца, которое приводит к уменьшению прочности связи О—Н. В результате атом водорода гидроксильной группы молекулы фенола может замещаться на атом металла не только при взаимодействии со щелочными металлами, но и со щелочами.
По кислотным свойствам фенол превосходит не только спирты, но и воду. Поэтому феноляты, в отличие от алкоголятов, не разлагаются водой. Наличие у фенола кислотных свойств отражает его тривиальное название — карболовая кислота.
Тем не менее фенол — очень слабая кислота. Даже угольная кислота сильнее фенола и поэтому вытесняет его из фенолята натрия:
Эту реакцию можно осуществить следующим образом. Через раствор фенолята натрия пропускают углекислый газ, при этом наблюдается помутнение раствора, так как образующийся фенол выпадает в осадок.
3. Взаимодействие с бромной водой (отличие фенола от бензола)
В молекуле фенола содержится бензольное кольцо, следовательно, можно ожидать, что фенол будет проявлять химические свойства, присущие ароматическим углеводородам, например бензолу. Как вы уже знаете, для бензола характерны реакции замещения атомов водорода. Так, бензол в присутствии катализатора реагирует с бромом. При этом протекает реакция замещения одного атома водорода на бром:
Бромную воду бензол не обесцвечивает!
В молекуле фенола гидроксильная группа влияет на свойства бензольного кольца, облегчая замещение атомов водорода, поэтому взаимодействие фенола с бромом легко протекает и без катализатора. Так, при смешивании разбавленного раствора фенола с бромной водой наблюдается обесцвечивание бромной воды и выпадение белого осадка. Уравнение протекающей реакции:
В результате реакции происходит замещение трёх атомов водорода бензольного кольца атомами брома и образуется 2,4,6-трибромфенол. Отметим, что замещение атома водорода бензольного кольца атомом брома возможно и для бензола, но условия протекания реакции гораздо более жёсткие, чем для фенола. Для этого требуется бром, а не бромная вода, а также катализатор. Бромирование фенола протекает в мягких условиях, что свидетельствует о повышенной реакционной способности бензольного кольца фенола. Это обусловлено влиянием гидроксильной группы, которая облегчает замещение атомов водорода в положениях 2, 4, 6 бензольного кольца молекулы фенола.
4. Взаимодействие с азотной кислотой
При взаимодействии фенола со смесью концентрированных азотной и серной кислот можно заместить три атома водорода бензольного кольца на группы —NO2:
В результате реакции образуется 2,4,6-тринитрофенол. Кислотные свойства 2,4,6-тринитрофенола выражены значительно сильнее, чем у фенола. Тривиальное название 2,4,6-тринитрофенола — пикриновая кислота. Пикриновая кислота и её соли являются взрывчатыми веществами.
Рассмотренные химические свойства фенола демонстрируют взаимное влияние атомов в молекулах органических соединений: бензольное кольцо усиливает кислотность гидроксильной группы молекулы фенола, в свою очередь, гидроксильная группа влияет на бензольное кольцо, облегчая замещение атомов водорода в положениях 2, 4, 6.
фенол, физические, химические свойства и применение фенола
Фенол (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Получение, производство фенола
В настоящее время производство фенола в промышленном масштабе осуществляется следующими способами способами:
Кумольный метод получение фенола
Кумольный метод. Этим способом получают более 95 % всего производимого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
Окисление толуола, с промежуточным образованием бензойной кислоты
Около 3 % всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты.
Весь остальной фенол выделяют из каменноугольной смолы.
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Физические свойства
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства
Из-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.
По гидроксильной группе:
Обладает слабыми кислотными свойствами (более сильными, чем у спиртов), при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa):
Фенол — очень слабая кислота; даже угольная кислота вытесняет его из фенолятов:
Более интенсивно феноляты разлагаются под действием сильных кислот, например, серной:
Взаимодействие с металлическим натрием:
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
Образование простых эфиров.
Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
Во втором случае получают чисто-ароматические простые эфиры:
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом:
По ароматическому кольцу:
Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
Взаимодействие с бромной водой (качественная реакция на фенол):
образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
Реакция присоединения
Гидрированием фенола в присутствии металлических катализаторов получают циклогексанол и циклогексанон:
Вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Биологическая роль и значение
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
Ммировое потребление фенола имеет следующую структуру (данные 2006 г.):
44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных смол;
12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
в России большое количество фенола используется в нефтепереработке, в частности для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу;
остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство.
Фенол и его производные обусловливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт» и «Фукорцин». В косметологии как химический пилинг (токсично).
в скотоводстве: дезинфекция животных растворами фенола и его производных.
в косметологии для проведения глубокого пилинга.
Токсические свойства
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Предельно допустимые концентрации (ПДК) фенола:
Фенольная катастрофа в Уфе
Наглядный пример воздействия фенола на окружающую среду был продемонстрирован весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз.
Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Было оповещено население Уфы об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек