формирует внутрисуставные диски и мениски какой хрящ
Коленный сустав
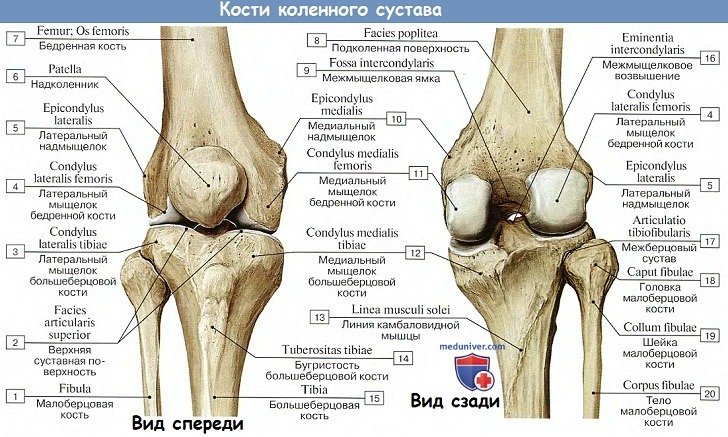
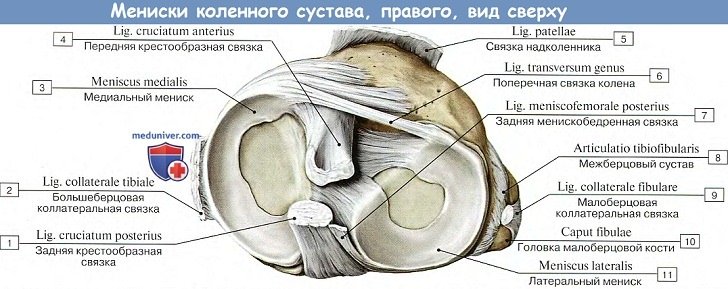
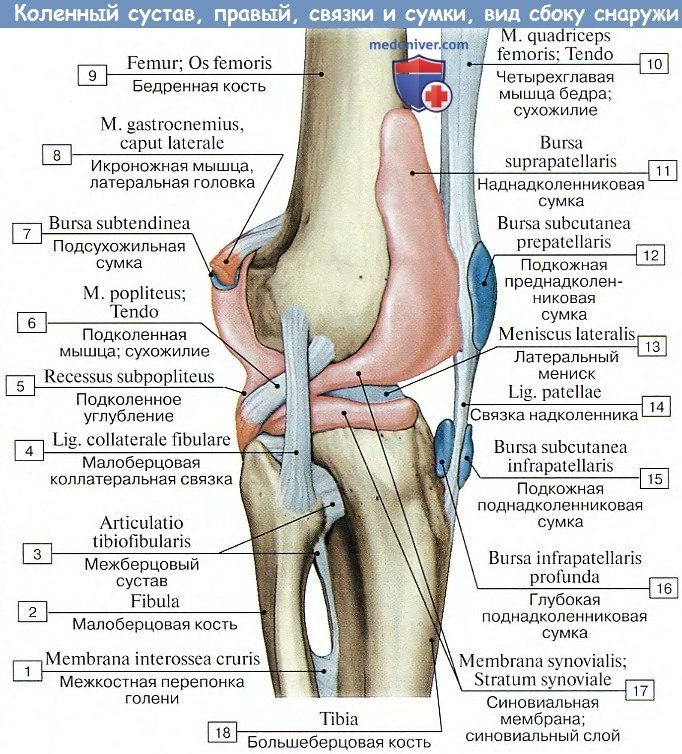
В его образовании принимают участие: дистальный конец бедренной кости, проксимальный конец большеберцовой кости и надколенник. Суставные поверхности мыщелков бедра, сочленяющиеся с tibia, выпуклы в поперечном и сагиттальном направлении и представляют отрезки эллипсоида. Facies articularis superior большеберцовой кости, сочленяющаяся с мыщелками бедренной кости, состоит из двух слабовогнутых, покрытых гиалиновым хрящом суставных площадок; последние дополняются посредством двух внутрисуставных хрящей, или менисков, meniscus lateralis et medialis, лежащих между мыщелками бедренной кости и суставными поверхностями большеберцовой кости.
Каждый мениск представляет трехгранную, согнутую по краю пластинку, периферический утолщенный край которой сращен с суставной капсулой, а обращенный внутрь сустава заостренный край свободен. Латеральный мениск более согнут, чем медиальный; последний по своей форме скорее напоминает полулуние, тогда как латеральный приближается к кругу. Концы обоих менисков прикрепляются спереди и сзади к eminentia intercondylaris. Спереди между обоими менисками протягивается фиброзный пучок, называемый lig. transversum genus.
Суставная капсула прикрепляется несколько отступя от краев суставных поверхностей бедра, большеберцовой кости и надколенника.
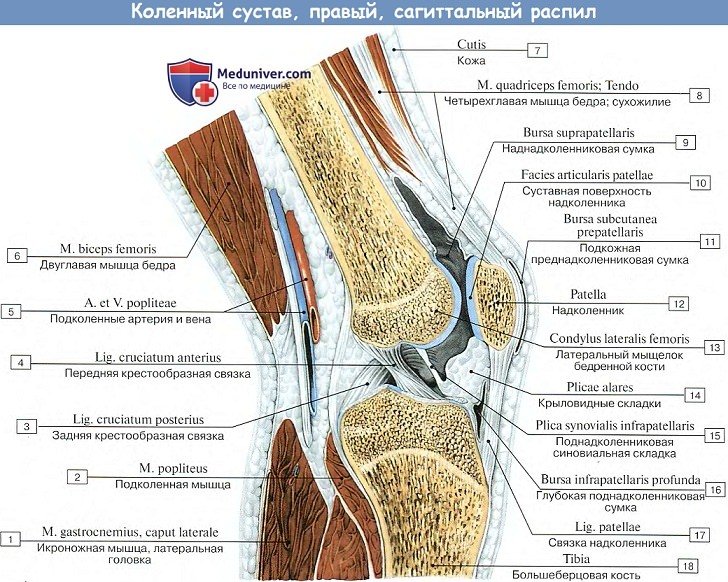
Поэтому на бедре она спереди поднимается вверх, обходя facies patellaris, по бокам идет между мыщелками и надмыщелками, оставляя последние вне капсулы, для прикрепления мышц и связок, а сзади опускается до краев суставных поверхностей мыщелков. Кроме того, спереди синовиальная оболочка образует большой заворот, bursa suprapatellaris, высоко простирающийся между бедренной костью и четырехглавой мышцей бедра. Иногда bursa suprapatellaris может быть замкнутой и обособленной от полости коленного сустава.
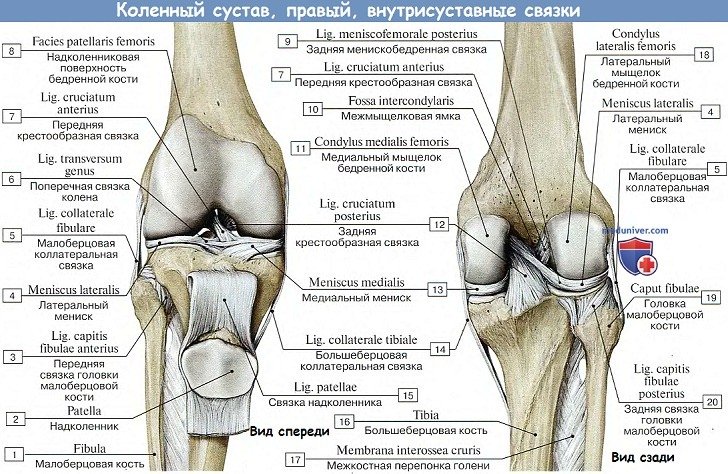
На большеберцовой кости капсула прикрепляется по краю суставных поверхностей мыщелков. На надколеннике она прирастает к краям хрящевой его поверхности, вследствие чего он оказывается как бы вставленным в передний отдел капсулы, как в рамку. По бокам сустава находятся коллатеральные связки, идущие перпендикулярно фронтальной оси: с медиальной стороны, lig. collaterale tibiale (от epicondylus medialis бедра до края tibiae, срастаясь с капсулой и медиальным мениском), и с латеральной стороны, lig. collaterale fibulare (от epicondylus lateralis до головки fibulae).
На задней стороне капсулы коленного сустава находятся две связки, вплетающиеся в заднюю стенку капсулы — lig. popliteum arcuatum и lig. popliteum obliquum (один из 3 конечных пучков сухожилия m. semimembranosi).
На передней стороне коленного сочленения располагается сухожилие четерехглавой мышцы бедра, которое охватывает patella, как сесамовидную кость, и затем продолжается в толстую и крепкую связку, lig.patellae, которая идет от верхушки надколенника вниз и прикрепляется к tuberositas tibiae.
По бокам patella боковые расширения сухожилия четырехглавой мышцы образуют так называемые retinacula patellae (laterale et mediate), состоящие из вертикальных и горизонтальных пучков; вертикальные пучки прикрепляются к мыщелкам tibiae, а горизонтальные — к обоим epicodyli бедренной кости. Эти пучки удерживают надколенник в его положении во время движения.
Кроме описанных внесуставных связок, коленный сустав имеет две внутрисуставные связки, называемые крестообразными, ligg. cruciata genus. Одна из них — передняя, lig. cruciatum anterius, соединяет внутреннюю поверхность латерального мыщелка бедренной кости с area intercondylaris anterior tibiae. Другая — задняя, lig. cruciatum posterius, идет от внутренней поверхности медиального мыщелка бедренной кости к area intercondylaris posterior большеберцовой кости.
Выстилающая изнутри капсулу синовиальная оболочка покрывает вдающиеся в сустав крестообразные связки и образует на передней стенке сустава ниже надколенника две содержащие жир складки, plicae alares, которые приспособляются при каждом положении колена к суставным поверхностям, заполняя промежутки между ними.
Крестообразные связки делят полость сустава на переднюю и заднюю части, препятствуя в случае воспаления до определенного времени проникновению гноя из одной части в другую.
По соседству с суставом залегает ряд синовиальных сумок; некоторые из них сообщаются с суставом. На передней поверхности надколенника встречаются сумки, число которых может доходить до трех: под кожей — bursa prepatellaris subcutanea, глубже под фасцией — bursa subfascialis prepatellaris, наконец, под апоневротическим растяжением m. quadricipitis — bursa subtendinea prepatellaris. У места нижнего прикрепления lig. patellae, между этой связкой и большеберцовой костью, заложена постоянная, не сообщающаяся с суставом синовиальная сумка, bursa infrapatellaris profunda.
В задней области сустава сумки встречаются под местами прикрепления почти всех мышц.
В коленном суставе возможны движения: сгибание, разгибание, вращение. По своему характеру он представляет собой мыщелковый сустав. При разгибании мениски сжимаются, ligg. collateralia et cruciata сильно натягиваются, и голень вместе с бедром превращается в одно неподвижное целое. При сгибании мениски расправляются, a ligg. collateralia благодаря сближению их точек прикрепления расслабляются, вследствие чего при согнутом колене появляется возможность вращения вокруг вертикальной оси. При вращении голени внутрь крестообразные связки затормаживают движение. При вращении кнаружи крестообразные связки, наоборот, расслабляются. Ограничение движения в этом случае происходит за счет боковых связок.
Устройство и расположение связок коленного сустава у человека способствует длительному пребыванию его в вертикальном положении. (У обезьян же связки коленного сустава, наоборот, затрудняют вертикальное положение и облегчают сидение «на корточках»).
Кровоснабжение коленного сустава
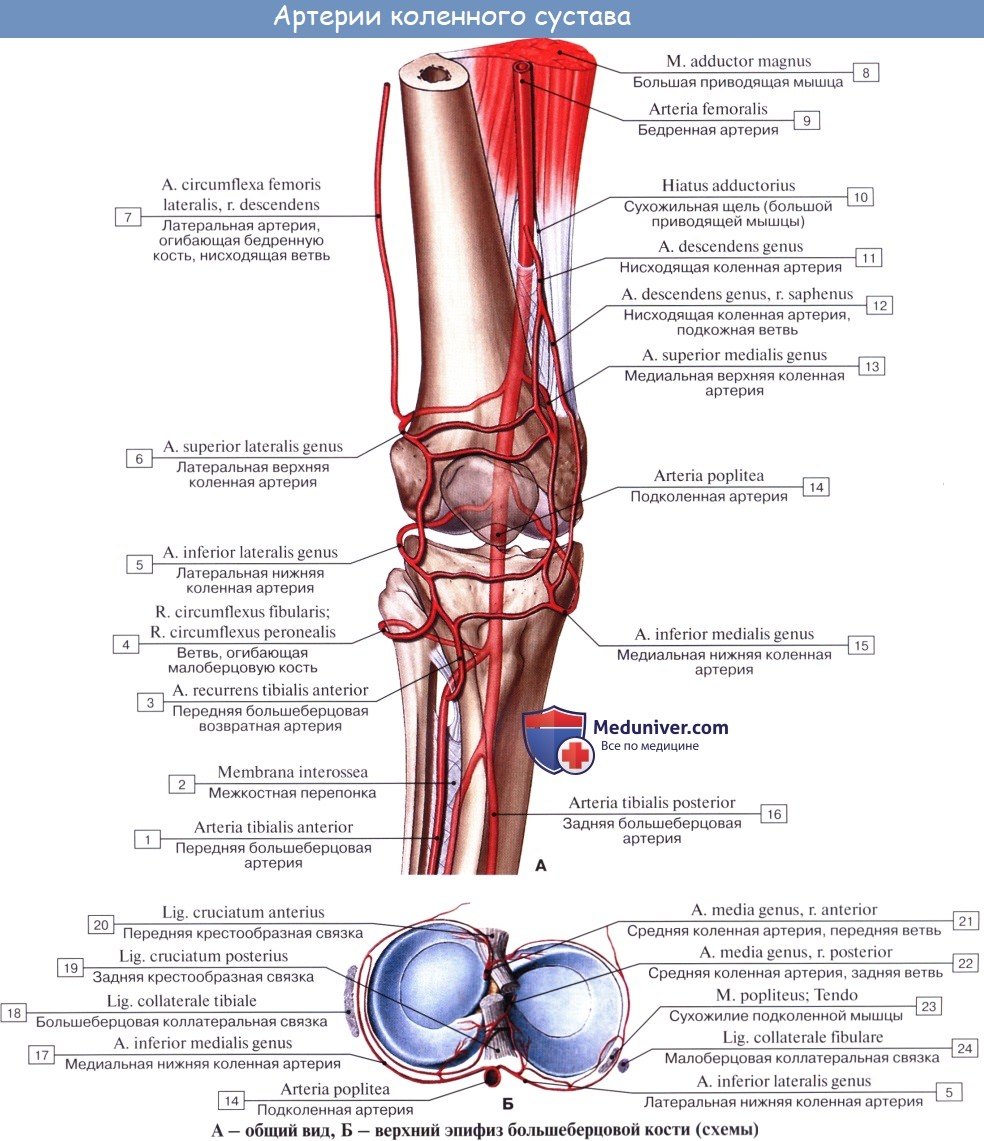
Коленный сустав получает питание из rete articulare, которая образована аа. genus superiores medialis et lateralis, aa. genus ihferiores medialis et lateralis, a. genus media (из a. poplitea), a. geniis descendens (из a. femoralis), aa. recurrentes tibiales anterior et posterior (из a. tibialis anterior). Венозный отток происходит по одноименным венам в глубокие вены нижней конечности — vv. tibiales anteriores, v. poplitea, v. femoralis. Отток лимфы происходит по глубоким лимфатическим сосудам в nodi lymphatici poplitei. Иннервируется капсула сустава из nn. tibialis et peroneus communis.
Учебное видео по кровоснабжению коленного сустава находится: Здесь.
Учебное видео анатомии коленного сустава
Редактор: Искандер Милевски. Дата последнего обновления публикации: 23.07.2021
Коленный сустав: как устроен и почему болит
Боли в колене – самая частая причина обращения к ортопеду-ревматологу. Этот сустав поражается чаще остальных, поскольку ежедневно выдерживает колоссальную нагрузку. Он принадлежит к одним из самых сложных в организме человека. Как устроен коленный сустав и в чем причина болевого синдрома в нем?
Строение коленного сустава в двух словах
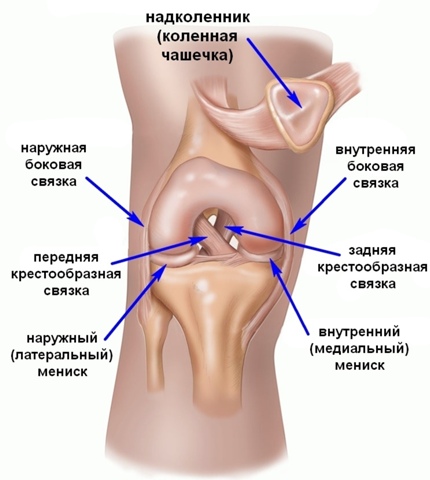
Коленный сустав состоит из двух костей – бедренной и большеберцовой. Между костями находятся две соединительные связки, расположенные относительно друг друга крест-накрест. Их называют передняя и задняя. С наружной и внутренней сторон есть две боковые связки (по-научному внутренняя медиальная и наружная латеральная). Связки – это прочные эластичные волокна, задача которых – направлять движение сустава и тормозить его в определенных позициях. Они не имеют ничего общего с сухожилиями.
Связки представляют собой эластичные волокна между костями, а сухожилия соединяют кости с мышцами. Это две совершенно разные субстанции. Мышцы постепенно переходят в сухожилия, которые крепятся к костям. Сгибая или разгибая ногу, человек управляет мышцами, которые через сухожилия тянут за собой кости.
Связки и сухожилия – разные субстанции: не путать!
Хрящи, суставная сумка, синовиальная жидкость…
В месте, где кости соединяются между собой, их головки покрыты хрящом, который защищает их от трения и ударов. Внутри сустава есть два мениска, напоминающих по форме полумесяцы. Они нужны в качестве дополнительной защиты хрящей и костей от механических воздействий.
Хрящи и мениски находятся в так называемой суставной сумке, внутри которой расположена синовиальная жидкость. По аналогии с маслом она смазывает все поверхности сустава и предотвращает их трение. Это справедливо, если синовиальной жидкости достаточно и ее вязкость соответствует нормальной.
Спереди сустава находится надколенник, или коленная чашечка. Ее удерживают связки и сухожилия, а внутри – покрывает хрящ. Надколенник – это своеобразный щит, который защищает внутренние составляющие коленного сустава от повреждения.
Так выглядит коленный сустав изнутри
Как устроен коленный сустав? Наглядная демонстрация с детальными пояснениями:
Что может болеть в суставе
Нервных окончаний в хрящах и менисках нет, поэтому болеть они не могут. По сути, в суставе нет ничего, что могло бы болеть в привычном понимании. Нервы подходят не к костям, а к надкостницам – тонким оболочкам, покрывающим кость снаружи. Поэтому человек испытывает боль при повреждении кости. Что же происходит, если перелома нет?
При отсутствии перелома источником болевого синдрома могут быть связки, окружающие коленный сустав и удерживающие внутри мениски. Кроме того, нервные окончания подходят к суставной сумке, которая также может вызывать боль.
Хрящи не болят: нервных окончаний в них нет
При механической травме происходит следующее:
Спустя какое-то время мелкие связки заживают, отек спадает, жидкость снова начинает циркулировать – боль исчезает. Так происходит, если повреждены только мелкие связки, а крупные и мениск остались целы. При повреждении мениска ситуация развивается иначе, поскольку человек не испытывает боли, а структура продолжает нарушаться.
Со временем мениск повреждается еще больше, хрящи вокруг него также деформируются, оказавшись в неблагоприятных условиях. Их поверхность постепенно истирается, что приводит к трению костей, раздражению нервных окончаний в надкостнице и как следствие – к боли. Именно так развивается артроз коленного сустава – заболевание, которое редко диагностируют на ранней стадии.
Когда человеку назначают лечение артроза или остеоартроза, состояние суставов у него уже оставляет желать лучшего. Почти наверняка в суставной сумке недостаточно синовиальной жидкости, а в условиях дефицита смазки хрящи быстро иссушиваются, трескаются и истираются. Исправить ситуацию можно внутрисуставными инъекциями заменителя синовиальной жидкости «Нолтрекс».
«Нолтрекс» – как недостающий кирпичик в строительстве дома
Препарат вводится внутрь суставной сумки и равномерно распределяется по хрящевым поверхностям. Из-за высокой молекулярной массы он не проникает внутрь, а задерживается там, выполняя функцию смазки. Noltrex не имеет в составе белков животного происхождения, поэтому не вызывает аллергии и не распознается иммунными клетками организма. Нескольких инъекций достаточно, чтобы восстановить физиологические особенности сустава на год, полтора или даже два, а значит, избавить человека от боли.
Формирует внутрисуставные диски и мениски какой хрящ
Различают непрерывные (синостозы, синхондрозы и синдесмозы) и прерывные (диартрозы) соединения костей. Синостозы — это неподвижные плотные соединения, осуществляемые за счет костной ткани (кости таза). Синхондрозы — соединения костей при помощи хряща (например, межпозвонковые диски). Синдесмозы — фиброзные соединения. К ним относятся связки, межкостные перепонки и швы. Прерывные соединения (диартрозы) называют синовиальными соединениями, или суставами.
В суставе различают суставные поверхности сочленяющихся костей, суставную сумку и суставную полость. Суставные поверхности костей покрыты слоем гиалинового хряща, который не имет надхрящницы. Суставная капсула состоит из наружного фиброзного слоя и внутренней синовиальной оболочки. Фиброзный слой капсулы представлен плотной волокнистой соединительной тканью.
Соединение надкостницы одной из сочленяющихся костей с надкостницей другой осуществляется переплетающимися пучками коллагеновых и эластических волокон, направленных вдоль продольной оси сустава.
Синовиальная оболочка состоит из поверхностного и глубокого волокнистых коллагеново-эластических слоев, содержащих сосуды и нервные волокна, и покровного слоя, выстилающего суставную полость. Покровный слой представлен синовиальным эндотелием. Он состоит из синовиоцитов — специализированных клеток фибробластического ряда.
Различают макрофагоподобные (фагоцитарные) синовиоциты и синовиальные фибробласты (или секреторные синовиоциты). Макрофагоподобные синовиоциты (антигенпредставляющие клетки) очищают содержимое синовиальной полости от продуктов распада. Секреторные синовиоциты вырабатывают синовию — липкую прозрачную жидкость, содержащую гиалуроновую кислоту. Синовия выполняет роль смазки, уменьшающей трение сочленяющихся в суставе костей.
Суставная полость представляет собой герметически закрытое щелевидное пространство, заполненное синовиальной жидкостью. Среди добавочных образований суставов различают складки синовиальной оболочки, внутрисуставные хрящи (диски, мениски) и связки.
Хрящи
Хрящи могут быть представлены гиалиновой (суставные поверхности костей, хрящи гортани и бронхов), эластической (ушная раковина, надгортанник) или волокнистой (межпозвонковые и суставные диски) тканями. На поверхности хряща располагается волокнистая соединительная ткань — надхрящница, в составе которой проходят сосуды и нервы, а также находятся малодифференцированные хондрогенные клетки, составляющие камбий.
За счет деления этих клеток происходит рост хряща путем наложения (аппозиционный). Внутренний (интерстициальный) рост осуществляется путем деления хондробластов. В центре хряща располагаются изогенные группы хондроцитов, которые утратили способность делиться. В хряще нет сосудов, и питание его происходит диффузно. С возрастом могут возникнуть гибель хондроцитов и отложение солей кальция. Хрящ применяется с целью трансплантации, в нем нет сосудов с кровью и он не подвергается быстрому отторжению из-за несовместимости тканей.
Регенерация хряща происходит за счет деления камбиальных клеток надхрящницы и синтеза межклеточного вещества хондробластами.
Анатомия коленного сустава
Коленный сустав, будучи одним из самых сложных суставов в человеческом теле, очень часто подвергается повреждениям, затрагивающим как костную структуру, так и капсульно-связочный аппарат.
Коленный сустав сформирован мыщелками бедра с эксцентричной кривизной, а также суставными поверхностями надколенника и большеберцовой кости. Суставные поверхности мыщелков, относящихся к большеберцовой кости, между собой разделены межмыщелковым возвышением с задними и передними бугорками, в которых прикрепляются мениски и крестообразные связки.
Мениски, образованные волокнистым хрящом, повышают степень вогнутости большеберцовой кости. Медиальный мениск имеет полулунную форму, а латеральный – кольцевидную. Латеральный мениск несколько шире, чем мениск медиальный. Его передний рог прикреплен к наружной части медиального межмыщелкового возвышения и передней крестообразной связки (ПКС), а задний рог крепится непосредственно к латеральному межмыщелковому возвышению. Важно знать, что медиальный мениск – полукруг, больший по размеру, чем мениск латеральный. Узкий передний рог данного мениска прикрепляется к медиальному возвышению, находящемуся перед ПКС, а более широкий задний рог крепится к латеральному возвышению впереди задней крестообразной связки (ЗКС), а также кзади от заднего рога латерального мениска. Тем временим, передние рога менисков отделяет ПКС, задние – прикреплены в положении рядом. Наружный край медиального мениска очень прочно сращен с суставной капсулой. Малая подвижность мениска, связанная с этим, предопределяет частое возникновение его разрывов. Латеральный мениск на протяжении 1-1,5 см в наружном отделе отделяется посредством сухожилия подколенной мышцы от капсулы сустава, что обеспечивает большую его подвижность, за счет чего и предохраняет мениск от травм.
Менискам свойственны следующие функции:
На 70% ПКС образована переднемедиальным и заднелатеральным пучками. Данная связка отвечает за ограничение передней нестабильности. В процессе ротации голени кнаружи она расслаблена, в то время как при ротации внутрь данная связка напряжена. ЗКС образована переднелатеральным и заднемедиальным пучками. Напряжение в переднелатеральном пучке возрастает от разгибания к сгибанию (тем самым, ограничивая заднее смещение), а напряжение в заднемедиальном пучке увеличивается от сгибания к разгибанию (то есть ограничивает переразгибание). Во время ротации голени кнаружи передние пучки являются расслаблеными, в то время как задние пучки всегда напряжены. Задняя крестообразная связка не дает голени смешаться назад и препятствует ее переразгибанию.
Кроме указанных связок сустав колена окружен мощнейшим капсульно-связочным аппаратом, который обеспечивает стабильность, а также движения в суставе.
По своим биомеханическим показателям коленный сустав является наиболее сложным и крупным вращательно-блоковидным сочленением. В данном суставе могут осуществляться следующие три типа движений: сдвиг, качение и скольжение.
За счет такого сложного строения сустав колена обеспечивает стабильность, а также устойчивость при ходьбе, стоянии, беге, прыжках, то есть при любых физических или спортивных нагрузках.
Строение синовиальных суставов
Международные названия
Содержание
Современные представления о строении и функции синовиальных суставов
ОА — заболевание синовиальных суставов (диартрозов). Основные функции диартрозов — двигательная (перемещение составляющих сустав элементов по определенным осям) и опорная (нагрузка при стоянии, ходьбе, прыжке). Синовиальный сустав состоит из сочленяющихся костных поверхностей, покрытых хрящом, суставной полости, содержащей синовиальную жидкость, и суставной капсулы. Непостоянными анатомическими элементами диартроза являются связки, расположенные снаружи или, реже, внутри сочленения, и хрящевые мениски.
По форме сочленяющихся костных поверхностей диартрозы разделяют на следующие виды (Насонова В.А., Бунчук Н.В., 1997):
Сустав окружен фиброзной капсулой, прикрепляющейся к кости вблизи периферии суставного хряща и переходящей в надкостницу. Капсула синовиального сустава состоит из двух слоев — наружного фиброзного и внутреннего — синовиального. Фиброзный слой состоит из плотной волокнистой ткани, в некоторых местах фиброзный слой капсулы истончается с образованием заворотов или бурс, в других местах он утолщен, выполняя функцию связки сустава. Толщина фиброзного слоя капсулы определяется функциональной нагрузкой на сустав.
Утолщения капсулы образуют связки, состоящие из плотных параллельных пучков коллагеновых волокон, которые служат для стабилизации и укрепления сустава и ограничивают определенные движения. Среди особенностей капсулы, помимо выполнения ею функции опоры для синовиальной оболочки и соединения со связками, следует отметить большое количество находящихся в ней нервных окончаний в отличие от синовии, имеющей незначительное количество таких окончаний, и суставного хряща, не содержащего их вовсе. Считается, что вместе с нервами мышц нервы капсулы участвуют в контроле положения, а также реагируют на болевые воздействия (Вернон-Робертс В., 1990).
Синовиальная оболочка — наименьшая по массе и объему, но наиболее важная составная часть синовиального сустава, поскольку большая часть ревматических болезней протекает с воспалением синовиальной оболочки, которое носит общее название «синовит». Синовиальная оболочка выстилает все внутрисуставные структуры кроме суставного хряща, ее толщина составляет 25–35 мкм. Гистологически она представляет собой пласт соединительной ткани, состоящий из покровного, коллагенового и эластического слоев (Павлова В.Н., 1980). Синовиальная оболочка в норме имеет известное количество складок и пальцевидных ворсин и формирует тонкий синовиальный слой (называемый иногда покровным слоем); в его состав входят слой покровных клеток, образующий выстилку несочленяющихся поверхностей сустава, и субсиновиальный поддерживающий слой, состоящий из фиброзно-жировой соединительной ткани различной толщины, которая соединяется с капсулой. Синовиальный слой часто сливается с субсиновиальной тканью путем плавного перехода от аваскулярного внутреннего покрытия, содержащего множество клеток, к васкуляризированной субсиновиальной соединительной ткани с меньшим количеством клеток, которая по мере приближения к соединению ее с фиброзной капсулой становится все более насыщенной коллагеновыми волокнами. Из кровеносных сосудов субсиновиальной соединительной ткани в синовиальную жидкость выходят клетки и питательные вещества благодаря отсутствию морфологического разъединения синовиального и субсиновиального слоев (отсутствию базальной мембраны, наличию промежутков между покровными клетками).
Синовиальная оболочка в норме выстлана 1–3 слоями синовицитов — синовиальных клеток, расположенных в матриксе (основном веществе), богатом микрофибриллами и аггрегатами протеогликанов. Синовициты делят на две группы — типа А (макрофагоподобные) и типа В (фибробластоподобные). Синовициты типа А имеют неровную клеточную поверхность с большим количеством выростов, у них хорошо развит комплекс Гольджи, много вакуолей и везикул, однако рибосомальная эндоплазматическая сеть выражена слабо. Макрофагальные синовициты также могут содержать большое количество фагоцитированного материала. У синовицитов типа В поверхность относительно гладкая, хорошо развита рибосомальная эндоплазматическая сеть, они содержат лишь незначительное количество вакуолей. Классическое деление синовицитов на А-клетки, выполняющие фагоцитирующую функцию, и В-клетки, основной функцией которых является выработка компонентов синовиальной жидкости, прежде всего гиалуроновой кислоты, не отражает всех функций синовицитов. Так, были описаны синовициты типа С, которые по своим ультраструктурным признакам занимают промежуточное положение между клетками типа А и В. Кроме того, установлено, что макрофагоподобные клетки способны синтезировать гиалуроновую кислоту, а фибробластоподобные обладают способностью к активному фагоцитозу (Вернон-Робертс Б., 1990).
Современные представления о строении и функции суставного хряща
Структура суставного хряща человека
Нормальный суставной хрящ выполняет две основные функции: поглощение давления путем деформации во время механической нагрузки и обеспечение гладкости суставных поверхностей, что позволяет максимально уменьшить трение при движениях в суставе. Это обеспечивается уникальной структурой суставного хряща, который состоит из хондроцитов, погруженных во внеклеточный матрикс (ВКМ).
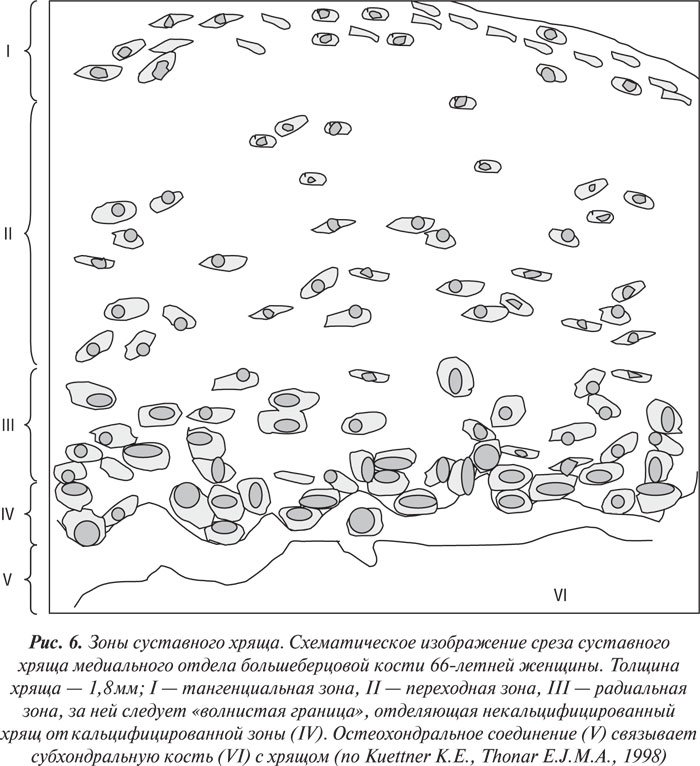
Нормальный суставной хрящ взрослого можно разделить на несколько слоев, или зон (рис. 6): поверхностная, или тангенциальная, зона, переходная зона, глубокая, или радиальная, зона и кальцифицированная зона. Слой между поверхностной и переходной зонами и особенно между переходной и глубокой зонами не имеет четких границ. Соединение между некальцифицированным и кальцифицированным суставным хрящом называется «волнистой границей» — это линия, определяемая при окрашивании декальцифицированной ткани. Кальцифицированная зона хряща составляет относительно постоянную пропорцию (6–8%) в общей высоте среза хряща (Oegema T.R., Thompson R.C., 1992). Общая толщина суставного хряща, включая зону кальцифицированного хряща, варьирует в зависимости от нагрузки на определенный участок суставной поверхности и от вида сустава. Перемежающееся гидростатическое давление в субхондральной кости играет важную роль в поддержании нормальной структуры хряща, замедляя оссификацию.
Хондроциты составляют приблизительно 2–3% от общей массы ткани; в поверхностной (тангенциальной) зоне они рсположены вдоль, а в глубокой (радиальной) зоне — перпендикулярно к поверхности хряща; в переходной зоне хондроциты формируют группы по 2–4 клетки, рассеянные по всему матриксу. В зависимости от зоны суставного хряща варьирует плотность расположения хондроцитов — наивысшая плотность клеток в поверхностной зоне, наиболее низкая — в кальцифицированной (рис. 6). Кроме того, плотность распределения клеток варьирует от сустава к суставу, она обратно пропорциональна толщине хряща и нагрузке, которую испытывает соответствующий его участок.
Наиболее поверхностно расположенные хондроциты имеют дисковидную форму и образуют в тангенциальной зоне несколько слоев клеток, расположенных ниже узкой полоски матрикса; глубже расположенные клетки этой зоны имеют тенденцию к более неровным контурам. В переходной зоне хондроциты имеют сферическую форму, иногда они объединяются в небольшие группы, рассеянные в матриксе. Хондроциты глубокой зоны имеют преимущественно эллипсоидную форму, группируются в радиально расположеные цепочки из 2–6 клеток. В кальцифицированной зоне они распределены еще более разреженно; некоторые из них некротизированы, хотя большинство жизнеспособны. Клетки окружены некальцифицированным матриксом, межклеточное пространство — кальцифицировано.
Таким образом, суставной хрящ человека состоит из гидратированного ВКМ и погруженных в него клеток, которые составляют 2–3% от общего объема ткани. Так как хрящевая ткань не имеет кровеносных и лимфатических сосудов, взаимодействие между клетками, доставка к ним питательных веществ, удаление продуктов обмена осуществляется путем диффузии через ВКМ. Несмотря на то, что метаболически хондроциты очень активны, в норме у взрослых людей они не делятся. Хондроциты существуют в бескислородной среде, считают, что их метаболизм осуществляется преимущественно анаэробным путем (Shapiro I.M. et al., 1991).
Каждый хондроцит рассматривают как отдельную метаболическую единицу хряща, изолированную от соседних клеток, но ответственную за продукцию элементов ВКМ в непосредственной близости от данной клетки и поддержание его состава (Aydelotte M.B., Kuettner K.E., 1988).
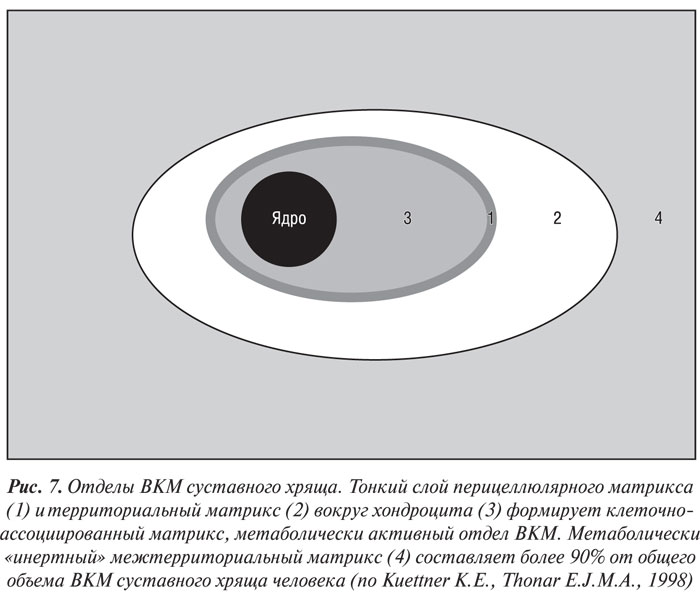
В ВКМ выделяют три отдела (рис. 7), каждый из которых имеет уникальную морфологическую структуру (Hunziker E.B., 1992) и определенный биохимический состав (Mok S.S. et al., 1994; Hauselmann H.J. et al., 1996). ВКМ, непосредственно прилегающий к базальной мембране хондроцита, называется перицеллюлярным, или лакунарным, матриксом. Он характеризуется высоким содержанием агрегатов протеогликанов, связанных с клеткой взаимодействием гиалуроновой кислоты с СD44-подобными рецепторами (Knudson C.B., Knudson W., 1993), и относительным отсутствием организованных фибрилл коллагенов. Непосредственно с перицеллюлярным матриксом соприкасается территориальный, или капсулярный, матрикс, который состоит из сети перекрещивающихся фибриллярных коллагенов, которая инкапсулирует отдельные клетки или (иногда) группы клеток, формируя хондрон, и, вероятно, обеспечивает специальную механическую поддержку клеток (Kuettner K.E., Thonar E.J.M.A., 1998). Контакт хондроцитов с капсулярным матриксом осуществляется посредством многочисленных цитоплазматических отростков, богатых микрофиламентами, а также посредством специфических матриксных молекул, таких, как анкорин и СD44-подобные рецепторы. Наиболее крупный и наиболее удаленный от базальной мембраны хондроцита отдел ВКМ — межтерриториальный матрикс, содержащий наибольшее количество коллагеновых фибрилл и протеогликанов (Hunziker E.B., 1992).
Разделение ВКМ на отделы более четко очерчено в суставном хряще взрослого человека, чем в незрелом суставном хряще (Kuettner K.E., Thonar E.J.M.A., 1998). Относительный размер каждого отдела варьирует не только в разных суставах, но даже в пределах одного и того же хряща. Каждый хондроцит вырабатывает матрикс, окружающий его. По данным исследований (Hunziker E.B., 1992; Mok S.S. et al., 1994), хондроциты зрелой хрящевой ткани осуществляют активный метаболический контроль над своими перицеллюлярным и территориальным матриксами, менее активно они контролируют межтерриториальный матрикс, который может быть метаболически «инертным».
Как указывалось раньше, суставной хрящ главным образом состоит из обширного ВКМ, синтезируемого и регулируемого хондроцитами. Тканевые макромолекулы и их концентрация меняются в течение жизни в соответствии с изменяющимися функциональными потребностями. Однако остается неясным: клетки синтезируют весь матрикс одновременно или в определенные фазы в соответствии с физиологическими потребностями (Kuettner K.E., Thonar E.J.M.A., 1998). Концентрация макромолекул, метаболическое равновесие между ними, взаимоотношение и взаимодействие определяют биохимические свойства, а значит, и функцию суставного хряща в пределах одного сустава. Основным компонентом ВКМ суставного хряща взрослого человека является вода (65–70% от общей массы), которая прочно связана внутри него благодаря особым физическим свойствам макромолекул хрящевой ткани, входящих в состав коллагенов, протеогликанов и неколлагеновых гликопротеинов (Thonar E.J.M.A. et al., 1999).
Биохимический состав хряща
Коллагеновые волокна состоят из молекул фибриллярного белка коллагена. У млекопитающих на долю коллагена приходится четвертая часть всех белков организма. Коллаген формирует фибриллярные элементы (коллагеновые фибриллы), состоящие из структурных субъединиц, называемых тропоколлагеном. Молекула тропоколлагена имеет три цепи, которые образуют тройную спираль. Такое строение молекулы тропоколлагена, а также структура коллагенового волокна, когда эти молекулы располагаются параллельно в продольном направлении с постоянным сдвигом примерно на 1/4 длины и обеспечивают высокую упругость и прочность тканям, в которых они находятся. В настоящее время известны 10 генетически различных типов коллагена, различающихся химической структурой α-цепей и/или их набором в молекуле. Наиболее изученные первые четыре типа коллагена способны формировать до 10 молекулярных изоформ.
Коллагеновые фибриллы входят в состав внеклеточного пространства большинства видов соединительной ткани, в том числе и хрящевой. Внутри нерастворимой трехмерной сети из перекрещивающихся коллагеновых фибрилл «запутаны» другие более растворимые компоненты, такие, как протеогликаны, гликопротеины и тканеспецифические протеины; иногда они ковалентно связаны с коллагеновыми элементами.
Организованные в фибриллы коллагеновые молекулы составляют около 50% органического сухого остатка хряща (10–20% нативного хряща) (Thonar E.J.M.A. et al., 1999). В зрелом хряще около 90% коллагенов составляют коллагены II типа, которые обнаруживают лишь в некоторых тканях (например, стекловидное тело, эмбриональная спинная струна). Коллаген II типа относится к I классу (формирующих фибриллы) коллагеновых молекул. Кроме него в зрелом суставном хряще человека также находят коллагены IX, XI типа и в небольшом количестве VI типа. Относительное количество коллагеновых волокон IX типа в коллагеновых фибриллах снижается от 15% в хряще плода до около 1% в зрелом хряще быка (Mayne R., 1989; Eyre D.R., 1991; 1992).
Молекулы коллагена II типа состоят из трех идентичных полипептидных α1(II)-цепей, синтезируемых и секретируемых в виде проколлагена-предшественника. Как только готовые молекулы коллагена высвобождаются во внеклеточное пространство, они формируют фибриллы (Kuettner K.E., Thonar E.J.M.A., 1992). В зрелом суставном хряще коллаген II типа образуют фибриллярные аркады, в которых более «толстые» молекулы расположены в глубоких слоях ткани, а более «тонкие» — горизонтально в поверхностных слоях (Schenk R.K. et al., 1986; Aydelotte M.B., Kuettner K.E., 1988).
В гене проколлагена II типа обнаружен экзон, кодирующий богатый цистеином N-терминальный пропептид. Этот экзон экспрессируется не в зрелом хряще, а на ранних стадиях развития (прехондрогенез). Благодаря наличию этого экзона молекула проколлагена II типа (тип II А) длиннее коллагена II типа (Ryan M.C., Sandell L.J., 1990). Вероятно, экспрессия этого типа проколлагена угнетает накопление элементов в ВКМ суставного хряща. Возможно, он играет определенную роль в развитии патологии хряща (например, неадекватный репаративный ответ, образование остеофитов и др.) (Sundell L.J. et al., 1992).
Сеть из коллагеновых фибрилл II типа обеспечивает функцию сопротивления растяжению и необходима для поддержания объема и формы ткани (Eyre D.R. et al., 1992; Hunziker E.B., 1992). Эта функция усиливается ковалентными и поперечными связями между молекулами коллагена (Eyre D.R. et al., 1990). В ВКМ фермент лизилоксидаза образует альдегид из гидроксилизина, который затем превращается в мультивалентную аминокислоту гидроксилизил-пиридинолин, формирующую поперечные связи между цепями. С одной стороны, концентрация этой аминокислоты повышается с возрастом, однако в зрелом хряще она практически не изменяется (Eyre D.R. et al., 1988). С другой стороны, в суставном хряще обнаруживают повышение с возрастом концентрации поперечных связей различных типов, образующихся без участия ферментов (Monnier V.M., Cerami A., 1981).
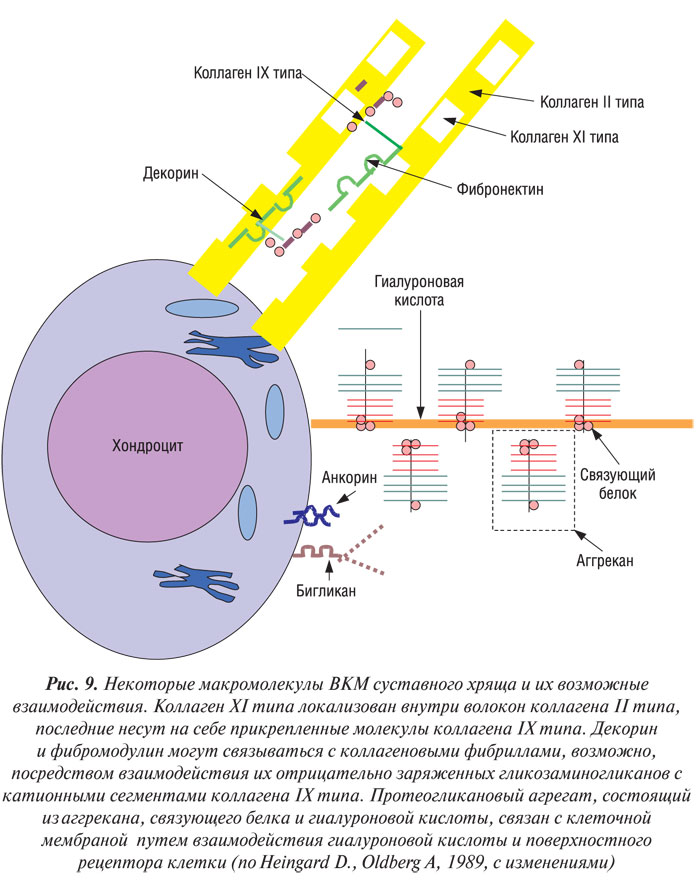
Около 10% от общего количества коллагенов хрящевой ткани составляют так называемые минорные коллагены, которые во многом обусловливают уникальную функцию этой ткани (Thonar E.J.M.A. et al., 1999). Коллаген IX типа принадлежит к III классу короткоспиральных молекул и к уникальной группе FACIT-коллагенов (Fibril-Associated Collagen with Interrupted Triple-helices — фибрилл-ассоциированный коллаген с прерванной тройной спиралью) (Olsen B.R., 1992). Он состоит из трех генетически различных цепей. Одна из них — α2-цепь — гликозилируется одновременно с хондроитин сульфатом, что делает эту молекулу одновременно протеогликаном. Между сегментами спирали коллагена IХ типа и коллагеном II типа обнаруживают как зрелые, так и незрелые гидроксипиридиновые поперечные связи (Eyre D.R. et al., 1987; van der Rest M., Mayne R., 1988). Коллаген IХ также может функционировать как межмолекулярный-интерфибриллярный «коннектор» (или мостик) между прилежащими коллагеновыми фибриллами (Muller-Glauser W. et al., 1986; Wu J.J., Eyre D.R., 1989). Молекулы коллагена IХ образуют поперечные связи между собой, что увеличивает механическую стабильность фибриллярной трехмерной сети и защищает ее от воздействия ферментов. Они также обеспечивают сопротивление деформации, ограничивая набухание находящихся внутри сети протеогликанов. Кроме анионной CS-цепи молекула коллагена IХ содержит катионный домен, сообщающий фибрилле большой заряд и склонность к взаимодействию с другими матриксными макромолекулами (Vasios G. et al., 1988).
Коллаген ХI типа составляет только 2–3% от общей массы коллагенов. Он принадлежит к I классу (образующих фибриллы) коллагенов и состоит из трех различных α-цепей. Вместе с коллагенами II и IХ типов коллаген ХI типа образует гетеротипные фибриллы суставного хряща (Eyre D.R., 1991). Молекулы коллагена ХI типа выявлены внутри коллагеновых фибрилл II типа с помощью иммуноэлектромикроскопии. Возможно, они организуют молекулы коллагена II типа, контролируя латеральный рост фибрилл и детерминируя диаметр гетеротипной коллагеновой фибриллы (Eikenberry E.F. et al., 1992). Кроме того, коллаген ХI принимает участие в формировании поперечных связей, однако даже в зрелом хряще поперечные связи остаются в виде незрелых дивалентных кетоаминов (Eyre D.R. et al., 1992).
Малое количество коллагена VI типа, другого представителя III класса короткоспиральных молекул, обнаружено в суставном хряще (Eyre D.R., 1991; Thomas J.T. et al., 1994). Коллаген VI типа образует различные микрофибриллы и, возможно, концентрируется в капсулярном матриксе хондрона (Poole C.A. et al., 1988).
Протеогликаны — это белки, к которым ковалентно присоединена по крайней мере одна гликозаминогликановая цепь. Протеогликаны относятся к одним из наиболее сложных биологических макромолекул. Наиболее обширно протеогликаны представлены в ВКМ хряща. «Запутанные» внутри сети из коллагеновых фибрилл, гидрофильные протеогликаны выполняют свою основную функцию — сообщают хрящу способность обратимо деформироваться (Kuettner K.E., Thonar E.J.M.A., 1998). Предполагают, что протеогликаны осуществляют и ряд других функций, суть которых до конца не ясна (Wight T., Mecham R., 1987; Hardingham T.E. et al., 1992; Sandy J.D., 1992).
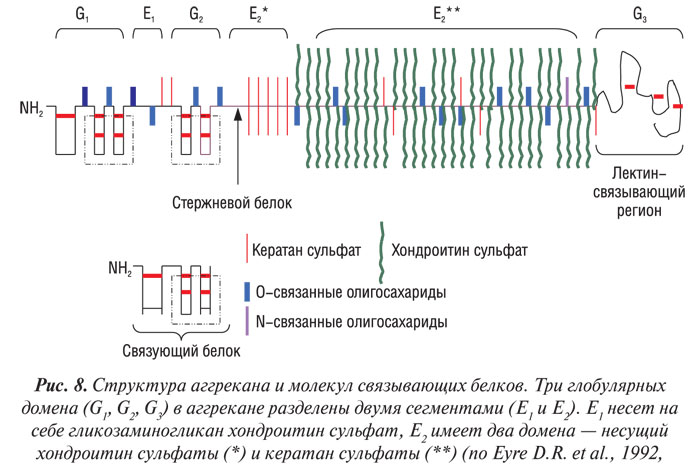
Аггрекан — основной протеогликан суставного хряща: он составляет около 90% общей массы протеогликанов в ткани (Thonar E.J.M.A. et al., 1999). Его стрежневой белок массой 230 кД гликозилирован множеством ковалентно связанных гликозаминогликановых цепей, а также N-концевыми и С-концевыми олигосахаридами (рис. 8).
Гликозаминогликановые цепи суставного хряща, которые составляют около 90% от общей массы макромолекул, — кератансульфат (представляет собой последовательность из сульфатированного дисахарида N-ацетилглюкозамингалактоза с множественными сульфатированными участками и других моносахаридных остатков, таких, как сиаловая кислота) и хондроитин сульфат (представляет собой последовательность из дисахарида N-ацетилгалактозамин-глюкуроновой кислоты с сульфатным эфиром, присоединенным к каждому четвертому или шестому атому углерода N-ацетилгалактозамина).
Стержневой белок аггрекана содержит три глобулярных (G1, G2, G3) и два межглобулярных (Е1 и Е2) домена (см. рис. 8). N-концевой участок содержит G1- и G2- домены, разделенные Е1-сегментом, протяженностью 21 нм. G3-домен, расположенный на С-концевом участке, отделен от G2 более длинным (около 260 нм) Е2-сегментом, который несет на себе более 100 цепей хондроитин сульфатов около 15–25 цепей кератан сульфатов, а также О-связанные олигосахариды. N-связанные олигосахариды обнаруживают главным образом в пределах G1- и G2-доменов и Е1-сегмента, а также вблизи G3-региона. Гликозаминогликаны группируются в двух регионах: наиболее протяженный (так называемый регион, богатый хондроитин сульфатами) содержит цепи хондроитин сульфатов и около 50% кератан сульфатных цепей (Thonar E.J.M.A., Kuettner K.E., 1987). Регион, богатый кератан сульфатами, локализуется на Е2-сегменте вблизи G2-домена и предшествует региону, богатому хондроитин сульфатами (Hardingham T.E. et al., 1992). Молекулы аггрекана также содержат фосфатные эфиры, локализованные прежде всего на ксилозных остатках, которые присоединяют цепи хондроитин сульфатов к стержневому белку; их также обнаруживают на сериновых остатках стержневого белка (Thonar E.J.M.A. et al., 1999).
С-терминальный сегмент G3-домена высокогомологичен лектину, благодаря чему молекулы протеогликана могут фиксироваться в ВКМ путем связывания с некоторыми углеводородными структурами (Hardingham T.E. et al., 1992).
В недавно проведенных исследованиях был обнаружен экзон, кодирующий ЭФР-подобный (эпидермальный фактор роста) субдомен в пределах G3. Используя анти-ЭФР поликлональные антитела, ЭФР-подобный эпитоп был локализован внутри пептида массой 68 кД в аггрекане суставного хряща человека. Однако его функции требуют уточнения (Kuettner K.E., Thonar E.J.M.A., 1998). Этот субдомен также обнаружен в структуре молекул адгезии, контролирующих миграцию лимфоцитов (Hardingham T.E. et al., 1992). Лишь около трети молекул аггрекана, изолированных из зрелого суставного хряща человека, содержат интактный G3-домен; вероятно, это связано с тем, что в ВКМ молекулы аггрекана могут быть уменьшены в размерах ферментным путем. Дальнейшая судьба и функция отщепленных фрагментов неизвестны (Kuettner K.E., Thonar E.J.M.A., 1998).
Главным функциональным сегментом молекулы аггрекана является гликозаминогликан-несущий Е2-сегмент. Участок, богатый кератан сульфатами, содержит аминокислоты пролин, серин и треонин. Большинство остатков серина и треонина О-гликозилированы N-ацетилгалактозаминовыми остатками, они запускают синтез некоторых олигосахаридов, которые встраиваются в цепи кератан сульфатов, тем самым удлиняя их. Остальная часть Е2-сегмента содержит более 100 последовательностей серин–глицин, в которых серин обеспечивает прикрепление к ксилозильным остаткам в начале цепей хондроитин сульфатов. Обычно и хондроитин-6-сульфат, и хондроитин-4-сульфат существуют одновременно в пределах одной и той же молекулы протеогликана, из соотношение варьирует в зависимости от локализации хрящевой ткани и возраста человека (Thonar E.J.M.A. et al., 1999).
Структура молекул аггрекана в матриксе суставного хряща человека претерпевает ряд изменений в процессе созревания и старения (Roughley P.J., Mort J.S., 1986; Thonar E.J.M.A. et al., 1986; Thonar E.J.M.A., Kuettner K.E., 1987; Bayliss M.T., 1990). Связанные со старением изменения включают снижение гидродинамического размера в результате изменения средней длины цепей хондроитин сульфатов, увеличение числа и длины цепей кератан сульфатов (Thonar E.J.M.A., Kuettner K.E., 1987). Ряд изменений молекулы аггрекана также претерпевают под действием протеолитических ферментов (например, аггреканазы и стромелезина) на стержневой белок (Plass A.H.K., Sandy J.D., 1995). Это приводит к прогрессирующему уменьшению средней длины стержневого белка молекул аггрекана.
Молекулы аггрекана синтезируются хондроцитами и секретируются в ВКМ, где они формируют агрегаты, стабилизированные молекулами связующих белков. Эта агрегация включает в себя высокоспецифичные нековалентные и кооперативные взаимодействия между нитью глюкуроновой кислоты и почти 200 молекулами аггреканов и связующих белков. Глюкуроновая кислота — внеклеточный несульфатированный линейный гликозаминогликан с большой молекулярной массой, состоящий из множества последовательно связанных молекул N-ацетилглюкозамина и глюкуроновой кислоты (Knudson C.B., Knudson W., 1993). Спаренные петли G1-домена аггрекана (см. рис. 8) обратимо взаимодействуют с пятью последовательно расположенными дисахаридами гиалуроновой кислоты. Связующий белок, который содержит аналогичные (высокогомологичные) спаренные петли (Neame P.J. et al., 1987), взаимодействует с G1-доменом и молекулой гиалуроновой кислоты и стабилизирует структуру агрегата. Комплекс G1-домен — гиалуроновая кислота — связующий белок формирует высокостабильное взаимодействие, которое защищает G1-домен и связующий белок от действия протеолитических ферментов. Идентифицированы две молекулы связующего белка с молекулярной массой 40–50 кД; они отличаются друг от друга степенью гликозилирования. Только одна молекула связующего белка имеется в месте связи гиалуроновая кислота — аггрекан. Третья, более мелкая, молекула связующего белка образуется из более крупных путем протеолитического отщепления (Roughley P.J. et al., 1992).
Около 200 молекул аггрекана могут связываться с одной молекулой гиалуроновой кислоты с образованием агрегата длиной 8 мкм. В клеточно-ассоциированном матриксе, состоящем из перицеллюлярного и территориального отделов, агрегаты сохраняют свою связь с клетками путем связывания (через нить гиалуроновой кислоты) с CD44-подобными рецепторами на клеточной мембране (Knudson C.B., Knudson W., 1993).
Образование агрегатов в ВКМ — процесс сложный. Вновь синтезированные молекулы аггрекана не сразу проявляют способность связываться с гиалуроновой кислотой (Sandy J.D., Plass A.H.K., 1989). Это может служить регуляторным механизмом, позволяющим вновь синтезированным молекулам достичь межтерриториальной зоны матрикса перед тем, как быть иммобилизированными в крупные агрегаты (Mok S.S. et al., 1994). Количество вновь синтезированных молекул аггрекана и связующих белков, способных образовывать агрегаты путем взаимодействия с гиалуроновой кислотой, значительно уменьшается с возрастом (Bayliss M.T., 1992). Кроме того, с возрастом значительно уменьшаются размеры агрегатов, выделенные из суставного хряща человека. Это отчасти связано с уменьшением средней длины молекул гиалуроновой кислоты и молекул аггрекана.
Установлено два вида агрегатов в суставном хряще (Manicourt D.H. et al., 1988). Средний размер агрегатов первого вида — 60 S, агрегатов второго вида (быстро осаждающихся «суперагрегатов») — 120 S. Последний отличается обилием молекул связующего белка (Manicourt D.H. et al., 1988; Pita J.C. et al., 1992). Наличие этих суперагрегатов, возможно, играет большую роль в функционировании ткани; во время восстановления ткани после иммобилизации конечности в средних слоях суставного хряща обнаруживают более высокие их концентрации, в суставе, пораженном ОА, на ранних стадиях заболевания их размеры значительно уменьшаются (Pita J.C. et al., 1992).
Кроме аггрекана, суставной хрящ содержит ряд более мелких протеогликанов. Бигликан и декорин, молекулы, несущие дерматан сульфаты, имеют молекулярную массу около 100 и 70 кД соответственно; масса их стержневого белка — около 30 кД (Fisher L.W. et al., 1989).
В суставном хряще человека молекула бигликана содержит две цепи дерматан сульфата, тогда как более часто встречающийся декорин — только одну. Эти молекулы составляют лишь небольшую часть протеогликанов в суставном хряще, хотя их может быть также много, как и крупных агрегированных протеогликанов. Мелкие протеогликаны взаимодействуют с другими макромолекулами в ВКМ, включая коллагеновые фибриллы, фибронектин, факторы роста и др. (Kuettner K.E., Thonar E.J.M.A., 1998). Декорин первоначально локализуется на поверхности коллагеновых фибрилл и угнетает коллагеновый фибриллогенез (Vogel K.G. et al., 1984; Scott J.E., 1990). Стержневой протеин прочно сохраняется с клеточно-связывающим доменом фибронектина, тем самым, вероятно, препятствуя связыванию последнего с рецепторами клеточной поверхности (интегринами). В связи с тем что и декорин, и бигликан связываются с фибронектином и сдерживают адгезию и миграцию клеток, а также образование тромбов, они способны угнетать процессы тканевой репарации (Rosenberg L., 1992).
Фибромодулин суставного хряща — это протеогликан с молекулярной массой 50–65 кД, ассоциированный с коллагеновыми фибриллами (Olberg A. et al., 1989). Его стержневой протеин, гомологичный стержневым протеинам декорина и бигликана, содержит большое количество остатков сульфата тирозина. Эта гликозилированная форма фибромодулина (ранее ее называли матриксный протеин 59 кД) может участвовать в регуляции образования и поддержании структуры коллагеновых фибрилл (Plass A.H.K. et al., 1992). Фибромодулин и декорин располагаются на поверхности коллагеновых фибрилл. Таким образом, как указывалось раньше, увеличению фибриллы в диаметре должно предшествовать селективное удаление этих протеогликанов (а также молекул коллагена IХ типа) (Kuettner K.E., Thonar E.J.M.A., 1998).
Суставной хрящ содержит в ВКМ ряд белков, которые не относятся ни к протеогликанам, ни к коллагенам (рис. 9). Они взаимодействуют с другими макромолекулами с образованием сети, в которую включено большинство молекул ВКМ (Heingard D., Oldberg A., 1989; Heingard D. et al., 1995).
Анкорин, белок с массой 34 кД, локализуется на поверхности хондроцитов и в клеточной мембране, опосредует взаимодействие между клеткой и матриксом. В связи с его высокой аффинностью к коллагену II типа он может выступать в качестве механорецептора, передающего сигнал об измененном давлении на фибриллу хондроциту (von der Mark K. et al., 1986).
Фибронектин — компонент большинства хрящевых тканей, незначительно отличается от фибронектина плазмы крови (Kuettner K.E., Thonar E.J.M.A., 1998). Предполагают, что фибронектин способствует интеграции матрикса путем взаимодействия с клеточными мембранами и другими составными матрикса, такими, как коллаген II типа и тромбоспондин (Heingard D. et al., 1995). Фрагменты фибронектина негативно влияют на метаболизм хондроцитов — угнетают синтез аггрекана, стимулируют катаболические процессы. В суставной жидкости больных с ОА обнаружена высокая концентрация фрагментов фибронектина, таким образом, они могут участвовать в патогенезе заболевания на поздних стадиях (Homandberg G.A. et al., 1992). Вероятно, такими же эффектами обладают и фрагменты других матриксных молекул, которые связываются с рецепторами хондроцитов (Poole A.R., 1995).
Олигомерный матриксный протеин хряща (ОМПХ) — член суперсемейства тромбоспондинов, представляет собой пентамер с пятью идентичными субъединицами с молекулярной массой около 83 кД. Их обнаруживают в большом количестве в суставном хряще, особенно в слое пролиферирующих клеток в растущей ткани. Поэтому, возможно, ОМПХ принимает участие в регуляции роста клеток (Heingard D. et al., 1995). В значительно более низкой концентрации их обнаруживают в ВКМ зрелого суставного хряща (Heingard D. et al., 1995).
К матриксным протеинам также относят:
Кроме того, очевидно, что хондроциты экспрессируют негликозилированные формы малых неагрегированных протеогликанов на определенных стадиях развития хряща и в патологических условиях, однако их специфическая функция в настоящее время изучается.
Функциональные свойства суставного хряща
Молекулы аггрекана сообщают суставному хрящу способность претерпевать обратимую деформацию (Maroudas A. et al., 1992). Они демонстрируют специфические взаимодействия внутри внеклеточного пространства и, несомненно, играют важную роль в организации, структуре и функции ВКМ. В хрящевой ткани молекулы аггрекана достигают концентрации 100 мг/мл (Thonar E.J.M.A. et al., 1999). В хряще молекулы аггрекана сжаты до 20% объема, который они занимают в растворе. Трехмерная сеть, образованная фибриллами коллагена, сообщает ткани свойственную ей форму и предотвращает увеличение объема протеогликанов. Внутри коллагеновой сети неподвижные протеогликаны несут большой отрицательный электрический заряд (содержат большое количество анионных групп), который позволяет взаимодействовать с подвижными катионными группами интерстициальной жидкости (Kuettner K.E., Thonar E.J.M.A., 1998). Взаимодействуя с водой, протеогликаны обеспечивают так называемое давление набухания, которому противодействует коллагеновая сеть (Maroudas A., 1975).
Наличие воды в ВКМ является очень важным моментом. Вода определяет объем ткани; связанная с протеогликанами, она обеспечивает сопротивление сжатию. Кроме того, вода обеспечивает транспорт молекул и диффузию в ВКМ. Высокая плотность отрицательного заряда на крупных протеогликанах, фиксированных в ткани, создает «эффект исключенного объема» (Kuettner K.E., Thonar E.J.M.A., 1998). Размер пор внутри концентрированного раствора протеогликанов настолько мал, что диффузия крупных глобулярных белков в ткань резко ограничена (Urban J.P.G., 1990). ВКМ отталкивает мелкие отрицательно заряженные (например, ионы хлора) и крупные (такие, как альбумин и иммуноглобулины) белки. Размер ячеек внутри плотной сети из коллагеновых фибрилл и протеогликанов соизмерим лишь с размерами некоторых неорганических молекул (например, натрия и калия, но не кальция).
В ВКМ некоторое количество воды присутствует в коллагеновых фибриллах. Физико-химические и биомеханические свойства хряща определяет экстрафибриллярное пространство (Maroudas A. et al., 1992). Содержание воды во внутрифибриллярном пространстве зависит от концентрации протеогликанов в экстрафибриллярном пространстве и повышается при снижении концентрации последних.