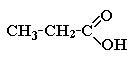формула высшего оксида химического элемента ro3 к какой группе главной подгруппы псхэ он принадлежит
1. Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-3. Какое положение он занимает в ПСХЭ?
2. Формула высшего оксида химического элемента RO. К какой группе главной подгруппы ПСХЭ он принадлежит?
3. Какое из указанных веществ имеет металлическую связь:
Zn; S; C; KH.
4. Укажите тип химической реакции Ba(OH)2 + HNO3 → Ba(NO3)2 + H2O:
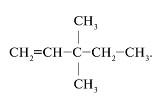
9. Название нижеприведенного углеводорода по систематической номенклатуре
10. Глицерин в водном растворе можно обнаружить с помощью:
11. Предельные одноатомные спирты – это вещества с общей формулой:
СnH2n; СnH2n+1ОН СnH2n–2; СnH2n–4.
Часть В
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) Без белка можно прожить;
б) первый представитель гомологического ряда алканов – метан;
в) основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп;
г) сено, которое ест корова, содержит растительный белок;
д) индикатор, который показывающий наличие ОН-ионов – лакмус.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
1. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид алюминия
Б) Серная кислота
В) Гидроксид алюминия
Г) Сульфат алюминия 1) Al(OH)3
2) Al2(SO4)3
3) AlCl3
4) Al2O3
5) H2SO4
6) H2SO3.
2. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит:
Название соединения: Класс веществ:
А) метаналь 1) ацетиленовые у/в
Б) пропин 2) предельные у/в
В) этановая кислота 3) карбоновые кислоты
Г) бензол 4) альдегиды
5) ароматические у/в
6) кетоны.
Часть С
1. Решите задачу: Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода и 7,7% водорода. Найдите его молекулярную формулу.
Дифференцированный зачет по химии для студентов среднего профессионального образования
Тест состоит из 3 частей: А, В и С. В данном тесте присутствуют задания различного характера: задания на соответствие, задания свободного выбора, задачи и практическая составляющая. Задания составлены в соответствии с рабочей программой дисциплины «Химия» среднего профессионального образования. Всего в зачете предусмотрено 4 варианта, прилагается ключ к тесту.
Просмотр содержимого документа
«Дифференцированный зачет по химии для студентов среднего профессионального образования »
Дифференцированный зачет по дисциплине «Химия» I курс II семестр
Тест состоит из частей А, В, С. Часть А включает 11 заданий, часть В – 3 задания, часть С – 2 задания.
Задания части А оцениваются по 1 баллу, части В – по2 балла, части С – по 3 балла. Общее количество баллов, которое может набрать студент – 24 балла.
К каждому заданию части А даны несколько ответов, из которых только 1 верный. Выберите верный, по Вашему мнению, ответ.
Химический элемент имеет следующую схему строения атома +18 2)8)8). Какое положение он занимает в ПСХЭ?
а) II период, VII группа; б) III период, VIII группа; в) IV период, I группа.
Формула высшего оксида химического элемента R2O5. К какой группе главной подгруппы ПСХЭ он принадлежит?
а) первая; б) пятая; в) четвертая.
Какое из веществ имеет ионную связь?
а) LiCl; б) HBr; в) O2; г) CO.
а) разложения; б) соединения; в) обмена; г) замещения.
5. Символ элемента, образующего простое вещество — металл:
6. В начале каждого периода стоят атомы:
а) металлов; б) неметаллов.
а) гомологами; б) изомерами; в) радикалами; г) молекулами.
8. К классу алканов относится углеводород состава:
9. Название нижеприведенного углеводорода по систематической номенклатуре
а) 2-метилпентан; б) 2,2-диметилпентан; в) 2,4-диметилпентан; г) 2,4-диметилпентен.
10. Качественной реакцией на фенол является его взаимодействие с:
а) гидроксидом меди (II); б) аммиачным раствором оксида серебра (I); в) хлоридом железа (III); г) водородом.
11. Общая формула непредельных углеводородов:
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) при кипячении белок теряет свои ферментативные, защитные и другие функции;
б) натрий является щелочным металлом;
в) элемент органической химии – водород;
г) углекислый газ используют для изготовления шипучих напитков и для получения соды;
д) раствор фенола называют карболовой кислотой или карболкой.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
1. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
Б) Гидроксид бария 2) BaSO3
В) Сульфат бария 3) BaO
Г) Оксид бария 4) BaSO4
2. Установите соответствие между названием органического соединения и классом веществ, к которому оно относится:
Название соединения: Класс веществ:
А) бутен-1 1) ацетиленовые у/в
Б) бутанол-2 2) непредельные у/в
Г) бутаналь 4) альдегиды
Решите задачу: Найти массовую долю глюкозы в растворе, содержащем 280 г. воды и 40г глюкозы.
При помощи качественной реакции докажите наличие крахмала в хлебе.
Дифференцированный зачет по дисциплине «Химия» I курс II семестр
Тест состоит из частей А, В, С. Часть А включает 11 заданий, часть В – 3 задания, часть С – 2 задания.
Задания части А оцениваются по 1 баллу, части В – по2 балла, части С – по 3 балла. Общее количество баллов, которое может набрать студент – 23 балла.
К каждому заданию части А даны несколько ответов, из которых только 1 верный. Выберите верный, по Вашему мнению, ответ.
Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-7. Какое положение он занимает в ПСХЭ?
а) II период, VI группа; б) III период, VII группа; в) IV период, I группа.
Формула высшего оксида химического элемента RO3. К какой группе главной подгруппы ПСХЭ он принадлежит?
а) вторая; б) пятая; в) шестая.
Какое из указанных веществ имеет ковалентную неполярную связь?
а) разложения; б) соединения; в) обмена; г) замещения.
5. Символ элемента, образующего простое вещество — металл:
6. Единственным жидким металлом является:
а) алюминий; б) цинк; в) магний; г) ртуть.
7. Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разное строение, а потому и разные свойства, называются
а) гомологами; б) изомерами; в) радикалами; г) молекулами.
8. К классу предельных углеводородов относится:
9. Название нижеприведенного углеводорода по систематической номенклатуре
а) 2,2-метилпентан; б) 3,3-диметилпентен-1; в) 3,3-диметилпентан-1; г) 3,3-диметилпентанол-1.
10. Качественной реакцией на белок является его взаимодействие с:
а) гидроксидом меди (II); б) аммиачным раствором оксида серебра(I); в) концентрированной азотной кислотой; г) водородом.
11. Непредельные углеводороды – это вещества с общей формулой:
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) угарный газ очень ядовит, т.к., попадая при дыхании в кровь, быстро соединяется с гемоглобином, лишая тем самым гемоглобин возможности переносить кислород;
б) сливочное масло содержит белок;
в) раствор – это гомогенная система;
г) вещество или элемент, который отдает электроны, является окислителем;
д) индикатор, показывающий наличие ионов Н в растворе – лакмус.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид меди (II) 1) Cu2O
Б) Нитрат меди (II) 2) HNO3
В) Азотная кислота 3) Cu(OH)2
2. Установите соответствие между названием вещества и классом органических соединений, к которому оно относится:
Название соединения: Класс веществ:
А) этаналь 1) ацетиленовые у/в
Б) метанол 2) алкадиены
Г) бензол 4) альдегиды
5) ароматические у/в
Решите задачу: Какое количество вещества оксида меди (II) содержится в 120г его массы?
При помощи качественной реакции докажите наличие белка в молоке.
Дифференцированный зачет по дисциплине «Химия» I курс II семестр
Тест состоит из частей А, В, С. Часть А включает 11 заданий, часть В – 3 задания, часть С – 2 задания.
Задания части А оцениваются по 1 баллу, части В – по2 балла, части С – по 3 балла. Общее количество баллов, которое может набрать студент – 23 балла.
К каждому заданию части А даны несколько ответов, из которых только 1 верный. Выберите верный, по Вашему мнению, ответ.
Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-6. Какое положение он занимает в ПСХЭ?
а) IV период, II группа; б) II период, VII группа; в) III период, VI группа.
2. Формула водородного соединения химического элемента RH4. К какой группе главной подгруппы ПСХЭ он принадлежит?
а) четвертая; б) третья; в) вторая.
3. Какое из указанных веществ имеет ковалентную неполярную связь?
а) разложения; б) соединения; в) обмена; г) замещения.
5. Символ элемента, образующего простое вещество — неметалл:
а) Mg; б) Сu; в) Na; г) F.
6. В конце каждого периода стоят формулы:
а) металлов; б) неметаллов.
7. Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разное строение, а потому и разные свойства, называются
а) гомологами; б) изомерами; в) радикалами; г) молекулами.
8. К классу спиртов относится:
9. Название нижеприведенного углеводорода по систематической номенклатуре
а) 2,2-метилпентан; б) пентанол-3; в) 3-гидроксопентан; г) пентанол-1.
10. Характерной реакцией для альдегидов является взаимодействие с:
а) хлоридом железа (III); б) аммиачным раствором оксида серебра (I); в) хлорной известью; г) раствором карбоната натрия.
11. Ацетиленовые углеводороды – это вещества с общей формулой:
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) Белки имеют первичную, вторичную и третичную структуру;
б) масса вещества выражается в г/моль;
в) гидролиз – это взаимодействие веществ с солями;
г) глицерин используется в качестве компонента косметических средств для ухода за кожей лица и рук;
д) процесс распада вещества на ионы называют электролитической диссоциацией.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
1. Установите соответствие между названием вещества и формулой соединения:
В) Гидроксид магния
4) HCl 5) MgCl2 6) MgO.
2. Установите соответствие между названием органического соединения и классом, к которому оно принадлежит.
Название соединения: Класс веществ:
А) бутан 1) непредельные у/в
Б) пропен 2) предельные у/в
В) этаналь 3) спирты
Г) бензол 4) альдегиды
5) ароматические у/в
Решите задачу: Сколько атомов содержится в 5 моль фосфора?
При помощи качественной реакции докажите, что выданное вам вещество фенол
Дифференцированный зачет по дисциплине «Химия» I курс II семестр
Тест состоит из частей А, В, С. Часть А включает 11 заданий, часть В – 3 задания, часть С – 2 задания.
Задания части А оцениваются по 1 баллу, части В – по2 балла, части С – по 3 балла. Общее количество баллов, которое может набрать студент – 23 балла.
К каждому заданию части А даны несколько ответов, из которых только 1 верный. Выберите верный, по Вашему мнению, ответ.
Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-3. Какое положение он занимает в ПСХЭ?
а) IV период, II группа; б) III период, III группа; в) II период, V группа.
Формула высшего оксида химического элемента RO. К какой группе главной подгруппы ПСХЭ он принадлежит?
а) пятая; б) вторая; в) третья.
Какое из указанных веществ имеет металлическую связь:
а) разложения; б) соединения; в) обмена; г) замещения.
5. Символ элемента, образующего простое вещество — неметалл:
а) Нg; б) С; в) Na; г) Fе.
6. Самым пластичным металлом является:
а) Аl; б) Cu; в) Au; г) Pb.
а) гомологами; б) изомерами; в) радикалами; г) молекулами.
8. К классу карбоновых кислот относится:
9. Название нижеприведенного углеводорода по систематической номенклатуре
а) 2-метилпропан; б) пропанол-3; в) пропановая кислота; г) пропанол-1.
10. Глицерин в водном растворе можно обнаружить с помощью:
а) хлорной извести; б) гидроксида меди (II); в) хлорида железа (III); г) гидроксида натрия.
11. Предельные одноатомные спирты – это вещества с общей формулой:
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) Без белка можно прожить;
б) первый представитель гомологического ряда алканов – метан;
в) основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп;
г) сено, которое ест корова, содержит растительный белок;
д) индикатор, который показывающий наличие ОН-ионов – лакмус.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
В) Гидроксид алюминия
Г) Сульфат алюминия
2. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит:
Название соединения: Класс веществ:
А) метаналь 1) ацетиленовые у/в
Б) пропин 2) предельные у/в
В) этановая кислота 3) карбоновые кислоты
Г) бензол 4) альдегиды
5) ароматические у/в
Решите задачу: Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода и 7,7% водорода. Найдите его молекулярную формулу.
1. Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-3. Какое положение он занимает в ПСХЭ?
2. Формула высшего оксида химического элемента RO. К какой группе главной подгруппы ПСХЭ он принадлежит?
3. Какое из указанных веществ имеет металлическую связь:
Zn; S; C; KH.
4. Укажите тип химической реакции Ba(OH)2 + HNO3 → Ba(NO3)2 + H2O:
9. Название нижеприведенного углеводорода по систематической номенклатуре
10. Глицерин в водном растворе можно обнаружить с помощью:
11. Предельные одноатомные спирты – это вещества с общей формулой:
СnH2n; СnH2n+1ОН СnH2n–2; СnH2n–4.
Часть В
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) Без белка можно прожить;
б) первый представитель гомологического ряда алканов – метан;
в) основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп;
г) сено, которое ест корова, содержит растительный белок;
д) индикатор, который показывающий наличие ОН-ионов – лакмус.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
1. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид алюминия
Б) Серная кислота
В) Гидроксид алюминия
Г) Сульфат алюминия 1) Al(OH)3
2) Al2(SO4)3
3) AlCl3
4) Al2O3
5) H2SO4
6) H2SO3.
2. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит:
Название соединения: Класс веществ:
А) метаналь 1) ацетиленовые у/в
Б) пропин 2) предельные у/в
В) этановая кислота 3) карбоновые кислоты
Г) бензол 4) альдегиды
5) ароматические у/в
6) кетоны.
Часть С
1. Решите задачу: Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода и 7,7% водорода. Найдите его молекулярную формулу.
1. Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-3. Какое положение он занимает в ПСХЭ?
2. Формула высшего оксида химического элемента RO. К какой группе главной подгруппы ПСХЭ он принадлежит?
3. Какое из указанных веществ имеет металлическую связь:
Zn; S; C; KH.
4. Укажите тип химической реакции Ba(OH)2 + HNO3 → Ba(NO3)2 + H2O:
9. Название нижеприведенного углеводорода по систематической номенклатуре
10. Глицерин в водном растворе можно обнаружить с помощью:
11. Предельные одноатомные спирты – это вещества с общей формулой:
СnH2n; СnH2n+1ОН СnH2n–2; СnH2n–4.
Часть В
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) Без белка можно прожить;
б) первый представитель гомологического ряда алканов – метан;
в) основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп;
г) сено, которое ест корова, содержит растительный белок;
д) индикатор, который показывающий наличие ОН-ионов – лакмус.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
1. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид алюминия
Б) Серная кислота
В) Гидроксид алюминия
Г) Сульфат алюминия 1) Al(OH)3
2) Al2(SO4)3
3) AlCl3
4) Al2O3
5) H2SO4
6) H2SO3.
2. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит:
Название соединения: Класс веществ:
А) метаналь 1) ацетиленовые у/в
Б) пропин 2) предельные у/в
В) этановая кислота 3) карбоновые кислоты
Г) бензол 4) альдегиды
5) ароматические у/в
6) кетоны.
Часть С
1. Решите задачу: Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода и 7,7% водорода. Найдите его молекулярную формулу.
1. Химический элемент имеет распределение электронов по электронным слоям в атоме 2-8-3. Какое положение он занимает в ПСХЭ?
2. Формула высшего оксида химического элемента RO. К какой группе главной подгруппы ПСХЭ он принадлежит?
3. Какое из указанных веществ имеет металлическую связь:
Zn; S; C; KH.
4. Укажите тип химической реакции Ba(OH)2 + HNO3 → Ba(NO3)2 + H2O:
9. Название нижеприведенного углеводорода по систематической номенклатуре
10. Глицерин в водном растворе можно обнаружить с помощью:
11. Предельные одноатомные спирты – это вещества с общей формулой:
СnH2n; СnH2n+1ОН СnH2n–2; СnH2n–4.
Часть В
В задании В1 выберите верные утверждения. Запишите выбранные буквы в алфавитном порядке.
а) Без белка можно прожить;
б) первый представитель гомологического ряда алканов – метан;
в) основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогрупп;
г) сено, которое ест корова, содержит растительный белок;
д) индикатор, который показывающий наличие ОН-ионов – лакмус.
В2. Установите соответствие. Ответ запишите в следующем виде: А-4, Б-1 и т.д.
1. Установите соответствие между названием вещества и формулой соединения:
Название вещества: Формула соединения:
А) Оксид алюминия
Б) Серная кислота
В) Гидроксид алюминия
Г) Сульфат алюминия 1) Al(OH)3
2) Al2(SO4)3
3) AlCl3
4) Al2O3
5) H2SO4
6) H2SO3.
2. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит:
Название соединения: Класс веществ:
А) метаналь 1) ацетиленовые у/в
Б) пропин 2) предельные у/в
В) этановая кислота 3) карбоновые кислоты
Г) бензол 4) альдегиды
5) ароматические у/в
6) кетоны.
Часть С
1. Решите задачу: Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода и 7,7% водорода. Найдите его молекулярную формулу.