фосфат натрия какая соль
Фосфат натрия, характеристика, свойства и получение, химические реакции
Фосфат натрия, характеристика, свойства и получение, химические реакции.
Фосфат натрия – неорганическое вещество, имеет химическую формулу Na3PO4.
Краткая характеристика фосфата натрия:
Фосфат натрия – неорганическое вещество бесцветного либо белого цвета, соль щелочного металла натрия и ортофосфорной кислоты.
Фосфат натрия представляет собой бесцветные кристаллы.
Химическая формула фосфата натрия Na3PO4.
Хорошо растворяется в воде, с которой образует кристаллогидраты Na3PO4·0,5H2O, Na3PO4·H2O и Na3PO4·12H2O. Водный раствор имеет сильнощелочную реакцию из-за гидролиза по аниону.
Не растворим в этаноле.
В пищевой промышленности используется 3 типа фосфатов натрия, согласно степени замещения атомов водорода:
– добавка Е339(i) – ортофосфат натрия 1-замещенный с химической формулой NaH2PO4;
– добавка Е339(ii) – ортофосфат натрия 2-замещенный с химической формулой Na2HPO4;
– добавка Е339(iii) – ортофосфат натрия 3-замещенный с химической формулой Na3PO4.
Физические свойства фосфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na3PO4 |
| Синонимы и названия иностранном языке | sodium phosphate (англ.) |
натрий фосфорнокислый трёхзамещенный (устар. рус.)
натрия ортофосфат (рус.)
тринатрий фосфат (рус.)
Получение фосфата натрия:
Фосфат натрия получается в результате следующих химических реакций:
Химические свойства фосфата натрия. Химические реакции фосфата натрия:
1. реакция фосфата натрия с нитратом серебра:
В результате реакции образуются ортофосфат серебра и нитрат натрия.
2. реакция фосфата натрия и нитрата хрома:
3. реакция фосфата натрия и нитрата галлия:
В результате реакции образуются ортофосфат галлия и нитрат натрия.
4. реакция фосфата натрия и хлорида алюминия:
В результате реакции образуются ортофосфат алюминия и хлорид натрия.
5. реакция фосфата натрия и хлорида кальция:
В результате реакции образуются ортофосфат кальция и хлорид натрия.
6. реакция фосфата натрия и хлорида бария:
В результате реакции образуются ортофосфат бария и хлорид натрия.
7. реакция фосфата натрия и сульфата железа:
В результате реакции образуются ортофосфат железа и сульфат натрия. Фосфат натрия используется в виде разбавленного раствора.
8. реакция фосфата натрия и сульфата лития:
9. реакция фосфата натрия и сульфата магния:
В результате реакции образуются ортофосфат магния (который выпадает в осадок) и сульфат натрия. Реакция уменьшения жесткости воды.
10. реакция фосфата натрия и гидрокарбоната кальция:
В результате реакции образуются ортофосфат кальция (который выпадает в осадок) и гидрокарбонат натрия. Реакция уменьшения жесткости воды.
11. реакция фосфата натрия, алюминия и воды:
12. реакция фосфата натрия, цинка и воды:
13. реакция термического разложения кристаллогидрата фосфата натрия:
14. реакция фосфата натрия с азотной кислотой:
В результате химической реакции образуются нитрат натрия и ортофосфорная кислота. Реакция носит обратимый характер.
Аналогично проходят реакции фосфата натрия и с другими сильными минеральными кислотами.
15. реакция термического разложения фосфата натрия:
Применение и использование фосфата натрия:
Фосфат натрия используется во множестве отраслей промышленности и для бытовых нужд:
– для уменьшения жесткости воды,
– в пищевой промышленности как разрыхлитель для теста (при взаимодействии с пищевой содой) и эмульгатор для плавленого сыра, колбасы, сгущённого молока,
– как пищевая добавка Е339,
– в стекольной промышленности для обесцвечивания стекла при его плавке,
– как составной компонент зубных паст и некоторых косметических препаратов.
Фосфаты натрия (Е339)

В продуктах питания чаще всего используется как антиоксидант и консервант, хотя имеет также свойства эмульгатора и стабилизатора. Кроме того, вещество выступает и регулятором кислотности, так как влияет на установление и поддержание определённого уровня кислой среды в продукте. Также оказывает влагоудерживающее действие.
Встретив в составе выбираемой пищи код Е339, покупатель может определить для себя, что продукт подвергался обработке фосфатами натрия, и решить, стоит ли его покупать и употреблять. Согласно мировым стандартам и нормам, вещество относится к пищевым добавкам низкой степени опасности.
Способы получения фосфатов натрия в лабораторных условиях
На сегодняшний день существует несколько технологий добычи фосфатов натрия: с использованием термической фосфорной кислоты, суперфосфата или кислоты, полученной сернокислотным методом.
Один из способов предполагает проведение реакции нейтрализации 25-процентной фосфорной кислоты раствором кальцинированной соды. Полученную смесь фильтруют, выпаривают до определённой плотности и кристаллизуют. Если фосфорная кислота имеет насыщенность более 40%, реакцию нейтрализации проводят при температуре 85-95 градусов Цельсия.
Суперфосфаты обрабатывают раствором сульфата натрия. Полученное вещество – мононатрийфосфат, который в кислом растворе отфильтровывают от нерастворимого остатка и выделившегося сульфата кальция, а далее также выпаривают или гранулируют в распылительной сушилке.
Химические свойства вещества
Добавка имеет вид белого порошка в гранулах или кристаллах. Она не чувствительна к термическому воздействию и хорошо растворима в воде.
Вещество Е339 используют в качестве загустителя, так как оно имеет свойство регулирования вязкости смеси, улучшения её текстуры. Как стабилизатор, добавка Е339 участвует в формировании консистенции продукта, способствует её улучшению и сохранению в неизменном виде, предохраняет пищу от пригорания в процессе термической обработки. Также фосфаты натрия нашли своё применение как эмульгаторы, так как одним из их свойств является способность создавать смеси вместе с изначально несмешиваемыми веществами, например, смесь масла и воды.
Разновидности пищевой добавки
В пищевой промышленности обычно используются такие виды фосфатов натрия;
Их химические формулы отличаются между собой, однако вещества оказывают аналогичное действие. Поэтому, увидев на упаковке продукта одно из этих обозначений, можно быть уверенным, что в нём использовались фосфаты натрия.
Применение в производстве

Особенно часто он встречается в колбасе и сосисках, мясе и рыбе: вещество работает как влагоудерживающий компонент, поэтому таким способом удаётся сохранить продукцию без потерь влаги и, соответственно, веса.
Кроме того, до 1960-х годов его масштабно использовали в производстве моющих средств и порошков. Однако, из-за избыточного попадания в водоёмы соединений азота и фосфора, качество отработанной воды, попадающей далее в водопроводы и выбрасываемой в природную среду, начало значительно ухудшаться, что могло нанести вред водной экосистеме. По этой причине начали появляться ограничения и запреты на применение вещества в подобной продукции, и сегодня их практически не используют в изготовлении порошков и моющей продукции.
Фосфаты натрия используют и в фармацевтической промышленности – их добавляют в слабительные препараты, так как вещество имеет соответствующий эффект при определённой дозировке.
Воздействие на организм человека, возможный вред от употребления
Слабительное действие вещества известно и медикам, и химикам. Продукты, которые содержат его в своём составе, должны присутствовать в рационе человека в ограниченном количестве, чтобы не спровоцировать соответствующую реакцию пищеварительного тракта.
Что касается других возможных опасностей пищевой добавки Е339, к ним относят вероятность появления заболеваний органов желудочно-кишечного тракта: гастрита, язвы, панкреатита. Однако на сегодняшний день связь между употреблением вещества и этими нарушениями официально не подтверждена.
Результаты исследований, проведённых на лабораторных животных, говорят о том, что фосфаты натрия способствуют нарушению усвоения кальция в организме, вымыванию его из костной ткани и эмали зубов.
В некоторых случаях моющие средства и порошки с содержанием Е339 становятся причиной аллергических реакций в виде кожной сыпи и покраснений.
У детей употребление продуктов с этим компонентом в составе может вызывать нервные расстройства: нарушение концентрации, агрессию, беспокойство, гиперактивность, моторное беспокойство. Для них следует ограничить количество пищи с добавкой Е339.
По некоторым неподтверждённым данным, фосфаты натрия обладают онкогенным эффектом, то есть могут вызывать онкологические заболевания органов пищеварительного тракта. Кроме возможной терапии от запоров, на сегодняшний день ничего не известно о пользе вещества для здоровья человека.
Пока производители идут по пути удешевления себестоимости выпускаемой пищевой продукции, на этикетках разнообразной пищи будут обозначаться добавки с кодом “Е”, в том числе, Е339. Компонент используется как антислёживатель, эмульгатор, антиоксидант и загуститель: с его помощью улучшают вкусовые и текстурные характеристики пищи, при этом он является дешёвым и выгодным для производителей ингредиентом.
Фосфаты натрия относятся к веществам с крайне низким уровнем опасности для человека, их использование разрешено в Украине, России и странах Европейского союза. Кроме угрозы нарушения кальциевого обмена в организме, никакая другая информация о возможном вреде здоровью пока не подтверждена официально. Тем не менее исследования по вопросам влияния фосфатов натрия на человека продолжаются и сегодня.
Фосфат натрия
Характеристики и физические свойства фосфата натрия
Он хорошо растворяется в воде (гидролизуется), создавая щелочную среду.
Рис. 1. Фосфат натрия. Внешний вид.
Основные характеристики фосфата натрия приведены в таблице ниже:
Молярная масса, г/моль
Температура плавления, o С
Растворимость в воде (0 o С), г/100 мл
Получение фосфата натрия
Лабораторные способы получения фосфата натрия предполагают действие ортофосфорной кислоты на соли натрия (1) или гидроксид натрия (2):
Химические свойства фосфата натрия
Фосфат натрия – это средняя соль, образованная сильным основанием – гидроксидом натрия (NaOH) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН — свидетельствует о щелочном характере среды.
3Na + + PO4 3- + HOH ↔ HPO4 2- + 3Na + + OH — ;
Для фосфата натрия характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
— разложение при нагревании
Применение фосфата натрия
Фосфат натрия нашел применение в пищевой промышленности – добавка Е542, используемая при производстве макаронных изделий, кисломолочных продуктов, мясных и кулинарных полуфабрикатов. Он также является составным компонентом зубных паст и некоторых косметических препаратов.
Примеры решения задач
| Задание | Какая масса оксида фосфора (V)образуется в ходе реакции термического разложения фосфата натрия массой 200 г? |
| Решение | Запишем уравнение реакции термического разложения фосфата натрия: |
Рассчитаем количество вещества фосфата натрия (молярная масса – 164 г/моль):
Найдем массу образовавшегося оксида фосфора (V) (молярная масса – 284 г/моль):
| Задание | Какая масса фосфата лития образуется в результате взаимодействия 250 г фосфата натрия с сульфатом лития? |
| Решение | Запишем уравнение реакции фосфата натрия с сульфатом лития с образованием твердого продукта — фосфата лития: |
Рассчитаем количество вещества фосфата натрия (молярная масса – 164 г/моль):
Найдем массу образовавшегося фосфата лития (молярная масса – 94 г/моль):
Ортофосфат натрия
Фосфат натрия (ортофосфат натрия) — натриевая соль ортофосфорной кислоты с химической формулой Na3PO4.
Описание
Фосфат натрия — соль. Белого цвета, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагирует в растворе с цинком и алюминием. Вступает в реакции ионного обмена.
Получение
Применение
Использование фосфата натрия в стиральных порошках запрещено во многих странах для уменьшения эвтрофикации водоемов.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Ортофосфат натрия» в других словарях:
ортофосфат натрия — (Na3PO4X12H2O) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN trisodium phosphate … Справочник технического переводчика
вторичный ортофосфат натрия — двузамещённый фосфорнокислый натрий … Cловарь химических синонимов I
первичный ортофосфат натрия — однозамещённый фосфорнокислый натрий … Cловарь химических синонимов I
третичный ортофосфат натрия — трёхзамещённый, ортофосфорнокислый натрии, трёхзамещённый фосфорнокислый натрий … Cловарь химических синонимов I
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
Ортофосфат марганца(II) — Общие Систематическое наименование Ортофосфат марганца(II) Традиционные названия Фосфорнокислый марганец Химическая формула Mn3(PO4)2 Физические свойства … Википедия
Ортофосфат хрома(III) — Общие Систематическое наименование Ортофосфат хрома(III) Традиционные названия Фосфорнокислый хром Химическая формула CrPO4 Физические свойства … Википедия
Ортофосфат свинца(II) — Общие Систематическое наименование Ортофосфат свинца Традиционные названия Фосфорнокислый свинец Химическая формула Pb3(PO4)2 Физические свойства … Википедия
Ортофосфат меди(II) — Ортофосфат меди(II) … Википедия
Ортофосфат серебра(I) — Ортофосфат серебра (I) … Википедия
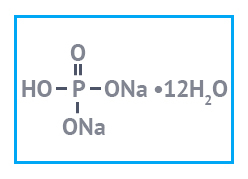
Натрий фосфорнокислый 2-замещенный — популярная пищевая добавка
Натрий фосфорнокислый 2-замещенный — неорганическое 
Получают реактив взаимодействием раствора гидроокиси натрия NaOH с раствором фосфорной кислоты H3PO4 или с дигидрофосфатом натрия NaH2PO4.
Свойства
Сыпучее вещество, состоящее из бесцветных прозрачных кристалликов или гранул. Водорастворимо, гигроскопично. Образует кристаллогидраты с 2-мя, 7-ю и 12-ю молекулами воды. Плохо растворяется в этиловом спирте. При нагревании кристаллогидрата он сначала теряет воду, а потом разлагается до пирофосфата Na4P2O4. При хранении на открытом сухом воздухе кристаллогидраты постепенно теряют влагу, выветриваются.
Раствор имеет слегка щелочную реакцию. Вступает в реакции со щелочами c образованием солей фосфорной кислоты. В результате взаимодействия с фосфорной кислотой получается дигидрофосфат NaH2PO4. Обменные реакции с солями сильных кислот приводят к образованию новых солей.
 |  |
| Перчатки «Бай Колор» (Ansell) р. 8,5-9 | Натрий фосфорнокислый 2-замещенный, 12 водный ХЧ |
Меры предосторожности
Попадание раствора, пыли или аэрозоля вещества на кожу, слизистые глаз или органов дыхания вызывает раздражение.
Большая передозировка медицинских препаратов, содержащих гидрофосфат натрия, может оказать резко негативное влияние на почки, сердце и даже привести к смерти. Особенно осторожно нужно использовать такие средства для детей младше 5 лет, пожилым людям, пациентам с заболеваниями кишечника, почек.
Внимание! Не пользуйтесь препаратами, содержащими динатрий фосфат, без консультации с врачом, даже если это безрецептурный препарат.
Работать с реактивом следует в помещении, снабженным принудительной общей вентиляцией. Сотрудник должны использовать средства защиты: спец. одежду с длинными рукавами, резиновые перчатки, маску или респиратор и защитные очки.
Хранят гидрофосфат натрия в герметичной таре, защищая от влаги воздуха, на крытых отапливаемых складах. Перевозят любым видом транспорта.
Применение
Производство гидрофосфата натрия относится к многотоннажному.














