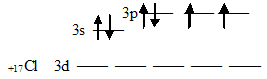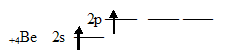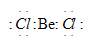хлорид бария какая связь
Хлорид бария какая связь




3. Химическая связь
4. Степ. окисл. Валентн.
5. Строение вещества
7. Простые вещества
12. Строение орг. в-в
17. Азотсодерж. соед.
19. Классиф. реакций
20. Скорость реакции
21. Электр. дисс. РИО
22. Хим. лаборатория
25. Термохим. расчеты
26. Расч. по уравнен.
33. Качествен. реакции
38. Органич. цепочки
39. Раствор и реакции
Виртуальная химическая школа
Тестовый практикум по ЕГЭ
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
3. Соединение с ионной связью образуется при взаимодействии
4. В каком ряду все вещества имеют ковалентную полярную связь?
5. В каком ряду записаны формулы веществ только с ковалентной полярной
связью?
7. Веществом с ковалентной полярной связью является
8. Веществом с ковалентной связью является
1) СаС1 2 2) MgS 3) H 2 S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
10. Веществами с неполярной ковалентной связью являются
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
2) ковалентная полярная
3) ковалентная неполярная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р 4 4) СаС l 2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
2) ковалентную неполярную
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1> ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
16. Водородные связи образуются между молекулами
1) диметилового эфира
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
19. Водородная связь не характерна для вещества
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3> брома 4> иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
27. Полярность связи наиболее выражена в молекулах
28. В молекуле какого вещества химические связи наиболее прочные?
Описание электронного строения и геометрической структуры молекулы хлорида бария
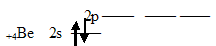
Неспаренный электрон участвует в образовании ковалентной связи с атомом бериллия. Атом бериллия в основном состоянии (1s 2 2s 2 2p 0 ) неспаренных электронов не имеет:
Соответственно, для участия в образовании химических связей по обычному ковалентному механизму атом бериллия должен перейти в возбуждённое состояние (1s 2 2s 1 2p 1 ):
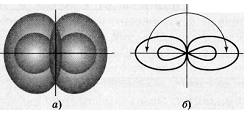
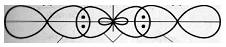
Рис. 1. Взаимное расположение sp-гибридных
орбиталей одного атома
Рис. 2. Трёхатомная молекула BeCl2
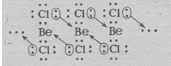
При переходе BeCl2 в твёрдое состояние тип гибридизации изменяется. Между отдельными молекулами BeCl2 возникают новые ковалентные связи. В итоге при конденсации BeCl2 образуются линейные полимерные цепи. Объяснить это можно тем, что в общее число электронов в молекуле BeCl2 недостаточно для того, чтобы целиком заполнить внешний электронный слой атома бериллия. Так в молекуле BeCl2:
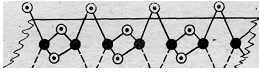
В наружном слое атома бериллия имеются две свободные р-орбитали, а у атома хлора имеются неподелённые электронные пары; поэтому атом Ве способен быть акцептором неподелённых электронных пар, а атом Cl – донором. При охлаждении газообразного хлорида бериллия между отдельными молекулами BeCl2 возникают ковалентные связи по донорно-акцепторному механизму (рис. 3.). При конденсации BeCl2 возникает линейный полимер, в котором атомы хлора играют роль мостиков, связывающих атомы бериллия. (рис. 4.).
Рис. 3. Ковалентные связи по донорно-акцепторному
механизму между молекулами BeCl 2
Рис. 4. Схема строения линейного полимера
(BeCl2)n
Тетрагидроксобериллат калия и тетрафторобериллат натрия
Задача 1009.
Написать формулы тетрагидроксобериллата калия и тетрафторобериллата натрия. Как можно получить эти соединения?
Решение:
Для бериллия характерно то, что в водных растворах щелочей он растворяется с образованием гидроксобериллата:
Здесь атом бериллия находится в состоянии sр-гибридизации, поэтому ион [BeF4] 2- построен в форме тетраэдра.
Хлорид бария какая связь
В приведённой ниже таблице представлены примеры формул веществ с ковалентной и ионной химической связью.
Примеры формул веществ
| С ковалентной химической связью | С ионной химической связью |
Используя данную информацию, определите вид химической связи:
1) в хлориде бария ;
2) в молекуле азота .
Запишите ответ в отведённом месте:
2) в молекуле азота
Хлорид бария — вещество с ионной химической связью.
Азот — вещество с ковалентной неполярной химической связью.
Ответ: Хлорид бария — ионная химическая связь, азот — ковалентная химическая связь.
Хлорид бария
Характеристики и физические свойства хлорида бария
Он хорошо растворяется в воде, при этом не подвергаясь гидролизу, так как образован сильной кислотой и сильным основанием.
Рис. 1. Хлорид бария. Внешний вид.
Основные характеристики хлорида бария приведены в таблице ниже:
Молярная масса, г/моль
Температура плавления, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение хлорида бария
В лабораторной практике для получения хлорида бария используют следующие реакции:
Химические свойства хлорида бария
В водном растворе хлорид бария диссоциирует на ионы:
Он хорошо растворяется в концентрированной азотной кислоте и разлагается серной, но нерастворим в концентрированной хлороводородной кислоте.
Хлорид бария вступает в реакции обмена с другими солями только в случае образования в качестве продуктов нерастворимого вещества, газообразного или малодиссоциирующего соединения:
Применение хлорида бария
Хлорид бария используют в кожевенном деле, при производстве керамических изделий, пигментов, а также в химическом анализе, как качественный реактив для обнаружения сульфат-анионов.
Примеры решения задач
| Задание | Вычислите массу хлорида бария, который может прореагировать с концентрированным раствором серной кислоты объемом 100 мл (массовая доля H2SO4 98%, плотность 1,8365 г/мл). Определите объем хлороводорода, выделяющийся в результате этой реакции. |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора серной кислоты, а также массу растворенного вещества H2SO4 в нем:
msolution =100 × 1,8365 = 183,65г.
Рассчитаем количество моль серной кислоты (молярная масса равна 98 г/моль):
Согласно уравнению реакции n (H2SO4) :n (HCl) = 1: 2. Значит,
n(HCl) = 2 × n(H2SO4) = 2 × 1,84 = 3,86 моль.
Тогда, объем выделившегося хлороводорода будет равен:
V (HCl) = 3,86 × 22,4 = 82,432 л.
Согласно уравнению реакции n(H2SO4) :n (BaCl2) = 1: 1. Значит,количество вещества карбоната хлорида бария равно:
Тогда масса хлорида бария, вступившего в реакцию будет равна (молярная масса – 208 г/моль):
m (BaCl2) = 1,84 × 208 = 382,72г.
| Задание | Вычислите массу бария, который необходим для получения хлорида бария массой 7,9 г по реакции взаимодействия с хлором. |
| Решение | Запишем уравнение реакции взаимодействия бария и хлора с образованием хлорида бария: |
Рассчитаем число моль хлорида бария (молярная масса – 208 г/моль):
n (BaCl2) = 7,9 / 208 = 0,04моль.
Согласно уравнению реакции n(BaCl2) :n(Ba) = 1:1, значит,
Масса бария необходимого для получения хлорида бария по реакции взаимодействия с хлоромравна (молярная масса – 137 г/моль):
Хлорид бария
| Хлорид бария | |
 | |
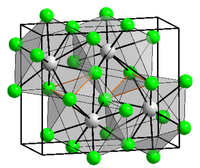 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид бария |
| Традиционные названия | Хлористый барий |
| Химическая формула | BaCl2 |
| Эмпирическая формула | BaCl2 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 208,246 г/моль |
| Плотность | 3,92 (20 °C) г/см³ |
| Термические свойства | |
| Температура плавления | 962 °C |
| Температура кипения | 1560 °C |
| Энтальпия образования (ст. усл.) | -860,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 36,2 (20 °C) [1] г/100 мл |
| Классификация | |
| Рег. номер CAS | 10361-37-2 |
Содержание
Описание
Получение
1. Взаимодействие металлического бария с хлором:
Химические свойства
1. Взаимодействие с растворами солей (реакция идёт, если образуется нерастворимое вещество):
2. Взаимодействие с некоторыми кислотами (реакция идёт, если образуется нерастворимое вещество):
Применение
См. также
Примечания
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлорид бария» в других словарях:
хлорид бария — хлористый барий … Cловарь химических синонимов I
Хлорид цезия — Хлорид цезия … Википедия
Хлорид вольфрама(VI) — Общие … Википедия
Хлорид титана(IV) — Хлорид титана(IV) … Википедия
Хлорид вольфрама(II) — Общие Систематическое наименование Хлорид вольфрама(II) Традиционные названия Хлористый вольфрам; гексамер дихлорида вольфрама Химическая формула WCl2 Физические свойства … Википедия
Хлорид вольфрама(IV) — Общие Систематическое наименование Хлорид вольфрама(IV) Традиционные названия хлористый вольфрам Химическая формула WCl4 Физические свойства Сос … Википедия
Хлорид вольфрама(V) — Общие Систематическое наименование Хлорид вольфрама(V) Традиционные названия Хлористый вольфрам Химическая формула WCl5 Физические свойства Состо … Википедия
Хлорид молибдена(II) — Общие Систематическое наименование Хлорид молибдена(II) Традиционные названия Хлористый молибден; гексамер дихлорида молибдена Химическая формула MoCl2 Физические свойства … Википедия
Хлорид молибдена(III) — Общие Систематическое наименование Хлорид молибдена(III) Традиционные названия Хлористый молибден Химическая формула MoCl3 Физические свойства … Википедия
Хлорид молибдена(IV) — Общие Систематическое наименование Хлорид молибдена(IV) Традиционные названия Хлористый молибден Химическая формула MoCl4 Физические свойства Со … Википедия