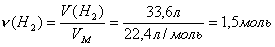хлорид натрия какой электролит
Хлорид натрия какой электролит
Одним из способов получения металлов является электролиз. Активные металлы встречаются в природе только в виде химических соединений. Как выделить из этих соединений в свободном состоянии?
Электролизом называются процессы, происходящие при пропускании через растворы или расплавы электролитов электрического тока.
Процессы, происходящие при электролизе растворов и расплавов электролитов, достаточно сильно отличаются. Рассмотрим подробно оба этих случая.
Хлорид-ионы теряют электроны, то есть происходит их окисление.
Запишем вместе уравнения процессов, происходящих на катоде и аноде
Сложим вместе оба уравнения и получим общее уравнение реакции.
2 NaCl = 2 Na + Cl 2 (молекулярное уравнение реакции)
Пример 2. Электролиз расплава гидроксида натрия.
На поверхности катода происходит восстановление катионов натрия, при этом образуются атомы натрия:
На поверхности анода окисляются гидрокисд-ионы, при этом выделяется кислород и образуются молекулы воды:
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Na + + e à Na
Число электронов, участвующих в реакции восстановления катионов натрия и в реакции окисления гидроксид-ионов, должно быть одинаковым. Поэтому умножим первое уравнение на 4:
катод (-) Na + + e à Na 4
Сложим вместе оба уравнения и получим уравнение реакции электролиза:
4 NaOH à 4 Na + 2 H 2 O + O 2
Пример 3. Рассмотрим электролиз расплава Al 2 O 3
Число электронов, участвующих в процессах восстановления катионов алюминия и окисления ионов кислорода, должно быть равно, поэтому умножим первое уравнение на 4, а второе на 3:
2 O 2- – 4 e à O 2 3
Сложим оба уравнения и получим общее уравнение электролиза:
4 Al 3+ + 6 O 2- à 4 Al 0 +3 O 2 0 (ионное уравнение реакции)
На аноде может происходить окисление молекул воды с выделением кислорода:
Поэтому на катоде могут восстанавливаться либо катионы электролита, либо молекулы воды. Эти два процесса как бы конкурируют между собой. Какой процесс в действительности происходит на катоде, зависит от природы металла. Будут ли на катоде восстанавливаться катионы металла или молекулы воды, зависит от положения металла в ряду напряжений металлов.
Li K Na Ca Mg Al ¦¦ Zn Fe Ni Sn Pb (H2) ¦¦ Cu Hg Ag Au
Если металл находится в ряду напряжений правее водорода, на катоде восстанавливаются катионы металла и выделяется свободный металл. Если металл находится в ряду напряжений левее алюминия, на катоде восстанавливаются молекулы воды и выделяется водород. Наконец, в случае катионов металлов от цинка до свинца может происходить либо выделение металла, либо выделение водорода, а иногда одновременно выделяются и водород, и металл. Вообще это довольно сложный случай, многое зависит от условий реакции: концентрации раствора, сипы электрического тока и других.
Пример 1. Давайте рассмотрим электролиз водного раствора хлорида натрия.
катод (-) 2 Na + ; 2 H + ; 2Н + + 2е à Н 0 2
Химическая активность анионов в ряду уменьшается.
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
Анионы кислородсодержащих кислот не окисляются на аноде ( ряд активности анионов), происходит окисление молекул воды:
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
В процессах восстановления участвуют 4 электрона и в процессе окисления тоже участвуют 4 электрона. Сложим вместе эти уравнения и получим общее уравнение реакции:
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 +2 H 2 О + O 2 + 2 H +
Сократим по две молекулы воды в обеих частях уравнения:
Ni 2+ +2 H 2 О à Ni 0 + H 2 + O 2 + 2 H +
Таким образом, у нас при электролизе раствора сульфата никеля ( II ) на катоде выделяется водород и никель, а на аноде – кислород.
Пример 3. Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия с инертным анодом.
Стандартный электродный потенциал системы Na + + e = Na 0 значительно отрицательнее потенциала водного электрода в нейтральной водной среде (-0,41 В).Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода
2 H 2 O – 4е à O 2 + 4 H +
поскольку отвечающий этой системе стандартный электродный потенциал (1,23 В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему
Умножая уравнение катодного процесса на два, и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза:
Приняв во внимание, что одновременно происходит накопление ионов в катодном пространстве и ионов в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве).
Катод (-) 2+ + SO4 2- à анод (+)
катод (-) Cu 2+ + 2e à Cu 0 2
анод (+) 2H2O – 4 е à O2 + 4H + 1
катод (-) Cu 2+ + 2e à Cu 0
В обоих уравнениях участвуют по два электрона.
CuCl 2 à Cu + Cl 2 (молекулярное уравнение)
катод (-) Ag + + e à Ag 0
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 (ионное уравнение)
4 AgNO 3 + 2 H 2 O à 4 Ag 0 + 4 HNO 3 + O 2 (молекулярное уравнение)
катод (-) 2 H + + 2 e à H 2
2 HCl à H 2 + Cl 2 (молекулярное уравнение)
Катод (-) + + SO4 2- à анод (+)
катод (-) 2H+ + 2e à H2
Катионы калия не будут восстанавливаться на катоде, так как калий находится в ряду напряжения металлов левее алюминия, вместо этого будет происходить восстановление молекул воды:
катод (-) 2H2O + 2e à H2 + 2OH- 2
анод (+) 2H2O – 4 е à O2 + 4H+ 1
При пропускании электрического тока через растворы кислородосодержащих кислот, щелочей и солей кислородсодержащих кислот с металлами, находящимися в ряду напряжения металлов, левее алюминия, практически происходит электролиз воды. При этом на катоде выделяется водород, а на аноде кислород.
Выводы. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
4 HOH – 4 e à 2 H 2 O + O 2 + 4 H +
З а дача 1. При электролизе раствора сульфата меди на катоде выделилось 48 г меди. Найдите объем газа, выделившегося на аноде, и массу серной кислоты, образовавшейся в растворе.
Сульфат меди в растворе диссоциирует ни ионы Си 2+ и S 04 2 ‘.
2H20-4e- = 4H + + 02 
Общее уравнение электролиза:
2Cu2+ + 2H2O = 2Cu + 4H+ + O2 (краткоеионное уравнение)
Добавим в обе части уравнения по 2 сульфат-иона, которые образуются при диссоциации сульфата меди, получим полное ионное уравнение:
2Си2+ + 2S042″ + 2Н20 = 2Cu + 4Н+ + 2SO4 2′ + О2
Перепишем уравнение в молекулярном виде:
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + О2
Молярная масса меди равна 64 г/моль, вычислим количество вещества меди:
По уравнению реакции при выделении на катоде 2 моль меди ла аноде выделяется 1 моль кислорода. На катоде выделилось 0,75 моль меди, пусть на аноде выделилось х моль кислорода. Составим пропорцию:
На аноде выделилось 0,375 моль кислорода,
Вычислим объем выделившегося кислорода:
V(O2) = v(O2)«VM = 0,375 моль«22,4 л/моль = 8,4 л
По уравнению реакции при выделении на катоде 2 моль меди в растворе образуется 2 моль серной кислоты, значит, если на катоде выделилось 0,75 моль меди, то в растворе образовалось 0,75 моль серной кислоты, v(H2SO4) = 0,75 моль. Вычислим молярную массу серной кислоты:
M(H2SO4) = 2-1+32+16-4 = 98 г/моль.
Вычислим массу серной кислоты:
m(H2S04) = v(H2S04>M(H2S04) = = 0,75 моль«98 г/моль = 73,5 г.
Ответ: на аноде выделилось 8,4 л кислорода; в растворе образовалось 73,5 г серной кислоты
Задача 2. Найдите объем газов, выделившихся на катоде и аноде, при электролизе водного раствора, содержащего 111,75 г хлорида калия. Какое вещество образовалось в растворе? Найдите его массу.
Хлорид калия в растворе диссоциирует на ионы К+ и Сl:
Ионы калия не восстанавливаются на катоде, вместо этого происходит восстановление молекул воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 20Н- |1
Общее уравнение электролиза:
2СГl+ 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение) В растворе присутствуют также ионы К+, образовавшиеся при диссоциации хлорида калия и не участвующие в реакции:
2К+ + 2Сl + 2Н20 = Н2 + 2К+ + 2ОН’ + С12
Перепишем уравнение в молекулярном виде:
2КС1 + 2Н2О = Н2 + С12 + 2КОН
На катоде выделяется водород, на аноде хлор, в растворе образуется гидроксид калия.
В растворе содержалось 111,75 г хлорида калия.
Вычислим молярную массу хлорида калия:
М(КС1) = 39+35,5 = 74,5 г/моль
Вычислим количество вещества хлорида калия:

По уравнению реакции при электролизе 2 моль хлорида калия выделяется 1 моль хлора. Пусть при электролизе 1,5 моль хлорида калия выделяется х моль хлора. Составим пропорцию:
Выделится 0,75 моль хлора, v(C!2) = 0,75 моль. По уравнению реакции при выделении 1 моль хлора на аноде на катоде выделяется 1 моль водорода. Следовательно, если на аноде выделится 0,75 моль хлора, то на катоде выделится 0,75 моль водорода, v(H2) = 0,75 моль.
Вычислим объем хлора, выделившегося на аноде:
V(C12) = v(Cl2)-VM = 0,75 моль«22,4 л/моль = 16,8 л.
Объем водорода равен объему хлора:
По уравнению реакции при электролизе 2 моль хлорида калия образуется 2 моль гидроксида калия, значит, при электролизе 0,75 моль хлорида калия образуется 0,75 моль гидроксида калия. Вычислим молярную массу гидроксида калия:
Вычислим массу гидроксида калия:
m(KOH) = v(KOH>M(KOH) = 0,75 моль-56 г/моль = 42 г.
Ответ: на катоде выделилось 16,8 л водорода, на аноде выделилось 16,8 л хлора, в растворе образовалось 42 г гидроксида калия.
Задача 3. При электролизе раствора 19 г хлорида двухвалентного металла на аноде выделилось 8,96 л хлора. Определите, хлорид какого металла подвергли электролизу. Вычислите объем водорода, выделившегося на катоде.
Обозначим неизвестный металл М, формула его хлорида МС12. На аноде окисляются хлорид-ионы и выделяется хлор. В условии сказано, что на катоде выделяется водород, следовательно, происходит восстановление молекул воды:
2Н20 + 2е- = Н2 + 2ОH |1
Общее уравнение электролиза:
2Сl + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
В растворе присутствуют также ионы М2+, которые при реакции не изменяются. Запишем полное ионное уравнение реакции:
2СГ + М2+ + 2Н2О = Н2 + М2+ + 2ОН- + С12
Перепишем уравнение реакции в молекулярном виде:
Найдем количество вещества выделившегося на аноде хлора:
По уравнению реакции при электролизе 1 моль хлорида неизвестного металла выделяется 1 моль хлора. Если выделилось 0,4 моль хлора, то электролизу подвергли 0,4 моль хлорида металла. Вычислим молярную массу хлорида металла:
Молярная масса хлорида неизвестного металла 95 г/моль. На два атома хлора приходится 35,5»2 = 71 г/моль. Следовательно, молярная масса металла равна 95-71 = 24 г/моль. Этой молярной массе соответствует магний.
По уравнению реакции на 1 моль выделившегося на аноде хлора приходится 1 моль выделившегося на катоде водорода. В нашем случае на аноде выделилось 0,4 моль хлора, значит, на катоде выделилось 0,4 моль водорода. Вычислим объем водорода:
V(H2) = v(H2>VM = 0,4 моль«22,4 л/моль = 8,96 л.
Ответ: электролизу подвергли раствор хлорида магния; на катоде выделилось 8,96 л водорода.
*3адача 4. При электролизе 200 г раствора сульфата калия с концентрацией 15% на аноде выделилось 14,56 л кислорода. Вычислите концентрацию раствора по окончании электролиза.
В растворе сульфата калия и на катоде, и на аноде реагируют молекулы воды:
2Н20 + 2е’ = Н2 + 20Н- |2
Сложим вместе оба уравнения:
6Н2О = 2Н2 + 4ОН» + 4Н+ + О2, или
6Н2О = 2Н2 + 4Н2О + О2, или
Фактически при электролизе раствора сульфата калия происходит электролиз воды.
Концентрация растворенного вещества в растворе определяется по формуле:
С=m(растворенного вещества) 
Чтобы найти концентрацию раствора сульфата калия по окончании электролиза, необходимо знать массу сульфата калия и массу раствора. Масса сульфата калия при реакции не изменяется. Вычислим массу сульфата калия в исходном растворе. Обозначим концентрацию исходного раствора Сь
m(K2S04) = C2 (K2S04 ) 

Масса раствора во время электролиза изменяется, так как часть воды превращается в водород и кислород. Вычислим количество вещества выделившегося кислорода:

По уравнению реакции из 2 моль воды образуется 1 моль кислорода. Пусть 0,65 моль кислорода выделяется при разложении х моль воды. Составим пропорцию:
Разложилось 1,3 моль воды, v(H2O) = 1,3 моль.
Вычислим молярную массу воды:
Вычислим массу разложившейся воды:
m(H2O) = v(H2O>M(H2O) = 1,3 моль* 18 г/моль = 23,4 г.
Масса раствора сульфата калия уменьшилась на 23,4 г и стала равна 200-23,4 = 176,6 г. Вычислим теперь концентрацию раствора сульфата калия по окончании электролиза:
С2 (K2 SO4 )=m(K2 SO4 ) 

Ответ: концентрация раствора по окончании электролиза равна 17%.
*3адача 5. 188,3 г смеси хлоридов натрия и калия растворили в воде и пропустили через полученный раствор электрический ток. При электролизе на катоде выделилось 33,6 л водорода. Вычислите состав смеси в процентах по массе.
После растворения смеси хлоридов калия и натрия в воде в растворе содержатся ионы К+, Na+ и Сl-. Ни ионы калия, ни ионы натрия не восстанавливаются на катоде, восстанавливаются молекулы воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 2ОН» ] 1
Общее уравнение электролиза:
2СГ + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
Полные ионные уравнения реакций электролиза хлорида натрия и хлорида калия.
2К+ + 2Cl 

2Na+ + 2С1 

Перепишем уравнения в молекулярном виде:
2КС1 + 2Н20 = Н2 + С12 + 2КОН
2NaCl + 2Н2О = Н2 + С12 + 2NaOH
Обозначим количество вещества хлорида калия, содержащегося в смеси, х моль, а количество вещества хлорида натрия у моль. По уравнению реакции при электролизе 2 моль хлорида натрия или калия выделяется 1 моль водорода. Поэтому при электролизе х моль хлорида калия образуется х/2 или 0,5х моль водорода, а при электролизе у моль хлорида натрия 0,5у моль водорода. Найдем количество вещества водорода, выделившегося при электролизе смеси:
Составим уравнение: 0,5х + 0,5у =1,5
Вычислим молярные массы хлоридов калия и натрия:
М(КС1) = 39+35,5 = 74,5 г/моль
M(NaCl) = 23+35,5 = 58,5 г/моль
Масса х моль хлорида калия равна:
m(KCl) = v(KCl)-M(KCl) = х моль-74,5 г/моль = 74,5х г.
Масса у моль хлорида натрия равна:
m(KCl) = v(KCl)-M(KCl) = у моль-74,5 г/моль = 58,5у г.
Масса смеси равна 188,3 г, составим второе уравнение:
Итак, решаем систему из двух уравнений с двумя неизвестными:
Из первого уравнения выразим х:
Подставим это значение х во второе уравнение, получим:
223,5-74,5у + 58,5у= 188,3
Найдем теперь значение х:
В смеси содержится 0,8 моль хлорида калия и 2,2 моль хлорида натрия.
Вычислим массу хлорида калия и хлорида натрия:
m(KCl) = v(KCl) 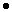
m(KCl) = v(KCl) 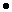
Вычислим массовую долю хлорида калия в смеси:
w(KCl)=m(KCl) 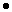
Вычислим массовую долю хлорида натрия:
Ответ: в смеси содержится 31,65% хлорида калия и 68,35% хлорида натрия.
Натрия хлорид инъекции белмед : инструкция по применению
Описание
Прозрачный бесцветный раствор.
Состав
активное вещество: натрия хлорид – 18 мг;
вспомогательное вещество – вода для инъекций.
Фармакотерапевтическая группа
Фармакологическое действие
Ионы натрия и хлора являются важнейшими неорганическими компонентами внеклеточной жидкости, поддерживающими соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. Изотоничен плазме крови человека.
Показания к применению
Растворение и разведение лекарственных средств.
Способ применения и дозы
Перед использованием препарата натрия хлорид, растворителя для приготовления лекарственных форм для инъекций для растворения и разведения лекарственных препаратов, необходимо ознакомиться с инструкцией по применению данных препаратов. Применяют внутривенно, внутримышечно, подкожно в зависимости от способа введения основного лекарственного средства. Применяют также наружно и местно.
В процессе приготовления лекарственных форм с использованием натрия хлорида, растворителя для приготовления лекарственных форм для инъекций, необходимо соблюдать правила асептики (вскрытие ампул, наполнение шприца или других емкостей с лекарственными препаратами).
Количество натрия хлорида, растворителя для приготовления лекарственных форм для инъекций, подбирается исходя из необходимой концентрации растворяемого/разводимого препарата или концентрата электролитов.
Внутривенно вводят в объеме 5-10 мл. При внутримышечном и подкожном введении объем раствора натрия хлорида варьирует в зависимости от растворяемого лекарственного средства и способа введения (1-5 мл). Перед применением’ раствор натрия хлорида рекомендуется подогреть до температуры 36-38 °C.
Побочное действие
При использовании изотонического раствора натрия хлорида в качестве растворителя и разбавителя для лекарственных средств побочные эффекты редки.
Подкожное введение: любое дополнение к изотоническому раствору может сделать его гипертоническим, что может стать причиной болезненности в месте инъекции.
Сообщение о нежелательном действии
Если у Вас появились побочные эффекты, сообщите об этом своему лечащему врачу. Это также относится к любым побочным эффектам, которые не указаны в данной инструкции. Вы также можете сообщить о нежелательных реакциях в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов, выявленным на территории государства (УП «Центр экспертиз и испытаний в здравоохранении М3 РБ», rceth.by). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Противопоказания
Несовместимость основного лекарственного средства и изотонического раствора натрия хлорида 9 мг/мл, гипернатриемия, ацидоз, гиперхлоремия, гипокалиемия, внеклеточная гипергидратация; циркуляторные нарушения, угрожающие отеком мозга и легких; отек мозга, отек легких, острая ЛЖ недостаточность, сопутствующее назначение ГКС в больших дозах.
Передозировка
При введении рекомендуемых объемов раствора натрия хлорида передозировка маловероятна. В больших количествах может привести к развитию хлоридного ацидоза, повышенной элиминации калия (гипокалиемии), гипергидратации.
Меры предосторожности
Большие объемы изотонического раствора натрия хлорида применяют с осторожностью у больных с хронической почечной недостаточностью (олигоанурия), хронической сердечной недостаточностью, при гипокалиемии.
Не применять растворы с изменившимися при растворении физическими свойствами.
Перед растворением препарата следует проверить, возможно ли применение Натрия хлорида, раствора для инъекций изотонического 9 мг/мл для растворения/разведения данного препарата.
Препарат использовать непосредственно после вскрытия ампулы или после приготовления готовых к применению лекарственных форм.
Ампулы только для одноразового применения. Оставшиеся неиспользованными объемы препарата подлежат уничтожению.
Раствор использовать только если он прозрачен и ампула не повреждена.
С точки зрения микробиологиеской безопасности готовые к применению лекарственные формы, полученные при разведении/разбавлении препаратом натрия хлорид, растворитель для приготовления лекарственных форм для инъекций с соблюдением правил асептики, должны быть использованы немедленно.
Влияние на способность к управлению автотранспортом и другими потенциально опасными механизмами
Влияние на способность к управлению транспортными средствами и механизмами определяется инструкцией того препарата, для растворения/разведения которого применяется натрия хлорид, растворитель для приготовления лекарственных форм для инъекций.
Применение во время беременности и в период лактации
Применение при беременности и в период грудного вскармливания определяется инструкцией того препарата, для растворения/разведения которого будет применяться натрия хлорид, растворитель для приготовления лекарственных форм для инъекций.
Взаимодействие с другими лекарственными средствами
Использовать в соответствии с инструкцией по медицинскому применению основного лекарственного средства. При смешивании с другими лекарственными средствами необходимо визуально контролировать совместимость (тем не менее, возможна невидимая и терапевтическая несовместимость).
Упаковка
По 2 мл в ампулах. По 10 ампул вместе с инструкцией по применению помещают в коробку. По 5 ампул помещают в контурную ячейковую упаковку, по 1 или 2 контурные ячейковые упаковки вместе с инструкцией по применению помещают в пачку.