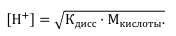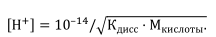Как индикаторы действуют на кислоты
Кислоты, их состав, действие на индикаторы
« Кислоты, их состав, действие на индикаторы. »
Цели урока: уметь распознавать растворы кислот с помощью индикаторов; уметь определять класс неорганических веществ – кислоты, их состав и принципы составления формул по соответствующим оксидам; уметь классифицировать кислоты по составу и называть их; уметь записывать общие способы получения кислот.
- Эксперимент(ы) к уроку (можно провести в виде минилабораторной работы ):
(до урока на дем. столе) 3 комплекта штативов с промаркированными пробирками,
(на уроке) из капельницы Шустера добавляем поочередно в каждый комплект
кислот индикаторы лакмус, фенолфталеин, метилоранж.
Постановка проблемы и актуализация знаний
Два урока мы говорили об оксидах, в частности, об оксидах неметаллов. Какой способ получения оксидов неметаллов вам известен?
Что происходит при растворении оксидов неметаллов (не всех) в воде?
Что значит «соответствующего»?
Как определяли образование кислоты при растворении оксида в воде?
Что означает понятие «индикатор»?
Можно получить, сжигая простые вещества неметаллы. Если сжигать неметаллы с избытком кислорода образуются высшие оксиды (в них неметаллы проявляют максимальную валентность).
Образуется кислота соответствующего оксида.
Валентности неметалла в оксиде и валентность этого же неметалла в кислоте равны.
Использовали индикатор лакмус, который в растворах кислот краснеет.
Индикатор должен что-то показывать, в данном случае изменением окраски показывает наличие кислоты.
(работа с учебником)
Проверим предположение по учебнику (стр.151, 2-ой абзац текста).
Существуют ли другие индикаторы?
Как с их помощью доказать наличие кислот в растворах?
1-ая подтема (на доске) в план открытия нового знания
Сформулируйте первую подтему, изучаемой сегодня темы.
( читают подтверждение) Все правильно.
Нужно знать, как они изменяют свой цвет.
Постановка проблемы и актуализация знаний
Познакомимся с некоторыми из них.
Обратите внимание, как изменяется цвет каждого индикатора в растворах различных кислот.
По маркировке пробирок видно, что состав кислот различен. Какой же элемент в составе кислот влияет на изменение окраски индикатора?
Какие правила нужно соблюдать при составлении формул кислот?
В растворе любой кислоты лакмус изменяет окраску с фиолетовой на красную; фенолфталеин остаётся бесцветным ; метилоранж становится красно-розовым.
В состав всех кислот входит водород, следовательно, его наличие вызывает изменение окраски индикаторов.
(учащиеся не высказывают предположений)
(работа с учебником)
На стр. 152 таблица с молекулярными формулами и названиями кислот. Какие закономерности в написании формул вы видите?
2-ая подтема (на доске) в план открытия нового знания
Сформулируйте вторую подтему.
Водород в формулах кислот всегда стоит на первом месте. На втором ставится символ кислотообразующего неметалла, а затем – кислород, если он входит в состав кислоты.
Состав и молекулярные формулы кислот.
Постановка проблемы и актуализация знаний
Напишем небольшой химический диктант по составлению молекулярных формул кислот.
В состав кислоты входит:
1 атом водорода и 1 атом хлора;
1 – водорода, 1 – азота и 2 – кислорода;
1 атом серы и 2 атома водорода;
2 атома водорода, 4 – кислорода,1 – серы;
1 атом фтора и 1 атом водорода;
1 атом серы; 2 – водорода, 3 – кислорода;
3 атома кислорода, 1 – водорода, 1 – азота;
3 – водорода, 1 – фосфора, 4 – кислорода.
4 – водорода, 2 – фосфора, 7 – кислорода
Как, исходя из состава, можно классифицировать кислоты?
1-версия: По содержанию атомов одного и
2-версия: По содержанию атомов
3-версия: По содержанию атомов водорода.
(работа с учебником)
Сверим версии с текстом учебника ( стр. 151 4,5 абзацы и стр.152 1 абзац)
Более правильно : (в схему классификации) бескислородные и кислородсодержащие.
3-ю версию проверим по учебнику (стр. 156 2-ой абзац текста)
3-тья подтема (на доске) в план открытия нового знания
Третья часть темы урока …
Кислоты подразделяются на бескислородные и кислородные.
(записывают в схему классификацию по основности)
Классификация кислот (по наличию кислорода и по основности).
Предположите, как образуются названия кислот.
По символу кислотообразующего металла, сера – серная, азот –азотная.
(учащиеся в замешательстве)
(работа с учебником)
Ответ на этот вопрос мы можем найти на стр. 152 (с 4 абзаца текста до конца параграфа).
4-ая подтема (на доске) в план открытия нового знания
Как выглядит формулировка четвертой подтемы урока?
(читают текст и сравнивают названия по таблице на стр. 152)
Сформулируйте определение кислот.
Посмотрите внимательно, один или несколько атомов водорода в формулах кислот – неизменная часть состава кислот. А как может называться часть формул кислот, которая остается, если из формулы кислоты убрать атомы водорода?
Вернее – кислотный остаток.
Уточните формулировку определения.
Сформулируйте тему урока?
Кислоты – это сложные вещества, в состав которых входят атомы водорода и … (затруднение)
Кислоты – это сложные вещества, в состав которых входят атомы водорода и кислотный остаток.
Кислоты, их названия, состав, действие на индикаторы, получение.
Самостоятельное применение знаний
Запишите уравнения реакций образования кислот из оксидов и назовите их:
Что общего в формулах кислот
Назовите эти кислоты.
Объясните их образование (посредством уравнений реакций ).
Сходна ли с ними дифосфорная кислота? Какова ее молекулярная формула?
Запишите уравнение реакции ее получения.
Сравните эти реакции и на их примере
составьте (с объяснением) формулу дисерной кислоты.
Определите валентность хлора в кислотах:
Запомните валентность, связав их с названиями кислот, это поможет при составлении формул.
SO2 + H2O = H2 SO3 сернистая,
SO3 + H2O = H2 SO4 серная,
N2O5 + H2O = 2 H NO3 азотная,
N2O3 + H2O = 2 H NO2 азотистая,
P2O5 + 3 H2O = 2 H3PO4 фосфорная,
СO2 + H2O = H2 СO3 угольная.
Валентность фосфора равна V.
Ортофосфорная и метафосфорная.
P2O5 + 3 H2O = 2 H3PO4
Да, валентность фосфора равна V.
P2O5 + 2H2O = H4P2O7
Кислородсодержащие и бескислородные.
Индикаторы, т. к. они изменяют окраску в растворах кислот (лакмус – краснеет, м/о – становится красно-розовым, ф/ф – не изменяется) из-за наличия в составе кислот атомов водорода.
§42 (на стр. 156 2-ой абзац текста); из задачника стр.26 № 2, № 11
Урок химии по теме «Кислоты. Действие кислот на индикаторы. Взаимодействие кислот с металлами»
Разделы: Химия
Тип урока: Урок изучения и первичного закрепления новых знаний.
Оборудование урока: мультимедиа, индикаторы, пробирки, штатив для пробирок, лучина, химические стаканы, растворы кислот HCl, H2SO4, металлы: Fe, Cu.
Ход урока
| Формы организации познавательной деятельности | содержание |
| I. Организация урока. Подготовка учащихся к работе | |
| Беседа. Индивидуальных, групповых и фронтальных форм работы уч-ся |
Письменная работа
1. Выявить качественный уровень выполнения д/з (осмысленность, прочность, осознанность.
2. Выявить типичные ошибки в знаниях учащихся, акцентировать на них внимание класса и показать пути их устранения.
3. Составить представление об уровне развития мышления.
Содержание этапа:
Общие
1. Как в лаборатории можно получить водород? (на уровне воспроизведения)
I-й уровень
Из данного перечня формул выбрать формулы оксидов:
1) Ca(OH)2
2) SO2
3) HCl
4) BaCl2
5) CaO
6) H2SO4
III-й уровень
Составьте уравнение реакций, в результате которых можно получить водород.
Mg + HCl=
H2+ PbO =
Ca + H2O =
Постановка проблемы
Актуализировать ведущие знания уч-ся, необходимые для адекватного включения в УПД.
Содержание этапа:
1) Состав кислот
2) Физические свойства соляной и серной кислот
3) Изменение окраски индикаторов в кислой среде
4) Взаимодействие кислот с металлами
5) Постановка проблемы
Дорогие ребята, вы любите фрукты,ягоды? (слайд №4)?
Какой вкус у фруктов? (слайд)
Как видите, здесь есть представители растений и животных. А что между ними общего? Лимон, яблоко, муравей?
Чем объясняется кислый вкус фруктов и других продуктов?
Работа над словами «кислота», «индикаторы»,
Работа в парах
Постановка проблемы
Парная работа
МО.
Проблемно-поисковый.
Работа с учебником
Работа над терминами «валентность», «кислотный остаток».
Запись в тетрадь
Подберите однокоренные слова к слову кислота.
Таким образом, само название класса указывает на одно из физических свойств кислот. Действительно кислоты имеют кислый вкус, его вы ощущаете, когда положите на язык ломтик лимона, в соке которого содержится небольшое количество лимонной кислоты. Но, помните о том, что эта кислота пищевая! Пробовать на вкус кислоты ни в коем случае нельзя – можно отравиться или получить сильный химический ожог, так как кислоты обладают разъедающим действием.
Как можно распознать кислоты, не пробуя на вкус?
Учащимся предлагается проверить изменение окраски индикаторов при действии кислот и щелочей. Л/р
Повторение ТБ при работе с кислотами. Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление.
Но, чтобы этого не случилось нужно при выполнении лабораторных работ с кислотами соблюдать правила техники безопасности.
Повторим: выполнять все указания учителя, Не пробовать вещества на вкус, пробирку в руки не брать, не приступать к выполнению опыта, не зная, что и как нужно делать,
Обращаться с лабораторной посудой бережно и закончив работу, привести рабочее место в порядок. При попадании кислоты на кожу надо смыть её струёй воды. Обработать 2% раствором гидрокарбонатом натрия.
Кислотно-основное титрование. Индикаторы, техника титрования
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кислотно-основное титрование
Основные понятия кислотно-основного титрования
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Техника титрования
Основные понятия кислотно-основного титрования
Метод кислотно-основное титрование базируется на реакциях взаимодействия между кислотами и основаниями, т. е. на реакции нейтрализации:
Рабочими растворами метода являются растворы сильных кислот (HCl, H2S, НNО3 и др.) или сильных оснований (NaOH, КОН, Ва(ОН)2 и др.). В зависимости от титрованного раствора (титранта) кислотно-основное титрование подразделяют на ацидиметрию, если титрантом является раствор кислоты, и алкалиметрию, если используют в качестве титранта раствор основания.
Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo вещества в растворе титранта становится строго эквивалентным количеству определяемого вещества согласно уравнению химической реакции, называют точкой эквивалентности.
Точку эквивалентности устанавливают различными способами. В методах ручного анализа преимущественно используют изменение окраски индикатора, добавляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,04 мл (2 капли) титранта. Это то количество вещества в растворе титранта, которое необходимо для взаимодейcтвия его с индикатором.
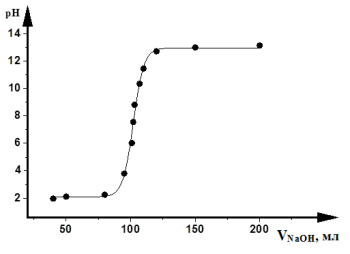
Кривые кислотно-основного титрования выражают зависимость изменения рН раствора от объема добавленного титранта (рис. 3.4).
Рис. 3.4. Кривая кислотно-щелочного титрования
При расчете рН необходимо знать состав титриметрической смеси. Для упрощения вычислений (что не приводит к заметным ошибкам) не учитывают разбавление раствора в процессе титрования и используют понятие «концентрация», а не «активность». Кривые титрования представляют в виде графика зависимости рН от объема добавленного титранта или объема избытка определяемого вещества и избытка титранта.
В начале титрования рН изменяется очень медленно. Кривая (см. рис. 3.4) показывает, в частности, что если оттитровать половину имеющегося количества кислоты (50 мл), рН раствора изменится незначительно по сравнению с исходным, если оттитровать 90 % (90 мл), то и тогда уменьшение рН составит лишь одну единицу. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Оттитровывание кислоты от 90 до 99 % вызывает изменение рН на три единицы. Также на единицу возрастает рН при оттитровывании от 99 до 99,9 %, т. е. на 0,9 %. Титрование остатка кислоты (0,1%) приводит к изменению рН на целых 3 единицы. Введение избытка в 0,1 % NaOH по сравнению с эквивалентным количеством вызывает изменение рН также на 3 единицы, и рН раствора становится равным 13,0.
Кривая титрования сильного основания сильной кислотой представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием. При титровании сильной кислотой сильного основания и наоборот до точки эквивалентности рН раствора определяется концентрацией неоттитрованной щелочи или кислоты, а после точки эквивалентности — концентрацией добавленной кислоты или щелочи. В точке эквивалентности раствор нейтрален.
Скачок титрования — это резкое изменение рН в области точки эквивалентности. Факторы, влияющие на величину и положение скачка титрования (на величину скачка титрования влияют все факторы, от которых зависят значения рН):
Чем меньше концентрация титруемого вещества и титранта, тем меньше скачок. Практически невозможно оттитровать сильные протолиты концентрацией 10 –4 М, а слабые — концентрацией 10 –2 М. При изменении температуры сильно изменяется константа автопротолиза воды, входящая во многие формулы расчета рН. В результате при увеличении температуры скачок уменьшается и смещается в более кислую область. Ионная сила влияет незначительно.
В рассматриваемом случае расчет рН проводят по следующим формулам:
● Для сильной кислоты, например HCl, рН определяется концентрацией ионов водорода: [H+] = M кислоты.
● Для сильного основания, например КОН [H+] = 10 –14 / Mщелочи. Часто проводят титрование с использованием слабых электролитов.
При титровании слабой кислоты сильным основанием чем слабее кислота, тем больше значение рН в начале титрования. Следовательно, ветвь кривой титрования (рис. 3.5) до точки эквивалентности смещается в щелочную область. После достижения точки эквивалентности образуется сильное основание, следовательно, значение рН резко смещается в щелочную область. При дальнейшем титровании кривая изменяется незначительно.
В ходе титрования раствора уксусной кислоты сильным основанием значение pH все время остается выше, чем при тех же концентрациях соляной кислоты. В результате этого скачок на кривой начинается с более высокого значения рН. Заканчивается он, как и в первом случае, при рН = 10, так как титрование производят тем же раствором 0,1 моль/л NaOH.
Рис. 3.5. Ход титрования слабой кислоты сильным основанием
При титровании слабой кислоты сильным основанием pH раствора кислоты вычисляют с учетом ее константы диссоциации:
Интервал скачка рН на кривой титрования 0,1 мольл уксусной кислоты раствором 0,1 мольл NaOH значительно уже предыдущего случая. Он простирается от рН = 7,8 до рН = 10.
При титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Рассчитывается рН в этом случае следующим образом:
При титрование слабой кислоты слабым основанием (или наоборот) сужение интервала скачка рН происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой вовсе исчезает. Пример — нейтрализация раствора 0,1 моль/л СН3СООН раствором 0,1 моль/л NН4ОН. Кривая титрования не имеет скачка рН. Поэтому нельзя ожидать и резкого изменения окраски индикаторов. Титрование слабой кислоты слабым основанием вообще невозможно.
Индикаторы метода кислотно-основного титрования. Теории индикаторов
Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. В методах кислотно-основного титрования для определения конечной точки титрования используют кислотноосновные индикаторы (табл. 3.1). Это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды.
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода независимо от того, достигнута ли точка эквивалентности. Правильно выбранный индикатор изменяет окраску в области скачка титрования. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности или после нее.
Таблица 3.1 Характеристики кислотно-основных индикаторов
Выбирают индикатор с помощью кривой титрования. Для этого на график наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, то индикатор для данного титрования не подходит. Значение рН, при котором заканчивается титрование с данным индикатором, называют показателем титрования и обозначают рТ. Показатель титрования находится обычно в середине интервала перехода индикатора. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd = Н+ + Ind — (бесцветный — малиновый).
Изменение окраски индикаторов происходит при прибавлении к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индикаторов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоциированной и недиссоциированной форм, т. е.
Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind−] = 10 –8 /10 –9 уменьшится в 10 раз и раствор станет бледно-розовым. При рН = 9 соотношение [HInd] / [Ind−] = 10 –9 /10 –9 = 1,0, т. е. в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов, при этом раствор приобретает розовую окраску. Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+].
Техника титрования
Правильное определение точки эквивалентности при титровании зависит не только от выбора индикатора, но и от порядка титрования. По методу нейтрализации титруют растворы кислот растворами оснований или наоборот. Этот порядок следует учитывать при выборе индикатора. Например, если титруют кислоту основанием и в качестве индикатора используют метиловый оранжевый (или метиловый красный), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую.
Такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) рекомендуют титровать растворы оснований растворами кислот. С фенолфталeином удобнее титровать растворы кислот растворами оснований, так как при этом бесцветный раствор становится малиновым.
Следует заметить, что при использовании индикаторов для фиксирования конечной точки титрования возможно появление индикаторной ошибки. Она образуется в случае несовпадения рН раствора в точке эквивалентности и рТ индикатора. Если такое несовпадение имеет место, то раствор обычно либо несколько перетитровывают, либо, наоборот, недотитровывают. Для уменьшения индикаторной ошибки титрование проводят с так называемым свидетелем. В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, например метилового оранжевого, сколько и к титруемому раствору, и приливают из бюретки 1−2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом свидетель используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и свидетель была одинакова. С помощью свидетель вводят также поправку в результаты титрования на прибавленный избыток кислоты, т. е. из затраченного ее объема вычитают объем двух капель (0,04 мл), использованных на окрашивание индикатора в свидетель.
Правильное определение точки эквивалентности зависит от количества прибавленного индикатора. Иногда стараются прилить побольше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение точки эквивалентности. Но чем больше прибавлено индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления конечной точки титрования имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным путем найдено, что на 10–15 мл анализируемого раствора следует брать одну каплю раствора индикатора, а на 25 мл — не более двух капель.
Таким образом, результат объемного определения зависит не только от выбора индикатора, но также от его взятого количества и от принятого порядка титрования.
Химические свойства кислот
Цели. Исследовать химические свойства кислот: действие на индикаторы, взаимодействие с металлами и основными оксидами; продолжить формирование умений делать опыты, наблюдать, анализировать, выделять главное, делать выводы; способствовать формированию научного мировоззрения; воспитывать культуру труда, инициативность, уверенность в своих силах, самостоятельность, любознательность.
Оборудование. Kроссворд «Индикатор», таблица «Действие растворов кислот на индикаторы», схема «Взаимодействие кислот с металлами», схема «Ромашка», лабиринт «Kислоты», лабораторное оборудование.
Формы. Фронтальная работа, групповая работа, самостоятельная работа обучающего характера.
Учитель. На прошлых уроках мы начали знакомство с кислотами, разобрали их химический состав и строение. Сегодня на уроке мы начинаем изучение химических свойств кислот. Откройте тетради и запишите тему. В ходе групповой работы мы исследуем три важнейших химических свойства кислот, закрепим написание химических уравнений, а также повторим особенности окислительно-восстановительных реакций (ОВР) с участием кислот.
МОЗГОВАЯ АТАКА
• Kакие три класса неорганических соединений уже изучены?
• Kакие вещества называются кислотами?
• Kак определить валентность кислотного остатка?
• Kакие вещества называются солями?
• Kакие вещества называются оксидами?
• На какие три группы делятся оксиды?
• Дать определение основных оксидов.
• В оксидах степень окисления кислорода равна –2. А как называются реакции, протекающие с изменением степеней окисления элементов?
• Что такое окисление и как называется вещество, которое участвует в этом процессе?
• Что такое восстановление и как называется вещество, которое участвует в этом процессе?
Учитель. Мы повторили основные понятия, необходимые нам на уроке. Прежде чем мы начнем работать, я хочу напомнить вам о технике безопасности: с кислотами работать осторожно, нагревать пробирку по всей длине и отверстие пробирки не направлять на людей, все выполнять только по инструкции. Перед исследованием первого химического свойства кислот разгадайте кроссворд и в выделенном столбце прочтите новое химическое понятие, с которого мы и начнем обсуждение. На это вам отводится 4 минуты.
2. Он бывает положительно и отрицательно заряженным.
3. Элемент, не имеющий постоянной «прописки» в периодической системе Д.И.Менделеева.
4. Элемент, относящийся к благородным газам.
5. Элемент 4 периода, в названии которого есть название дерева.
6. Сейчас вы мною пишете, я углерод – вы слышите.
7. Элемент IV группы, который является настоящим гигантом.
8. Газ, который утверждает, что он – не он.
9. Металл I группы, который, теряя начальный слог, превращается в часть скелета человека и животных.
Учитель. Kакое новое химическое понятие вы получили? (Индикатор.)
Итак, ребята, нам надо выяснить, что такое индикаторы. Мы познакомимся с тремя индикаторами, которые чаще всего используют в лаборатории: лакмус, метиловый оранжевый и фенолфталеин. Первые два у вас в виде индикаторной бумаги, фенолфталеин (ф/ф) – жидкость. Kаждой группе даны три пробирки с определенной кислотой (соляная, азотная, серная и ортофосфорная). Пользуясь алгоритмом проведения эксперимента, выясните действие растворов кислот на индикаторы, а результаты оформите в виде таблицы, используя цветную бумагу. После окончания работы каждая группа приклеит свои результаты на общую таблицу, найдя в ней свою кислоту. На выполнение этого задания вам отводится 4 минуты.
Действие растворов кислот на индикаторы
(запись на доске)
Алгоритм проведения эксперимента
«Действие растворов кислот на индикаторы»
1. В одну из трех пробирок с кислотой опустите лакмусовую бумажку и наблюдайте, что с ней происходит. Выберите бумагу соответствующего цвета и вклейте в таблицу.
2. Во вторую пробирку опустите индикаторную бумажку метилового оранжевого. Что произошло? Оформите результат в таблице.
3. В третью пробирку прилейте несколько капель фенолфталеина. Наблюдение оформите в таблице.
4. Опираясь на свои наблюдения, попытайтесь вывести определение «индикаторы».
5. П о д у м а й т е: если даны растворы двух веществ, как можно практически доказать, что одно из них является раствором кислоты.
Учитель. Все закончили проведение эксперимента, подвели итоги, и мы разбираемся с первым свойством кислот – действием на индикаторы (таблица).
Действие растворов кислот на индикаторы
| Индикатор | Цвет при действии кислоты | |||
|---|---|---|---|---|
| 1-я группа | 2-я группа | 3-я группа | 4-я группа | |
| Соляная кислота | Серная кислота | Азотная кислота | Ортофосфорная кислота | |
| Лакмус | Kрасный | Kрасный | Kрасный | Kрасный |
| Метиловый оранжевый | Розовый | Розовый | Розовый | Розовый |
| Фенолфталеин | Бесцветный | Бесцветный | Бесцветный | Бесцветный |
Ответьте на следующие вопросы.
1) Что же такое индикатор?
(От лат. indicator – указатель.)
2) Kак изменяется цвет каждого из индикаторов в растворах кислот?
3) Для чего можно использовать индикаторы?
(Для определения природы раствора.)
4) Почему растворы всех кислот одинаково изменяют цвет индикаторов?
(В растворах кислоты распадаются
с образованием ионов водорода.)
5) Kак заряжен ион водорода?
6) Kак называется положительно заряженный ион?
Kислота, когда здорова,
Угостить друзей готова
Тем, что ей дала природа, –
Kатионом водорода.
Взаимодействие кислот с металлами
(записи на доске и в тетради)
Учитель. О следующем химическом свойстве кислот мы говорили, когда изучали получение водорода в лаборатории.
У вас на столах – схема 1 «Взаимодействие кислот с металлами». Заполните ее и вывесьте на доску. На выполнение этого задания вам отводится 3 минуты. Запишите схему 1 в тетради. Опираясь на схему 1, работаем со схемой 2 «Ромашка» (см. с. 28). Запишите уравнения возможных химических реакций, найдите в них окислитель и восстановитель (один ученик работает на развороте доски).
На выполнение этого задания вам отводится 2 минуты.
Взаимодействие кислот с основными оксидами
(записи на доске и в тетради)
Учитель. Последнее химическое свойство кислот, которое мы сегодня исследуем, – взаимодействие с основными оксидами.
У вас на столах – пробирка с серной кислотой и в скляночке – оксид меди(II). По алгоритму действий проведите эксперимент, оформите результаты. На выполнение этого задания вам отводится 5 минут.
Алгоритм проведения эксперимента
«Взаимодействие кислот с основными оксидами»
1. Пробирку с серной кислотой нагрейте, не доводя кислоту до кипения.
2. В горячий раствор серной кислоты насыпьте немного оксида меди(II) и содержимое помешайте стеклянной палочкой. Если весь оксид меди(II) прореагирует, то добавляйте его до тех пор, пока останется непрореагировавший небольшой избыток.
3. Дав раствору отстояться, при помощи пипетки нанесите несколько капель его на предметное стекло, зажмите его в пробиркодержателе и аккуратно выпарьте до появления первых кристаллов.
ЛАБИРИНТ «КИСЛОТЫ»
Учитель. Ответьте на вопросы и выполните следующие задания.
1) Kристаллы какого вещества остались на предметном стекле после испарения воды?
2) Запишите уравнение проведенной реакции и укажите степени окисления каждого элемента в соединениях (в тетради и на приложенном листе).
3) Определите тип реакции. Является ли она окислительно-восстановительной?
4) Допишите общую схему взаимодействия кислот с основными оксидами (в тетради и на приложенном листе).
Итак, мы рассмотрели взаимодействие кислот с основными оксидами. При этом что всегда образуется?
Сегодня мы изучили три химических свойства кислот. Kакие? У кого есть вопросы?
Учитель. У вас на партах лежит лабиринт «Kислоты». Необходимо пройти путь от начала до финиша за 4 минуты.
ПОДВЕДЕНИЕ ИТОГОВ И ВЫХОД НА ТЕМУ СЛЕДУЮЩЕГО УРОКА
Учитель. Мы исследовали химические свойства кислот. Вспомните, какие. Но химические свойства кислот ими не ограничиваются. Для дальнейшего углубления наших знаний необходимо познакомиться еще с одним классом неорганических соединений – основаниями. Этим мы и займемся на последующих уроках.
Инструктаж выполнения домашнего задания (1 мин).
Выставление оценок и благодарность за работу.