Как инсулин влияет на тестостерон
Какая связь между диабетом и уровнем тестостерона?
Тестостерон имеет решающее значение для мужского сексуального поведения и репродукции, с дополнительным благотворным влиянием на плотность костей и эмоциональное благополучие.
Несправедливость для женщин, но именно тестостерон позволяет мужской коже стареть позже. Благодаря гормону мужская кожа более плотная. Еще и борода защищает от солнечного воздействия. ( Дама может получить немного положительного эффекта тестостерона будучи беременной мальчиком. Так что, Джентльмены, скрашивайте природную несправедливость и не заставляйте свои половинки хмурится, чтобы у тех не появлялись дополнительные мимические морщины).
В отличие от женщин, мужчины не испытывают внезапного снижения уровня гормонов в процессе старения, поэтому могут долго не замечать этот процесс. Уровень тестостерона снижается постепенно, обычно начиная с 40 лет. Согласно исследованию, опубликованному в Европейском журнале эндокринологии, после начала этого процесса типичная скорость снижения составляет от 0,5% до 2% в год. Это постепенное снижение уровня тестостерона может ощущаться мужчиной, как меньшее количество энергии, усталость и более низкое либидо.
Хотя дискуссия о причине и следствии продолжается, некоторые исследователи считают, что низкий уровень тестостерона является сильным прогностическим параметром в развитии инсулинорезистентности. Если это так, то снижение уровня тестостерона может постепенно увеличивать риск развития диабета.
Возрастной дефицит тестостерона у больных сахарным диабетом II типа
Структура статьи
Введение
Происходящие вследствие дефицита тестостерона изменения в организме мужчин по решению рабочего совещания Австрийского общества урологов (1994г.) было предложено назвать «частичной андрогенной недостаточностью у пожилых мужчин«, или синдромом PADAM (partial androgen deficiency in aging male). Но в отечественной медицине все больше склоняются к термину «возрастной андрогенный дефицит» или «возрастной гипогонадизм«. Возрастной андрогенный дефицит представляет собой состояние, обусловленное возрастным снижением секреции тестостерона в клетках Лейдига.
В последнее время отмечается необычайный интерес к данной проблеме, связанный, прежде всего, с широкой распространенностью возрастного гипогонадизма. Общепризнанно, что у мужчин с возрастом происходит постепенное снижение уровня половых гормонов, начало которого приходится на период 30-40 лет. Известно, что от 40 до 50 лет примерно 7% мужчин страдает гипогонадизмом, от 60 до 80 лет – 20%, старше 80 лет – уже 35%. По результатам многочисленных исследований, проведенных в США, андрогенная недостаточность отмечается почти у 5 млн. мужчин, а заместительную гормональную терапию получают всего лишь 5% из них. Помимо этого показано, что снижение или отсутствие половой функции влияет не только на качество жизни, но и сказывается на ее продолжительности.
Известно, что основным мужским половым гормоном, который отвечает за здоровье и активность мужчины на протяжении всей жизни, является тестостерон. Вместе с дигидротестостероном, андростендионом и их метаболитами он создает соответствующий тонус центральной нервной системы, подкорковых образований, центров автономной нервной системы, поддерживая функциональную активность половых желез и обеспечивая копулятивную функцию. Тестостерон, наряду с андрогенными эффектами, способен оказывать и мощное анаболическое действие на различные ткани человека. Не напрасно на Национальном конгрессе «Человек и лекарство» (2006, Москва), член-корреспондент РАМН О.Б.Лоран заявил: «Изменение уровня тестостерона оказывает влияние на аденогипофизарную регуляцию в целом, вызывает не только снижение творческого потенциала, изменение эмоциональности, сексуальной активности, но и негативно влияет на минеральный и углеводный обмен, поэтому дефицит андрогенов – это проблема, объединяющая врачей многих специальностей».
Одной из актуальных проблем, часто сочетающейся с возрастным андрогенным дефицитом у мужчин, является наличие у них разнообразных сопутствующих заболеваний и, прежде всего, сахарного диабета 2 типа.
Сахарный диабет является одним из наиболее распространенных хронических заболеваний и имеет стойкую тенденцию к устойчивому росту. Ежегодно количество больных увеличивается на 6-7%, и к настоящему времени им болеет уже 2-4% населения. В соответствии с официальной статистикой МЗ РФ, сахарным диабетом в нашей стране страдает более 2 млн. человек, причем ежегодно регистрируется до 200 тысяч новых случаев этого заболевания. Примерно в 88% случаев – это сахарный диабет 2 типа. А распространенность андрогенного дефицита у этих больных достигает 65%. Таким образом, практически каждый второй пациент, имеющий нарушение половой функции страдает и сахарным диабетом 2 типа. Наиболее точные данные относительно распространенности нарушений половой функции в общей популяции и среди больных сахарным диабетом были получены в результатах многолетнего Массачусетского исследования по изучению старения мужчин (1994) и работах Vinik и Richardson. Результаты первого исследования показали взаимосвязь между уровнями свободного тестостерона, глобулина, связывающего половые стероиды (ГСПС), и риском развития инсулинорезистентности и сахарного диабета 2 типа. При снижении уровня свободного тестостерона на 1 стандартное отклонение (3,9 нг/дл) риск развития сахарного диабета 2 типа равен 1,58, а при снижении ГСПС на 1 стандартное отклонение (15,8 нмоль/л) – 1,89. По данным второго исследования уровень тестостерона у больных сахарным диабетом 2 типа на 10-15% ниже, чем у людей тех же возрастных групп без диабета. Помимо этого, дефицит андрогенов у мужчин тесно коррелирует с наличием инсулинорезистентности и гиперинсулинемии, а введение препаратов тестостерона ведет к их уменьшению. Интересно отметить, что по данным ЭНЦ РАМН уровень тестостерона, у пациентов с сахарным диабетом 2 типа, находящихся на инсулинотерапии, остается в пределах нормальных значений, в отличие от больных, получающих пероральные сахароснижающие препараты (Калинченко С.Ю., Козлов Г.И.,2003г). Поэтому нельзя исключить влияние инсулина на выработку тестостерона в клетках Лейдига. Также убедительно доказано, что наблюдаемый при сахарном диабете 2 типа, особенно у пациентов с ожирением, низкий уровень свободного и об¬щего тестостерона не связан со степенью декомпенсации диабета.
Полагают, что первой причиной развития возрастного гипогонадизма, вероятно, является уменьшение числа клеток Лейдига вследствие ухудшения кровоснабжения тестикулярной ткани и снижение на их поверхности количества рецепторов к лютеинизирующему гормону. Второй возможной причиной андрогенной недостаточности у тучных пациен¬тов с сахарным диабетом 2 типа является абдоминальный тип ожирения, как правило, сочетающийся с этим заболеванием.
В настоящее время существуют многочисленные данные, подтверждающие взаимосвязь между висцеральным ожирением и снижением уровня тестостерона у мужчин. Жировая ткань имеет «сродство» к стероидным гормонам. Ароматаза жировой ткани в повы-шенных количествах превращает андрогены (тестостерон и андростендион) в эстрогены, кото¬рые подавляют секрецию как гонадотропин-рилизинг-гормона, так и лютеинизирующего гормона, что приводит к снижению уровня тестостерона крови. Помимо этого, причиной дефицита андрогенов при ожирении является вырабатываемый белой жировой тканью лептин, стимулирующий секрецию гонадотропин-рилизинг-гормона. Считается, что некоторая резистентность центральных структур к лептину у больных ожирением приводит к нарушению ритма секреции гонадотропин–рилизинг–гормона, что может являться еще одной причиной развития гипогонадотропного гипогонадизма.
Клинические проявления и диагностика
Большинство клинических проявлений недостаточности тестостерона неспецифичны. Очень часто единственным симптомом возрастного андрогенного дефицита может быть снижение или потеря сексуального влечения (либидо). Также отмечаются и другие сексуальные симптомы (ухудшение качества и частоты эрекции, особенно ночной, трудность достижения оргазма, снижение интенсивности достигаемого оргазма, снижение чувствительности полового члена), происходят изменения нервно-эмоционального статуса (снижение интеллектуальной активности, творческой продуктивности, увеличение усталости, снижение настроения, депрессии, бессонница), изменения костей, мышц, кожи и жировой ткани (снижение силы и объема мышечной массы, снижение волосяного покрова тела, появление морщин, снижение костной плотности, увеличение объема висцерального жира). Помимо этого мужчину беспокоят чувство жара – «приливы», колебания уровня артериального давления в течение суток, головокружение, повышенная потливость, кардиалгии.
Среди лабораторных методов исследования ведущее место в клинической практике занимает определение уровня общего тестостерона в сыворотке крови. Концентрация этого гормона ниже 12 нмоль/л (нормальные показатели 13-33 нмоль/л) свидетельствует о наличии андрогенного дефицита. Хотя следует отметить, что наиболее информативным является определение уровня свободного тестостерона или биологически активного. Но, к сожалению, в настоящее время проведение этого лабораторного исследования технически затруднено. В связи с этим при необходимости (при выраженной клинической симптоматике и нормальной концентрации общего тестостерона) его определяют расчетным методом по отношению уровней общий тестостерон/глобулин, связывающий половые гормоны. Помимо специфического обследования целесообразно также выполнить общий анализ крови (при снижении уровня тестостерона возможно возникновение анемии) и денситометрию (дефицит андрогенов является одной из основных причин остеопороза у мужчин).
Заместительная терапия препаратами тестостерона
В лечении возрастного гипогонадизма основная роль принадлежит терапии, целью которой является нормализация содержания тестостерона в плазме крови. Данное лечение направлено на улучшение сексуальной функции и общего самочувствия мужчины. При длительном лечении (более одного года) отмечаются и другие положительные эффекты: значительное повышение плотности костной ткани, уменьшение объема как подкожного, так и висцерального жира, нарастание мышечной массы и силы, снижение уровня атерогенных липидов, повышение чувствительности к инсулину и др.
В настоящее время на фармацевтическом рынке представлен достаточно широкий спектр препаратов тестостерона для заместительной гормональной терапии, отличающихся друг от друга путем введения, продолжительностью действия и числом побочных эффектов.
Среди препаратов тестостерона, предназначенных для накожного применения, самыми современными являются тестостероновые гели. Препараты из этой группы наносятся на чистую и сухую кожу плеч, предплечий или передней брюшной стенки, растираются тонким слоем до полного высыхания в течение минимум 3-5 мин. перед одеванием. Через 2-3 дня от момента начала лечения происходит насыщение кожи гелем и возникает равновесие между адсорбцией тестостерона и его выведением из организма. Постоянное равномерное высвобождение тестостерона через кожу препятствует значительным колебаниям его уровня в сыворотке крови. Не мало важным обстоятельством является сохранение циркадного суточного ритма концентрации тестостерона в организме мужчины.
Заключение
Несомненно, проблема андрогенного дефицита у мужчин с сахарным диабетом 2 типа в настоящее время является очень актуальной. Диагностика и лечение возрастного гипогонадизма позволяет не только предупредить развитие такого серьезного заболевания как сахарный диабет 2 типа, но и добиться компенсации углеводного и липидного обмена при наличии этой патологии. Применение препаратов тестостерона в комбинации с сахароснижающей терапией приводит к улучшению метаболического контроля сахарного диабета, что выражается в снижении уровня гликированного гемоглобина, увеличении чувствительности к инсулину, а также уменьшении веса в основном за счет количества висцеральной жировой ткани. Таким образом, с помощью заместительной гормональной терапии врачи действительно могут обеспечить достойное качество жизни современного мужчины.
Как повысить тестостерон в организме: естественные способы и препараты
Пик выработки тестостерона в организме мужчины приходится на период с 25 до 30 лет. Затем количество гормона начинает постепенно снижаться — на 1-2% каждый год. Но уровень тестостерона может уменьшаться не только по естественным причинам. На его содержание влияют стрессы, недостаток калорий и переедание, прием лекарств, перетренированность, а также болезни, недостаток сна и алкоголь.
Чтобы выяснить причину низкого тестостерона, запишитесь на прием к урологу, не занимайтесь самолечением!
В обоих случаях (и по естественным, и по другим причинам) мужчина может самостоятельно повысить естественный тестостерон. Для этого существуют простые и безопасные методы, относительно которых доказано, что они увеличивают выработку гормона. Далее подробно о том, что же делать для повышения тестостерона.
Ввести силовые тренировки
Один из первых и самых действенных способов повысить уровень тестостерона — это силовые тренировки, направленные на рост мышечной массы. Главное условие таких занятий — наличие отягощения. Тренировки проводятся с весом: штангами, гантелями, гирями, на тренажерах. Полезны такие упражнения, как приседания, жим, становая тяга.
Основные правила силовых тренировок для повышения тестостерона:
Важно! Если помимо пониженного тестостерона есть другие симптомы, например, боль в паху, физическая нагрузка запрещена до консультации с врачом.
Употреблять особые продукты и соблюдать калорийность
Следующий шаг к увеличению тестостерона — переход на рацион с нормальной калорийностью. Она должна быть слегка избыточной, поскольку низкокалорийная диета снижает активность ферментов семенников, которые выступают катализаторами выработки тестостерона.
Калорийность особенно важна, если у мужчины высокая физическая активность. Несмотря на положительное влияние спорта на выработку половых гормонов, он может столкнуться с обратным эффектом — снижением тестостерона. Это может быть связано с перетренированностью (повышает уровень кортизола) и недостатком калорий. В таком случае необходимо повысить калорийность рациона и уменьшить физические нагрузки.
Но с калорийностью важно не переусердствовать, поскольку набор жира ведет к тому, что активируется особый фермент — ароматаза, отвечающий за преобразование тестостерона в эстроген (женский половой гормон). Чтобы этого избежать, нужно употреблять больше продуктов, повышающих тестостерон:
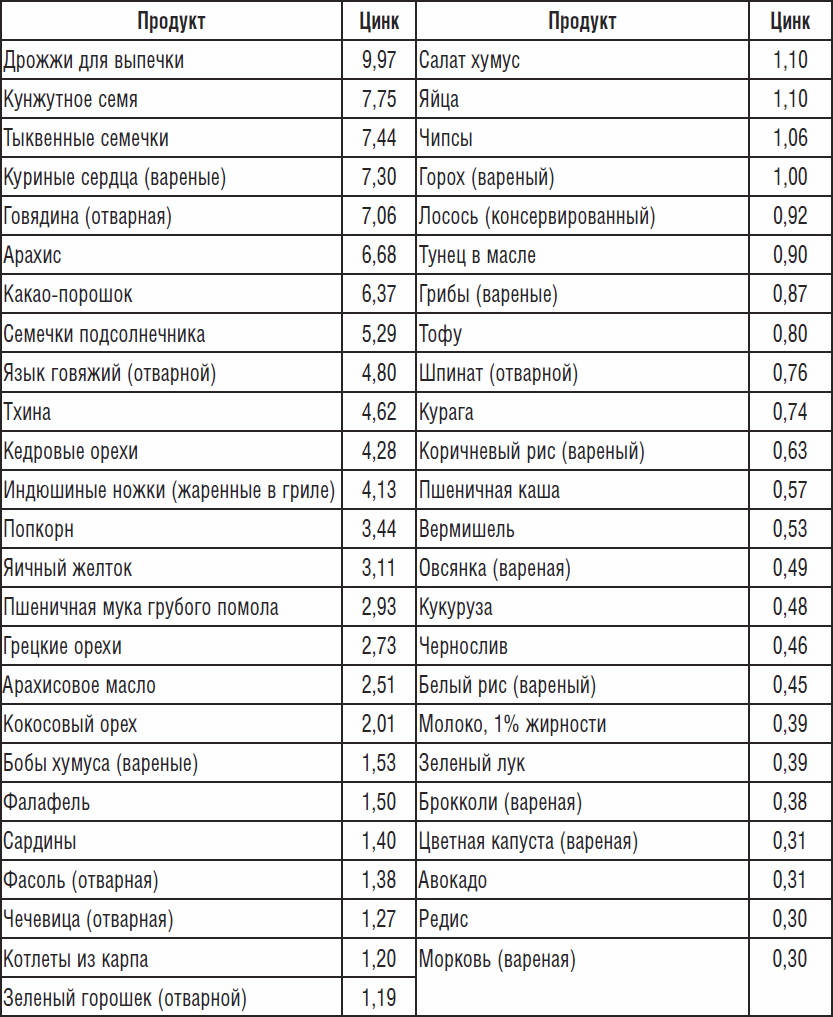
Повысить количество цинка в рационе
Количество цинка в организме и уровень тестостерона напрямую связаны между собой. Если наблюдается дефицит этого микроэлемента, то выработка полового гормона замедляется. В таблице приведены продукты, повышающие тестостерон у мужчин путем увеличения уровня цинка в организме.
Вести регулярную половую жизнь
При оргазме в кровь выбрасываются определенные биохимически активные вещества, которые обеспечивают нормальную работу репродуктивной системы. Отсюда легко понять, что при регулярных сексуальных контактах тестостерон вырабатывается более активно. Это особенно важно для мужчин старше 40 лет. Понятие нормы очень субъективное, но урологами установлена частота не менее 2 половых актов в неделю.
Обеспечить качественный сон
Большая часть тестостерона вырабатывается во время сна. Если спать недостаточно, то выработка полового гормона замедляется. Если в течение 7 дней спать менее 5 часов, то концентрация андрогена снизится на 15-25%. Важно не только количество сна, но и время. Необходимо ложиться в 10-11 часов вечера. Для качественного сна в комнате должно быть темно, поэтому стоит выключать все источники света и плотно зашторивать окна.
Исключить стрессы и депрессии
Сильные переживания повышают уровень кортизола в организме. Это гормон стресса, который мешает выработке тестостерона. Все потому, что кортизол — один из его прямых антагонистов (действует противоположным образом). Уровень гормона стресса повышается при умственном перенапряжении и длительных стрессах, вызванных разными ситуациями.
Что делать при пониженном тестостероне
Если естественные способы не приводят к положительному результату, то на смену им приходят препараты, повышающие тестостерон у мужчин. Но их может назначить только врач после обследования и исключения серьезных заболеваний вроде рака простаты или аденомы простаты. Поэтому при подозрении на сниженный тестостерон необходимо сначала обратиться к специалисту. В клинике урологии имени И.М. Сеченова вы можете записаться на прием в удобное время. Для этого напишите нам в онлайн-чате, заполните форму записи или позвоните по любому из контактных номеров.
Гонадотропная функция инсулина. Гиперандрогения и гиперинсулинемия (обзор литературы)
| В течение последних десятилетий стало очевидным, что гонадотропины гипофиза не являются единственными регуляторами репродуктивной функции. Некоторые другие гормоны и различные факторы роста также играют важную роль в физиологии яичника. Инсулин и инсулино-подобные факторы роста — одни из них. |
Инсулин — глюкорегуляторный гормон, секретируемый b-клетками поджелудочной железы. Первичными органами-мишенями его действия служат скелетные мышцы, печень и жировая ткань. Кроме того, инсулин возможно является фактором роста с многообразным влиянием на ткани [1]. Его дефицит или избыток могут значительно изменять функцию яичников. Так, инсулинзависимый сахарный диабет — состояние, характеризующееся недостатком инсулина — ассоциируется с клиническими проявлениями гипофункции яичников: первичная аменорея, позднее менархе, ановуляция, низкий процент беременностей и раннее наступление менопаузы. Напротив, инсулинорезистентность и гиперинсулинемия связана с избыточным синтезом стероидных гормонов в яичнике, преимущественно с гиперандрогенией [2].
В данной работе мы остановимся на вопросах взаимосвязи таких патологических состояний, как инсулинорезистентность, гиперинсулинемия и гиперандрогения.
Инсулинорезистентность определяется как недостаточный ответ тканей-мишеней на инсулин. Это вызывает компенсаторное увеличение секреции инсулина поджелудочной железой, что первоначально поддерживает нормогликемию. При прогрессировании инсулинорезистентности развивается неспособность b-клеток к компенсации, что приводит к повышению уровня глюкозы, нарушению толерантности к глюкозе и сахарному диабету.
Причинами инсулинорезистентности могут быть внутренние дефекты клеток-мишеней (мутация генов инсулиновых рецепторов и других генов, важных для осуществления действия инсулина), а также факторы, повреждающие клетки-мишени (стресс, гипертермия, сепсис, голодание, уремия, цирроз, ожирение, диабет, синдром Кушинга, акромегалия, феохромоцитома, тиреотоксикоз, инсулинома, аутоантитела к инсулиновым рецепторам и др). Инсулинорезистентность обнаруживается при некоторых физиологических состояниях — в подростковом возрасте, при беременности, в период старения [3].
Описано несколько синдромов, при которых имеется сочетание инсулинорезистентности и гиперандрогении.
Такие заболевания, как синдромы Кана типа А и В, липоатрофия, лепречаунизм и синдром Рэбсона-Менденхолла, достаточно редки и встречаются в основном в практике общих эндокринологов. Предполагается, что в основе патогенеза данных синдромов лежит патология инсулиновых рецепторов [1].
Около 1–5% женщин с гиперандрогенией имеют HAIRAN (hyperandrogenic insulin-resistant acantosis nigricans) синдром. Эти пациентки имеют, как правило, выраженные признаки андрогенизации. Изменения кожи — нигроидный акантоз — проявляются в виде шероховатых гиперпигментированных участков в местах трения и складок [4]. Механизм, ответственный за развитие этих кожных изменений, на сегодняшний день не ясен. Гистологически они характеризуются гиперкератозом и папилломатозом. Нигроидный акантоз, по мнению многих авторов, является маркером инсулинорезистентности [5].
По данным С.Н. Хейфеца, 1995, инсулинорезистентность выявляется почти у 90% женщин со стромальным гипертекозом яичников. Заболевание характеризуется значительным повышением уровня тестостерона (Т) при нормальном, либо сниженном, содержании ЛГ и ФСГ, что указывает на ведущую роль гиперинсулинемии в развитии гиперандрогении у этих пациенток [6].
Синдром поликистозных яичников (СПКЯ) — наиболее частое состояние, при котором наблюдается сочетание гиперандрогении и инсулинорезистентности. Burghen и соавторы, 1980, первыми описали зависимость между гиперинсулинемией и гирсутизмом у женщин с СПКЯ [7]. Важно отметить, что корреляция между повышенной продукцией андрогенов и инсулинорезистентностью была выявлена также у женщин с ановуляцией и нормальной массой тела [5, 8].
Механизмы возникновения гиперандрогении и гиперинсулинемии окончательно не изучены. Теоретически, возможны три варианта взаимодействия: гиперандрогения вызывает гиперинсулинемию, гиперинсулинемия приводит к гиперандрогении, или имеется какой-то неизвестный третий фактор, ответственный за оба феномена [1].
Предположение о том, что гиперандрогения вызывает гиперинсулинемию, основано на следующих фактах. У женщин, принимающих оральные контрацептивы, содержащие прогестины с “андрогенными” свойствами, выявляется нарушение толерантности к глюкозе. Длительное назначение тестостерона female-to-male транссексуалам сопровождается возникновением инсулинорезистентности [1]. Показано, что андрогены влияют на состав мышечной ткани, увеличивая количество мышечных волокон II типа, менее чувствительных к инсулину по сравнению с волокнами I типа [9].
Большинство фактов свидетельствуют в пользу того, что гиперинсулинемия приводит к гиперандрогении. Было показано, что инсулинорезистентность сохраняется у пациенток, подвергшихся субтотальному или тотальному удалению яичников, а также у женщин, длительно применявших а-ГнРГ, когда отмечалась выраженная супрессия уровня андрогенов [10]. Назначение диазоксида — препарата, подавляющего выделение инсулина поджелудочной железой, — вызывало снижение уровня Т и повышение уровня секссвязывающего глобулина (ССГ) у пациенток с СПКЯ, ожирением и гиперинсулинемией [10]. Внутривенное введение инсулина женщинам с СПКЯ приводило к повышению уровня циркулирующих андростендиона и Т. Мероприятия, направленные на повышение чувствительности к инсулину (снижение веса, голодание и низкокалорийная диета) сопровождались понижением уровня андрогенов [11].
Однако имеется ряд хорошо известных состояний инсулинорезистентности, которые не связаны с гиперандрогенией, например простое ожирение и сахарный диабет II типа [1]. Для объяснения, почему не у всех пациенток с ожирением и гиперинсулинемией развивается гиперандрогения и СПКЯ, выдвинута гипотеза о существовании генетической предрасположенности к стимулирующему действию инсулина на синтез андрогенов в яичнике. Очевидно, существует ген/группа генов, которые делают яичники женщин с СПКЯ более чувствительными к стимуляции инсулином продукции андрогенов [10].
Инсулин может прямо подавлять продукцию ССГ печенью, при этом полагают, что инсулин, а не половые гормоны, является основным регулятором синтеза ССГ. Понижение уровня ССГ приводит к возрастанию концентрации свободного, и следовательно, биологически активного Т [1].
Гипотеза, полагающая, что гиперинсулинемия вызывает гиперандрогению, поднимает два вопроса: почему гиперандрогения является основным проявлением стимуляции инсулином стероидогенеза в яичнике, и как яичник сохраняет чувствительность к инсулину при инсулинорезистентном состоянии организма. Было предложено несколько возможных объяснений. Так как инсулин обладает множеством функций, можно предположить селективный дефект некоторых из них. Может наблюдаться органоспецифичность чувствительности к инсулину. Но наиболее вероятно имеет предположение о том, что инсулин действует на яичник не только через рецепторы инсулина, но также через рецепторы инсулино-подобных факторов роста (ИФР) [2].
ИФР представляют группу белков, зависимых от гормона роста, со структурным и функциональным сродством с инсулином и широким спектром митогенного и метаболического действия. Инсулиновые рецепторы и рецепторы ИФР были идентифицированы в яичниках человека (в стромальной ткани яичников здоровых женщин, женщин с СПКЯ, в фолликулярной ткани и клетках гранулезы) [2]. Инсулин может связываться с рецепторами ИФР, хотя с меньшим сродством, чем с собственными рецепторами [8]. Однако, при гиперинсулинемии, а также в ситуации, когда рецепторы инсулина блокированы или имеется их дефицит, можно ожидать, что инсулин будет связываться с рецепторами ИФР в большей степени [5].
Возможные механизмы стимуляции инсулином/ИФР стероидогенеза в яичнике могут быть разделены на неспецифические и специфические.
Неспецифические механизмы заключаются в классическом действии инсулина на метаболизм глюкозы, аминокислот и синтез ДНК. В результате повышается жизнеспособность клетки и, следовательно, усиливается синтез гормонов [2].
Специфические механизмы включают прямое действие инсулина/ ИФР на стероидогенные ферменты, синергизм между инсулином и ЛГ/ФСГ, и влияние на количество рецепторов к ЛГ [2].
Инсулин/ИФР, действуя синергично с ФСГ, стимулируют ароматазную активность в культуре клеток гранулезы, и таким образом увеличивают синтез эстрадиола. Кроме того, они приводят к повышению концентрации рецепторов ЛГ и, следовательно, усиливают ЛГ-зависимый синтез андростендиона тека- и стромальными клетками [12].
Возрастающая концентрация андрогенов в яичнике под действием инсулина/ИФР вызывает атрезию фолликулов, что приводит к постепенной элиминации эстроген- и прогестерон-продуцирующих клеток гранулезы, которые прогрессивно замещаются андроген-продуцирующей тканью (тека-клетки, строма) [13]. Этим объясняется тот факт, что стимуляция яичникового стероидогенеза инсулином проявляется преимущественно в виде гиперандрогении.
Было высказано предположение, что инсулин/ИФР могут стимулировать как ЛГ-зависимую активность цитохрома Р450с17a яичниках и АКТГ-зависимую активность Р450с17a в надпочечниках, что, по-видимому, объясняет частое сочетание яичниковой и надпочечниковой форм гиперандрогении у пациенток с СПКЯ [8].
Проведя исследование уровней инсулина, ИФР, гормона роста и их корреляции с уровнями гонадотропинов и андрогенов у женщин с СПКЯ, Insler V., 1993, предложил две модели развития данного синдрома. У пациенток с ожирением гиперинсулинемия вызывает избыточную продукцию андрогенов через рецепторы ИФР, которые, действуя в синергизме с ЛГ, вызывают повышение активности цитохрома Р450с17a — основного контролирующего фермента в биосинтезе андрогенов. У пациенток с нормальной массой тела относительное повышение концентрации гормона роста стимулирует избыточную продукцию ИФР. С этого момента синергизм с ЛГ приводит к гиперпродукции андрогенов по тому же механизму, что и у пациенток с ожирением. Повышение андрогенов вызывает изменение функции важнейших мозговых центров, приводя к нарушению секреции гонадотропинов и типичным изменениям СПКЯ [14].
Отдаленными последствиями гиперандрогении и гиперинсулинемии являются онкологические заболевания (рак эндометрия и молочных желез), сердечно-сосудистые заболевания, сахарный диабет. Ретроспективное исследование женщин с СПКЯ, подвергшихся 20–30 лет назад клиновидной резекции яичников, показало, что частота артериальной гипертензии у них в 4 раза выше, чем у контрольной группы того же возраста, а риск инфаркта миокарда в 7,4 раза выше [1].
Согласно сообщению Dunaif, 1992, у 20% женщин с СПКЯ и ожирением наблюдается нарушение толерантности к глюкозе или сахарный диабет II типа [15]. Отмечено, что риск развития инсулиннезависимого сахарного диабета у пациенток с СПКЯ в 7 раз выше, чем в популяции [16].
Золотым стандартом для оценки чувствительности к инсулину является эугликемический «клэмп» метод и глюкозо-толерантный тест с частым (каждые 15–30 минут) забором крови из вены. Хотя эти методики наиболее точны для определения инсулинорезистентности, они слишком трудоемки и дороги для использования в широкой клинической практике [1].
Наиболее доступными методиками определения инсулинорезистентности являются общий осмотр с определением индекса массы тела (ИМТ), типа распределения жировой ткани и стандартный тест на толерантность к глюкозе.
Ожирение по мужскому типу (центральное ожирение) характеризуется накоплением жира в передней стенке живота и мезентерии внутренних органов. Этот жир более чувствителен к катехоламинам, менее чувствителен к инсулину, и, таким образом, метаболически более активен. Центральное ожирение ассоциируется с гиперинсулинемией, нарушением толерантности к глюкозе, диабетом и повышением андрогенов вследствие снижения уровня ССГ [17]. Тип распределения жировой ткани определяется по соотношению — объем талии/объем бедер. Если индекс составляет у пациентки более 0,85, можно говорить о мужском типе ожирения. Эти женщины должны проходить тестирование на гиперинсулинемию [5].
После стандартной нагрузки глюкозой (тест на толерантность к глюкозе с 75 г глюкозы) у инсулинорезистентных пациентов, в отличие от здоровых людей, уровень глюкозы в крови значительно выше [6].
К сожалению, на сегодняшний день остается неясным, какой уровень инсулина натощак или в ответ на тест с глюкозой коррелирует с клиническим исходом (развитие сахарного диабета). Поэтому нельзя не согласиться с Lergo R., 1997, что с клинической точки зрения всех пациенток с СПКЯ следует рассматривать как женщин с инсулинорезистентностью [1].
Снижение веса с помощью диеты или физических нагрузок должно стать краеугольным камнем в терапии женщин с СПКЯ и ожирением [1, 18, 19]. Нормализация веса приводит к понижению концентрации андрогенов и повышению уровня ССГ, уменьшает гирсутизм, нигроидный акантоз и олигоменорею у большинства пациенток с ожирением, и что самое важное, повышает частоту овуляций и беременностей у этих женщин [20]. Этот эффект, по-видимому, может наблюдаться вследствие хорошо известной способности диеты и снижения веса уменьшать гиперинсулинемию [21].
Предварительные исследования эффективности инсулин-понижающих препаратов у пациенток с СПКЯ дали противоречивые результаты. Velasquez, 1994, сообщил об эффективности изолированного, без рекомендации диеты, применения метформина — препарата, который действует как сенсибилизатор к инсулину и уменьшает инсулинорезистентность и связанные с ней метаболические нарушения. Он наблюдал снижение концентрации инсулина, концентрации андрогенов и ЛГ, и повышение уровня ССГ. Эти данные не подтверждены Crave, 1995, который не выявил различий между двумя группами женщин, соблюдающих диету, — с метформином и с плацебо. Pasquali R. и соавторы, 1996, провели сравнительную оценку эффективности двух терапевтических режимов: диета плюс антиандрогены (ципротерон ацетат) и диета плюс метаболические препараты (метформин, дексфенфлурамин). Не наблюдалось различий в концентрации андрогенов между двумя группами после проведения лечения [20].
Многие женщины с СПКЯ применяют комбинированные оральные контрацептивы для регуляции менструального цикла, уменьшения влияния относительной гиперэстрогении и подавления андрогенов. Так как оральные контрацептивы могут оказывать отрицательное действие на чувствительность к инсулину, существуют теоретические опасения использования их у пациенток с СПКЯ и доказанной инсулинорезистентностью. Некоторые авторы рекомендуют прерывистое применение у этих пациенток медроксипрогестерона ацетата, не влияющего на чувствительность к инсулину [1].
Длительное применение глюкокортикоидов у пациенток с СПКЯ и инсулинорезистентностью должно рекомендоваться осторожно, так как эти препараты могут понижать чувствительность к инсулину [1].
В заключение следует отметить, что гинекологи традиционно сфокусированы на гиперандрогенных аспектах СПКЯ: гирсутизме, нарушении менструального цикла, бесплодии. Вместе с тем, эти пациентки составляют группу риска по развитию онкологических заболеваний, болезней сердца и сосудов, сахарного диабета. В сложившейся в нашей стране социально-экономической ситуации гинекологи являются зачастую единственными врачами, регулярно посещаемыми женщинами. Поэтому именно эти специалисты не должны забывать о клинической значимости и отдаленных последствиях синдрома гиперандрогении и гиперинсулинемии и убеждать пациенток в необходимости регулярного наблюдения с целью их предотвращения.
Т.В. Овсянникова, И.Ю. Демидова, О.И. Глазкова
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва, кафедра эндокринологии Московской медицинской академии им. Сеченова, Москва