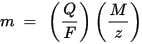Как используется электролиз в аккумуляторах
Применение электролиза в технике
Электролиз находит весьма широкое применение в технике. Электролизом получают некоторые металлы; многие, полученные неэлектрическим методом, очищают от примесей. Электролизом соответствующих растворов получают кислород, водород, хлор, «тяжелую воду». Посредством электролиза различные изделия покрывают слоем металла, а также изготавливают рельефные металлические копии нужных изделий. На электролизе основана зарядка аккумуляторов. Каждое из возможных применений электролиза получило свое название. Рассмотрим сущность некоторых из применений электролиза в технике.
Гальванопластика – получение металлических отпечатков рельефных предметов (медалей, монет и т.п.). Для этого с предмета сначала снимают слепок из воска (стеарина), покрывают поверхность слепка порошкообразным графитом для придания электропроводности и затем используют слепок в качестве катода в электролитической ванне, содержащей растворенную соль металла. При электролизе металл электролита выделяется на поверхности слепка и образует металлическую копию предмета. Этим способом, в частности, изготавливают типографские клише, бесшовные трубы, а также другие металлические детали сложной формы.
Гальваностегия. Электролитическое осаждение металлов широко используется для покрытия металлических предметов слоем благородных металлов или защитным слоем другого металла, обладающего механической прочностью и устойчивостью к коррозии. Таково электролитическое серебрение, золочение и патинирование, покрытие хромом и никелем, электролитическое покрытие железа цинком.
Очистка (рафинирование) металлов (получение чистых металлов). Для этого очищаемый металл отливают в виде пластин, и делают их анодом в электролитической ванне. Электролитом служит раствор соли данного металла. При правильном выборе напряжения между анодом и катодом добиваются того, чтобы только очищаемый металл переходил с анода в раствор и выделялся на катоде. Примеси выпадают на дно электролитической ванны в виде осадка (анодный шлам).
Очисткой путем электролиза получают, например, очень чистую (так называемую электролитическую рафинированную) медь, широко применяемую в электротехнике.
Электрометаллургия. В настоящее время многие металлы получают с помощью электролиза руд в расплавленном состоянии. Примером может служить получение алюминия. Электролизу подвергают расплав смеси глинозема Al2O3 и криолита Na2AlF6. Анодами служат опускаемые в расплав угольные стержни. Электролиз производится при температуре около 900 o C, причем высокая температура поддерживается самим током. Электролизом получают также натрий, магний, бериллий, фтор и другие элементы.
Электролитическое травление и полировка. Помещая металлические предметы в электролитическую ванну в качестве анода, можно заставить металл растворяться. При наличии шероховатостей у поверхности электролитическое растворение происходит быстрее у выступов и заострений, так как напряженность электрического поля, а следовательно, и плотность тока возле них больше. Поэтому с помощью электролиза можно производить травление и полировку поверхностей.
Электролитические конденсаторы. На явлении электролиза основано действие так называемых электролитических конденсаторов («электролитов»), широко применяемых в современной электротехнике и радиотехнике. Они имеют два алюминиевых электрода, находящихся в электролите. Состав электролита может быть разным, например из смеси борной кислоты и раствора аммиака с добавлением глицерина. Электролит часто изготовляют в виде густой пасты и пропитывают им бумажную прокладку, находящуюся между электродами. Работу электролитического конденсатора можно представить так: положительный полюс конденсатора покрыт тончайшим слоем окислов алюминия, который поддерживается вследствие электролиза. Этот слой является диэлектриком конденсатора, а обкладками служат алюминиевый электрод и электролит. Второй алюминиевый электрод является пассивным и служит только для включения конденсатора в цепь. Благодаря малой толщине слоя окислов емкость электролитических конденсаторов достигает многих сотен микрофарад на м 2 площади пластин.
Электролитический конденсатор обладает большой емкостью только при определенной полярности напряжения, а именно в том случае, когда окисленный электрод соединен с положительным полюсом источника. При обратном включении в цепь изолирующий слой исчезает и через конденсатор проходит большой ток, разрушающий его.
Недостатками электролитических конденсаторов являются сравнительно большие утечки, необходимость соблюдать полярность, малая величина пробойных напряжений и невозможность использования их в цепях переменного тока.
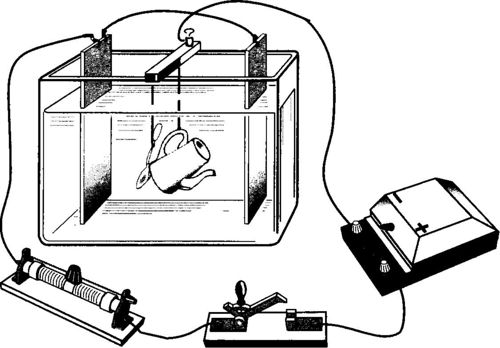
Электролиз и так называемая электролитическая поляризация получили важное техническое применение в аккумуляторах, или, иначе, вторичных источниках тока (элементах). Они представляют собой гальванические элементы, в которых вещества, предварительно накопленные на электродах в процессе электролиза (в процессе зарядки аккумулятора), расходуются при отборе тока.
Наибольшее распространение получили свинцовые, или кислотные, аккумуляторы. В простейшем виде они состоят из двух свинцовых электродов, находящихся в растворе серной кислоты. При погружении в кислоту на электродах образуется сернокислый свинец PbSO4, и раствор насыщается этой же солью.
При зарядке аккумулятора на его электроде, соединенном с положительным полюсом источника тока, свинец окисляется в перекись PbO2, а второй электрод превращается в чистый свинец. При зарядке аккумулятора появляются дополнительные молекулы кислоты, поэтому концентрация кислоты увеличивается.
При разрядке аккумулятора его положительный полюс постепенно раскисляется, и на нем происходит вновь образование сернокислого свинца, который появляется также и на отрицательном электроде. При разрядке концентрация кислоты уменьшается.
Аккумуляторы характеризуются, помимо ЭДС, емкостью, т.е. величиной заряда, отдаваемого при разрядке. Она измеряется в ампер-часах и, очевидно, тем больше, чем больше поверхность электродов.
Для увеличения емкости электроды аккумуляторов отливают в виде пластин с многочисленными ячейками наподобие пчелиных сотов и в ячейки запрессовывают окислы свинца.
Наряду со свинцовыми аккумуляторами в настоящее время применяют железоникелевые, или щелочные, аккумуляторы, которые отличаются меньшей массой при равной емкости. Они имеют один электрод из железа, а другой – из никеля, а электролитом служит 20-процентный раствор едкого калия KOH. В заряженном состоянии анодом у этих аккумуляторов служит гидрат окиси никеля Ni(OH)3, а катодом – железо.
Практическое применение электролиза
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.
Суть электролиза
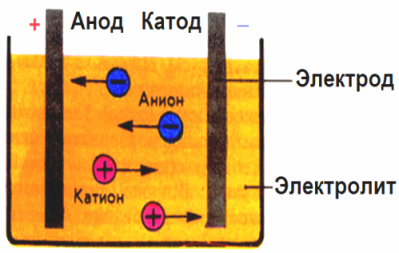
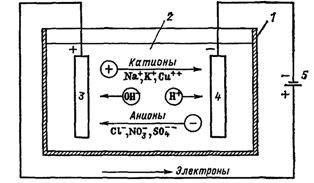
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
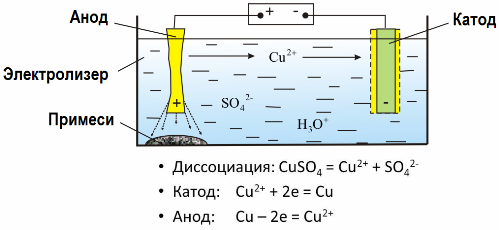
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
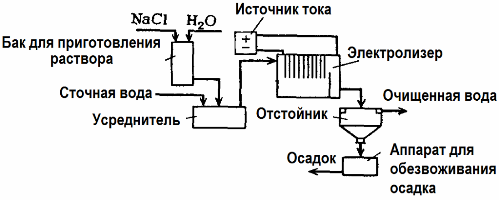
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование, он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Подробнее смотрите здесь: Химические источники электрического тока
Лимонная батарейка (для увеличения нажмите нажмите на картинку)
Подробнее о том, как работает такая батарейка смотрите здесь: Как сделать батарейку из лимона в домашних условиях
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
«Кипение» аккумулятора это процесс электролиза
«Кипение» аккумулятора это процесс электролиза: разложение воды на кислород и водород.
Одним из признаков того, что батарея не может «усваивать» по разным причинам слишком высокий для нее ток заряда и напряжение, является повышение температуры ее корпуса.
Также в летний период температура под капотом авто может достигать +100° С, а максимальная рабочая температура для АКБ +50°C. В этом случае батарея будет «закипать» из-за избыточного внешнего перегрева.
В грузовых автомобилях или автобусах применяется по 2 аккумулятора. Наиболее частые причины кипения грузовых АКБ в результате их неправильной эксплуатации:
В результате батареи сильно разряжаются. По правилам эксплуатации в этом случае их нужно зарядить стационарным зарядным устройством, током не выше 1/10 емкости (15-25А). Ток подаваемый генератором грузовика в сильно разряженную батарею будет в десятки раз выше.
Начав движение с разряженными аккумуляторами, водитель гарантировано добьется их кипения, вздутия или разрушения корпуса.
ВАЖНО! Сильно разряженную батарею нельзя эксплуатировать в машине и заряжать от автомобильного генератора. Ток заряда будет слишком высоким. Заряжать только стационарным ЗУ током равным 1/10 емкости.
На практике, в 99% случаев кипят неисправные аккумуляторы из-за короткого замыкания между плюсовыми и отрицательными пластинами в одной или нескольких банках. Происходит такое замыкание от старости батареи либо ее невысокого качества. Эксплуатировать батарею с такими неисправностями опасно!
Применение электролитов. Кислотные и щелочные электролиты
В прошлой статье рассказывалось об основных свойствах электролитов и технике безопасности при работе с ними. Сейчас речь пойдет о видах электролитов и их применении.
Основное применение электролитов — в промышленности: 
• В аналитической практике используются рН-метры и ионометры с электродами, заполненными солевыми электролитами. С их помощью измеряют не только уровень кислотности среды, но и содержание и концентрацию определенных элементов в веществах.
• В электрохимической индустрии электролиты — основа растворов для гальванирования металлов: хромирования, кадмирования, цинкования, золочения, фосфатирования и пр. С помощью электролитов проводят травление металлов.
• В медицине и биологии тоже имеют дело с электролитами. Диагностика многих заболеваний связана с определением характера водно-солевого и кислотно-щелочного баланса в организме.
Кислотные и щелочные электролиты
Чаще всего мы сталкиваемся с электролитами в аккумуляторах, работающих в различных транспортных средствах. Без них автомобили, электровозы, локомотивы и т.п. просто не способны функционировать. Используются в них кислотные и щелочные электролиты. Оба типа имеют свои достоинства и недостатки.
Щелочной электролит — это раствор щелочи в воде. Как правило, используют гидроокись натрия, калия, лития или их комбинации.

• долгий срок службы;
• высокая надежность;
• способны работать в широком диапазоне температур;
• при работе выделяется меньше токсичных газов;
• неприхотливы в эксплуатации, требуют меньшего обслуживания, чем кислотные;
• щелочные аккумуляторы меньше весят, не содержат свинец, не боятся тряски, сильных токов и коротких замыканий.
К сожалению, есть и недостатки:
• щелочные аккумуляторы дороже стоят;
• у них меньший к.п.д., меньшая величина э.д.с. (электродвижущая сила);
• не способны дать стартовый ток, необходимый для запуска двигателя автомобиля.
Щелочные электролиты преимущественно используются в электропогрузчиках и в шахтных электровозах, в локомотивах и электропоездах.
В автомобильной индустрии востребованы в основном кислотные аккумуляторы. Кислотный электролит — это раствор концентрированной серной кислоты в воде.
Достоинства аккумуляторов с кислотным электролитом:
• малый саморазряд;
• высокий к.п.д. и величина э.д.с.;
• простые, хорошо отработанные технологии обслуживания;
• способны выдавать высокий стартовый ток;
• гораздо дешевле щелочных.
К недостаткам можно отнести:
• большой вес;
• чувствительны к низким температурам — электролит может замерзнуть и вывести из строя весь аккумулятор;
• неэкологичны;
• требуют регулярного обслуживания.
Это важно: нельзя менять тип электролита в аккумуляторе. Щелочные заправляют только щелочью, кислотные — только кислотой.
В нашем магазине можно недорого купить щелочные электролиты следующих видов:
• твердый калиево-литиевый;
• жидкий калиево-литиевый, плотность 1,27
• жидкий калиево-литиевый, плотность 1,41
Сплав гидроокиси лития и калия. Представляет собой порошкообразный или гранулированный продукт. Применяется для изготовления жидких электролитов с нужными характеристиками.
Процессы, протекающие при электролизе

В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).

Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора.
Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Таблица 1. Нормальные электродные потенциалы при +25° С
Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов.
Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.

Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
Следовательно, для реального процесса m э = η1 х ( А / 96480 n) х It
Естественно, всегда η1
Выход по току существенно зависит от плотности тока на электроде. С увеличением плотности тока на электроде выход по току растет и повышается эффективность процесса.
Мощность, потребляемая при электролизе, равна: Рэл = IU эл = I (Ер + Еп + U э + U с)
Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IU э, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети: